염화헥삼민코발트(III)
Hexamminecobalt(III) chloride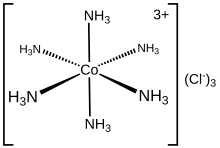 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 염화헥사암미네코발트(III) | |
| 기타 이름 코발트 헥삼민 염화물, 헥사암민코발트(III) 염화물 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.030.991 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| H18N6Cl3Co | |
| 어금질량 | 267.48 g/190 |
| 외관 | 황색 또는 주황색 결정체 |
| 밀도 | 1.71 g/cm3, |
| 녹는점 | 부패하다 |
| 0.26M(20°C) 트리브로마이드: 0.04M(18°C) | |
| 용해성 | NH에3 녹는 |
| 구조 | |
| 팔면체의 | |
| 0 D | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 독약을 타다 |
| GHS 라벨 표시: | |
 | |
| 경고 | |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 | |
| 관련 화합물 | |
기타 음이온 | [Co(NH3)6]Br3 [Co(NH3)6](OAc)3 |
기타 양이온 | [Cr(NH3)6]Cl3 [Ni(NH3)6]Cl2 |
관련 화합물 | [Co(H2NCH2CH2NH2)3]Cl3 [Co(NH3)5(H2O)]Cl3 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
헥사암미네코발트(III)염화물은 [Co(NH3)]6Cl이라는3 공식을 가진 화학 화합물이다.조정 화학의 선구자인 알프레드 베르너의 이름을 딴 원형의 '워너 콤플렉스'로 꼽히는 조정 콤플렉스[Co(NH3)]63+의 염화염이다.cation 자체는 코발트(III) 이온에 암모니아 리간드 6개가 부착된 금속암모니아 복합체다.
원래 [Co(NH3)]63+의 염분은 코발트의 루테오(라틴:노란색) 복합체로 설명되었다.현대 화학이 색상을 분자 구조보다 덜 중요하게 생각하면서 이 명칭은 폐기됐다.다른 유사 단지들도 코발트 펜타민 단지의 경우 자색(라틴어: 보라색), 이소메릭 테트라민 단지의 경우 프라세오(그리스어: 녹색)와 비올레오(라틴어: 보라색)와 같은 색명을 가지고 있었다.[1]
특성 및 구조
[Co(NH3)]63+는 직경이며, 저 스핀6 3d 옥타헤드 Co(III) 중심이 있다.cation은 18전자의 규칙에 따르며, 교환 불활성 금속 단지의 전형적인 예로 간주된다.그것의 불활성성의 발현으로서, [Co(NH3)]6Cl은3 농축 염산에서 변하지 않고 재분할될 수 있다: NH는3 Co(III) 중심과 매우 밀접하게 결합되어 있어서 그 양성화를 위해 분리되지 않는다.이와는 대조적으로 [Ni(NH3)]6Cl과2 같은 노폐한 금속 암뢰 복합체는 산과 함께 빠르게 반응하여 Ni(II)-NH3 채권의 노동을 반영한다.가열과 동시에 헥삼민코발트(III)는 암민 리간드의 일부를 잃기 시작하여 결국 더 강한 산화제를 생산하게 된다.
[Co(NH3)]6Cl의3 염화 이온은 해당 [Co(NH3)]6X파생물을 감당할 수 있도록 질산염, 브롬화, 요오드화, 황산염 등 다양한3 음이온과 교환할 수 있다.그러한 염분은 주황색 또는 밝은 노란색이며 다양한 수준의 수용성을 나타낸다.염화 이온은 헥사시오카나토크롬산염(III)과 같은 보다 복잡한 음이온과도 교환할 수 있으며, [Co(NH3)][6Cr(SCN)]]6 또는 철리시아니드 이온을 포함한 핑크 화합물을 산출한다.
준비
[Co(NH3)]6Cl은3 코발트를 치료하여 준비한다.II) 암모니아 및 염화암모늄을 사용한 염화물에 산화가 뒤따른다.산화제로는 과산화수소나 숯 촉매가 존재하는 산소가 있다.[2]이 소금은 Fremy에 의해 처음 보고된 것으로 보인다.[3]
아세테이트 소금은 코발트의 유산소 산화에 의해 준비될 수 있다.II) 아세테이트, 아세테이트 암모늄 및 메탄올의 암모니아.[4]아세테이트 소금은 1.9 M (20 °C) 레벨까지 수용성이 매우 높으며, 트리클로라이드의 경우 0.26 M 레벨이다.
사용하다
[Co(NH3)]63+는 X선 결정학이나[5] 핵자기 공명에 의해 구조를 해결하는 데 도움이 되는 일부 구조 생물학 방법(특히 DNA나 RNA의 경우 양성 이온이 인산염 백본의 3차 구조를 안정시키는 경우)의 구성요소다.[6]생물학계에서는 반작용은 Mg일2+ 가능성이 더 높지만 코발트(또는 PDB: 2GIS와 같은 이리듐)의 무거운 원자는 위상 문제를 해결하고 구조의 전자 밀도 지도를 생성하기 위해 변칙적인 산란을 제공한다.[7]
[Co(NH3)]63+는 수용성 3가 금속 복합체의 특이한 사례로 핵산과의 상호작용과 같이 음전하가 높은 복합체의 안정화 등 충전 차폐 용도에 유용하다.
참조
- ^ Huheey, James E. (1983). Inorganic Chemistry (3rd ed.). p. 360.
- ^ Bjerrum, J.; McReynolds, J. P. (1946). Hexamminecobalt(III) Salts. Inorg. Synth. Inorganic Syntheses. Vol. 2. pp. 216–221. doi:10.1002/9780470132333.ch69. ISBN 9780470132333.
- ^ Fremy, M. E. (1852). "Recherches sur le cobalt". Ann. Chim. Phys. 35: 257–312.
- ^ Lindholm, R. D.; Bause, Daniel E. (1978). Complexes of Cobalt Containing Ammonia or Ethylene Diamine: Hexaamminecobalt(III) Salts. Inorg. Synth. Inorganic Syntheses. Vol. 18. pp. 67–69. doi:10.1002/9780470132494.ch14. ISBN 9780470132494.
- ^ Ramakrishnan, B.; Sekharudu, C.; Pan, B.; Sundaralingam, M. (2003). "Near-atomic resolution crystal structure of an A-DNA decamer d(CCCGATCGGG): cobalt hexammine interaction with A-DNA". Acta Crystallogr. D59 (Pt 1): 67–72. doi:10.1107/s0907444902018917. PMID 12499541.
- ^ Rudisser, S.; Tinoco, I., Jr. (2000). "Solution structure of Cobalt(III)hexammine complexed to the GAAA tetraloop, and metal-ion binding to G.A mismatches". J. Mol. Biol. 295 (5): 1211–1232. doi:10.1006/jmbi.1999.3421. PMID 10653698.
- ^ McPherson, Alexander (2002). Introduction to Macromolecular Crystallography. John Wiley & Sons. ISBN 0-471-25122-4.


