코발트
Cobalt | ||||||||||||||||||||||||||||||||||||
| 코발트 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | /ˈ코 ʊb ɒlt/ ⓘ[1] | |||||||||||||||||||||||||||||||||||
| 외모 | 단단하고 광택이 나는 푸른 회색 금속 | |||||||||||||||||||||||||||||||||||
| 표준 원자량 Ar°(Co) | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| 주기율표의 코발트 | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| 원자번호 (Z) | 27 | |||||||||||||||||||||||||||||||||||
| 그룹. | 9조 | |||||||||||||||||||||||||||||||||||
| 기간 | 4교시 | |||||||||||||||||||||||||||||||||||
| 블록 | 디블록 | |||||||||||||||||||||||||||||||||||
| 전자구성 | [아르] 3d7 4s2 | |||||||||||||||||||||||||||||||||||
| 포탄당 전자 | 2, 8, 15, 2 | |||||||||||||||||||||||||||||||||||
| 물성 | ||||||||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | |||||||||||||||||||||||||||||||||||
| 융점 | 1768 K (1495 °C, 2723 °F) | |||||||||||||||||||||||||||||||||||
| 끓는점 | 3200 K (2927 °C, 5301 °F) | |||||||||||||||||||||||||||||||||||
| 밀도 (근처) | 8.90g/cm3 | |||||||||||||||||||||||||||||||||||
| 액체일 때에 | 7.75g/cm3 | |||||||||||||||||||||||||||||||||||
| 융해열 | 16.06 kJ/mol | |||||||||||||||||||||||||||||||||||
| 기화열 | 377kJ/mol | |||||||||||||||||||||||||||||||||||
| 몰열용량 | 24.81 J/(mol·K) | |||||||||||||||||||||||||||||||||||
증기압
| ||||||||||||||||||||||||||||||||||||
| 원자적 성질 | ||||||||||||||||||||||||||||||||||||
| 산화상태 | -3, -1, 0, +1, +2, +3, +4, +5[3](양극성 산화물) | |||||||||||||||||||||||||||||||||||
| 전기음성도 | 폴링 눈금: 1.88 | |||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||
| 원자반지름 | 경험적: 오후 125시 | |||||||||||||||||||||||||||||||||||
| 공유반지름 | 로우 스핀 : 126±3pm 하이 스핀 : 150±7pm | |||||||||||||||||||||||||||||||||||
| 기타속성 | ||||||||||||||||||||||||||||||||||||
| 자연발생 | 원시의 | |||||||||||||||||||||||||||||||||||
| 결정구조 | 육각밀봉(hcp) | |||||||||||||||||||||||||||||||||||
| 음속 가느다란 막대 | 4720 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||
| 열팽창 | 13.0 µm/(m⋅K) (at 25 °C) | |||||||||||||||||||||||||||||||||||
| 열전도율 | 100W/(m⋅K) | |||||||||||||||||||||||||||||||||||
| 전기 비저항 | 62.4 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||||||||||||
| 자기순서 | 강자성의 | |||||||||||||||||||||||||||||||||||
| 영률 | 209 GPa | |||||||||||||||||||||||||||||||||||
| 전단 탄성률 | 75 GPa | |||||||||||||||||||||||||||||||||||
| 부피 탄성률 | 180 GPa | |||||||||||||||||||||||||||||||||||
| 포아송비 | 0.31 | |||||||||||||||||||||||||||||||||||
| 모스 경도 | 5.0 | |||||||||||||||||||||||||||||||||||
| 비커스 경도 | 1043MPa | |||||||||||||||||||||||||||||||||||
| 브리넬 경도 | 470~3000MPa | |||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-48-4 | |||||||||||||||||||||||||||||||||||
| 역사 | ||||||||||||||||||||||||||||||||||||
| 검색 및 첫 번째 격리 | 게오르크 브란트 (1735) | |||||||||||||||||||||||||||||||||||
| 코발트 동위 원소 | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
코발트는 화학 원소로 기호는 Co이고 원자 번호는 27입니다.니켈과 마찬가지로 코발트도 화학적으로 결합된 형태로만 지구의 지각에서 발견되는데, 이는 천연 유성 철의 합금에서 발견되는 소량의 침전물을 제외한 것입니다.환원 제련에 의해 생성되는 자유 원소는 단단하고 광택이 나는 은 금속입니다.
코발트계의 청색 안료(코발트 블루)는 예로부터 보석이나 도료 등에 사용되어 왔으며, 유리에 특유의 청색 색조를 부여하기 위한 것이었지만, 그 색은 오랫동안 알려진 금속 비스무트에 의한 것으로 생각되어 왔습니다.광부들은 오랫동안 청색 안료를 생산하는 광물들 중 일부에 코볼드 광석(독일어로 도깨비 광석)이라는 이름을 사용해 왔습니다; 그것들은 알려진 금속들이 빈약하고 제련될 때 유독한 비소를 포함하는 연기를 내뿜기 때문에 그렇게 이름 지어졌습니다.[5]1735년, 그러한 광석들은 새로운 금속으로 환원될 수 있다는 것이 밝혀졌고(고대 이래로 최초로 발견됨), 이것은 결국 코볼트의 이름을 따서 지어졌습니다.
오늘날, 일부 코발트는 코발트라이트(CoAsS)와 같은 많은 금속성 광택 광석 중 하나로 특별히 생산됩니다.그러나 이 원소는 일반적으로 구리와 니켈 채굴의 부산물로 더 많이 생산됩니다.콩고 민주 공화국과 잠비아의 구리 벨트는 전 세계 코발트 생산량의 대부분을 생산합니다.2016년 세계 생산량은 116,000톤(11만 4,000 롱톤, 128,000 쇼트톤)이었고(Natural Resources Canada에 따르면), DRC만 50%[6] 이상을 차지했습니다.
코발트는 리튬 이온 배터리에 주로 사용되며, 자성, 내마모성 및 고강도 합금 제조에 사용됩니다.코발트 실리케이트와 코발트의 화합물(II) 알루미네이트(CoAlO24, 코발트 블루)는 유리, 세라믹, 잉크, 페인트 및 바니시에 독특한 짙은 파란색을 제공합니다.코발트는 오직 하나의 안정 동위 원소인 코발트-59로 자연적으로 발생합니다.코발트-60은 상업적으로 중요한 방사성 동위원소로, 방사성 추적자로 사용되며 고에너지 감마선 생산에 사용됩니다.코발트는 석유 산업에서도 원유를 정제할 때 촉매제로 사용됩니다.태울 때 매우 오염되고 산성비를 유발하는 유황 성분을 제거하기 위한 것입니다.[7]
코발트는 코발아민이라고 불리는 조효소 그룹의 활성 중심입니다.이 유형의 가장 잘 알려진 예인 비타민 B는12 모든 동물에게 필수적인 비타민입니다.무기 형태의 코발트는 또한 박테리아, 조류 및 곰팡이의 미량 영양소입니다.
특성.

코발트는 비중이 8.9인 강자성 금속입니다.퀴리 온도는 1,115 °C(2,039 °[8]F)이고 자기 모멘트는 원자당 1.6–1.7 보어 마그네트론입니다.[9]코발트는 철의 3분의 2 정도의 상대적 투과율을 가지고 있습니다.[10]금속 코발트는 hcp와 fcc의 두 가지 결정학적 구조로 발생합니다.hcp와 fcc 구조 사이의 이상적인 전이 온도는 450 °C(842 °F)이지만 실제로는 이들 사이의 에너지 차이가 너무 작아서 두 구조의 무작위 상호 성장이 일반적입니다.[11][12][13]
코발트는 산화 방지막에 의해 산화로부터 보호되는 약한 환원성 금속입니다.할로겐과 유황의 공격을 받습니다.산소에서 가열하면 90034°C(1,650°F)에서 산소를 잃어 일산화탄소를 생성합니다.[14]금속은 520K에서 불소(F2)와 반응하여 CoF를3 생성하고 염소(Cl2), 브롬(Br2) 및 요오드(I2)와 반응하여 동등한 2가 할로겐화물을 생성합니다.가열해도 수소가스(H2)나 질소가스(N2)와는 반응하지 않지만 붕소, 탄소, 인, 비소, 황과는 반응합니다.[15]일반 온도에서는 미네랄 산과 천천히 반응하고, 건조하지 않은 습한 공기와 매우 천천히 반응합니다.[citation needed]
컴파운드
코발트의 일반적인 산화 상태는 +2와 +3을 포함하지만, 산화 상태가 -3에서 +5까지의 화합물도 알려져 있습니다.단순 화합물의 일반적인 산화 상태는 +2(코발트(II))입니다.이 염들은 물 속에서 분홍색 금속 아쿠아 복합체 [Co(HO
2)]
62+
를 형성합니다.염화물을 첨가하면 강렬하게 푸른 [CoCl
4]을 얻을 수 있습니다.2−
[3]붕사 비드 화염 시험에서 코발트는 산화 화염과 환원 화염 모두에서 짙은 파란색을 보여줍니다.[16]
산소 및 칼코겐 화합물
코발트의 몇 가지 산화물이 알려져 있습니다.그린코발트(II) 산화물(CoO)은 암염 구조를 갖습니다.물과 산소로 쉽게 산화되어 갈색 코발트(III) 수산화물(Co(OH))3이 됩니다.600-700 °C의 온도에서 CoO는 푸른 코발트로 산화됩니다(II,III) 스피넬 구조를 갖는 산화물(CoO34).[3]흑색 코발트(III) 산화물(CoO23)도 알려져 있습니다.[17]코발트 산화물은 산화 상태가 +2와 +3으로 혼합된 자철석(FeO34)과 유사한 CoO34(Neel 온도: 40 K)와 낮은 온도에서의 반강자성입니다.[18]
코발트의 주요 칼코게나이드는 검은 코발트를 포함합니다.II) 황화물, 황철석과 같은 구조를 갖는 CoS2 및 코발트(III) 황화물(CoS23).[citation needed]
할리데스

코발트의 4개의 디할라이드(dihalids)II)는 코발트(cobalt)로 알려져 있습니다.II) 불소(CoF2, 핑크), 코발트(cobalt)II) 염화물(CoCl2, blue), 코발트(cobalt)II) 브로마이드 (CoBr2, 녹색), 코발트 (II) 요오드화물(CoI2, blue-black).이 할로겐화물은 무수 및 수화된 형태로 존재합니다.무수 디클로라이드는 파란색인 반면 수화물은 빨간색입니다.[19]
반응 Co + e → Co의 환원 전위는 +1.92 V이며 염소에서 염화까지의 환원 전위를 초과하여 +1.36 V입니다. 따라서 코발트(III) 염화물은 자발적으로 코발트로 환원됩니다.II) 염소 및 염소.코발트(III) 플루오린화물은 불소에서 불소로의 환원 전위가 +2.87 V로 매우 높기 때문에 몇 안 되는 안정한 코발트(III) 화합물 중 하나입니다.일부 불소화 반응에 사용되는 코발트(III) 플루오라이드는 물과 격렬하게 반응합니다.[14]
배위화합물
모든 금속은 코발트의 분자 화합물 및 다원자 이온이 배위 복합체, 즉 코발트를 하나 이상의 리간드에 연결된 분자 또는 이온으로 분류됩니다.이들은 다음과 같은 잠재적으로 무한히 다양한 분자와 이온의 조합일 수 있습니다.
- 물 HO
2, 양이온 헥사아쿼코볼트(hexaquocovalt)와 같이II) [Co(H
2O)
6]2+
.이 핑크색 복합체는 고체 황산코발트 CoSO·(HO), x = 6 또는 7의 양이온 및 이의 수용액에서 우세합니다. - ammonia NH
3, as in cis-diaquotetraamminecobalt(III) [Co(NH
3)
4(H
2O)
2]3+
, in hexol [Co(Co(NH
3)
4(HO)
2)
3]6−
, in [Co(NO
2)
4(NH
3)
2]−
(the anion of Erdmann's salt),[20] and in [Co(NH
3)
5(CO
3)]−
.[20] - 탄산염 [CO
3],2−
녹색 삼탄산나트륨()과 같이III) [Co(CO
3)]
33−
음이온.[21][20][22] - [Co(NO
2)(
4NH
3)]
2−
[20]에서와 같이 아질산염 [NO
2].− - 히드록사이드[HO]−
를 헥솔과 같이 사용합니다. - 염화물 [Cl],−
테트라클로리도코발트산()에서와 같이II) CoCl
4]2−
. - [Co(CO
3)(
2HCO
3
3)(HO
2)]3−
[20]에서와 같이 중탄산염 [HCO].− - 옥살산[CO
2
4],2−
트리스옥살라토코발트산()과 같이III) [Co(C
2O
4)3−
3].[20]
이러한 부착된 그룹은 전기 음성 및 경도-부드러움의 일반적인 원리에 따라 코발트 원자의 산화 상태 안정성에 영향을 미칩니다.예를 들어, Co3+ 복합체는 아민 리간드를 갖는 경향이 있습니다.인은 질소보다 더 부드러우므로, 포스핀 리간드는 더 부드러운 Co와2+ Co를+ 특징으로 하는 경향이 있습니다. 예를 들어, 트리스(트리페닐포스핀)코발트(I)클로라이드(P(CH
6
5)
3
3CoCl).더4+ 전기적인 (그리고 더 단단한) 산화물과 불소가 Co 및 Co5+ 유도체, 예를 들어 6불화코발트산 세슘(IV26)(CsCoF) 및 과코발트산칼륨(KCoO34)을 안정화시킬 수 있습니다.[14]
노벨상을 수상한 배위화학의 선구자인 알프레드 베르너는 경험식 [Co(NH
3)]
63+
의 화합물을 연구했습니다.결정된 이성질체 중 하나는 코발트(III) 헥사민 클로라이드였습니다.전형적인 베르너형 복합체인 이 배위 복합체는 6개의 암민 직교 리간드와 3개의 염화 카운터 음이온에 의해 배위된 중심 코발트 원자로 구성됩니다.암모니아 대신에 킬레이트화 에틸렌디아민 리간드를 사용하면 광학 이성질체로 분해된 최초의 배위 복합체 중 하나인 트리스(에틸렌디아민) 코발트(III)([Co(en)])
33+
가 생성됩니다.이 복합체는 "3개의 날이 있는 프로펠러"의 오른손과 왼손 형태로 존재합니다.이 복합체는 Werner에 의해 노란색-금침과 같은 결정체로 처음 분리되었습니다.[23][24]
유기금속 화합물
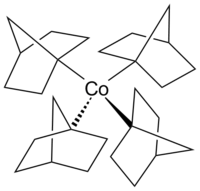
코발트세는 철 대신 코발트가 있는 페로센과 구조적 유사체입니다.코발트센은 페로센보다 산화에 훨씬 민감합니다.[25]코발트 카르보닐(Co2(CO))8은 카르보닐화 및 히드로실릴화 반응의 촉매입니다.[26]비타민 B12(아래 참조)는 자연에서 발견되는 유기금속 화합물로 유일하게 금속 원자를 함유하고 있는 비타민입니다.[27]코발트의 일반적이지 않은 +4 산화 상태의 알킬코발트 착물의 예로는, Bredt의 규칙에 따라 [28]β-수소 제거에 대한 내성으로 유명한 전이금속-알킬 착물인 호모레틱 착물 테트라키스(1-노르보르닐)코발트(IV)(Co(1-노르보닐))4가 있습니다.코발트(III) 및 코발트(V) 착물 [Li(THF)][
4+
Co(1-norb)]
4−
및 [Co(1-norb)][
4+
BF
4]−
도 알려져 있습니다.[29]
동위 원소
59Co는 지구상에 자연적으로 존재하는 유일한 안정적인 코발트 동위 원소입니다.가장 안정한 Co의 반감기는 5.2714년, Co의 반감기는 271.8일, Co의 반감기는 77.27일, Co의 반감기는 70.86일입니다.코발트의 다른 모든 방사성 동위원소들은 반감기가 18시간보다 짧으며, 대부분의 경우 1초보다 짧습니다.이 요소는 또한 4개의 메타 상태를 가지고 있으며, 모두 반감기가 15분 미만입니다.[30]
코발트의 동위 원소는 원자량이 50u(Co)50에서 73u(73Co)까지 다양합니다.유일한 안정 동위 원소인 Co보다 원자 질량 단위 값이 작은 동위 원소의 1차 붕괴 모드는 전자 포획이며 원자 질량 단위가 59보다 큰 동위 원소의 1차 붕괴 모드는 베타 붕괴입니다.Co 아래의 주요 붕괴 생성물은 원소 26(철) 동위 원소이며, 그 위의 붕괴 생성물은 원소 28(니켈) 동위 원소입니다.[30]
역사

코발트 화합물은 수백 년 동안 유리, 유리, 유리 및 세라믹에 풍부한 파란색을 부여하는 데 사용되었습니다.코발트는 이집트 조각품, 기원전 3천년의 페르시아 보석, 폼페이 유적에서 발견되었고, 중국에서는 당나라 (618년–907년)와 명나라 (1368년–1644년)의 것으로 추정됩니다.[31]
코발트는 청동기 시대부터 유리를 착색하는 데 사용되었습니다.울루부룬 난파선의 발굴은 기원전 14세기에 주조된 파란색 유리 덩어리를 산출했습니다.[32][33]이집트의 파란 유리는 구리, 철 또는 코발트로 물들었습니다.가장 오래된 코발트색 유리는 이집트 18왕조 (1550–1292 BC)의 것입니다.이집트인들이 사용한 코발트의 출처는 알려지지 않았습니다.[34][35]
코발트라는 단어는 광부들이 코발트 광석을 위해 사용하는 미신적인 용어인 "도깨비"를 의미하는 코볼트(kobold)에서 독일 코발트(kobald)에서 유래되었습니다.구리 또는 은을 위해 광석을 제련하려는 첫 번째 시도는 실패하여 단순 분말(코발트())을 산출했습니다.II) 대신 산화물).코발트의 1차 광석은 항상 비소를 함유하고 있기 때문에 광석을 제련하면 비소가 독성이 강하고 휘발성이 강한 산화비소로 산화되어 광석의 악명이 높아집니다.[36]파라셀수스, 게오르기우스 아그리콜라, 바실 발렌타인은 모두 이러한 규산염을 "코발트"라고 불렀습니다.[37]
스웨덴의 화학자 게오르크 브란트(Georg Brandt, 1694–1768)는 코발트 1735를 발견한 것으로 알려져 있으며, 이것이 비스무트와 다른 전통적인 금속과는 구별되는 이전에 알려지지 않은 원소임을 보여줍니다.브랜트는 그것을 새로운 "반금속"이라고 불렀습니다.[38][39]그는 코발트 금속의 화합물이 이전에 코발트와 함께 발견된 비스무트에 기인한 유리의 푸른색의 근원이라는 것을 보여주었습니다.코발트는 선사시대 이후 처음으로 발견된 금속이 되었습니다.다른 알려진 모든 금속(철, 구리, 은, 금, 아연, 수은, 주석, 납, 비스무트)에는 기록된 발견자가 없었습니다.[40]
19세기에 노르웨이 블라파르베프 æ시장에서 코발트 블루(코발트 화합물과 알루미나로 만든 안료)와 스말트(도자기와 회화에 안료를 사용하기 위해 코발트 유리를 가루로 만든 것) 생산의 상당 부분이 수행되었습니다.16세기에 처음으로 소금을 생산하는 광산은 노르웨이, 스웨덴, 작센, 헝가리에 있었습니다.1864년 뉴칼레도니아에서 코발트 광석이 발견되면서 유럽의 코발트 채굴량은 감소했습니다.1904년 캐나다 온타리오에서 광상이 발견되고 1914년 콩고 카탕가 지방에서 더 큰 광상이 발견되면서 광산 운영이 다시 전환되었습니다.[36]1978년 샤바 분쟁이 시작되었을 때, 카탕가 주의 구리 광산들은 거의 생산을 중단했습니다.[43][44]이 분쟁으로 인해 세계 코발트 경제에 미치는 영향은 예상보다 작았습니다: 코발트는 희귀 금속이고, 안료는 독성이 강하며, 업계는 코발트 재료를 재활용할 수 있는 효과적인 방법을 이미 수립했습니다.어떤 경우에는 업계가 코발트가 없는 대안으로 바꿀 수 있었습니다.[43][44]
1938년 존 리빙우드와 글렌 T. 시보그는 방사성 동위원소 코발트-60을 발견했습니다.[45]이 동위원소는 1950년대 컬럼비아 대학교에서 방사성 베타 붕괴에서 패리티 위반을 확립하기 위해 사용된 것으로 유명합니다.[46][47]
제2차 세계 대전 이후, 미국은 (독일이 그랬던 것처럼) 군사용 코발트 광석의 공급을 보장하기를 원했고, 미국 국경 내에서 코발트를 기대했습니다.아이다호에서 발견된 광석의 충분한 공급은 산 옆 블랙버드 협곡 근처에서 이루어졌습니다.Calera Mining Company라는 회사는 현장에서 생산을 시작했습니다.[48]
코발트가 재생에너지로 작동하고 배터리에 의존하는 세계에서 지정학적 경쟁의 주요 대상 중 하나가 될 것이라는 주장이 제기되었지만, 이러한 관점은 확대된 생산에 대한 경제적 유인의 힘을 과소평가한다는 비판을 받기도 했습니다.[49]
발생
안정한 형태의 코발트는 초신성에서 r-과정을 통해 생성됩니다.[50]지각의 0.0029%를 차지합니다.지구에서는 대기 중의 산소와 바다 중의 염소 때문에 자유 코발트(천연 금속)가 발견되지 않습니다.둘 다 지구 지각의 상층에 충분히 풍부하여 천연 금속 코발트가 형성되는 것을 방지할 수 있습니다.최근에 유성 철로 배달된 것을 제외하고는, 천연 금속 형태의 순수한 코발트는 지구상에 알려지지 않았습니다.그 원소는 중간 정도의 양을 가지고 있지만 코발트의 천연 화합물은 많고 대부분의 암석, 토양, 식물 및 동물에서 소량의 코발트 화합물이 발견됩니다.[citation needed]
자연에서 코발트는 니켈과 종종 관련이 있습니다.코발트는 니켈보다 철 운석에 훨씬 덜 풍부하지만 둘 다 유성철의 특징적인 성분입니다.니켈과 마찬가지로 유성 철 합금의 코발트도 산소와 수분으로부터 보호되어 자유 금속(그러나 합금화된)으로 남아있을 수 있을 정도로 충분히 보호되었을 수 있지만,[51] 고대의 육상 지각에서는 두 원소 모두 그런 형태로 보이지 않습니다.[citation needed]
화합물 형태의 코발트는 구리와 니켈 광물에서 발생합니다.황화 코발트산(CoAs), 사플로라이트(CoAs2), 글라우코닷(Co,Fe)As), 스쿠터루다이트(CoAs3) 광물의 황 및 비소와 결합하는 주요 금속 성분입니다.[14]이 광물인 카티에라이트는 황철석과 비슷하며 카탕가 주의 구리 퇴적물에서 바에사이트와 함께 발생합니다.[52]대기 중에 도달하면 풍화작용이 일어나 황화물 광물이 산화하여 핑크 홍적석("코발트 글랜스": Co3(AsO4)·28)HO2) 및 스페로코발트(CoCO3).[53][54]
코발트는 담배 연기의 성분이기도 합니다.[55]담배 식물은 주변 토양에서 코발트와 같은 중금속을 잎에 쉽게 흡수하고 축적합니다.이들은 이후 담배를 피우는 동안 흡입됩니다.[56]
바다에서.
코발트는 대부분의 해양 분지에서 검출되는 광합성 및 질소 고정에 관여하는 미량 금속이며 식물성 플랑크톤 및 남세균의 제한 미세 영양소입니다.[57][58]Co-함유 복합 코발아민은 남세균과 몇몇 고세균에 의해서만 합성되기 때문에 용해된 코발트 농도가 상층부에서 낮습니다.Mn 및 Fe와 마찬가지로 Co는 대부분의 소거가 복잡한 유기 리간드에 의해 제한되지만 상부 해양에서 광합성 및 심해에서 소거를 통해 식물성 플랑크톤에 의한 생물학적 흡수의 하이브리드 프로파일을 가지고 있습니다.[59][60]Co는 대부분 산화균에 의해 제거되지만 대부분은 바다 아래로 가라앉는 부패한 유기물에 의해 바다에서 재활용됩니다.[citation needed]
많은 해양 생물의 코발트 공급원은 열수 분출구에서 일부 유입되는 강과 육상 유출수를 포함합니다.[61]심해에서 코발트 공급원은 해류가 해저를 휩쓸어 수백만 년에 걸쳐 퇴적물을 제거하여 철망간 지각으로 형성될 수 있도록 해주는 해산(크거나 작을 수 있음)의 꼭대기에서 발견됩니다.[62]해저에 대한 제한된 지도가 이루어졌지만, 예비 조사에 따르면 코발트가 풍부한 지각이 Clarion Clipperton Zone에 위치해 있으며,[63] 이 지역 내 광물이 풍부한 환경으로 인해 심해 채굴 벤처에 대한 관심이 증가하고 있습니다.인위적인 입력은 비천연 공급원으로 기여하지만 매우 적은 양입니다.바다를 가로지르는 용존 코발트(dCo) 농도는 주로 용존 산소 농도가 낮은 저수지에 의해 조절됩니다.바다에서 코발트의 복잡한 생화학적 순환은 아직 완전히 이해되지 않았지만, 남대서양의 산소 최소 구역(OMZ)과 같은 산소가[64] 적은 지역에서 고농도의 패턴이 발견되었습니다.[65]
코발트는 고농도의 해양 환경에 독성이 있는 것으로 간주됩니다.[66]규조류와 같은 플랑크톤의 경우 해양에서 안전한 농도가 18μg/L 내외로 떨어집니다.[citation needed]
생산.

| 나라 | 생산. | 적립금 |
|---|---|---|
| 130,000 | 4,000,000 | |
| 10,000 | 600,000 | |
| 8,900 | 250,000 | |
| 5,900 | 1,500,000 | |
| 3,900 | 220,000 | |
| 3,800 | 500,000 | |
| 3,800 | 260,000 | |
| 3,000 | 100,000 | |
| 3,000 | 47,000 | |
| 2,700 | 36,000 | |
| 2,300 | 13,000 | |
| 2,200 | 140,000 | |
| 800 | 69,000 | |
| 타국 | 5,200 | 610,000 |
| 세계합계 | 190,000 | 8,300,000 |
코발트의 주요 광석은 코발트라이트, 에리스라이트, 글라우코닷 및 스쿠터루다이트(위 참조)이지만 대부분의 코발트는 니켈 및 구리 채굴 및 제련의 코발트 부산물을 감소시켜 얻어집니다.[68][69]
코발트는 일반적으로 부산물로 생산되기 때문에 코발트의 공급은 주어진 시장에서 구리와 니켈 채굴의 경제성에 크게 좌우됩니다.코발트 수요는 2017년에 6% 증가할 것으로 예상됩니다.[70]
모로코의 부-아제르 지역으로 대표되는 극저온 암석과 관련된 열수 퇴적물에서 발생하는 것과 같은 1차 코발트 퇴적물은 희귀합니다.이러한 장소에서 코발트 광석은 낮은 농도이지만 독점적으로 채굴되므로 코발트 추출을 위해 더 많은 다운스트림 처리가 필요합니다.[71][72]
코발트의 농도와 사용된 광석의 정확한 조성에 따라 구리와 니켈에서 코발트를 분리하는 몇 가지 방법이 존재합니다.한 가지 방법은 계면활성제가 광석 성분과 결합하여 코발트 광석을 농축하는 거품 부상입니다.이후 로스팅을 하면 광석이 황산코발트로 바뀌고, 구리와 철은 산화물로 산화됩니다.물로 침출하면 황산염이 비산염과 함께 추출됩니다.잔류물을 황산으로 추가 침출시켜 황산구리 용액을 만듭니다.코발트는 또한 구리 제련의 슬래그에서 침출될 수 있습니다.[73]
위에서 언급한 공정의 생성물은 산화코발트(CoO34)로 변환됩니다.이 산화물은 용광로에서 탄소와의 환원 또는 알루미늄 발열 반응에 의해 금속으로 환원됩니다.[14]

추출.
미국 지질조사국은 코발트의 세계 매장량을 7,100,000 미터 톤으로 추정하고 있습니다.[74]콩고민주공화국(DRC)은 현재 전 세계 코발트의 63%를 생산하고 있습니다.글렌코어(Glencore Plc)와 같은 광산 생산업체의 계획적인 확장이 예상대로 이루어진다면 2025년에는 이 시장 점유율이 73%에 이를 수 있습니다.블룸버그 뉴 에너지 파이낸스는 2030년까지 코발트에 대한 전 세계 수요가 2017년의 47배에 달할 수 있다고 추정했습니다.[75]
콩고가 2002년에 광산법을 개정하면서 콩고의 구리와 코발트 프로젝트에 새로운 투자를 유치했습니다.글렌코어의 무탄다 광산은 2016년 콩고 DRC 생산량의 40%, 전 세계 생산량의 4분의 1에 가까운 24,500톤의 코발트를 선적했습니다.공급 과잉 이후 글렌코어는 2019년 말 무탄다를 2년간 폐쇄했습니다.[76][77]글렌코어에 따르면 글렌코어의 카탕가 광산 프로젝트도 재개되고 있으며 2019년까지 구리 30만톤과 코발트 2만톤을 생산해야 합니다.[70]
콩고 민주 공화국
2005년, 코발트의 최고 생산국은 콩고 민주 공화국의 카탕가 지방에 있는 구리 매장량이었습니다.이전의 샤바 지방은 전 세계 매장량의 거의 40%를 보유하고 있었다고 2009년 영국 지질조사국이 보고했습니다.[78]
장인 광업은 DRC 생산량의 17~40%를 공급했습니다.[79]콩고 민주 공화국에 있는 약 10만 명의 코발트 광부들은 계획이 거의 없고 안전 조치가 덜한 채 수 백 피트를 파내기 위해 수공구를 사용하고 있다고 노동자들과 정부, NGO 관계자들은 말하고 있으며, 고립된 광산을 방문한 워싱턴 포스트 기자들의 관찰도 하고 있습니다.안전 예방 조치가 미흡하여 부상이나 사망의 원인이 되는 경우가 많습니다.[80]보건 당국에 따르면 채굴은 주변을 오염시키고 지역 야생동물과 토착민 공동체를 선천적 장애와 호흡 곤란을 일으키는 것으로 생각되는 독성 금속에 노출시킵니다.[81]
아프리카 장인 광산에서 코발트를 채굴하는 데 아동 노동이 사용됩니다.[79][82]인권운동가들은 이를 강조했고 탐사보도 언론도 이를 확인했습니다.[83][84]2017년 3월 3일 휴대전화 제조업체인 애플사는 DRC의 장인 광산을 공급하는 저장 화요 코발트와 같은 공급업체로부터 광석 구매를 중단하고 작업장 기준에 적합한 것으로 확인된 공급업체만 사용하기 시작했습니다.[85][86]
전 세계적으로 코발트의 전 세계 생산이 공급망의 지속 가능하고 책임감 있게 생산되고 추적 가능하도록 EU와 주요 자동차 제조업체(OEM)에 의해 추진되고 있습니다.광산 회사들은 OECD 지침에 따라 ESG 이니셔티브를 채택하고 실천하고 있으며, 리튬 이온 배터리의 공급망 생산에 탄소 발자국이 0에서 0으로 감소한다는 증거를 제시하고 있습니다.이러한 이니셔티브는 이미 주요 광산 회사, 장인 및 소규모 광산 회사(ASM)와 함께 이루어지고 있습니다. 자동차 제조업체 및 배터리 제조업체 공급망:Tesla, VW, BMW, BASF 및 Glencore는 책임 있는 코발트 이니셔티브 및 코발트 개발 연구와 같은 여러 이니셔티브에 참여하고 있습니다.2018년 삼성SDI와 삼성전자는 BASF와 손잡고 DRC에서 장인 광부와 주변 지역사회의 조건을 개선하고 과제를 해결하기 위해 시범 광산 하나를 두고 시범 프로젝트를 시작했습니다.
이 지역의 정치적, 민족적 역학은 과거에 폭력의 발생과 수년간의 무력 충돌 및 난민 인구를 야기했습니다.이 불안정은 코발트 가격에 영향을 미쳤고, 또한 제1차 콩고 전쟁과 제2차 콩고 전쟁에서 전투원들이 전투를 연장하도록 하는 잘못된 동기를 만들어냈습니다. 다이아몬드 광산과 기타 귀중한 자원에 대한 접근은 종종 대량학살에 해당하는 군사 목표를 재정적으로 조달하는 데 도움이 되었고 전투원들 자신을 풍부하게 했기 때문입니다.콩고 민주 공화국은 2010년대에 인접한 군사력에 의해 최근에 침략당하지는 않았지만, 가장 풍부한 광물 매장량 중 일부는 여전히 투치스와 후투스가 자주 충돌하는 지역과 인접해 있지만, 규모는 작지만 불안은 계속되고 있으며 난민들은 여전히 폭력 사태에서 벗어나고 있습니다.[87]
2007년 콩고의 소규모 장인 광업에서 추출한 코발트는 콩고 둥팡 국제 광업이라는 단일 중국 기업에 공급했습니다.세계 최대 코발트 생산업체 중 하나인 저장 화유 코발트의 자회사인 콩고 동팡(Congo DongFang)은 애플 아이폰과 같은 유비쿼터스 제품용 배터리를 생산하는 세계 최대 배터리 제조업체 중 일부에 코발트를 공급했습니다.LG화학은 이후 OECD 가이드라인에 따라 콩고 동팡을 감사했습니다.자동차 업체의 배터리 소재도 생산하는 LG화학은 검사하는 모든 공급업체에 행동강령을 내렸습니다.[88]
카탕가 주에 있는 중앙아프리카 채굴 및 탐사 회사(CAMEC)가 운영하는 무콘도 산 프로젝트는 세계에서 가장 풍부한 코발트 매장량일 것입니다.2008년 전 세계 코발트 생산량의 약 3분의 1을 생산했습니다.[89]2009년 7월, COMC는 중국의 저장 갈리코 코발트&니켈 머티리얼즈에 연간 코발트 농축액 전량을 공급하기로 장기 계약을 발표했습니다.[90]
2018년 2월 글로벌 자산운용사 얼라이언스번스타인은 DRC를 코발트 자원으로 인해 경제적으로 "전기차 시대의 사우디아라비아"라고 정의했습니다.[91]
2018년 3월 9일 Joseph Kabila 대통령은 2002년 광산법을 업데이트하여 로열티 요금을 인상하고 코발트와 콜탄을 "전략 금속"으로 선언했습니다.[92][93]
2002년 채굴 코드는 2018년 12월 4일에 유효하게 업데이트되었습니다.[94]
2019년 12월, 인권 NGO인 국제 권리 옹호 단체는 애플, 테슬라, 델, 마이크로소프트, 구글 회사 알파벳을 상대로 코발트 채굴에 있어 "어린 아이들의 잔인하고 잔인한 사용으로부터 지식적으로 이익을 얻고 도움을 주고 방조했다"는 획기적인 소송을 제기했습니다.[95]해당 기업들은 아동 노동에 관여한 사실을 부인했습니다.[96]
캐나다
2017년, 일부 탐사 회사들은 상당한 양의 퇴적물이 있는 것으로 추정되는 온타리오주 코발트 지역의 오래된 은과 코발트 광산을 조사할 계획이었습니다.[97]
쿠바
캐나다의 Sherritt International은 쿠바의 모아 광산에서 나오는 니켈 광상에서 코발트 광석을 처리하고 있으며, 이 섬에는 Mayarí, Camagüey, Pinar del Rio에 여러 개의 다른 광산들이 있습니다.셰릿 인터내셔널이 17-20년 동안 광업권을 획득하면서 쿠바 니켈과 코발트 생산에 대한 지속적인 투자를 함으로써 2019년 공산주의 국가는 캐나다보다 먼저 코발트 매장량 3위를 차지했습니다.[98]
인도네시아
인도네시아는 2021년부터 니켈 생산의 부산물로 코발트를 생산하기 시작했습니다.2022년까지 이 나라는 세계에서 두 번째로 큰 코발트 생산국이 되었고 벤치마크 미네랄 인텔리전스는 2030년까지 인도네시아 생산량이 전 세계 생산량의 20%를 차지할 것으로 예측했습니다.[99]
적용들
2016년에는 116,000톤(128,000 쇼트톤)의 코발트가 사용되었습니다.[6]코발트는 고성능 합금 생산에 사용되어 왔습니다.[68][69]일부 충전식 배터리에도 사용됩니다.
합금
코발트계 초합금은 역사적으로 생산된 코발트의 대부분을 소비해 왔습니다.[68][69]이들 합금의 온도 안정성은 니켈계 단결정 합금이 성능을 능가하지만 가스터빈용 터빈 블레이드와 항공기 제트 엔진에 적합합니다.[100]코발트계 합금은 또한 부식과 내마모성이 있어 티타늄처럼 시간이 지나도 마모되지 않는 정형외과 임플란트를 만드는 데 유용합니다.내마모성 코발트 합금의 개발은 20세기 첫 10년 동안 다양한 양의 텅스텐과 탄소를 가진 크롬을 함유한 스텔라이트 합금에서 시작되었습니다.크롬 및 텅스텐 탄화물과의 합금은 매우 단단하고 내마모성이 있습니다.[101]인공 부품(엉덩이 및 무릎 대체품)에는 비탈륨과 같은 특수 코발트-크롬-몰리브덴 합금이 사용됩니다.[102]코발트 합금은 알레르기성일 수 있는 니켈의 유용한 대체물로서 치과 보철에도 사용됩니다.[103]일부 고속 강철에는 열과 내마모성을 높이기 위해 코발트도 포함되어 있습니다.Alnico로 알려진 알루미늄, 니켈, 코발트 및 철의 특수 합금과 사마륨 및 코발트(사마륨–코발트 자석)의 특수 합금이 영구 자석에 사용됩니다.[104]또한 보석용으로 95% 백금과 합금되어 미세 주조에 적합한 합금을 산출하며, 이 또한 약간의 자성을 띠고 있습니다.[105]
건전지
리튬 코발트 산화물(LiCoO2)은 리튬 이온 배터리 음극에 널리 사용됩니다.재료는 리튬이 삽입된 코발트 산화물 층으로 구성됩니다.방전 중(즉, 능동적으로 충전되지 않을 때) 리튬은 리튬 이온으로 방출됩니다.[106]니켈-카드뮴[107](NiCd) 및 니켈 금속 수소화물[108](NiMH) 배터리에는 코발트도 포함되어 있어 배터리 내 니켈의 산화를 개선합니다.[107]투명성 시장 조사는 2015년 전 세계 리튬이온 배터리 시장을 300억 달러로 추정하고 2024년에는 750억 달러 이상으로 증가할 것으로 예측했습니다.[109]
2018년에 배터리의 코발트는 대부분 모바일 장치에 사용되었지만 [110]코발트에 대한 보다 최근의 용도는 전기 자동차용 충전식 배터리입니다.이 산업은 코발트 수요가 5배나 증가하여 세계에서 더 안정적인 지역에서 새로운 원료를 찾는 것이 시급합니다.[111]전기차 보급이 증가함에 따라 수요는 지속되거나 증가할 것으로 예상됩니다.[112]2016-2017년 탐사에는 온타리오주 코발트 주변 지역이 포함되었으며, 이 지역은 수십 년 전에 많은 은 광산이 운영을 중단한 지역입니다.[111]전기차용 코발트는 2018년 상반기 대비 81% 증가한 7,200톤으로, 배터리 용량은 46.3GWh입니다.[113][114]
DR콩고의 장인 광산을 중심으로 코발트 채굴에서 아동 및 노예 노동이 반복적으로 보고된 이후 윤리적 공급망을 모색하는 기술 회사들은 이 원료의 부족에 직면했고[115] 코발트 금속 가격은 2017년 10월 파운드당 30달러 이상으로 2015년 말 10달러에 비해 9년 만에 최고치를 기록했습니다.[116]공급 과잉 이후 2019년에는 가격이 더 정상적인 15달러까지 떨어졌습니다.[117][118]DR 콩고의 장인 코발트 채굴 문제에 대한 대응으로 많은 코발트 공급업체와 그 고객들은 DR 콩고에서 아동 노동의 사용을 중단하고 코발트 채굴 및 가공의 작업 조건을 개선하는 것을 목표로 하는 공정 코발트 연합(FCA)을 결성했습니다.FCA의 회원사로는 저장 화요 코발트, 소노 모터스, 책임 코발트 이니셔티브, 페어폰, 글렌코어 및 테슬라가 있습니다.[119][120]
유럽연합은 리튬이온 배터리 생산에서 코발트 요구량을 제거할 수 있는 가능성에 대한 연구를 진행하고 있습니다.[121][122]배터리 제조사들은 2020년 8월 현재 음극 코발트 함량을 1/3(NMC 111)에서 1/5(NMC 442)으로 점차 줄여 현재 1/10(NMC 811)으로 줄였고, 테슬라 모델 3 등 전기차 배터리 팩에도 코발트 프리 인산철 리튬 음극을 도입했습니다.[123][124]2020년 9월 테슬라는 코발트가 없는 배터리 셀을 직접 만들 계획을 설명했습니다.[125]
리튬 인산철 배터리는 장착 용량 52%로 2021년 3원 코발트 배터리를 공식적으로 앞질렀습니다.2024년에는 시장 점유율이 60%를 넘어설 것이라는 분석이 나오고 있습니다.[126]
촉매제
여러 코발트 화합물은 산화 촉매입니다.코발트 아세테이트는 크실렌을 괴상 고분자 폴리에틸렌 테레프탈레이트의 전구체인 테레프탈산으로 전환하는 데 사용됩니다.대표적인 촉매는 코발트 카르복실레이트(코발트 비누로 알려져 있음)입니다.그들은 또한 건조 오일의 산화를 통해 "건조제"로서 페인트, 바니시 및 잉크에 사용됩니다.[127][106]그러나 독성 우려로 인해 사용이 단계적으로 중단되고 있습니다.[128]강철 벨트 래디얼 타이어에서 강철과 고무 사이의 접착력을 향상시키기 위해 동일한 카르복실레이트가 사용됩니다.또한 폴리에스테르 수지 시스템에서 가속기로 사용됩니다.[129][130][131]
코발트계 촉매는 일산화탄소와 관련된 반응에 사용됩니다.코발트는 또한 Fischer-Tropsch 공정에서 일산화탄소를 액체 연료로 수소화하는 촉매제입니다.[132]알켄의 하이드로포밀화는 종종 코발트 옥타카르보닐을 촉매로 사용합니다.[133]
석유의 수소 탈황은 코발트와 몰리브덴에서 유래한 촉매를 사용합니다.이 공정은 액체 연료의 정제를 방해하는 황 불순물의 석유 세정에 도움이 됩니다.[106]
색소 및 착색


19세기 이전에는 코발트가 주로 안료로 사용되었습니다.중세 시대부터 파란색 유리인 작은 유리를 만드는 데 사용되었습니다.소금은 구운 미네랄인 소금과 석영, 탄산칼륨의 혼합물을 녹여서 생산되며, 이 혼합물은 생산 후 미세하게 분쇄된 검푸른 규산염 유리를 생성합니다.[134]소금은 유리에 색을 입히거나 그림을 그리기 위한 안료로 널리 사용되었습니다.[135]1780년에 스벤 린만은 코발트 그린을 발견했고, 1802년에 루이 자크 테나르는 코발트 블루를 발견했습니다.[136]코발트 블루(코발트 알루미네이트), 세룰렌 블루(코발트(cerulean blue) 등의 코발트 안료II) 스탠네이트), 코발트 그린(코발트의 혼합물)의 다양한 색조II) 산화물 및 산화아연), 코발트 바이올렛(코발트 포스페이트)은 색 안정성이 우수하여 예술가의 안료로 사용됩니다.[137][138]
방사성동위원소
코발트-60(Co-60 또는 Co)은 코발트에 중성자를 충돌시켜 높은 활성으로 예측 가능한 양으로 생성할 수 있기 때문에 감마선 소스로 유용합니다.1.17 및 1.33 MeV의 에너지로 감마선을 생성합니다.[30][139]
코발트는 외부 빔 방사선 치료, 의료 용품 및 의료 폐기물 살균, 살균을 위한 식품의 방사선 처리(냉온 저온 살균),[140] 산업용 방사선 촬영(예: 용접 무결성 방사선 촬영), 밀도 측정(예: 콘크리트 밀도 측정) 및 탱크 충전 높이 스위치에 사용됩니다.금속은 미세먼지를 발생시켜 방사선 방호에 문제를 일으키는 불행한 성질을 가지고 있습니다.방사선 치료기에서 나오는 코발트는 제대로 버려지지 않을 때 심각한 위험 요소로 작용해 왔으며, 1984년 멕시코 후아레스의 폐차장에서 코발트-60이 포함된 버려진 방사선 치료기가 잘못 분해되면서 북미에서 발생한 최악의 방사선 오염 사고 중 하나입니다.[141][142]
코발트-60의 방사능 반감기는 5.27년입니다.효력 상실은 방사선 치료에서 주기적으로 소스를 교체해야 하며, 코발트 기계가 현대 방사선 치료에서 선형 가속기로 대체된 한 가지 이유입니다.[143]코발트-57(Co-57 또는 Co)은 코발트 방사성 동위원소로 의료 테스트, 비타민 B12 흡수용 방사성 표지 및 실링 테스트에 가장 많이 사용됩니다.코발트-57은 뫼스바우어 분광학에서 소스로 사용되며 X선 형광 소자에서 가능한 여러 소스 중 하나입니다.[144][145]
핵무기 설계는 의도적으로 Co를 포함할 수 있으며, 그 중 일부는 핵폭발로 활성화되어 Co를 생산할 수 있습니다.핵 낙진으로 분산된 Co는 코발트 폭탄이라고 불리기도 합니다.[146]
기타 용도
생물학적 역할
코발트는 모든 동물의 신진대사에 필수적입니다.그것은 초미량 원소로서 코발트의 주요 생물학적 저장소인 비타민 B로도12 알려진 코발아민의 주요 구성 요소입니다.[150][151]반추동물의 위 속에 있는 박테리아는 코발트염을 박테리아나 고세균에 의해서만 생산될 수 있는 화합물인 비타민 B로12 바꿉니다.따라서 토양에 최소한의 코발트가 존재하면 방목하는 동물의 건강이 현저하게 개선되며 비타민 B의12 다른 공급원이 없기 때문에 하루 0.20mg/kg 섭취가 권장됩니다.[152]
코발아민을 기반으로 한 단백질은 코린을 사용하여 코발트를 잡아줍니다.코엔자임 B는12 반응에 참여하는 반응성 C-Co 결합을 특징으로 합니다.[153]사람에게서 B는12 메틸과 아데노실의 두 종류의 알킬 리간드를 가지고 있습니다.MeB는12 메틸기 전달을3 촉진합니다.B의12 아데노실 버전은 치환기가 있는 탄소 원자, 알코올의 산소 원자 또는 아민일 수 있는 두 번째 치환기 X의 동시 교환과 함께 인접한 두 원자 사이에 수소 원자가 직접 전달되는 재배열을 촉매합니다.MUT(Methylmalonyl coenzyme A mutase)는 MML-CoA를 Su-CoA로 전환시키는데, 이는 단백질과 지방에서 에너지를 추출하는 중요한 단계입니다.[154]
다른 금속단백질(예: 아연 및 철)에 비해 훨씬 덜 흔하지만, B12 외에도 다른 코발트단백질이 알려져 있습니다.이12 단백질에는 B의 코린 고리를 사용하지 않고 코발트와 직접 결합하는 효소인 메티오닌 아미노펩티다제 2가 포함되어 있습니다.또 다른 비코린 코발트 효소는 니트릴을 대사하는 박테리아의 효소인 니트릴 하이드라타제입니다.[155]
코발트결핍
인간의 경우, 코발트 함유 비타민12 B의 섭취는 코발트에 대한 모든 필요를 충족시킵니다.반추위 내 상주균에 의한 합성을 통해 비타민12 B 요구량을 충족시키는 소와 양에게는 무기코발트의 기능이 있습니다.20세기 초, 뉴질랜드 북섬 화산 고원에서 농업이 발달하는 동안, 소들은 "부시병"이라고 불리는 것으로 고통을 받았습니다.화산 토양에는 소 먹이사슬에 필수적인 코발트염이 부족한 것으로 나타났습니다.[156][157]1930년대 사우스오스트레일리아 남동부의 90마일 사막에서 발생한 양의 "해안 질병"은 미량 원소 코발트와 구리의 영양 결핍에서 비롯되는 것으로 밝혀졌습니다.코발트 결핍은 동물의 반추위에서 숙박하기 위해 경구로 제공되는 점토와 혼합된 산화코발트의 조밀한 펠렛인 "코발트 총알"의 개발로 극복되었습니다.[clarification needed][158][157][159]
-
코발트가 부족한 양
건강문제
| 유해성 | |
|---|---|
| GHS 라벨링:[160] | |
  | |
| 위험 | |
| H302, H317, H319, H334, H341, H350, H360F, H412 | |
| P273, P280, P301+P312, P302+P352, P305+P351+P338, P308+P313 | |
| NFPA704(파이어다이아몬드) | |
가용성 코발트 염의 LD50 값은 150~500mg/kg으로 추정되었습니다.[161]미국에서는 산업안전보건국(OSHA)이 작업장 내 허용 노출 한도(PEL)를 시간 가중치 평균(TWA) 0.1mg/m로3 지정했습니다.미국 산업 안전 보건 연구소(NIOSH)는 권장 노출 한도(REL)를 시간 가중치 평균인 0.05mg/m로3 설정했습니다.IDLH(생명과 건강에 즉시 위험) 값은 20mg/m입니다3.[162]
그러나 만성 코발트 섭취는 치사량보다 훨씬 적은 양에서 심각한 건강 문제를 야기시켰습니다.1966년 캐나다에서 맥주 거품을 안정화시키기 위해 코발트 화합물을 첨가하면서 독특한 형태의 독소 유발 심근병증이 발생했고, 이는 맥주를 마시는 사람의 심근병증으로 알려지게 되었습니다.[163][164]
또한 국제암연구기관(IARC) 모노그래프에 따르면 코발트 금속은 암을 유발하는 것으로 의심됩니다(즉, 발암 가능성이 있는 IARC 그룹 2B).[165]
흡입 시 호흡기 문제를 유발합니다.[166]또한 만졌을 때 피부 문제를 유발합니다. 니켈과 크롬 다음으로 코발트는 접촉성 피부염의 주요 원인입니다.[167]
참고문헌
- ^ "cobalt". Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ "Standard Atomic Weights: Cobalt". CIAAW. 2017.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1117–1119. ISBN 978-0-08-037941-8.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ "cobalt". Oxford English Dictionary (2nd ed.). Oxford University Press. 1989.
- ^ a b Danielle Bochove (November 1, 2017). "Electric car future spurs Cobalt rush: Swelling demand for product breathes new life into small Ontario town". Vancouver Sun. Bloomberg. Archived from the original on July 28, 2019.
- ^ "Catalysts". Cobalt Institute. Retrieved August 15, 2023.
- ^ Enghag, Per (2004). "Cobalt". Encyclopedia of the elements: technical data, history, processing, applications. Wiley. p. 667. ISBN 978-3-527-30666-4.
- ^ Murthy, V. S. R (2003). "Magnetic Properties of Materials". Structure And Properties Of Engineering Materials. McGraw-Hill Education (India) Pvt Limited. p. 381. ISBN 978-0-07-048287-6.
- ^ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (May 1, 2008). Electromagnetic Shielding. Wiley. p. 27. ISBN 978-0-470-05536-6.
- ^ Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). "Surface structures of the two allotropic phases of cobalt". Physical Review B. 17 (4): 1510–1520. Bibcode:1978PhRvB..17.1510L. doi:10.1103/PhysRevB.17.1510.
- ^ "Properties and Facts for Cobalt". American Elements. Archived from the original on October 2, 2008. Retrieved September 19, 2008.
- ^ Cobalt, Centre d'Information du Cobalt, Brussels (1966). Cobalt. p. 45.
{{cite book}}: CS1 maint: 다중 이름: 저자 목록 (링크) - ^ a b c d e Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). "Cobalt". Lehrbuch der Anorganischen Chemie (in German) (102nd ed.). de Gruyter. pp. 1146–1152. ISBN 978-3-11-017770-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. p. 722. ISBN 978-0-13-175553-6.
- ^ Rutley, Frank (December 6, 2012). Rutley's Elements of Mineralogy. Springer Science & Business Media. p. 40. ISBN 978-94-011-9769-4.
- ^ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide (2nd ed.). Greenwood Publishing Group. p. 107. ISBN 0-313-33438-2.
- ^ Petitto, Sarah C.; Marsh, Erin M.; Carson, Gregory A.; Langell, Marjorie A. (2008). "Cobalt oxide surface chemistry: The interaction of CoO(100), Co3O4(110) and Co3O4(111) with oxygen and water". Journal of Molecular Catalysis A: Chemical. 281 (1–2): 49–58. doi:10.1016/j.molcata.2007.08.023. S2CID 28393408.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1119–1120. ISBN 978-0-08-037941-8.
- ^ a b c d e f 토마스 맥커천과 윌리엄 J. 슐레 (1953): "코발트와 크롬의 복잡한 산.녹색 카르보나토코발트(III) 음이온".미국화학회지, 75권, 8쪽, 1845-1846. doi:10.1021/ja01104a019
- ^ H. F. Bauer and W. C. Drinkard(1960): "코발트(III) 복합체의 일반적인 합성; 새로운 중간체, Na3[CO3]·3H2O"미국화학회지, 82권, 19호, 5031-5032페이지. doi:10.1021/ja01504a004.
- ^ Fikru Tafesse, Elias Aphane, Elizabeth Mongadi (2009):"열중량 측정법에 의한 삼탄산나트륨(III), Na3[Co(CO3)3]·3H2O의 구조식의 결정"열분석 및 열량측정 저널, 102권, 1호, 91-97페이지. doi:10.1007/s10973-009-0606-2
- ^ Werner, A. (1912). "Zur Kenntnis des asymmetrischen Kobaltatoms. V". Chemische Berichte. 45: 121–130. doi:10.1002/cber.19120450116.
- ^ Gispert, Joan Ribas (2008). "Early Theories of Coordination Chemistry". Coordination chemistry. Wiley. pp. 31–33. ISBN 978-3-527-31802-5. Archived from the original on May 5, 2016. Retrieved June 27, 2015.
- ^ James E. House (2008). Inorganic chemistry. Academic Press. pp. 767–. ISBN 978-0-12-356786-4. Retrieved May 16, 2011.
- ^ Charles M. Starks; Charles Leonard Liotta; Marc Halpern (1994). Phase-transfer catalysis: fundamentals, applications, and industrial perspectives. Springer. pp. 600–. ISBN 978-0-412-04071-9. Retrieved May 16, 2011.
- ^ Sigel, Astrid; Sigel, Helmut; Sigel, Roland, eds. (2010). Organometallics in Environment and Toxicology (Metal Ions in Life Sciences). Cambridge, UK: Royal Society of Chemistry Publishing. p. 75. ISBN 978-1-84755-177-1.
- ^ Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (January 1, 1986). "Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal". Journal of the Chemical Society, Chemical Communications (19): 1491. doi:10.1039/C39860001491. ISSN 0022-4936.
- ^ Byrne, Erin K.; Theopold, Klaus H. (February 1, 1987). "Redox chemistry of tetrakis(1-norbornyl)cobalt. Synthesis and characterization of a cobalt(V) alkyl and self-exchange rate of a Co(III)/Co(IV) couple". Journal of the American Chemical Society. 109 (4): 1282–1283. doi:10.1021/ja00238a066. ISSN 0002-7863.
- ^ a b c Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ 코발트, æ디아 브리태니커 온라인 백과사전.
- ^ Pulak, Cemal (1998). "The Uluburun shipwreck: an overview". International Journal of Nautical Archaeology. 27 (3): 188–224. doi:10.1111/j.1095-9270.1998.tb00803.x.
- ^ Henderson, Julian (2000). "Glass". The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Routledge. p. 60. ISBN 978-0-415-19933-9.
- ^ Rehren, Th. (2003). "Aspects of the Production of Cobalt-blue Glass in Egypt". Archaeometry. 43 (4): 483–489. doi:10.1111/1475-4754.00031.
- ^ Lucas, A. (2003). Ancient Egyptian Materials and Industries. Kessinger Publishing. p. 217. ISBN 978-0-7661-5141-3.
- ^ a b Dennis, W. H (2010). "Cobalt". Metallurgy: 1863–1963. AldineTransaction. pp. 254–256. ISBN 978-0-202-36361-5.
- ^ "Tariff Information Surveys on the Articles in Paragraph 1- of the Tariff Act of 1913 ... And Related Articles in Other Paragraphs". August 17, 2023.
- ^ 게오르크 브란트는 코발트가 새로운 금속임을 처음으로 보여주었습니다: G. 브란트 (1735) "Dissertatio de semimetallis" (반금속에 관한 논문), Acta Literaria et Scientiarum Sveciae (스웨덴 문학과 과학 저널), vol. 4, 1-10.
참고 항목: (1) G. Brandt (1746) "Rönochan märkningar angäende en synnerlig färg—cobolt" (비범한 색소-코발트에 관한 관찰 및 발언), Kongliga Svenska vetenskapsakademiens handlingar (스웨덴 왕립과학원 거래), vol. 7, pp.119–130; (2) G. Brandt (1748) "Cobalti nova species examinata et descripta" (코발트, 조사되고 기술된 새로운 원소), Acta Regiae Societatis Scientiarum Upsaliensis (Uppsala 왕립과학회 저널), 제1시리즈, vol. 3, pp. 33–41; (3) James L. Marshall and Virginia R.마셜 (2003년 봄) "요소의 재발견: 스웨덴 리다히탄"헥사곤(화학자 알파치 시그마 협회 공식 저널), vol. 94, 1호, 3~8쪽. - ^ Wang, Shijie (2006). "Cobalt—Its recovery, recycling, and application". Journal of the Minerals, Metals and Materials Society. 58 (10): 47–50. Bibcode:2006JOM....58j..47W. doi:10.1007/s11837-006-0201-y. S2CID 137613322.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. III. Some eighteenth-century metals". Journal of Chemical Education. 9 (1): 22. Bibcode:1932JChEd...9...22W. doi:10.1021/ed009p22.
- ^ Ramberg, Ivar B. (2008). The making of a land: geology of Norway. Geological Society. pp. 98–. ISBN 978-82-92394-42-7. Retrieved April 30, 2011.
- ^ Cyclopaedia (1852). C. Tomlinson. 9 divs (ed.). Cyclopædia of useful arts & manufactures. pp. 400–. Retrieved April 30, 2011.
- ^ a b Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Global Nonfuel Mineral Resources and Sustainability". United States Geological Survey.
- ^ a b Westing, Arthur H; Stockholm International Peace Research Institute (1986). "cobalt". Global resources and international conflict: environmental factors in strategic policy and action. Oxford University Press. pp. 75–78. ISBN 978-0-19-829104-6.
- ^ Livingood, J.; Seaborg, Glenn T. (1938). "Long-Lived Radio Cobalt Isotopes". Physical Review. 53 (10): 847–848. Bibcode:1938PhRv...53..847L. doi:10.1103/PhysRev.53.847.
- ^ Wu, C. S. (1957). "Experimental Test of Parity Conservation in Beta Decay". Physical Review. 105 (4): 1413–1415. Bibcode:1957PhRv..105.1413W. doi:10.1103/PhysRev.105.1413.
- ^ Wróblewski, A. K. (2008). "The Downfall of Parity – the Revolution That Happened Fifty Years Ago". Acta Physica Polonica B. 39 (2): 251. Bibcode:2008AcPPB..39..251W. S2CID 34854662.
- ^ "Richest Hole In The Mountain". Popular Mechanics: 65–69. 1952.
- ^ Overland, Indra (March 1, 2019). "The geopolitics of renewable energy: Debunking four emerging myths". Energy Research & Social Science. 49: 36–40. doi:10.1016/j.erss.2018.10.018. ISSN 2214-6296.
- ^ Ptitsyn, D. A.; Chechetkin, V. M. (1980). "Creation of the Iron-Group Elements in a Supernova Explosion". Soviet Astronomy Letters. 6: 61–64. Bibcode:1980SvAL....6...61P.
- ^ Nuccio, Pasquale Mario and Valenza, Mariano (1979). "Determination of metallic iron, nickel and cobalt in meteorites" (PDF). Rendiconti Societa Italiana di Mineralogia e Petrografia. 35 (1): 355–360.
{{cite journal}}: CS1 maint: 다중 이름: 저자 목록 (링크) - ^ Kerr, Paul F. (1945). "Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo" (PDF). American Mineralogist. 30: 483–492.
- ^ Buckley, A. N. (1987). "The Surface Oxidation of Cobaltite". Australian Journal of Chemistry. 40 (2): 231. doi:10.1071/CH9870231.
- ^ Young, R. (1957). "The geochemistry of cobalt". Geochimica et Cosmochimica Acta. 13 (1): 28–41. Bibcode:1957GeCoA..13...28Y. doi:10.1016/0016-7037(57)90056-X.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). "Hazardous Compounds in Tobacco Smok". International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Pourkhabbaz, A; Pourkhabbaz, H (2012). "Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues". Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Bundy, Randelle M.; Tagliabue, Alessandro; Hawco, Nicholas J.; Morton, Peter L.; Twining, Benjamin S.; Hatta, Mariko; Noble, Abigail E.; Cape, Mattias R.; John, Seth G.; Cullen, Jay T.; Saito, Mak A. (October 1, 2020). "Elevated sources of cobalt in the Arctic Ocean". Biogeosciences. 17 (19): 4745–4767. Bibcode:2020BGeo...17.4745B. doi:10.5194/bg-17-4745-2020. Retrieved November 24, 2020.
- ^ Noble, Abigail E.; Lamborg, Carl H.; Ohnemus, Dan C.; Lam, Phoebe J.; Goepfert, Tyler J.; Measures, Chris I.; Frame, Caitlin H.; Casciotti, Karen L.; DiTullio, Giacomo R.; Jennings, Joe; Saito, Mak A. (2012). "Basin-scale inputs of cobalt, iron, and manganese from the Benguela-Angola front to the South Atlantic Ocean". Limnology and Oceanography. 57 (4): 989–1010. Bibcode:2012LimOc..57..989N. doi:10.4319/lo.2012.57.4.0989. ISSN 1939-5590.
- ^ Cutter, Gregory A.; Bruland, Kenneth W. (2012). "Rapid and noncontaminating sampling system for trace elements in global ocean surveys". Limnology and Oceanography: Methods. 10 (6): 425–436. doi:10.4319/lom.2012.10.425.
- ^ Bruland, K. W.; Lohan, M. C. (December 1, 2003). "Controls of Trace Metals in Seawater". Treatise on Geochemistry. 6: 23–47. Bibcode:2003TrGeo...6...23B. doi:10.1016/B0-08-043751-6/06105-3. ISBN 978-0-08-043751-4.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). "On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic". Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS....74....1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ International Seabed Authority. "Cobalt-Rich Crusts" (PDF). isa.org. International Seabed Authority. Retrieved December 30, 2020.
- ^ US Department of Commerce, National Oceanic and Atmospheric Administration. "DeepCCZ: Deep-sea Mining Interests in the Clarion-Clipperton Zone: NOAA Office of Ocean Exploration and Research". oceanexplorer.noaa.gov. National Oceanic and Atmospheric Administration. Retrieved December 30, 2020.
- ^ Hawco, Nicholas J.; McIlvin, Matthew M.; Bundy, Randelle M.; Tagliabue, Alessandro; Goepfert, Tyler J.; Moran, Dawn M.; Valentin-Alvarado, Luis; DiTullio, Giacomo R.; Saito, Mak A. (July 7, 2020). "Minimal cobalt metabolism in the marine cyanobacterium Prochlorococcus". Proceedings of the National Academy of Sciences. 117 (27): 15740–15747. Bibcode:2020PNAS..11715740H. doi:10.1073/pnas.2001393117. PMC 7354930. PMID 32576688.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). "On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic". Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS....74....1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ Karthikeyan, Panneerselvam; Marigoudar, Shambanagouda Rudragouda; Nagarjuna, Avula; Sharma, K. Venkatarama (2019). "Toxicity assessment of cobalt and selenium on marine diatoms and copepods". Environmental Chemistry and Ecotoxicology. 1: 36–42. doi:10.1016/j.enceco.2019.06.001.
- ^ Cobalt Statistics and Information (PDF), U.S. Geological Survey, 2023
- ^ a b c Shedd, Kim B. "Mineral Yearbook 2006: Cobalt" (PDF). United States Geological Survey. Retrieved October 26, 2008.
- ^ a b c Shedd, Kim B. "Commodity Report 2008: Cobalt" (PDF). United States Geological Survey. Retrieved October 26, 2008.
- ^ a b Henry Sanderson (March 14, 2017). "Cobalt's meteoric rise at risk from Congo's Katanga". Financial Times.
- ^ 머레이 W.히츠만, 아서 A.북스트롬, 존 F.슬랙, 그리고 마이클 L. 지엔텍(2017)."코발트—예금의 스타일과 주요 예금의 검색".USGS.2021년 4월 17일 회수.
- ^ "코발트 가격: BMW는 콩고 문제를 일단 피합니다."Mining.com .2021년 4월 17일 회수.
- ^ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. p. 347. ISBN 0-87170-685-7.
- ^ "Cobalt" (PDF). United States Geological Survey, Mineral Commodity Summaries. January 2016. pp. 52–53.
- ^ Wilson, Thomas (October 26, 2017). "We'll All Be Relying on Congo to Power Our Electric Cars". Bloomberg. Retrieved March 25, 2023.
- ^ "Glencore's cobalt stock overhang contains prices despite mine suspension". Reuters. August 8, 2019.
- ^ "Glencore closes Mutanda mine, 20% of global cobalt supply comes offline". Benchmark Mineral Intelligence. November 28, 2019.
the mine would be placed on care and maintenance for a period of no less than two years
- ^ "African Mineral Production" (PDF). British Geological Survey. Retrieved June 6, 2009.
- ^ a b Frankel, Todd C. (September 30, 2016). "Cobalt mining for lithium ion batteries has a high human cost". The Washington Post. Retrieved October 18, 2016.
- ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (February 28, 2018). "Perspective - The hidden costs of cobalt mining". The Washington Post. ISSN 0190-8286. Retrieved March 7, 2018.
- ^ Todd C. Frankel (September 30, 2016). "THE COBALT PIPELINE: Tracing the path from deadly hand-dug mines in Congo to consumers' phones and laptops". The Washington Post.
- ^ 스마트폰과 전기차 배터리 뒤에서 어린이 노동.국제앰네스티(2016-01-19).2018-01-07에 검색됨.
- ^ 크로포드, 알렉스스마트폰을 작동시키기 위해 코발트를 채굴하는 8살 Dorsen을 만나보세요.스카이 뉴스 UK.2018-01-07에 검색됨.
- ^ 당신은 지금 아동 노동의 산물을 들고 있습니까? (영상)Sky News UK (2017-02-28).2018-01-07에 검색됨.
- ^ Reisinger, Don. (2017-03-03) 아동 노동 폭로로 애플은 공급자 정책 변화를 유도합니다.운.2018-01-07에 검색됨.
- ^ Frankel, Todd C. (2017-03-03) 애플은 아동 노동이 지속됨에 따라 콩고의 코발트 공급업체를 더욱 단속합니다.워싱턴 포스트.2018-01-07에 검색됨.
- ^ Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Global Nonfuel Mineral Resources and Sustainability". Retrieved May 16, 2009.
- ^ 콩고 둥팡 국제 광업에 대한 감사 보고서.DNV-GL 2021년 4월 18일 회수.
- ^ "CAMEC – The Cobalt Champion" (PDF). International Mining. July 2008. Retrieved November 18, 2011.
- ^ Amy Witherden (July 6, 2009). "Daily podcast – July 6, 2009". Mining weekly. Retrieved November 15, 2011.
- ^ Mining Journal "The [Ivanhoe] pullback 투자자들이 기다렸습니다", Aspermont Ltd, 2018년 2월 22일, 영국 런던.2018년 11월 21일 회수.
- ^ 샤발랄라, 잔디 "코발트 콩고 전략광물로 선포" 로이터, 2018년 3월 14일2018년 10월 3일 회수]
- ^ 로이터 "콩고의 카빌라, 새로운 채굴 코드에 서명", 2018년 3월 14일.2018년 10월 3일 회수]
- ^ [1]"DRC, 코발트 '전략적' 선언", Mining Journal, 2018년 12월 4일2020년 10월 7일 회수]
- ^ "U.S. cobalt lawsuit puts spotlight on 'sustainable' tech". Sustainability Times. December 17, 2019. Retrieved September 16, 2020.
- ^ "Apple, Google Fight Blame For Child Labor In Cobalt Mines - Law360". www.law360.com. Retrieved September 16, 2020.
- ^ 테슬라가 되살리고 있는 캐나다 유령도시.블룸버그 (2017-10-31).2018-01-07에 검색됨.
- ^ "큐바스 니켈 생산량 5만 톤 돌파"쿠바 비즈니스 리포트.2021년 4월 18일 회수.
- ^ "The biggest source of cobalt outside Africa is now Indonesia". Bloomberg News. February 8, 2023. Retrieved May 10, 2023.
- ^ Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9.
- ^ Campbell, Flake C (June 30, 2008). "Cobalt and Cobalt Alloys". Elements of metallurgy and engineering alloys. ASM International. pp. 557–558. ISBN 978-0-87170-867-0.
- ^ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). "Systemic effects of implanted prostheses made of cobalt-chromium alloys". Archives of Orthopaedic and Trauma Surgery. 110 (2): 61–74. doi:10.1007/BF00393876. PMID 2015136. S2CID 28903564.
- ^ Disegi, John A. (1999). Cobalt-base Aloys for Biomedical Applications. ASTM International. p. 34. ISBN 0-8031-2608-5.
- ^ Luborsky, F. E.; Mendelsohn, L. I.; Paine, T. O. (1957). "Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles". Journal of Applied Physics. 28 (344): 344. Bibcode:1957JAP....28..344L. doi:10.1063/1.1722744.
- ^ Biggs, T.; Taylor, S. S.; Van Der Lingen, E. (2005). "The Hardening of Platinum Alloys for Potential Jewellery Application". Platinum Metals Review. 49: 2–15. doi:10.1595/147106705X24409.
- ^ a b c Hawkins, M. (2001). "Why we need cobalt". Applied Earth Science. 110 (2): 66–71. Bibcode:2001ApEaS.110...66H. doi:10.1179/aes.2001.110.2.66. S2CID 137529349.
- ^ a b Armstrong, R. D.; Briggs, G. W. D.; Charles, E. A. (1988). "Some effects of the addition of cobalt to the nickel hydroxide electrode". Journal of Applied Electrochemistry. 18 (2): 215–219. doi:10.1007/BF01009266. S2CID 97073898.
- ^ Zhang, P.; Yokoyama, Toshiro; Itabashi, Osamu; Wakui, Yoshito; Suzuki, Toshishige M.; Inoue, Katsutoshi (1999). "Recovery of metal values from spent nickel–metal hydride rechargeable batteries". Journal of Power Sources. 77 (2): 116–122. Bibcode:1999JPS....77..116Z. doi:10.1016/S0378-7753(98)00182-7.
- ^ West, Karl (29 July 2017). "Carmakers' electric dreams depend on supplies of rare minerals". The Guardian. eISSN 1756-3224. ISSN 0261-3077. OCLC 60623878. Archived from the original on 6 June 2022. Retrieved 29 June 2022.
- ^ Castellano, Robert (13 October 2017). "How To Minimize Tesla's Cobalt Supply Chain Risk". Seeking Alpha. Archived from the original on 4 April 2022. Retrieved 29 June 2022.
- ^ a b "As Cobalt Supply Tightens, LiCo Energy Metals Announces Two New Cobalt Mines". cleantechnica.com. November 28, 2017. Retrieved January 7, 2018.
- ^ Shilling, Erik (31 October 2017). "We May Not Have Enough Minerals To Even Meet Electric Car Demand". Jalopnik. Archived from the original on 1 April 2022. Retrieved 29 June 2022.
- ^ "State of Charge: EVs, Batteries and Battery Materials (Free Report from @AdamasIntel)". Adamas Intelligence. September 20, 2019. Archived from the original on October 20, 2019. Retrieved October 20, 2019.
- ^ "Muskmobiles running rivals off the road". MINING.COM. September 26, 2019. Archived from the original on September 30, 2019.
- ^ 에르메스, 제니퍼(2017-05-31) Tesla & GE는 윤리적으로 원천이 되는 코발트의 주요 부족에 직면해 있습니다.Environmentalleader.com .2018-01-07에 검색됨.
- ^ 아직 코발트 시장을 금광으로 바꾸지 못한 전기차 – 노르니켈.MINING.com (2017-10-30).2018-01-07에 검색됨.
- ^ "Why Have Cobalt Prices Crashed". International Banker. July 31, 2019. Archived from the original on November 30, 2019.
- ^ "Cobalt Prices and Cobalt Price Charts - InvestmentMine". www.infomine.com.
- ^ "Tesla joins "Fair Cobalt Alliance" to improve DRC artisanal mining". mining-technology.com. September 8, 2020. Retrieved September 26, 2020.
- ^ Klender, Joey (September 8, 2020). "Tesla joins Fair Cobalt Alliance in support of moral mining efforts". teslarati.com. Retrieved September 26, 2020.
- ^ 미래 자동차 애플리케이션을 위한 COBalt-free 배터리 웹사이트
- ^ 유럽연합의 코브라 프로젝트
- ^ Yoo-chul, Kim (August 14, 2020). "Tesla's battery strategy, implications for LG and Samsung". koreatimes.co.kr. Retrieved September 26, 2020.
- ^ Shahan, Zachary (August 31, 2020). "Lithium & Nickel & Tesla, Oh My!". cleantechnica.com. Retrieved September 26, 2020.
- ^ Calma, Justine (September 22, 2020). "Tesla to make EV battery cathodes without cobalt". theverge.com. Retrieved September 26, 2020.
- ^ "EV Lithium Iron Phosphate Battery Battles Back". energytrend.com. May 25, 2022.
- ^ "Cobalt Drier for Paints Cobalt Cem-All®". Borchers. Retrieved May 15, 2021.
- ^ Halstead, Joshua (April 2023). "Expanded Applications and Enhanced Durability of Alkyd Coatings Using High-Performance Catalysts". CoatingsTech. 20 (3): 45–55 – via American Coatings Association.
- ^ Weatherhead, R. G. (1980), Weatherhead, R. G. (ed.), "Catalysts, Accelerators and Inhibitors for Unsaturated Polyester Resins", FRP Technology: Fibre Reinforced Resin Systems, Dordrecht: Springer Netherlands, pp. 204–239, doi:10.1007/978-94-009-8721-0_10, ISBN 978-94-009-8721-0, retrieved May 15, 2021
- ^ "The product selector AOC". aocresins.com. Retrieved May 15, 2021.
- ^ "Comar Chemicals - Polyester Acceleration". www.comarchemicals.com. Archived from the original on May 15, 2021. Retrieved May 15, 2021.
- ^ Khodakov, Andrei Y.; Chu, Wei & Fongarland, Pascal (2007). "Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels". Chemical Reviews. 107 (5): 1692–1744. doi:10.1021/cr050972v. PMID 17488058.
- ^ Hebrard, Frédéric & Kalck, Philippe (2009). "Cobalt-Catalyzed Hydroformylation of Alkenes: Generation and Recycling of the Carbonyl Species, and Catalytic Cycle". Chemical Reviews. 109 (9): 4272–4282. doi:10.1021/cr8002533. PMID 19572688.
- ^ Overman, Frederick (1852). A treatise on metallurgy. D. Appleton & company. pp. 631–637.
- ^ Muhlethaler, Bruno; Thissen, Jean; Muhlethaler, Bruno (1969). "Smalt". Studies in Conservation. 14 (2): 47–61. doi:10.2307/1505347. JSTOR 1505347.
- ^ Gehlen, A. F. (1803). "Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard". Neues Allgemeines Journal der Chemie, Band 2. H. Frölich. (L. J. Thénard로부터의 독일어 번역; Journal des Mines; Brumaire 12 1802; p128–136)
- ^ Witteveen, H. J.; Farnau, E. F. (1921). "Colors Developed by Cobalt Oxides". Industrial & Engineering Chemistry. 13 (11): 1061–1066. doi:10.1021/ie50143a048.
- ^ Venetskii, S. (1970). "The charge of the guns of peace". Metallurgist. 14 (5): 334–336. doi:10.1007/BF00739447. S2CID 137225608.
- ^ Mandeville, C.; Fulbright, H. (1943). "The Energies of the γ-Rays from Sb122, Cd115, Ir192, Mn54, Zn65, and Co60". Physical Review. 64 (9–10): 265–267. Bibcode:1943PhRv...64..265M. doi:10.1103/PhysRev.64.265.
- ^ Wilkinson, V. M; Gould, G (1998). Food irradiation: a reference guide. Woodhead. p. 53. ISBN 978-1-85573-359-6.
- ^ Blakeslee, Sandra (May 1, 1984). "The Juarez accident". The New York Times. Retrieved June 6, 2009.
- ^ "Ciudad Juarez orphaned source dispersal, 1983". Wm. Robert Johnston. November 23, 2005. Retrieved October 24, 2009.
- ^ National Research Council (U.S.). Committee on Radiation Source Use and Replacement; National Research Council (U.S.). Nuclear and Radiation Studies Board (January 2008). Radiation source use and replacement: abbreviated version. National Academies Press. pp. 35–. ISBN 978-0-309-11014-3. Retrieved April 29, 2011.
- ^ Meyer, Theresa (November 30, 2001). Physical Therapist Examination Review. SLACK Incorporated. p. 368. ISBN 978-1-55642-588-2.
- ^ Kalnicky, D.; Singhvi, R. (2001). "Field portable XRF analysis of environmental samples". Journal of Hazardous Materials. 83 (1–2): 93–122. doi:10.1016/S0304-3894(00)00330-7. PMID 11267748.
- ^ Payne, L. R. (1977). "The Hazards of Cobalt". Occupational Medicine. 27 (1): 20–25. doi:10.1093/occmed/27.1.20. PMID 834025.
- ^ Puri-Mirza, Amna (2020). "Morocco Cobalt Production". Statistica.
- ^ Davis, Joseph R; Handbook Committee, ASM International (May 1, 2000). "Cobalt". Nickel, cobalt, and their alloys. ASM International. p. 354. ISBN 978-0-87170-685-0.
- ^ Committee On Technological Alternatives For Cobalt Conservation, National Research Council (U.S.); National Materials Advisory Board, National Research Council (U.S.) (1983). "Ground–Coat Frit". Cobalt conservation through technological alternatives. p. 129.
- ^ Yamada, Kazuhiro (2013). "Chapter 9. Cobalt: Its Role in Health and Disease". In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 295–320. doi:10.1007/978-94-007-7500-8_9. PMID 24470095.
- ^ Cracan, Valentin; Banerjee, Ruma (2013). "Chapter 10 Cobalt and Corrinoid Transport and Biochemistry". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 333–374. doi:10.1007/978-94-007-5561-1_10. ISBN 978-94-007-5560-4. PMID 23595677. 전자서적 ISBN 978-94-007-5561-1 ISSN 1559-0836 전자-ISSN 1868-0402
- ^ Schwarz, F. J.; Kirchgessner, M.; Stangl, G. I. (2000). "Cobalt requirement of beef cattle – feed intake and growth at different levels of cobalt supply". Journal of Animal Physiology and Animal Nutrition. 83 (3): 121–131. doi:10.1046/j.1439-0396.2000.00258.x.
- ^ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. p. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ^ Smith, David M.; Golding, Bernard T.; Radom, Leo (1999). "Understanding the Mechanism of B12-Dependent Methylmalonyl-CoA Mutase: Partial Proton Transfer in Action". Journal of the American Chemical Society. 121 (40): 9388–9399. doi:10.1021/ja991649a.
- ^ Kobayashi, Michihiko; Shimizu, Sakayu (1999). "Cobalt proteins". European Journal of Biochemistry. 261 (1): 1–9. doi:10.1046/j.1432-1327.1999.00186.x. PMID 10103026.
- ^ "Soils". Waikato University. Archived from the original on January 25, 2012. Retrieved January 16, 2012.
- ^ a b McDowell, Lee Russell (2008). Vitamins in Animal and Human Nutrition (2nd ed.). Hoboken: John Wiley & Sons. p. 525. ISBN 978-0-470-37668-3.
- ^ Australian Academy of Science > Death Fellows > Hedley Ralph Marston 1900–1965 접근 2013년 5월 12일.
- ^ Snook, Laurence C. (1962). "Cobalt: its use to control wasting disease". Journal of the Department of Agriculture, Western Australia. 4. 3 (11): 844–852.
- ^ "Cobalt 356891". Sigma-Aldrich. October 14, 2021. Retrieved December 22, 2021.
- ^ Donaldson, John D. and Beyersmann, Detmar (2005) "코발트와 코발트 화합물" 울만의 산업 화학 백과사전, Wiley-VCH, Weinheim.doi:10.1002/14356007.a07_281.pub2
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0146". National Institute for Occupational Safety and Health (NIOSH).
- ^ Morin Y; Tětu A; Mercier G (1969). "Quebec beer-drinkers' cardiomyopathy: Clinical and hemodynamic aspects". Annals of the New York Academy of Sciences. 156 (1): 566–576. Bibcode:1969NYASA.156..566M. doi:10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148. S2CID 7422045.
- ^ Barceloux, Donald G. & Barceloux, Donald (1999). "Cobalt". Clinical Toxicology. 37 (2): 201–216. doi:10.1081/CLT-100102420. PMID 10382556.
- ^ [PDF]
- ^ Elbagir, Nima; van Heerden, Dominique; Mackintosh, Eliza (May 2018). "Dirty Energy". CNN. Retrieved May 30, 2018.
- ^ Basketter, David A.; Angelini, Gianni; Ingber, Arieh; Kern, Petra S.; Menné, Torkil (2003). "Nickel, chromium and cobalt in consumer products: revisiting safe levels in the new millennium". Contact Dermatitis. 49 (1): 1–7. doi:10.1111/j.0105-1873.2003.00149.x. PMID 14641113. S2CID 24562378.
더보기
- Harper, E. M.; Kavlak, G.; Graedel, T. E. (2012). "Tracking the metal of the goblins: Cobalt's cycle of use". Environmental Science & Technology. 46 (2): 1079–86. Bibcode:2012EnST...46.1079H. doi:10.1021/es201874e. PMID 22142288. S2CID 206948482.
- Narendrula, R.; Nkongolo, K. K.; Beckett, P. (2012). "Comparative soil metal analyses in Sudbury (Ontario, Canada) and Lubumbashi (Katanga, DR-Congo)". Bulletin of Environmental Contamination and Toxicology. 88 (2): 187–92. doi:10.1007/s00128-011-0485-7. PMID 22139330. S2CID 34070357.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). "The combined effect of abandoned mines and agriculture on groundwater chemistry". Journal of Contaminant Hydrology. 115 (1–4): 64–78. Bibcode:2010JCHyd.115...64P. doi:10.1016/j.jconhyd.2010.04.003. PMID 20466452.
- Bulut, G. (2006). "Recovery of copper and cobalt from ancient slag". Waste Management & Research. 24 (2): 118–24. doi:10.1177/0734242X06063350. PMID 16634226. S2CID 24931095.
- Jefferson, J. A.; Escudero, E.; Hurtado, M. E.; Pando, J.; Tapia, R.; Swenson, E. R.; Prchal, J.; Schreiner, G. F.; Schoene, R. B.; Hurtado, A.; Johnson, R. J. (2002). "Excessive erythrocytosis, chronic mountain sickness, and serum cobalt levels". Lancet. 359 (9304): 407–8. doi:10.1016/s0140-6736(02)07594-3. PMID 11844517. S2CID 12319751.
- Løvold, T. V.; Haugsbø, L. (1999). "Cobalt mining factory--diagnoses 1822-32". Tidsskrift for den Norske Laegeforening. 119 (30): 4544–6. PMID 10827501.
- Bird, G. A.; Hesslein, R. H.; Mills, K. H.; Schwartz, W. J.; Turner, M. A. (1998). "Bioaccumulation of radionuclides in fertilized Canadian Shield lake basins". The Science of the Total Environment. 218 (1): 67–83. Bibcode:1998ScTEn.218...67B. doi:10.1016/s0048-9697(98)00179-x. PMID 9718743.
- Nemery, B. (1990). "Metal toxicity and the respiratory tract". The European Respiratory Journal. 3 (2): 202–19. doi:10.1183/09031936.93.03020202. PMID 2178966.
- Kazantzis, G. (1981). "Role of cobalt, iron, lead, manganese, mercury, platinum, selenium, and titanium in carcinogenesis". Environmental Health Perspectives. 40: 143–61. doi:10.1289/ehp.8140143. PMC 1568837. PMID 7023929.
- Kerfoot, E. J.; Fredrick, W. G.; Domeier, E. (1975). "Cobalt metal inhalation studies on miniature swine". American Industrial Hygiene Association Journal. 36 (1): 17–25. doi:10.1080/0002889758507202. PMID 1111264.
외부 링크
- . Encyclopædia Britannica. Vol. VI (9th ed.). 1878. pp. 81–83.
- 비디오의 주기율표의 코발트 (노팅엄 대학교)
- 질병예방센터 – 코발트
- 코발트 연구소
- 책임 코발트 연구소 2021-03-07 웨이백 기계 보관