하이브리드마 기술
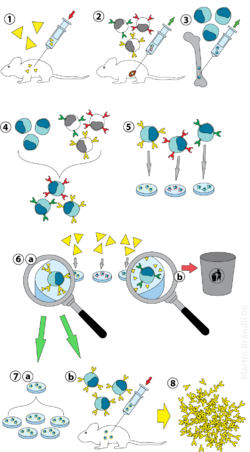
Hybridoma technology하이브리드마 기술은 동일한 항체를 대량으로 생산하는 방법이다(일원성 항체라고도 한다). 이 과정은 면역 반응을 유발하는 항원을 쥐(또는 다른 포유동물)에게 주입하는 것으로 시작한다. 백혈구의 한 종류인 B세포는 주사된 항원과 결합하는 항체를 생성한다. 그런 다음 B세포를 생산하는 이 항체는 쥐로부터 수확되어 근종인 불멸의 B세포 암세포와 융합되어 B세포의 항체생성능력과 근종의 장수와 재귀성을 모두 가진 복합세포종이라는 복합세포라인을 생산하게 된다.[clarification needed] 하이브리드오마는 하나의 생존 가능한 하이브리드종 세포로 시작하는 각각의 문화에서 자랄 수 있으며, 각각의 문화는 서로 다른 항체(폴리클론)의 혼합이 아니라 하나의 항체를 생성하는 유전적으로 동일한 하이브리드오마로 구성되어 있다. 이 과정에서 사용되는 골수종 세포 라인은 조직 배양에서 성장 능력이 뛰어나고 항체 합성이 없다는 이유로 선택된다. 여러 항체 분자가 혼합되어 있는 다면체 항체와 대조적으로, 각 복합종양 라인에 의해 생성된 단면체 항체는 모두 화학적으로 동일하다.
단핵 항체의 생산은 1975년 세사르 밀슈타인과 조르주 J. F. 쾰러에 의해 발명되었다. 그들은 면역학에 다른 공헌을 한 닐스 카즈 제른과 1984년 노벨 의학상 및 생리학상을 공동 수상했다. 하이브리드마라는 용어는 1976~1977년 세사르 밀슈타인의 실험실에서 열린 안식년 동안 레오나드 헤르젠버그에 의해 만들어졌다.[1]
방법
실험실 동물(예: 쥐)은 항체가 생성될 항원에 먼저 노출된다. 보통 이것은 문제의 항원을 몇 주 동안 연속적으로 주사함으로써 이루어진다. 이러한 주사는 일반적으로 면역 반응을 크게 향상시키는 생체내 전기회전을 사용한다. 일단 스플렌세포가 포유류의 비장과 격리되면, B세포는 불멸의 골수종 세포와 융합된다. 골수종 세포와 B 세포의 융합은 전기융합을 이용하여 이루어질 수 있다. 전착은 B세포와 골수종 세포가 전기장의 적용에 맞춰 정렬되고 융합되게 한다. 대신에, B세포와 골수종은 화학 규약에 의해 융합되도록 만들어질 수 있는데, 가장 흔히 폴리에틸렌 글리콜을 사용한다. 골수종 세포는 항체 자체를 분비하지 않고, 저산산산틴-과닌인산인산화효소(HGPRT) 유전자가 부족하여 HAT 매체에 민감하게 반응(아래 참조)하기 위해 미리 선택한다.
융합세포는 HAT 배지(저산산산틴-아미노프테린-타이미딘 배지)에 약 10~14일 동안 배양된다. 아미노프테린은 뉴클레오티드 합성을 허용하는 경로를 차단한다. 따라서 미사용 골수종 세포는 HGPRT가 없기 때문에 데 노보나 인양 경로로 뉴클레오티드를 생산할 수 없기 때문에 죽는다. 미사용 골수종 세포의 제거는 다른 세포들, 특히 약하게 확립된 복합체를 능가할 수 있는 잠재력을 가지고 있기 때문에 필요하다. 사용되지 않은 B세포는 수명이 짧기 때문에 죽는다. 이런 식으로 B세포에서 나오는 HGPRT 유전자가 기능하기 때문에 B세포 골수종 하이브리드만이 살아남는다. 이들 세포는 항체(B세포의 성질)를 생성하며 불멸(골수종 세포의 성질)이다. 배양된 매체는 각각의 웰이 하나의 셀만 포함할 정도로 다중 웰 플레이트로 희석된다. 우물 안의 항체는 동일한 B세포에 의해 생성되기 때문에, 그것들은 동일한 비문을 향하게 될 것이고, 따라서 단핵항체다.
다음 단계는 빠른 1차 선별 과정으로, 적절한 특수성의 항체를 생산하는 하이브리드오마만을 식별하고 선정한다. 첫 번째 선별 기법은 ELISA라고 불린다. 혼합종 배양 상등효소, 이차 효소인 결합효소, 색소생성 기질이 인큐베이팅되며, 색소생물의 형성은 양성 잡종임을 나타낸다. 대신 면역세포화학,[2] 웨스턴 블롯, 면역복제-질량분석 검사도 사용할 수 있다. Western blot assays와는 달리, 면역소모-질량분석법은 토종(비불포화) 항원단백질에 결합하는 클론의 선별과 순위를 용이하게 한다.[3]
원하는 항체를 생산하는 B세포는 많은 동일한 딸 복제를 위해 복제될 수 있다. 인터루킨-6(예: 브리클론)을 포함한 보충 매체는 이 단계를 위해 필수적이다. 잡종군락지가 조성되면 RPMI-1640(항생제, 태아소 혈청)과 같은 배양액에서 지속적으로 성장해 항체를 생산하게 된다.[2]
멀티웰 플레이트는 처음에는 하이브리드오마(hybridomas)를 재배하기 위해 사용되며, 선택 후에는 더 큰 조직 배양 플라스크로 변경된다. 이것은 혼혈아의 안녕을 유지하고 후속 조사를 위해 극저온 보존과 상등성을 위한 충분한 세포를 제공한다. 배양 상등액은 1 ~ 60 μg/ml의 단클론 항체를 산출할 수 있으며, 이 항체는 필요할 때까지 -20 °C 이하로 유지된다.[2]
배양 상등효소 또는 정제된 면역글로불린 조제를 사용함으로써, 복합종을 생성하는 잠재적 단클론 항체의 추가 분석이 반응성, 특수성, 교차 반응성의 측면에서 이루어질 수 있다.[2]
적용들
단클론 항체의 사용은 많고 질병의 예방, 진단, 치료를 포함한다. 예를 들어, 단클론 항체는 B 세포와 T 세포의 하위 세트를 구별할 수 있는데, 이것은 다른 종류의 백혈병을 식별하는 데 도움이 된다. 또한 백혈구 및 기타 세포 유형에 대한 세포 표면 표지를 정의하기 위해 특정 단핵 항체가 사용되어 왔다. 이것은 마커의 차별화 시리즈로 이어졌다. 이것들은 종종 CD 마커라고 불리며 각각 특정 단클론 항체의 결합에 의해 지정된 세포의 수백 가지 다른 세포 표면 구성요소를 정의한다. 그러한 항체는 형광 활성 세포 분류, 특정 유형의 세포의 특정한 격리에 매우 유용하다.
진단 조직병리학에서
단클론 항체의 도움으로 조직과 장기는 조직이나 세포 창조를 반영하는 특정한 정의된 표지의 표현에 기초하여 분류될 수 있다. 전립선 특이 항원, 태즈메탈 알칼리성 인산염, 인간 초리오닉 곤나도트로핀, α-페토프로틴 등은 장기 관련 항원이며 이들 항원에 대한 단핵 항체의 생성이 1차 종양의 성질을 결정하는 데 도움이 된다.[2]
단클론 항체는 흉막 및 복막 중피종, 아데노카르신종과 같이 형태학적으로 유사한 병변을 구별하고 미분화 전이물의 장기 또는 조직 유래를 파악하는 데 특히 유용하다. 선택된 단성형 항체는 골수, 기타 조직 흡인체, 림프절 및 기타 조직의 면역-사이톨로지 분석에 의해 오컬트 전이(미지 일차 원인의 암)의 검출에 도움을 주며 정상 조직병리학적 얼룩에 대한 민감도를 높일 수 있다.[2]
한 연구는[4] 국소 전립선암 환자 20명의 골수 흡인물에 대해 민감한 면역-역사화학 검사를 수행했다. 이번 검사에는 종양세포를 검출하기 위해 상피세포가 발현한 막과 세포골격계 항원을 인식할 수 있는 단핵항체(T16, C26, AE-1) 3개가 사용됐다. 국소 전립선암 환자(B, 0/5; C, 2/4)의 22%와 전이성 전립선암 환자(D1, 0/7 환자, D2, 4/4 환자)의 골수 흡인도는 골수에 항원 양성 세포가 있었다. 골수 흡인체의 면역-히스토케미컬 얼룩은 국소 전립선암으로 보이는 환자들의 후두골수 전이 검출에 매우 유용하다는 결론을 내렸다.
종양 관련 단핵항체를 이용한 면역-사이토화학이 골수 흡인체와 말초혈액에서 오컬트 유방암 세포를 검출할 수 있는 능력을 향상시켰지만, 일상적으로 이용되기 위해서는 이 방법의 추가 개발이 필요하다.[5] 면역-사이토케미학의 한 가지 큰 단점은 종양 관련 항체만 사용하고 종양 특이 단핵항체만 사용하며 그 결과 정상세포와 어느 정도 교차반응이 일어날 수 있다는 점이다.[6]
자가 줄기세포 주입에 앞서 유방암을 효과적으로 진행시키고 숙청요법의 효능을 평가하기 위해서는 소량의 유방암 세포라도 검출하는 것이 중요하다. 면역-역사화학적 방법은 간단하고 민감하며 상당히 구체적이기 때문에 이 목적에 이상적이다. 프랭클린 외 연구진은 [7]골수와 말초혈액에서 유방 종양세포 표면 당단백질(260F9, 520C9, 317G5, BrE-3)에 대해 4개의 단핵항체(260F9, 520C9, 317G5 및 BrE-3)를 조합해 민감한 면역-사이토케미칼 검사를 실시했다. 그들은 그 결과로부터 골수와 말초혈액의 면역-사이토케미컬 얼룩이 유방암 세포를 검출하고 정량화하는 민감하고 간단한 방법이라는 결론을 내렸다.
고형 종양 환자의 전이적 재발의 주요 원인 중 하나는 악성 세포의 조기 보급이다. 사이토케라틴 전용 단핵항체(mAbs)를 사용하면 골수에서 전파된 개별 상피종양세포를 식별할 수 있다.
한 연구는[8] 사이토케라틴 성분 18번(CK18)과 전립선 특이 항원(PSA)의 동시 표지를 위한 면역-사이토케미컬 절차를 개발했다고 보고한다. 이것은 전립선암 환자들에게 퍼진 개별 상피종양 세포의 추가적인 특성화에 도움이 될 것이다. 양성 전립선비대증 환자의 12개 대조군 기도는 음성의 얼룩을 보였으며, 이는 골수에서 상피 종양 세포를 검출하는 데 있어 CK18의 특수성을 더욱 뒷받침한다.
유출로 복잡해진 악성 질환의 경우 대부분 신소성세포가 쉽게 인지될 수 있다. 그러나 경우에 따라서는 악성 세포가 그렇게 쉽게 보이지 않거나 그 존재가 너무 의심스러워 이를 긍정적인 보고라고 할 수 없다. 면역-사이토케미칼 기법을 사용하면 이러한 경우 진단 정확도가 높아진다.
Ghosh, Mason, Spriggs는[9] 악성 질환을 앓고 있는 41명의 환자들로부터 53개의 흉막 또는 복막액 샘플을 분석했다. 종래의 세포학 검사에서는 신소성 세포가 발견되지 않았다. 악성 세포 검색에는 3개의 단핵항체(anti-CEA, Ca1, HMFG-2)가 사용되었다. 면역세포화학적 라벨 표시는 최대 18개월까지 -20°C에서 저장되어 온 비균형 얼룩에 대해 수행되었다. 면역-사이토케미칼 얼룩이 진행된 41건 중 12건이 악성세포를 드러냈다. 그 결과는 진단 정확도의 약 20% 증가를 나타냈다. 이 연구는 악성 질환이 의심되는 환자의 경우 면역-사이토화학 표지를 세포학적으로 음성 검체의 검사에 일상적으로 사용해야 하며 환자 관리와 관련하여 중요한 의미를 갖는다고 결론지었다.
면역-사이토케미컬 얼룩의 또 다른 적용은 같은 얼룩에서 두 개의 항원을 검출하는 것이다. 라이트 체인 항체와 T 및 B 세포 표지를 사용한 이중 얼룩은 림프종의 신소성 원점을 나타낼 수 있다.[10]
한 연구에서는 단핵항체(IgM, k 이소형)를 생산하는 복합종양세포선(clone 1E10)의 격리가 보고됐다. 이 단클론 항체는 핵올리의 특정 면역-사이토케미컬 얼룩을 보여준다.[11]
조직과 종양은 단클론 항체의 도움을 받아 특정 표지의 표현에 기초하여 분류할 수 있다. 그것들은 형태학적으로 유사한 병변을 구별하고 구분되지 않은 전이체의 장기 또는 조직 원점을 결정하는 데 도움이 된다. 선택된 단핵항체를 사용한 골수, 조직 흡인체, 림프절 등의 면역-사이톨로지 분석은 오컬트 전이 검출에 도움이 된다. 단클론 항체는 적은 양의 침습성 또는 전이성 세포라도 검출하는 민감도를 높인다. 사이토케라틴 전용 단핵항체(mAbs)는 골수에서 퍼진 개별 상피종양세포를 검출할 수 있다.
참조
- ^ Milstein, C (1999). "The hybridoma revolution: an offshoot of basic research". BioEssays. 21 (11): 966–73. doi:10.1002/(SICI)1521-1878(199911)21:11<966::AID-BIES9>3.0.CO;2-Z. PMID 10517870.
- ^ a b c d e f Nelson, PN; Reynolds, GM; Waldron, EE; Ward, E; Giannopoulos, K; Murray, PG (2000). "Demystified ...: Monoclonal antibodies". Molecular Pathology. 53 (3): 111–7. doi:10.1136/mp.53.3.111. PMC 1186915. PMID 10897328.
- ^ Korbakis, D; Brinc, D; Schiza, C; Soosaipillai, A; Jarvi, K; Drabovich, AP; Diamandis, E (2015). "Immunocapture-selected reaction monitoring screening facilitates the development of ELISA for the measurement of native TEX101 in biological fluids". Molecular & Cellular Proteomics. 14 (6): 1517–1526. doi:10.1074/mcp.M114.047571. PMC 4458717. PMID 25813379.
- ^ Bretton, PR; Melamed, MR; Fair, WR; Cote, RJ (1994). "Detection of occult micrometastases in the bone marrow of patients with prostate carcinoma". Prostate. 25 (2): 108–14. doi:10.1002/pros.2990250208. PMID 7518596.
- ^ Kvalheim, G (1996). "Detection of occult tumor cells in bone marrow and blood in breast cancer patients—methods and clinical significance". Acta Oncol. 35: 13–18. doi:10.3109/02841869609098516. PMID 9073044.
- ^ Kvalheim, G (1998). "Diagnosis of minimal residual disease in bone marrow and blood in cancer patients--methods and clinical implications". Acta Oncologica. 37 (5): 455–62. doi:10.1080/028418698430403. PMID 9831374.
- ^ Franklin, WA; Shpall, EJ; Archer, P; Johnston, CS; Garza-Williams, S; Hami, L; Bitter, MA; Bast, RC; Jones, RB (1996). "Immunocytochemical detection of breast cancer cells in marrow and peripheral blood of patients undergoing high dose chemotherapy with autologous stem cell support". Breast Cancer Res Treat. 41 (1): 1–13. doi:10.1007/BF01807031. PMID 8932871.
- ^ Riesenberg, R; Oberneder, R; Kriegmair, M; Epp, M; Bitzer, U; Hofstetter, A; Braun, S; Riethmüller, G; Pantel, K (1993). "Immunocytochemical double staining of cytokeratin and prostate specific antigen in individual prostatic tumour cells". Histochemistry. 99 (1): 61–6. doi:10.1007/BF00268022. PMID 7682210.
- ^ Ghosh, AK; Mason, D Y; Spriggs, A I (1983). "Immunocytochemical staining with monoclonal antibodies in cytologically "negative" serous effusions from patients with malignant disease". J Clin Pathol. 36 (10): 1150–53. doi:10.1136/jcp.36.10.1150. PMC 498493. PMID 6194182.
- ^ Ghosh, AK; Spriggs, AI; Taylor-Papadimitriou, J; Mason, DY (1983). "Immunocytochemical staining of cells in pleural and peritoneal effusions with a panel of monoclonal antibodies". J Clin Pathol. 36 (10): 1154–64. doi:10.1136/jcp.36.10.1154. PMC 498494. PMID 6194183.
- ^ Vissers, CJ; Flohil, CC; De Jong, AA; Dinjens, WN; Bosman, FT (1996). "A new monoclonal antibody for specific immunocytochemical staining of nucleoli". Acta Histochemica. 98 (2): 113–21. doi:10.1016/S0065-1281(96)80028-6. PMID 8739296.
외부 링크
- 미국 국립 의학 도서관의 하이브리드마(MeSH) 제목
- "Hybridoma Technology". Understanding Cancer Series: The Immune System. National Cancer Institute. Archived from the original on 5 October 2014.
- "Hybridoma Cell Culture".