이황화 실리콘
Silicon disulfide | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 황화 규소 | |
| 기타 이름 이황화 실리콘 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.033.935 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| SiS2 | |
| 어금질량 | 92.218 g/190 |
| 외관 | 흰색(샘플은 때때로 회색 또는 갈색) 바늘. 썩은 달걀은 습한 공기에서 냄새가 난다. |
| 밀도 | 1.853 g/cm3 |
| 녹는점 | 1,090°C(1,990°F, 1,360K) 하위 시간 |
| 디컴포스 | |
| 구조 | |
| 정형외과, oI12 | |
| 이밤로72번길[1] | |
| 사면체 | |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
| 관련 화합물 | |
기타 음이온 | 이산화 규소 |
기타 양이온 | 이황화 탄소 이황화 게르마늄 황화 주석 황화 납(IV) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
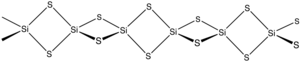
이황화 실리콘은 SiS라는2 공식을 가진 무기 화합물이다. 이산화규소처럼 이 물질은 중합체지만 일반적인 형태의 SiO와는2 상당히 다른 1차원 구조를 채택하고 있다.
합성, 구조 및 특성
이 물질은 실리콘과 황을 가열하거나 SiO와2 ALS 사이의23 교환 반응에 의해 형성된다. 소재는 가장자리 공유 테트라헤드라, Si(μ-S)2Si(μS)2 등으로 구성된 체인으로 구성된다.[2]
다른 실리콘 황 혼합물(예: bis(트리메틸실릴)설황화)과 마찬가지로 SiS는2 HS를2 방출하기 위해 쉽게 가수분해한다. 액체 암모니아에서는 이미드 Si(NH)2와 NHSH를4 형성한다고 보고되었으나,[3] 최근 보고에서 결정체(NH4)[2SiS3(NH3)]·2가 확인되었다.4면체 티오실리케이트 음이온 SiS3(NH3)를 포함하는 제품으로서의 NH3.[4]
에탄올과의 반응은 알카산화 테트라에틸 정형화합물과 HS를2 준다.[3] 부피가 큰 테르트 부탄올과 함께 알콜리시스(alcoholyis)는 트리스(tert-butoxy)실라네티올을 제공한다.[5]
- 3 (CH3)3COH + SiS2 → [(CH3)3CO]3SiSH + HS2
황화나트륨, 황화마그네슘, 황화알루미늄과 반응하면 티오실화물이 나온다.[3]
SiS는2 특정 성간 물체에서 발생한다고 한다.[6]
참조
- ^ Weiss, A.; Weiss, A. (1954). "Über Siliciumchalkogenide. VI. Zur Kenntnis der faserigen Siliciumdioxyd-Modifikation". Zeitschrift für Anorganische und Allgemeine Chemie. 276 (1–2): 95–112. doi:10.1002/zaac.19542760110.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5. 이 책의 인쇄 오류에 따르면 r은SiSi 214 피코미터라고 되어 있는데, 실제로 그 거리가 r을SiS 묘사하고 있다.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 359. ISBN 978-0-08-022057-4.
- ^ Meier, Martin; Korber, Nikolaus (2009). "The first thiosilicate from solution: synthesis and crystal structure of (NH4)2[SiS3(NH3)]·2NH3". Dalton Transactions (9): 1506–1508. doi:10.1039/b818856d. ISSN 1477-9226. PMID 19421590.
- ^ R. Piękoś, W. Wojnowski (1962). "Untersuchungen über die Alkoholyse des SiS2. II. Darstellung von Trialkoxysilanthiolen und Tetraalkoxycyclodisilthianen aus den tertiären Alkoholen". Z. Anorg. Allg. Chem. 318: 212–216. doi:10.1002/zaac.19623180310.
- ^ Goebel, J. H. (1993). "SiS2 in Circumstellar Shells" (PDF). Astronomy and Astrophysics. 278 (1): 226–230. Bibcode:1993A&A...278..226G.



