아밀로이드-베타 전구단백질
Amyloid-beta precursor protein
아밀로이드 전구 단백질(APP)은 많은 조직에서 발현되고 뉴런의 시냅스에 농축된 일체형 막 단백질이다. 세포 표면 수용체[5] 역할을 하며 시냅스 형성,[6] 신경 가소성,[7] 항균 활성,[8] 철 수출의 조절기로 관여해왔다.[9] 그것은 유전자 APP에 의해 코딩되고 기질 표시에 의해 조절된다.[10] APP는 프로테롤리시스(proteolyis)가 37~49개의 아미노산 잔류물을 함유한 폴리펩타이드인 아밀로이드 베타(Aβ)를 생성하는 전구 분자로 가장 잘 알려져 있으며, 아밀로이드 섬유아 형태는 알츠하이머병 환자의 뇌에서 발견되는 아밀로이드 플라크의 주요 성분이다.
유전학
아밀로이드-베타 전구 단백질은 고대의 보존도가 높은 단백질이다.[11] 인간의 경우, APP 유전자는 21번 염색체에 위치하며 290 킬로바이트에 이르는 18개의 엑손들을 포함하고 있다.[12][13] APP의 몇 가지 대체 스플리싱 이소 형태는 인체에서 639에서 770까지의 아미노산에 이르는 길이에서 뉴런에 우선적으로 표현되는 특정 이소 형태를 관찰했다; 이러한 이소형의 뉴런 비율의 변화는 알츠하이머병과 관련이 있다.[14] 동질 단백질은 드로소필라(과일파리), 씨엘레건(원충),[15] 모든 포유동물과 같은 다른 유기체에서 확인되었다.[16] 멤브레인 스패닝 영역에 위치한 단백질의 아밀로이드 베타 부위는 종 전체에 걸쳐 잘 보존되지 않으며 APP의 고유 상태 생물학적 기능과 뚜렷한 연관성이 없다.[16]
아밀로이드 베타(Aβ)를 생성하는 부위를 포함하여 아밀로이드 전구단백질의 중요한 부위에서 돌연변이는 알츠하이머병에 가족적인 감수성을 유발한다.[17][18][19][20] 예를 들어, 가족성 알츠하이머와 관련된 Aβ 영역 밖의 여러 돌연변이는 Aβ의 생산을 극적으로 증가시키는 것으로 밝혀졌다.[21]
APP 유전자의 돌연변이(A673T)는 알츠하이머병을 예방한다. 이 대체물은 베타 분비물 갈라짐 부위와 인접해 있으며 체외 아밀로이드 베타 형성이 40% 감소하는 결과를 초래한다.[22]
구조
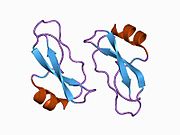
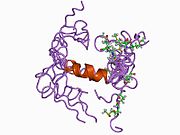
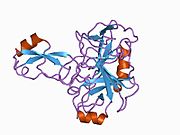
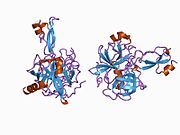
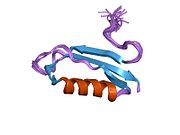
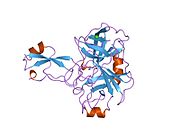
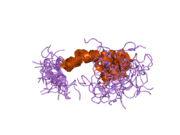
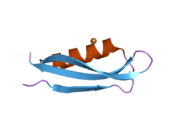
APP 순서에서 구별되고 대부분 독립적으로 접히는 구조 영역이 다수 식별되었다. 세포내 영역보다 훨씬 큰 세포외 영역은 산성 영역(AcD)에 의해 연결된 E1과 E2 영역으로 나뉘는데, E1에는 성장 요인 같은 영역(GFLD)과 긴밀하게 상호 작용하는 구리 결합 영역(CuBD)을 포함한 두 개의 하위 도메인이 포함되어 있다.[24] 세린 프로테아제 억제제 영역은 뇌에서 차등적으로 표현되는 등소형상에는 없으며 산성 부위와 E2 영역 사이에 발견된다.[25] APP의 완전한 결정 구조는 아직 해결되지 않았지만, 개별 도메인은 성공적으로 결정화되었고, 성장 요인 같은 도메인,[26] 구리 바인딩 도메인,[27] 완전한 E1 도메인[24] 및 E2 도메인이 되었다.[23]
변환 후 처리
APP는 글리코실화, 인산화, 시알릴화, 티로신 황화 등 변환 후 광범위한 수정을 거치며, 펩타이드 파편을 생성하기 위한 많은 유형의 단백질 분해 처리를 거친다.[28] 그것은 분비물 계열의 단백질에 의해 일반적으로 분해된다;[16] 알파 분비물과 베타 분비효소는 세포외 영역 거의 전체를 제거하여 세포외 막 부착된 카르복시 말단 파편들을 방출한다. 베타-시크릿아제 갈라진 후 멤브레인 스패닝 영역 내에서 감마시크레타아제에 의한 갈라지는 아밀로이드-베타 파편을 생성한다. 감마시크레타아제는 성분이 아직 완전하게 특성화되지 않은 대형 복합체지만 알츠하이머의 주요 유전 위험 인자로 확인된 프레세닐린을 포함한다.[29]
APP의 아밀로이드 유발 가공은 지질 뗏목에서의 존재와 연관되어 있다. APP 분자가 막의 지질 래프팅 영역을 점유할 때 베타 분비물에 의해 더 접근하기 쉽고 차등 분해되는 반면, 뗏목 외부의 APP 분자는 비 아밀로이드 유발 알파 분비물에 의해 차등 분해된다.[30] 감마 분비물 활동은 지질 뗏목과도 관련이 있다.[31] 지질 뗏목 정비에서 콜레스테롤의 역할은 높은 콜레스테롤과 아폴리포프로테인 E 유전자형이 알츠하이머병의 주요 위험 요소라는 관측에 대한 유력한 설명으로 인용되어 왔다.[32]
생물 함수
비록 APP의 기본적인 생물학적 역할이 알츠하이머 연구에 분명한 관심을 가지고 있지만, 철저한 이해는 여전히 모호하다.
시냅스 형성 및 수리
APP에서 가장 많이 보조되는 역할은 시냅스 형성 및 보수에 있다.[6] APP의 표현은 신경 분화 및 신경 손상 후와 같은 기간 동안 조절된다. 세포 신호, 장기 잠재력, 세포 접착력에서의 역할은 제한적 연구에 의해 제안되고 지원되었다.[16] 특히, 변환 후 처리에서의 유사성은 표면 수용체 단백질 노치의 신호 역할과의 비교를 불러왔다.[33]
APP 녹아웃 생쥐는 생존할 수 있으며, 일반 뉴런 손실 없이 장기적 위력 손상과 기억력 상실을 포함한 비교적 경미한 표현형 효과를 가지고 있다.[34] 한편, APP 표현이 상향 조정된 유전자 변형 생쥐도 장기적 위력이 손상된 것으로 보고되었다.[35]
논리적 추론은 Aβ가 알츠하이머병에 과도하게 축적되기 때문에 그 전조인 APP도 상승할 것이라는 것이다. 그러나 뉴런 세포체는 아밀로이드 판에 근접하는 함수로써 APP를 적게 함유하고 있다.[36] 이 자료들은 APP의 이러한 적자가 촉매제의 증가보다는 생산의 감소에서 기인한다는 것을 보여준다. 뉴런의 APP 상실은 치매를 일으키는 생리적 결손에 영향을 미칠 수 있다.
체재조합
인간의 뇌 신경세포에서는 APP를 암호화하는 유전자에서 체세포 재조합이 자주 일어난다.[37] 산발적인 알츠하이머병을 앓고 있는 개인의 뉴런은 건강한 개인의 뉴런보다 체체 재조합으로 인한 APP 유전자 다양성이 더 크다.[37]
항테로그라드 뉴런 수송
뉴런의 세포체에서 합성된 분자는 원위 시냅스로 바깥쪽으로 전달되어야 한다. 이것은 빠른 항로그레이드 수송을 통해 달성된다. APP는 화물과 키네신의 상호작용을 중재할 수 있어 이 수송을 용이하게 할 수 있는 것으로 밝혀졌다. 구체적으로는 세포질 카복시-터미누스의 15-아미노-아미노-아미노-아미누스 시퀀스가 모터 단백질과의 상호작용을 위해 필요하다.[38]
또한 APP와 Kinesin의 상호작용은 APP의 펩타이드 순서에 특정한 것으로 나타났다.[39] 펩타이드 콘주크 컬러 비드의 운송과 관련된 최근 실험에서, 위에서 언급한 15-아미노산 순서 개입 없이 APP와 동일한 단자 카르복실산 그룹을 표시하도록 조정기가 단일 아미노산 글리신(glycine)으로 결합되었다. 제어 비드는 모빌이 아니었으며, 이는 펩타이드의 단자 COOH 모이질이 이송을 중재하기에 충분하지 않음을 입증했다.
철 수출
알츠하이머에 대한 다른 관점은 APP가 세룰로플라스민과 유사한 페록시다제 활동을 가지고 있다는 것을 발견한 쥐 연구에 의해 밝혀지고, 페로포르틴과의 상호작용을 통해 철의 수출을 촉진한다; 이 활동은 알츠하이머에 축적된 Aβ에 의해 갇혀 있는 아연에 의해 차단된 것으로 보인다.[9] 단핵화 다형성(多形性)이 5'에 나타난 것으로 나타났다.APP mRNA의 UTR은 번역에 지장을 줄 수 있다.[40]
E2 도메인에 위치한 APP의 제안된 페록시다제 사이트는 페록시다제 활동이 없기 때문에 APP가 E2 도메인에서 페록시다제 활동을 하고 Fe(II)의 수출을 촉진한다는 가설이 잘못되었을 가능성이 있다.[41][42]
APP는 E2 도메인 내에서 페록시다제 활동을 보유하지 않기 때문에 페로포틴에서 나오는 APP 변조 철의 유출 메커니즘이 정밀하게 검토되고 있다. 한 모델은 APP가 세포의 플라스마 막에서 철분 유출 단백질 페로포르틴을 안정화시켜 막에 있는 페로포르틴 분자의 총 수를 증가시키는 작용을 한다고 제안한다. 이러한 철분 변환기는 알려진 포유류 페록시다아제(cerulopasmin 또는 헤파이스틴)에 의해 활성화될 수 있다.[43]
호르몬 조절
아밀로이드-β 전구단백질(AβPP)과 모든 관련 분비물은 개발 초기에 발현되며 인간 배아줄기세포(HESC) 증식을 조절하는 분비물에 의한 아βPP의 미분 처리와 신경 전구세포(NPC)로의 분화를 통해 재생산의 내분비학에서 핵심적인 역할을 한다. 임신호르몬인 인간합창고나도트로핀(hCG)은 AβPP 발현과[44] hESC 증식을 증가시키는 반면 프로게스테론은 AβPP 처리를 비아밀로이드제인 경로로 유도해 HESC 분화를 NPC로 촉진한다.[45][46][47]
AβPP와 그것의 갈라진 제품들은 포스트-mitotic 뉴런의 확산과 분화를 촉진하지 않는다. 오히려, 포스트-mitotic 뉴런에서 야생형 또는 돌연변이 AβPP의 과도한 압착은 세포 주기에 재진입한 후 사멸을 유발한다.[48] 성 스테로이드(프로게스테론 포함)의 손실과 성체 스테로이드제(프로게스테론 포함)의 손실, 그러나 성인 hCG에 상당하는 루틴화 호르몬의 상승, 후기 뇌종말 및 안드로포아제 기간 중은 아밀로이드-β 생산과[49] 후기 뉴런의 재진입을 세포 순환으로 유도한다고 가정한다.
상호작용
아밀로이드 전구 단백질은 다음과 상호작용하는 것으로 나타났다.
APP는 알츠하이머병을 포함한 많은 뇌 질환과 관련된 단백질인 릴린과 상호작용을 한다.[70]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000142192 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000022892 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Amyloid-beta precursor protein". Retrieved 10 January 2021.
- ^ a b Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (Jul 2006). "Synapse formation and function is modulated by the amyloid precursor protein". The Journal of Neuroscience. 26 (27): 7212–21. doi:10.1523/JNEUROSCI.1450-06.2006. PMC 6673945. PMID 16822978.
- ^ Turner PR, O'Connor K, Tate WP, Abraham WC (May 2003). "Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory". Progress in Neurobiology. 70 (1): 1–32. doi:10.1016/S0301-0082(03)00089-3. PMID 12927332. S2CID 25376584.
- ^ Moir RD, Lathe R, Tanzi RE (2018). "The antimicrobial protection hypothesis of Alzheimer's disease". Alzheimer's & Dementia. 14 (12): 1602–1614. doi:10.1016/j.jalz.2018.06.3040. PMID 30314800.
- ^ a b Duce JA, Tsatsanis A, Cater MA, James SA, Robb E, Wikhe K, Leong SL, Perez K, Johanssen T, Greenough MA, Cho HH, Galatis D, Moir RD, Masters CL, McLean C, Tanzi RE, Cappai R, Barnham KJ, Ciccotosto GD, Rogers JT, Bush AI (Sep 2010). "Iron-export ferroxidase activity of β-amyloid precursor protein is inhibited by zinc in Alzheimer's disease". Cell. 142 (6): 857–67. doi:10.1016/j.cell.2010.08.014. PMC 2943017. PMID 20817278.
- ^ Wang, Hao; Kulas, Joshua A.; Wang, Chao; Holtzman, David M.; Ferris, Heather A.; Hansen, Scott B. (17 August 2021). "Regulation of beta-amyloid production in neurons by astrocyte-derived cholesterol". Proceedings of the National Academy of Sciences. 118 (33): e2102191118. doi:10.1073/pnas.2102191118. PMC 8379952. PMID 34385305.
- ^ Tharp WG, Sarkar IN (April 2013). "Origins of amyloid-β". BMC Genomics. 14 (1): 290. doi:10.1186/1471-2164-14-290. PMC 3660159. PMID 23627794.
- ^ Yoshikai S, Sasaki H, Doh-ura K, Furuya H, Sakaki Y (Mar 1990). "Genomic organization of the human amyloid beta-protein precursor gene". Gene. 87 (2): 257–63. doi:10.1016/0378-1119(90)90310-N. PMID 2110105.
- ^ Lamb BT, Sisodia SS, Lawler AM, Slunt HH, Kitt CA, Kearns WG, Pearson PL, Price DL, Gearhart JD (Sep 1993). "Introduction and expression of the 400 kilobase amyloid precursor protein gene in transgenic mice [corrected]". Nature Genetics. 5 (1): 22–30. doi:10.1038/ng0993-22. PMID 8220418. S2CID 42752531.
- ^ Matsui T, Ingelsson M, Fukumoto H, Ramasamy K, Kowa H, Frosch MP, Irizarry MC, Hyman BT (Aug 2007). "Expression of APP pathway mRNAs and proteins in Alzheimer's disease". Brain Research. 1161: 116–23. doi:10.1016/j.brainres.2007.05.050. PMID 17586478. S2CID 26901380.
- ^ Ewald, Collin Y.; Li, Chris (2012-04-01). "Caenorhabditis elegans as a model organism to study APP function". Experimental Brain Research. 217 (3–4): 397–411. doi:10.1007/s00221-011-2905-7. ISSN 0014-4819. PMC 3746071. PMID 22038715.
- ^ a b c d Zheng H, Koo EH (2006). "The amyloid precursor protein: beyond amyloid". Molecular Neurodegeneration. 1 (1): 5. doi:10.1186/1750-1326-1-5. PMC 1538601. PMID 16930452.
- ^ Goate A, Chartier-Harlin MC, Mullan M, Brown J, Crawford F, Fidani L, Giuffra L, Haynes A, Irving N, James L (Feb 1991). "Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer's disease". Nature. 349 (6311): 704–6. Bibcode:1991Natur.349..704G. doi:10.1038/349704a0. PMID 1671712. S2CID 4336069.
- ^ Murrell J, Farlow M, Ghetti B, Benson MD (Oct 1991). "A mutation in the amyloid precursor protein associated with hereditary Alzheimer's disease". Science. 254 (5028): 97–9. Bibcode:1991Sci...254...97M. doi:10.1126/science.1925564. PMID 1925564.
- ^ Chartier-Harlin MC, Crawford F, Houlden H, Warren A, Hughes D, Fidani L, Goate A, Rossor M, Roques P, Hardy J (Oct 1991). "Early-onset Alzheimer's disease caused by mutations at codon 717 of the beta-amyloid precursor protein gene". Nature. 353 (6347): 844–6. Bibcode:1991Natur.353..844C. doi:10.1038/353844a0. PMID 1944558. S2CID 4345311.
- ^ Lloyd, GM; Trejo-Lopez, JA; Xia, Y; McFarland, KN; Lincoln, SJ; Ertekin-Taner, N; Giasson, BI; Yachnis, AT; Prokop, S (12 March 2020). "Prominent amyloid plaque pathology and cerebral amyloid angiopathy in APP V717I (London) carrier - phenotypic variability in autosomal dominant Alzheimer's disease". Acta Neuropathologica Communications. 8 (1): 31. doi:10.1186/s40478-020-0891-3. PMC 7068954. PMID 32164763.
- ^ Citron M, Oltersdorf T, Haass C, McConlogue L, Hung AY, Seubert P, Vigo-Pelfrey C, Lieberburg I, Selkoe DJ (Dec 1992). "Mutation of the beta-amyloid precursor protein in familial Alzheimer's disease increases beta-protein production". Nature. 360 (6405): 672–4. Bibcode:1992Natur.360..672C. doi:10.1038/360672a0. PMID 1465129. S2CID 4341170.
- ^ Jonsson T, Atwal JK, Steinberg S, Snaedal J, Jonsson PV, Bjornsson S, Stefansson H, Sulem P, Gudbjartsson D, Maloney J, Hoyte K, Gustafson A, Liu Y, Lu Y, Bhangale T, Graham RR, Huttenlocher J, Bjornsdottir G, Andreassen OA, Jönsson EG, Palotie A, Behrens TW, Magnusson OT, Kong A, Thorsteinsdottir U, Watts RJ, Stefansson K (Aug 2012). "A mutation in APP protects against Alzheimer's disease and age-related cognitive decline". Nature. 488 (7409): 96–9. Bibcode:2012Natur.488...96J. doi:10.1038/nature11283. PMID 22801501. S2CID 4333449. Lay summary – The New York Times.
{{cite journal}}: Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ a b PDB: 1RW6; Wang Y, Ha Y (Aug 2004). "The X-ray structure of an antiparallel dimer of the human amyloid precursor protein E2 domain". Molecular Cell. 15 (3): 343–53. doi:10.1016/j.molcel.2004.06.037. PMID 15304215.
- ^ a b Dahms 중요한 다른 또 하나, Hoefgen S, Roeser D, Schlott B, Gührs 근본, 그럼, ME(3월 2010년)."는 아밀로이드 전구 단백질의heparin-induced E1의 구조와 생물 화학 분석 2합체".미국 국립 과학 아카데미의 아메리카 미국의 회보.107(12):5381–6.Bibcode:2010PNAS..107.5381D. doi:10.1073/pnas.0911326107. 1.2851805.PMID 20212142.;또한 프로그램 데이터베이스 ID3KTM를 참조하십시오.
- ^ Sisodia SS, Koo EH, Hoffman PN, Perry G, Price DL (Jul 1993). "Identification and transport of full-length amyloid precursor proteins in rat peripheral nervous system". The Journal of Neuroscience. 13 (7): 3136–42. doi:10.1523/JNEUROSCI.13-07-03136.1993. PMC 6576678. PMID 8331390.
- ^ Rossjohn JCappai R, Feil SC, 헨리 A, McKinstry WJ, Galatis D, 헤세는 L, Multhaup G, Beyreuther K, 마스터스 CL, 파커 MW(4월 1999년)."그 질소 말단의 결정 구조, 알츠하이머 병 아밀로이드 전구 단백질의 성장factor-like 도메인".자연 구조 생물학.6(4):327–31. doi:10.1038/7562.PMID 10201399.S2CID 30925432.;또한 프로그램 데이터베이스 ID1MWP를 참조하십시오.
- ^ 홍콩 그때, 애덤스 JJ, 해리스 HH, 보아스 제이에프, 커튼 CC, Galatis D, 마스터스 CL, Barnham KJ, McKinstry WJ, Cappai R, 파커 MW(3월 2007년)."알츠하이머 아밀로이드 전구 단백질 copper-binding 도메인의 구조 연구 어떻게 그것은 구리 이온을 하나로 묶는 것을 보여 주".저널 분자 생물의.367(1):148–61. doi:10.1016/j.jmb.2006.12.041.PMID 17239395.;또 2007년 프로그램 데이터베이스 ID2FJZ, 2FK2, 2FKL을 참조하십시오.
- ^ De Strooper B, Annaert W (Jun 2000). "Proteolytic processing and cell biological functions of the amyloid precursor protein". Journal of Cell Science. 113 (11): 1857–70. doi:10.1242/jcs.113.11.1857. PMID 10806097.
- ^ Chen F, Hasegawa H, Schmitt-Ulms G, Kawarai T, Bohm C, Katayama T, Gu Y, Sanjo N, Glista M, Rogaeva E, Wakutani Y, Pardossi-Piquard R, Ruan X, Tandon A, Checler F, Marambaud P, Hansen K, Westaway D, St George-Hyslop P, Fraser P (Apr 2006). "TMP21 is a presenilin complex component that modulates gamma-secretase but not epsilon-secretase activity". Nature. 440 (7088): 1208–12. doi:10.1038/nature04667. PMID 16641999. S2CID 4349251.
- ^ Ehehalt R, Keller P, Haass C, Thiele C, Simons K (Jan 2003). "Amyloidogenic processing of the Alzheimer beta-amyloid precursor protein depends on lipid rafts". The Journal of Cell Biology. 160 (1): 113–23. doi:10.1083/jcb.200207113. PMC 2172747. PMID 12515826.
- ^ Vetrivel KS, Cheng H, Lin W, Sakurai T, Li T, Nukina N, Wong PC, Xu H, Thinakaran G (Oct 2004). "Association of gamma-secretase with lipid rafts in post-Golgi and endosome membranes". The Journal of Biological Chemistry. 279 (43): 44945–54. doi:10.1074/jbc.M407986200. PMC 1201506. PMID 15322084.
- ^ Riddell DR, Christie G, Hussain I, Dingwall C (Aug 2001). "Compartmentalization of beta-secretase (Asp2) into low-buoyant density, noncaveolar lipid rafts". Current Biology. 11 (16): 1288–93. doi:10.1016/S0960-9822(01)00394-3. PMID 11525745. S2CID 15502857.
- ^ Selkoe D, Kopan R (2003). "Notch and Presenilin: regulated intramembrane proteolysis links development and degeneration". Annual Review of Neuroscience. 26 (1): 565–97. doi:10.1146/annurev.neuro.26.041002.131334. PMID 12730322.
- ^ Phinney AL, Calhoun ME, Wolfer DP, Lipp HP, Zheng H, Jucker M (1999). "No hippocampal neuron or synaptic bouton loss in learning-impaired aged beta-amyloid precursor protein-null mice". Neuroscience. 90 (4): 1207–16. doi:10.1016/S0306-4522(98)00645-9. PMID 10338291. S2CID 6001957.
- ^ Matsuyama S, Teraoka R, Mori H, Tomiyama T (2007). "Inverse correlation between amyloid precursor protein and synaptic plasticity in transgenic mice". NeuroReport. 18 (10): 1083–7. doi:10.1097/WNR.0b013e3281e72b18. PMID 17558301. S2CID 34157306.
- ^ Barger SW, DeWall KM, Liu L, Mrak RE, Griffin WS (Aug 2008). "Relationships between expression of apolipoprotein E and beta-amyloid precursor protein are altered in proximity to Alzheimer beta-amyloid plaques: potential explanations from cell culture studies". Journal of Neuropathology and Experimental Neurology. 67 (8): 773–83. doi:10.1097/NEN.0b013e318180ec47. PMC 3334532. PMID 18648325.
- ^ a b Lee MH, Siddoway B, Kaeser GE, Segota I, Rivera R, Romanow WJ, Liu CS, Park C, Kennedy G, Long T, Chun J (November 2018). "Somatic APP gene recombination in Alzheimer's disease and normal neurons". Nature. 563 (7733): 639–645. Bibcode:2018Natur.563..639L. doi:10.1038/s41586-018-0718-6. PMC 6391999. PMID 30464338.
- ^ Satpute-Krishnan P, DeGiorgis JA, Conley MP, Jang M, Bearer EL (Oct 2006). "A peptide zipcode sufficient for anterograde transport within amyloid precursor protein". Proceedings of the National Academy of Sciences of the United States of America. 103 (44): 16532–7. Bibcode:2006PNAS..10316532S. doi:10.1073/pnas.0607527103. PMC 1621108. PMID 17062754.
- ^ Seamster PE, Loewenberg M, Pascal J, Chauviere A, Gonzales A, Cristini V, Bearer EL (Oct 2012). "Quantitative measurements and modeling of cargo-motor interactions during fast transport in the living axon". Physical Biology. 9 (5): 055005. Bibcode:2012PhBio...9e5005S. doi:10.1088/1478-3975/9/5/055005. PMC 3625656. PMID 23011729.
- ^ Rogers JT, Bush AI, Cho HH, Smith DH, Thomson AM, Friedlich AL, Lahiri DK, Leedman PJ, Huang X, Cahill CM (Dec 2008). "Iron and the translation of the amyloid precursor protein (APP) and ferritin mRNAs: riboregulation against neural oxidative damage in Alzheimer's disease". Biochemical Society Transactions. 36 (Pt 6): 1282–7. doi:10.1042/BST0361282. PMC 2746665. PMID 19021541.
- ^ Ebrahimi KH, Hagedoorn PL, Hagen WR (2012). "A synthetic peptide with the putative iron binding motif of amyloid precursor protein (APP) does not catalytically oxidize iron". PLOS ONE. 7 (8): e40287. Bibcode:2012PLoSO...740287E. doi:10.1371/journal.pone.0040287. PMC 3419245. PMID 22916096.
- ^ Honarmand Ebrahimi K, Dienemann C, Hoefgen S, Than ME, Hagedoorn PL, Hagen WR (2013). "The amyloid precursor protein (APP) does not have a ferroxidase site in its E2 domain". PLOS ONE. 8 (8): e72177. Bibcode:2013PLoSO...872177H. doi:10.1371/journal.pone.0072177. PMC 3747053. PMID 23977245.
- ^ McCarthy RC, Park YH, Kosman DJ (Jul 2014). "sAPP modulates iron efflux from brain microvascular endothelial cells by stabilizing the ferrous iron exporter ferroportin". EMBO Reports. 15 (7): 809–15. doi:10.15252/embr.201338064. PMC 4196985. PMID 24867889.
- ^ Porayette P, Gallego MJ, Kaltcheva MM, Meethal SV, Atwood CS (Dec 2007). "Amyloid-beta precursor protein expression and modulation in human embryonic stem cells: a novel role for human chorionic gonadotropin". Biochemical and Biophysical Research Communications. 364 (3): 522–7. doi:10.1016/j.bbrc.2007.10.021. PMID 17959150.
- ^ Porayette P, Gallego MJ, Kaltcheva MM, Bowen RL, Vadakkadath Meethal S, Atwood CS (Aug 2009). "Differential processing of amyloid-beta precursor protein directs human embryonic stem cell proliferation and differentiation into neuronal precursor cells". The Journal of Biological Chemistry. 284 (35): 23806–17. doi:10.1074/jbc.M109.026328. PMC 2749153. PMID 19542221.
- ^ Gallego MJ, Porayette P, Kaltcheva MM, Meethal SV, Atwood CS (Jun 2009). "Opioid and progesterone signaling is obligatory for early human embryogenesis". Stem Cells and Development. 18 (5): 737–40. doi:10.1089/scd.2008.0190. PMC 2891507. PMID 18803462.
- ^ Gallego MJ, Porayette P, Kaltcheva MM, Bowen RL, Vadakkadath Meethal S, Atwood CS (2010). "The pregnancy hormones human chorionic gonadotropin and progesterone induce human embryonic stem cell proliferation and differentiation into neuroectodermal rosettes". Stem Cell Research & Therapy. 1 (4): 28. doi:10.1186/scrt28. PMC 2983441. PMID 20836886.
- ^ McPhie DL, Coopersmith R, Hines-Peralta A, Chen Y, Ivins KJ, Manly SP, Kozlowski MR, Neve KA, Neve RL (Jul 2003). "DNA synthesis and neuronal apoptosis caused by familial Alzheimer disease mutants of the amyloid precursor protein are mediated by the p21 activated kinase PAK3". The Journal of Neuroscience. 23 (17): 6914–27. doi:10.1523/JNEUROSCI.23-17-06914.2003. PMC 6740729. PMID 12890786.
- ^ Bowen RL, Verdile G, Liu T, Parlow AF, Perry G, Smith MA, Martins RN, Atwood CS (May 2004). "Luteinizing hormone, a reproductive regulator that modulates the processing of amyloid-beta precursor protein and amyloid-beta deposition". The Journal of Biological Chemistry. 279 (19): 20539–45. doi:10.1074/jbc.M311993200. PMID 14871891.
- ^ a b c Biederer T, Cao X, Südhof TC, Liu X (Sep 2002). "Regulation of APP-dependent transcription complexes by Mint/X11s: differential functions of Mint isoforms". The Journal of Neuroscience. 22 (17): 7340–51. doi:10.1523/JNEUROSCI.22-17-07340.2002. PMC 6757996. PMID 12196555.
- ^ a b Borg JP, Ooi J, Levy E, Margolis B (Nov 1996). "The phosphotyrosine interaction domains of X11 and FE65 bind to distinct sites on the YENPTY motif of amyloid precursor protein". Molecular and Cellular Biology. 16 (11): 6229–41. doi:10.1128/mcb.16.11.6229. PMC 231626. PMID 8887653.
- ^ a b Araki Y, Tomita S, Yamaguchi H, Miyagi N, Sumioka A, Kirino Y, Suzuki T (Dec 2003). "Novel cadherin-related membrane proteins, Alcadeins, enhance the X11-like protein-mediated stabilization of amyloid beta-protein precursor metabolism". The Journal of Biological Chemistry. 278 (49): 49448–58. doi:10.1074/jbc.M306024200. PMID 12972431.
- ^ Tomita S, Ozaki T, Taru H, Oguchi S, Takeda S, Yagi Y, Sakiyama S, Kirino Y, Suzuki T (Jan 1999). "Interaction of a neuron-specific protein containing PDZ domains with Alzheimer's amyloid precursor protein". The Journal of Biological Chemistry. 274 (4): 2243–54. doi:10.1074/jbc.274.4.2243. PMID 9890987.
- ^ Tanahashi H, Tabira T (Feb 1999). "X11L2, a new member of the X11 protein family, interacts with Alzheimer's beta-amyloid precursor protein". Biochemical and Biophysical Research Communications. 255 (3): 663–7. doi:10.1006/bbrc.1999.0265. PMID 10049767.
- ^ Zambrano N, Buxbaum JD, Minopoli G, Fiore F, De Candia P, De Renzis S, Faraonio R, Sabo S, Cheetham J, Sudol M, Russo T (Mar 1997). "Interaction of the phosphotyrosine interaction/phosphotyrosine binding-related domains of Fe65 with wild-type and mutant Alzheimer's beta-amyloid precursor proteins". The Journal of Biological Chemistry. 272 (10): 6399–405. doi:10.1074/jbc.272.10.6399. PMID 9045663.
- ^ Guénette SY, Chen J, Jondro PD, Tanzi RE (Oct 1996). "Association of a novel human FE65-like protein with the cytoplasmic domain of the beta-amyloid precursor protein". Proceedings of the National Academy of Sciences of the United States of America. 93 (20): 10832–7. Bibcode:1996PNAS...9310832G. doi:10.1073/pnas.93.20.10832. PMC 38241. PMID 8855266.
- ^ Tanahashi H, Tabira T (Feb 1999). "Molecular cloning of human Fe65L2 and its interaction with the Alzheimer's beta-amyloid precursor protein". Neuroscience Letters. 261 (3): 143–6. doi:10.1016/S0304-3940(98)00995-1. PMID 10081969. S2CID 54307954.
- ^ Trommsdorff M, Borg JP, Margolis B, Herz J (Dec 1998). "Interaction of cytosolic adaptor proteins with neuronal apolipoprotein E receptors and the amyloid precursor protein". The Journal of Biological Chemistry. 273 (50): 33556–60. doi:10.1074/jbc.273.50.33556. PMID 9837937.
- ^ Chow N, Korenberg JR, Chen XN, Neve RL (May 1996). "APP-BP1, a novel protein that binds to the carboxyl-terminal region of the amyloid precursor protein". The Journal of Biological Chemistry. 271 (19): 11339–46. doi:10.1074/jbc.271.19.11339. PMID 8626687.
- ^ Zheng P, Eastman J, Vande Pol S, Pimplikar SW (Dec 1998). "PAT1, a microtubule-interacting protein, recognizes the basolateral sorting signal of amyloid precursor protein". Proceedings of the National Academy of Sciences of the United States of America. 95 (25): 14745–50. Bibcode:1998PNAS...9514745Z. doi:10.1073/pnas.95.25.14745. PMC 24520. PMID 9843960.
- ^ Wang B, Nguyen M, Breckenridge DG, Stojanovic M, Clemons PA, Kuppig S, Shore GC (Apr 2003). "Uncleaved BAP31 in association with A4 protein at the endoplasmic reticulum is an inhibitor of Fas-initiated release of cytochrome c from mitochondria". The Journal of Biological Chemistry. 278 (16): 14461–8. doi:10.1074/jbc.M209684200. PMID 12529377.
- ^ Lefterov IM, Koldamova RP, Lazo JS (Sep 2000). "Human bleomycin hydrolase regulates the secretion of amyloid precursor protein". FASEB Journal. 14 (12): 1837–47. doi:10.1096/fj.99-0938com. PMID 10973933. S2CID 44302063.
- ^ Araki Y, Miyagi N, Kato N, Yoshida T, Wada S, Nishimura M, Komano H, Yamamoto T, De Strooper B, Yamamoto K, Suzuki T (Jun 2004). "Coordinated metabolism of Alcadein and amyloid beta-protein precursor regulates FE65-dependent gene transactivation". The Journal of Biological Chemistry. 279 (23): 24343–54. doi:10.1074/jbc.M401925200. PMID 15037614.
- ^ Ikezu T, Trapp BD, Song KS, Schlegel A, Lisanti MP, Okamoto T (Apr 1998). "Caveolae, plasma membrane microdomains for alpha-secretase-mediated processing of the amyloid precursor protein". The Journal of Biological Chemistry. 273 (17): 10485–95. doi:10.1074/jbc.273.17.10485. PMID 9553108.
- ^ Hashimoto T, Wakabayashi T, Watanabe A, Kowa H, Hosoda R, Nakamura A, Kanazawa I, Arai T, Takio K, Mann DM, Iwatsubo T (Apr 2002). "CLAC: a novel Alzheimer amyloid plaque component derived from a transmembrane precursor, CLAC-P/collagen type XXV". The EMBO Journal. 21 (7): 1524–34. doi:10.1093/emboj/21.7.1524. PMC 125364. PMID 11927537.
- ^ Ohsawa I, Takamura C, Kohsaka S (Mar 2001). "Fibulin-1 binds the amino-terminal head of beta-amyloid precursor protein and modulates its physiological function". Journal of Neurochemistry. 76 (5): 1411–20. doi:10.1046/j.1471-4159.2001.00144.x. PMID 11238726. S2CID 83321033.
- ^ Chauhan VP, Ray I, Chauhan A, Wisniewski HM (May 1999). "Binding of gelsolin, a secretory protein, to amyloid beta-protein". Biochemical and Biophysical Research Communications. 258 (2): 241–6. doi:10.1006/bbrc.1999.0623. PMID 10329371.
- ^ Yan SD, Fu J, Soto C, Chen X, Zhu H, Al-Mohanna F, Collison K, Zhu A, Stern E, Saido T, Tohyama M, Ogawa S, Roher A, Stern D (Oct 1997). "An intracellular protein that binds amyloid-beta peptide and mediates neurotoxicity in Alzheimer's disease". Nature. 389 (6652): 689–95. Bibcode:1997Natur.389..689D. doi:10.1038/39522. PMID 9338779. S2CID 4343238.
- ^ Tarr PE, Roncarati R, Pelicci G, Pelicci PG, D'Adamio L (May 2002). "Tyrosine phosphorylation of the beta-amyloid precursor protein cytoplasmic tail promotes interaction with Shc". The Journal of Biological Chemistry. 277 (19): 16798–804. doi:10.1074/jbc.M110286200. PMID 11877420.
- ^ Hoe HS, Lee KJ, Carney RS, Lee J, Markova A, Lee JY, Howell BW, Hyman BT, Pak DT, Bu G, Rebeck GW (Jun 2009). "Interaction of reelin with amyloid precursor protein promotes neurite outgrowth". The Journal of Neuroscience. 29 (23): 7459–73. doi:10.1523/JNEUROSCI.4872-08.2009. PMC 2759694. PMID 19515914. Lay summary – Alzheimer Research Forum.
{{cite journal}}: Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말)
추가 읽기
- Beyreuther K, Pollwein P, Multhaup G, Mönning U, König G, Dyrks T, Schubert W, Masters CL (Sep 1993). "Regulation and expression of the Alzheimer's beta/A4 amyloid protein precursor in health, disease, and Down's syndrome". Annals of the New York Academy of Sciences. 695 (1 Transduction): 91–102. doi:10.1111/j.1749-6632.1993.tb23035.x. PMID 8239320. S2CID 22058428.
- Straub JE, Guevara J, Huo S, Lee JP (Jun 2002). "Long time dynamic simulations: exploring the folding pathways of an Alzheimer's amyloid Abeta-peptide". Accounts of Chemical Research. 35 (6): 473–81. doi:10.1021/ar010031e. PMID 12069633.
- Annaert W, De Strooper B (2003). "A cell biological perspective on Alzheimer's disease". Annual Review of Cell and Developmental Biology. 18 (1): 25–51. doi:10.1146/annurev.cellbio.18.020402.142302. PMID 12142279.
- Koo EH (Nov 2002). "The beta-amyloid precursor protein (APP) and Alzheimer's disease: does the tail wag the dog?". Traffic. 3 (11): 763–70. doi:10.1034/j.1600-0854.2002.31101.x. PMID 12383342. S2CID 40411806.
- Van Nostrand WE, Melchor JP, Romanov G, Zeigler K, Davis J (Nov 2002). "Pathogenic effects of cerebral amyloid angiopathy mutations in the amyloid beta-protein precursor". Annals of the New York Academy of Sciences. 977 (1): 258–65. Bibcode:2002NYASA.977..258N. doi:10.1111/j.1749-6632.2002.tb04824.x. PMID 12480759. S2CID 22567664.
- Ling Y, Morgan K, Kalsheker N (Nov 2003). "Amyloid precursor protein (APP) and the biology of proteolytic processing: relevance to Alzheimer's disease". The International Journal of Biochemistry & Cell Biology. 35 (11): 1505–35. doi:10.1016/S1357-2725(03)00133-X. PMID 12824062.
- Kerr ML, Small DH (Apr 2005). "Cytoplasmic domain of the beta-amyloid protein precursor of Alzheimer's disease: function, regulation of proteolysis, and implications for drug development". Journal of Neuroscience Research. 80 (2): 151–9. doi:10.1002/jnr.20408. PMID 15672415. S2CID 31985212.
- Maynard CJ, Bush AI, Masters CL, Cappai R, Li QX (Jun 2005). "Metals and amyloid-beta in Alzheimer's disease". International Journal of Experimental Pathology. 86 (3): 147–59. doi:10.1111/j.0959-9673.2005.00434.x. PMC 2517409. PMID 15910549.
- Tickler AK, Wade JD, Separovic F (Aug 2005). "The role of Abeta peptides in Alzheimer's disease". Protein and Peptide Letters. 12 (6): 513–9. doi:10.2174/0929866054395905. PMID 16101387.
- Reinhard C, Hébert SS, De Strooper B (Dec 2005). "The amyloid-beta precursor protein: integrating structure with biological function". The EMBO Journal. 24 (23): 3996–4006. doi:10.1038/sj.emboj.7600860. PMC 1356301. PMID 16252002.
- Watson D, Castaño E, Kokjohn TA, Kuo YM, Lyubchenko Y, Pinsky D, Connolly ES, Esh C, Luehrs DC, Stine WB, Rowse LM, Emmerling MR, Roher AE (Dec 2005). "Physicochemical characteristics of soluble oligomeric Abeta and their pathologic role in Alzheimer's disease". Neurological Research. 27 (8): 869–81. doi:10.1179/016164105X49436. PMID 16354549. S2CID 25687818.
- Calinisan V, Gravem D, Chen RP, Brittin S, Mohandas N, Lecomte MC, Gascard P (2006). "New insights into potential functions for the protein 4.1 superfamily of proteins in kidney epithelium". Frontiers in Bioscience. 11 (1): 1646–66. doi:10.2741/1911. PMID 16368544.
- Vetrivel KS, Thinakaran G (Jan 2006). "Amyloidogenic processing of beta-amyloid precursor protein in intracellular compartments". Neurology. 66 (2 Suppl 1): S69–73. doi:10.1212/01.wnl.0000192107.17175.39. PMID 16432149. S2CID 35965729.
- Gallo C, Orlassino R, Vineis C (Feb 2006). "[Recurrent intraparenchimal haemorrhages in a patient with cerebral amyloidotic angiopathy: description of one autopsy case]". Pathologica. 98 (1): 44–7. PMID 16789686.
- Coulson EJ (Aug 2006). "Does the p75 neurotrophin receptor mediate Abeta-induced toxicity in Alzheimer's disease?". Journal of Neurochemistry. 98 (3): 654–60. doi:10.1111/j.1471-4159.2006.03905.x. PMID 16893414. S2CID 20879380.
- Menéndez-González M, Pérez-Pinera P, Martínez-Rivera M, Calatayud MT, Blázquez Menes B (2006). "APP processing and the APP-KPI domain involvement in the amyloid cascade". Neuro-Degenerative Diseases. 2 (6): 277–83. doi:10.1159/000092315. PMID 16909010. S2CID 45002038.
- Neve RL, McPhie DL (Apr 2007). "Dysfunction of amyloid precursor protein signaling in neurons leads to DNA synthesis and apoptosis". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1772 (4): 430–7. doi:10.1016/j.bbadis.2006.10.008. PMC 1862818. PMID 17113271.
- Chen X, Stern D, Yan SD (Dec 2006). "Mitochondrial dysfunction and Alzheimer's disease". Current Alzheimer Research. 3 (5): 515–20. doi:10.2174/156720506779025215. PMID 17168650.
- Caltagarone J, Jing Z, Bowser R (Apr 2007). "Focal adhesions regulate Abeta signaling and cell death in Alzheimer's disease". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1772 (4): 438–45. doi:10.1016/j.bbadis.2006.11.007. PMC 1876750. PMID 17215111.
- Wolfe MS (Feb 2007). "When loss is gain: reduced presenilin proteolytic function leads to increased Abeta42/Abeta40. Talking Point on the role of presenilin mutations in Alzheimer disease". EMBO Reports. 8 (2): 136–40. doi:10.1038/sj.embor.7400896. PMC 1796780. PMID 17268504.
외부 링크
| 위키미디어 커먼스는 아밀로이드 전구 단백질과 관련된 미디어를 보유하고 있다. |
- Early-Onset 가족 알츠하이머병에 대한 GeneReviews/NCBI/NIH/UW 입력
- Amyloid+Protein+미국 국립 의학 도서관의 프리커서(MesH)
- 엔트레스 진: APP 아밀로이드 베타(A4) 전구 단백질(펩티다아제 넥신-II, 알츠하이머병)
- UCSC 게놈 브라우저의 인간 APP 게놈 위치 및 APP 유전자 세부 정보 페이지.