뇌 자극 보상
Brain stimulation reward뇌 자극 보상(BSR)은 제임스 올즈(James Olds)와 피터 밀너(Peter Milner)가 원래 발견한 특정 뇌 부위의 직접 자극을 통해 도출한 즐거운 현상이다. BSR은 강력한 작동자 보강재 역할을 할 수 있다. 표적 자극은 보상 체계 회로를 활성화하고 음식, 성 등 자연적인 보상에 의해 확립된 것과 유사한 대응 습관을 확립한다.[1] BSR에 대한 실험은 곧 자연적인 보상과 연관된 뇌의 다른 부위와 함께 측면 시상하부의 자극이 동기를 유발할 뿐만 아니라 보람도 있다는 것을 보여주었다.[2] 전기 뇌 자극과 뇌내 약물 주입은 비교적 직접적인 보상 회로 활성화로 인해 강력한 보상 감각을 만들어낸다. 이러한 활성화는 자연 자극에 의해 생성된 보상보다 더 직접적인 것으로 간주된다. 그러한 신호들은 일반적으로 더 간접적인 주변 신경을 통해 이동하기 때문이다.[3] 인간을 포함한 모든 척추동물에서 BSR이 발견되었으며, 보상체계와 관련된 신경전달뿐만 아니라 특정 뇌 영역과 회로에 의해 자연적인 보상이 어떻게 처리되는지를 이해하는 데 유용한 도구를 제공했다.[4]
두개내 자기 자극(ICSS)은 실험 환경에서 BSR을 생성하는 데 사용되는 작동자 조건화 방법이다. ICSS는 일반적으로 자극되었을 때 BSR을 생성하는 것으로 알려진 뇌의 여러 영역 중 하나에 영구 전극 임플란트를 가진 피실험자를 포함한다. 대상자들은 뇌 부위의 전기 자극에 지속적으로 반응하도록 훈련 받는다.[5] ICSS 연구는 다양한 약리학적 조작이 보상 민감도에 미치는 영향을 조사하는데 특히 유용했다. ICSS는 모노아민기, 오피오이드, 콜린기 신경전달에 작용하는 약물 등 여러 계층의 약물에 대한 중독성 책임을 측정하는 수단으로 활용되어 왔다. 이러한 데이터는 마약의 중독성 특성에 대한 자기 관리 연구의 결과와 잘 상관관계가 있다.[6]
역사
1953년 맥길 대학의 제임스 올즈와 피터 밀너는 쥐들이 뇌의 정격 부위로 직접 전기 자극을 받은 시험 장치의 영역으로 돌아가는 것을 선호한다는 것을 관찰했다.[7] 올즈와 밀너는 이 시범을 통해 자극이 보람을 느꼈다고 추론하고, 이후 실험을 통해 뇌 자극의 짧은 맥박을 전달받기 위해 쥐가 지렛대 누름 등 참신한 행동을 실행하도록 훈련할 수 있음을 확인했다.[7] 올즈와 밀너는 긍정적인 강화에 관여하는 뇌의 보상 메커니즘을 발견했고, 그들의 실험으로 전기 자극이 작용하는 강화제의 역할을 할 수 있다는 결론을 내렸다.[7][8] B.F.에 따르면 스키너, 피연산자 강화는 자극의 발현에 따른 행동이 뒤따를 때 발생하며, 반응 습관의 학습에 필수적인 것으로 간주된다.[9] 그들의 발견은 동기 부여와 강화가 그들의 근본적인 생리학적 관점에서 이해될 수 있게 했고, 그것은 보상과 강화의 신경적 기초를 결정하기 위한 추가적인 실험으로 이어졌다.[8] 최초 발견 이후, BSR의 현상은 모든 종에서 실험되어 왔으며, 로버트 갈브레이스 히스도 마찬가지로 BSR이 인간에게 적용될 수 있다는 것을 증명했다.[10]
1972년 'B-19'로 알려진 히스의 주제는 "즐거움, 경계심, 따뜻함의 느낌"과 "그에게서 부대를 빼앗길 때마다 검증되어 단지 몇 번 더 자기표현에 호소했다"[11]고 말했다. 윤리학자들 사이에서는 초기 '직접 뇌 자극'이나 '심신술' 실험이 '어제 기준으로는 (불안하고) 불안하다'는 비판을 받아왔다.[12] 1986년 출간된 사례에서 가정에서 자기 절제 능력을 부여받은 한 과목은 결국 가정과 개인 위생을 무시한 채 하루 종일 전기자극에만 매달렸다. 그녀의 가족이 개입할 때쯤, 그 주제는 반복적으로 물살을 조절하는 것으로부터 그녀의 손가락에 열린 통증이 생겼다.[13]
뇌 자극 강화
뇌 자극의 동기적 효과에 대한 초기 연구는 두 가지 주요 질문을 다루었다: 1. 어떤 뇌 부위가 자극되어 보상에 대한 인식을 만들어낼 수 있는가? 그리고 2. 자극에 대한 반응과 어떤 메커니즘을 통해 영향을 미치는 약은?[1] 뇌 보상 회로를 조사하면 BSR과 자연 보상 기능을 모두 결정하는 분산형 멀티 시냅스 회로로 구성된다.[1] 동기를 부여하고 행동을 형상화하는 자연적인 추진력은 시각, 소리, 맛, 후각, 촉각의 말초적 감각을 통해 시력 회로에 전달된다. 그러나 실험에 의해 유도된 BSR은 보다 직접적으로 보상 회로를 활성화하고 말초 감각 경로를 통한 전도를 우회한다.[2] 이러한 이유로 전기적 뇌 자극은 어느 정도 해부학적, 신경화학적 특수성으로 중추신경계 내의 보상 회로를 식별하는 도구를 제공한다.[2] 이 두 가지 형태의 실험실 보상에 관련된 연구는 광범위한 변연 및 뇌뇌 구조의 자극이 보상될 수 있을 뿐만 아니라 중임브릭 도파민 시스템의 도파민 함유 뉴런을 동기적 기능에 포함시킬 수 있다는 것을 보여주었다.[1] 뇌내 자기 자극의 동기 효과는 전기 자극 중 외과적으로 이식된 전극의 배치 부지에 따라 크게 달라지며, 동물은 현재 상태에 따라 각기 다른 신경 부위를 자극하는 작용을 하게 된다.[14] 종종, 뇌 자극을 시작하기 위해 일하는 동물들도 자극을 끝내기 위해 일하게 될 것이다.[1]
자연적 보상 및 추진과의 관계
BSR과 자연 보상(예: 음식, 물, 부화)의 관계는 오랫동안 논의되어 왔으며, BSR에 대한 초기 연구의 상당 부분은 각각의 유사성과 차이점에 초점을 맞추고 있다. BSR은 자연적 보상에 의해 활성화되는 동일한 강화 경로를 통해 촉진된다. 자기 자극은 처음에는 말초신경을 활성화시키는 자연적인 보상보다 직접적인 작용으로 인해 중심적인 보상 메커니즘의 강력한 활성화를 발휘할 수 있다.[3][2] 전기적 또는 화학적 수단을 통해 내부 전뇌다발(MFB)에 대한 BSR은 자연적 보상에 의해서도 활성화되는 보상 경로의 주요 구성요소를 활성화한다. 시상하부의 특정 부위가 전기적으로 자극을 받으면 식사, 음주, 교미 반응 등 보상 관련 행동을 이끌어낸다.[9]
자연적인 보상은 충족되지 않은 필요나 욕망으로부터 박탈된 상태(예: 굶주림)와 연관된다. 이러한 주들은 음식 소비와 같은 본능적이고 동기 부여된 행동을 촉진한다. 본질적인 생존 기반 요구를 충족시키지 못하기 때문에 BSR의 경우는 그렇지 않다는 주장이 제기되어 왔다. BSR은 또한 기억력에 있어서 보상 기대치의 학습을 자연스럽게 용이하게 하는 확립된 신경표현이 특히 부족하다. 이 두 가지 효과 모두 일련의 초기 실험에서 BSR에 대한 응답률 저하를 초래하지만, 실험에서는 또한 소멸된 행동이 보상과 관련된 단기 연관성을 새롭게 하는 프라이밍 자극에 의해 빠르게 회복될 수 있다는 것을 보여주었다.[8] BSR에 대한 연구는 강화 뇌 자극이 자연적인 운동과 관련된 자연적인 경로를 활성화할 수 있을 뿐만 아니라 일반적으로 자연적인 보상에 의해 활성화되는 강화 경로를 자극할 수 있다는 것을 보여준다.
구동 강도
쥐는 측면 시상하부의 직접적인 전기 자극에 대한 대가로 며칠 동안 시간당 수천 개의 반응 속도로 지렛대를 누른다.[14] 여러 연구는 쥐가 다른 모든 행동을 배제했을 때 강화된 행동을 할 것이라는 것을 입증했다. 실험 결과 쥐들은 매일 제한된 시간 동안 음식과 자극이 동시에 제공될 때 뇌 자극이나 정맥주 코카인의 대가로 굶어 죽을 정도로 음식을 포기하게 될 것으로 나타났다.[2] 쥐는 또한 전기화된 그리드를 가로질러 레버를 누를 것이고, 그들은 먹이를 얻기 보다는 전기 자극을 얻기 위해 기꺼이 더 높은 수준의 충격을 견뎌낼 것이다.[14]
포테이션
쥐에 대한 포만감 실험은 BSR이 포만감을 생성하지 않는다는 것을 밝혀냈다. 옛사람들은 이러한 BSR과 관련된 포만감의 부족이 동물들이 완전히 탈진할 수 있도록 스스로 자극할 수 있게 하고 포만감이 전기 자극의 위치에 따라 달라진다는 것을 증명했다.[14] 48시간 포만도 검사에서 저발성 전극을 가진 쥐는 탈진할 정도로 자가 자극하고 본질적인 포만 경향을 보이지 않는 반면, 뇌전극은 4~8시간 후 자기 자극이 급격히 느려지는 것을 보였다. BSR의 불감증은 구동력과 밀접한 관련이 있다. 자연적인 보상은 음식과 마찬가지로 포만감(포만감)과 맞닥뜨리지만, BSR은 비교할 만한 상관관계가 없다. 이를 통해 BSR은 무기한 또는 ICSS의 경우 소진될 때까지 경험할 수 있다.
중독
중독은 건강, 관계, 일을 포함한 삶의 다양한 측면에 해로운 영향을 주지만 유지되는 약물 복용과 탐구로 구성된 만성 뇌 질환이다. 실험실 절차는 중독성 있는 행동의 자격을 갖춘 자기 관리 습관을 찾아 섭취하는 강박적인 자기 관리 습관을 확립할 수 있다.[1] 설치류와 인간이 아닌 영장류들은 각성제 정맥주사를 맞기 위해 강제적으로 작용하는 것으로 나타났으며, 약물에 대한 접근이 제한되지 않을 때는 심한 체중감량과 사망에 이를 정도로 자가 투여한다.[2][15] 자기관리 행동과 마찬가지로 뇌내 자극에 대한 대응은 중독 상태의 강한 강박적 요소를 가지고 있다. BSR은 자연적인 보상에 반응하여 감각 경로를 통한 전달을 우회하여 보상 경로를 보다 직접적으로 활성화하기 때문에 강박적인 습관을 확립하는 데 매우 효과적이라는 가설을 세우고 있다. BSR에 대한 반응에 따른 지연된 보강은 이 동작이 얼마나 강하게 강화되는지 그리고 어느 정도까지 지속되는지를 감소시킨다. 예를 들어 레버 누름과 보상 전달(시뮬레이션) 사이에 1초가 지연되면 응답 수준이 감소할 수 있다.[2] BSR은 강화와 강박적 행동에 관련된 신경 회로에 대한 통찰력을 제공한다.
보상의 구조
BSR에 대한 매핑 및 병변 연구는 보상 관련 뉴런의 위치를 결정할 뿐만 아니라 뇌 자극에 직접 영향을 받는 신호 경로를 결정하기 위해 설계되었다. 뇌내 자기 자극의 현장은 실질적으로 다른 행동 특성을 유도한다. 내전뇌다발(MFB)의 길이를 따라 좌우 시상하부, 복측골격영역(VTA)을 통과하고 봉에 들어가는 부위는 자극의 가장 강력한 보상 효과와 연관된다.[1]
측면 시상하부
측면 시상하부는 시상하부의 일부분이며, 내측 전뇌다발 수준의 이 부위에 대한 뇌 자극은 가장 높은 응답률을 생성하며, 그에 따라 설치류에서 가장 높은 보상 효력이 발생한다. 이 지역이나 경계를 따라 병변이 발생하면 다른 모든 작동자 드라이브 동작뿐만 아니라 긍정적인 드라이브 보상 동작의 상실을 초래한다.[9]
내측전뇌다발
내전뇌다발(MFB)은 가장 많이 조사된 뇌 자극 보상 부위가 있는 곳으로, 기저 후각 부위와 중격핵에서 투영되는 복잡한 액손다발로 구성되어 있다.[3] MFB는 뇌 자극을 강화시키는 유일한 해부학적 기질은 아니지만, 상승 도파민 섬유에 대한 주관이며, VTA에서 핵으로 정보를 전달하는 기능을 한다. MFB 자극의 보상 효과는 중구체성 도파민 계통의 활성화를 통해 매개된다.[1]
중임벌통로
중음부 경로는 VTA를 측점핵에 연결한다. 측핵은 복측 선조체 내에 위치하며 피질 및 변연 뇌 구조의 정보를 통합하여 행동을 중재하여 보상을 강화한다.[16] 이것은 VTA의 도파민성 투영에 대한 주요 표적이다. VTA는 뉴런들의 집단으로, 중뇌 바닥의 중간선에 가깝게 위치해 있다. VTA는 도파민 세포체의 기원이며 중구체성 도파민 시스템을 구성한다.[3]
BSR은 측점핵 내에서 도파민이 분비되는 것으로 나타났으며, 이 역시 음식이나 성관계와 같은 자연적인 보상에 반응하여 발생한다.[1]
간접 활성화
전기생리학 데이터는 MFB나 VTA의 자극이 중임브릭 보상 경로에서 도파민성 뉴런을 직접 활성화하지 않는다는 것을 시사한다. 이러한 데이터는 BSR이 VTA의 상승, 미감염 뉴런을 활성화하는 내림차순, 골수성 뉴런의 초기 유입에 의해 촉진된다는 것을 시사한다. VTA에 대한 흥분성, 콜린거성 입력이 이러한 간접 활성화에 역할을 한다고 생각되지만, 이 회로의 신경원자성 요소는 아직 완전히 특성화되지 않았다.[5][6]
두개내 자기 자극(ICSS) 절차
초기훈련
Olds와 Milner에 의한 BSR의 초기 시연 이후, 설치류 실험은 자극을 받기 위한 동기 정량화에 대응하는 ICSS를 기록한다. 피실험자들은 원하는 뇌 부위에 독과점 또는 양극성 전극을 영구 이식하는 입체 수술을 받는다. 전극은 실험 당시 자극 기구에 연결되어 있다.
ICSS 실험의 첫 번째 부분에는 고정 비율 1(FR-1) 강화 일정(1 반응 = 1 보상)을 사용하여 자극에 반응하는 훈련 대상자가 포함된다. 쥐와 관련된 실험에서 피험자는 자극을 위해 지렛대를 누르는 훈련을 받으며, 지렛대 누르는 속도는 일반적으로 종속 변수다.[1] 마우스를 사용한 ICSS 연구에서는 마우스가 레버를 누르는 동작을 일관되게 수행하지 않기 때문에 보통 레버 대신 반응 휠을 사용한다.[5] 응답 휠의 각 1/4 회전을 기록하고 자극으로 보상한다. BSR 실험에서 보상 자극은 일반적으로 간격 펄스로 분리된 단기간 펄스열로 자극 진폭, 주파수, 펄스 지속시간의 독립 변수를 사용하여 실험적으로 조작할 수 있다.[17][1]
최소 유효 전류를 설정하는 중
자극의 진폭(전류)은 이식된 전극에 의해 활성화되는 뉴런의 집단을 결정한다. 특정 접근법에서는 전극 배치의 사소한 변동성으로 인해 모든 피험자에 대해 조정되며, 따라서 영향을 받는 뉴런의 모집단이 약간 다르다.[8] FR1 훈련에 이어 충분한 수준의 ICSS 응답(분당 약 40회 응답)을 생성하는 최소 임계 전류를 설정하는 것이 일반적이다. 이를 이산 심방 전류 강도 절차라고 한다.[18][19] 각각의 이산 실험은 일정한 진폭에서 비반환적 자극으로 구성되며, 그 후에 동물이 더 많은 자극을 위해 반응할 수 있는 짧은 창이 뒤따른다. BSR에 대한 유효 전류는 일정 비율 이상의 반응을 유도한다(예를 들어 4번의 시험 중 3번). 동물이 충분히 반응하는 최저 전류는 최소 유효 전류로 간주된다. 이것은 일반적으로 ICSS 연구에 채택된 주파수 범위의 상위 끝(140–160Hz)에서 일정한 주파수에서 수행된다.[5][6]
대상 연구 설계는 종종 전극 배치로 인한 가변성을 제거하기 위해 구현된다. 실험 대상 간 연구 설계에는 실험군 간의 일관성을 보장하기 위해 전극 배치의 엄격한 이력 검증이 필요하다. 전극 배치가 불완전한 피실험자는 리워드 회로를 활성화하고 ICSS 응답을 생성하기 위해 더 높은 시뮬레이션 진폭을 필요로 한다. 이상적인 해부학적 위치를 가진 피실험자들은 낮은 자극 진폭에서 반응할 것이다. 그러나 활성화 뉴런의 모집단을 증가시키면 인접 회로의 목표 외 활성화를 초래할 수 있기 때문에 이러한 교정 과정은 제한적이다. MFB가 내부 캡슐에 인접해 있기 때문에 이것은 종종 자극에 따른 원치 않는 모터 부작용에 의해 절정에 이르게 되는데, 이는 뇌계로 하강하는 모터 정보를 운반하는 차축 묶음이다. 이러한 차축의 우발적인 자극은 머리의 움직임이나 발바닥의 경련과 같은 모터 출력으로 이어질 수 있다.[20][5][8]
주파수 응답 속도
일정한 최소 유효 전류에서 ICSS 응답은 자극 빈도에 따라 다른 일련의 시행에 걸쳐 기록된다. 각 실험은 비응축 자극의 짧은 프라이밍 단계, 반응을 기록하고 자극으로 보상하는 반응 단계, 반응을 기록하지 않고 자극이 전달되지 않는 짧은 타임아웃 단계로 구성된다. 이는 20–200Hz 범위인 0.05 로그 단위 증분으로 10-15개의 서로 다른 오름차순 또는 내림차순 주파수에 대해 반복된다.[5]
자극의 진폭은 어떤 뉴런이 자극을 받느냐에 영향을 미치지만, 자극의 빈도는 그 뉴런 모집단에서 유도되는 발화율을 결정한다. 일반적으로 자극 빈도가 증가하면 대상 모집단의 발화율이 증가한다. 이는 ICSS 응답률이 높아져 결국 뉴런의 내화 특성에 의해 제한되는 최대 발화율에서 최대 수준에 도달하는 것과 관련이 있다.
기타인자
자극열과 맥박 지속시간의 독립변수도 각각이 ICSS 응답률에 어떻게 영향을 미치는지 결정하기 위해 변화할 수 있다. 열차 시간이 길수록 한 지점까지 더 활발하게 반응하며, 그 이후에는 열차 길이에 따라 반비례적으로 반응 속도가 달라진다. 이는 이전에 획득한 열차가 완공되기 전에 추가적인 자극을 위해 레버를 누르기 때문이다.[1]
강화 일정도 조작해 동물이 자극을 받기 위해 얼마나 열심히 일하느냐에 따라 자극을 받는 동기가 자극을 받기 위해 얼마나 동기부여를 받는지 판단할 수 있다. 이는 보상(FR-2, FR-3, FR-4 등)을 받기 위해 필요한 응답의 수를 늘리거나 필요한 응답의 수가 지속적으로 증가하는 점진적 비율 일정을 구현함으로써 이루어질 수 있다. 동물이 필요한 반응 수에 도달하지 못할 때까지 각 실험마다 필요한 반응의 수가 증가한다. 이는 "차단점"으로 간주되며 보상 규모와 관련된 동기를 잘 나타낸다.[6]
곡선-변위 분석
자극 강도, 펄스 지속 시간 또는 펄스 주파수는 곡선-변위 분석을 사용하여 응답하는 선량-반응 함수 ICSS를 결정하기 위해 변경할 수 있다. 이 접근방식은 일반적으로 약물의 복용량이 아닌 자극의 빈도를 검사하는 기존의 약리학적 용량-반응 곡선과 유사하다.[1] 이 방법을 사용하면 기준 조건과 비교하여 응답률에 대한 보상 변조 치료제의 정량적 분석이 가능하다. 자극 빈도가 낮을수록 ICSS가 확률 이상으로 반응하지 못한다. 반응 속도는 최대 반응 속도에 도달할 때까지 빈도가 증가함에 따라 자극 주파수의 동적 범위에 걸쳐 급격히 증가한다.[1][3] 이 범위에 대한 응답률의 변화는 보상의 규모 변화를 반영한다.[3] 요율 빈도, 요율 강도 또는 요율 지속 함수는 자극의 효력과 효능에 대한 추론을 만들고, 약물이 자극의 보람 있는 영향을 어떻게 변화시키는지 설명한다.[1]
곡선-변위 분석은 약리학 연구에서 약물 투여 후 반응률과 기준 반응률을 비교하기 위해 종종 사용된다. 기준 조건 중 최대 응답률은 일반적으로 주파수 비율 곡선의 데이터를 최대 제어 속도(MCR)로 정규화하는 데 사용된다. 구체적으로는, 주어진 실험에 대한 응답의 수를 기준 조건 시험에서 기록된 가장 높은 응답 수로 나눈 다음 100을 곱한다. 실험 조건에서 MCR이 가장 높은 자극 빈도에서 100% 미만으로 떨어지면 진정제 또는 역작용 특성을 가진 약물에 의해 잠재적으로 유발되는, 충격을 받은 능력이나 반응 동기를 반영하는 것으로 생각된다. MCR의 100% 이상의 이동은 반응 능력이나 동기가 개선된 것으로, 보상성 또는 자극성 특성을 가진 약물에 의해 잠재적으로 유발될 수 있다.[20]
자극의 보상 특성에 대한 신경회로의 민감도는 M50의 좌우변형 또는 우우변형, 또는 최대 반응수의 50%가 기록된 주파수를 분석하여 평가한다. 낮은 주파수에서 MCR의 50%에 도달하는 것은 주파수 속도 곡선의 좌회전 및 자극에 대한 보상 회로의 감작화의 특징이다. M50이 증가하면 MCR의 50%에 도달하기 위해 더 큰 자극 주파수가 필요했고, 실험 조작에 의해 보상 회로가 약화되었음을 나타낸다. 대조군과 실험 조건 사이의 주파수 비율 곡선을 분석하는 또 다른 방법은 (MCR에 정규화되지 않은) 원시 데이터 그림에서 오름차순 데이터 점을 통해 선형 회귀 분석을 수행하는 것이다. y=0 또는 x 절편(x-절편0)을 임계값 주파수 또는 세타 0( ()이라고 하는 지점. 이는 ICSS 응답률이 0과 같은 빈도(이 위의 빈도는 이론적으로 ICSS 응답을 이끌어낼 것이다)[5][6]이다.
약물을 이용한 변조
여러 주요 약물 등급이 ICSS 행동과 관련하여 광범위하게 연구되었다: 모노아민성 약물, 오피오이드, 콜린성 약물, GABAergic 약물, 그리고 다른 등급의 소수의 약물들.[6] 이러한 연구들은 일반적으로 기준선에서 대응하는 ICSS와 약물 투여 후의 ICSS를 비교한다. 일반적으로 주파수 속도 접근방식은 M50 또는 θ의0. 변화를 결정하는 데 사용된다.
중독성 책임성이 높은 약물은 일반적으로 ICSS 반응에 대한 자극 임계값을 감소시키는 반면, 반작용 성질을 가진 약물은 일반적으로 자극 임계값을 증가시켜 ICSS 반응에 도달한다. 이러한 연구는 BSR의 촉진에 관련된 특정 신경화학적 메커니즘에 대한 통찰력을 제공하며, 특정 신경전달물질 시스템의 활동을 약리학적으로 변경하여 보상지각을 어떻게 변조할 수 있는지에 대한 통찰력을 제공한다. 이러한 시스템의 약리학적 조작은 보상 회로의 활동에 직접 또는 간접적인 영향을 미칠 수 있다. ICSS 응답 임계값에 대한 약물 특이적 영향을 이해하면 보상 자극에 대한 민감도를 강화하거나 억제하고 보상 관련 행동을 수행하는 동기에 영향을 미침으로써 서로 다른 신경전달체 시스템이 보상 회로에 어떤 영향을 미치는지 규명하는 데 도움이 되었다.
중독의 BSR과 약물은 공유 신경원자 및 신경화학적 메커니즘을 통해 보람 있는 효과를 만들어 낸다. 뇌의 병변, 약리학, 해부학적 매핑을 이용한 연구에서는 많은 약물 남용(암페타민, 코카인, 오피오이드, 니코틴 등)이 MFB의 보상 회로를 활성화하는데, 이는 BSR을 달성하기 위해 자극에 의해 유사하게 활성화된다. 보상 회로의 핵심 구성 요소인 중경화 도파민 계통의 신경 축은 일반적으로 자극에 대한 문턱이 높다. 그러나 이러한 임계값은 약물 투여에 의해 증가하거나 감소할 수 있으며, 두개내 자극에 대한 민감도와 ICSS 거동에 영향을 미친다.
모노아민제
도파민, 노르에피네프린, 세로토닌의 신경전달 작용을 변화시키는 약물의 효과는 BSR과 관련하여 광범위하게 연구되어 왔다. 신경화학적 연구는 BSR이 핵 내 도파민의 발생을 유발한다는 것을 보여주었다.[21] 이 효과는 코카인과 같이 세포 내 공간에 도파민의 재흡수를 억제하는 코카인과 같은 세포외 도파민의 양을 스스로 증가시키는 약물을 투여한 후에 일반적으로 강력해진다. 반대로 신경전달물질의 분해나 재흡수를 촉진하여 도파민 수용체를 적대시하거나 세포외 도파민의 양을 감소시키는 약물을 투여한 후에는 이러한 수치가 감소하고 BSR의 보상성질이 차단된다. 도파민은 일반적으로 보상체계에 관여하는 주요 신경전달물질로 여겨지지만, 중독성 있는 모노아민성 약물에 의해 영향을 받는 유일한 신경전달물질은 아니다. 중요한 것은, BSR에 관련된 회로는 다합성 물질이며, 도파민성만 있는 것이 아니라는 점이다.[5][2] 이는 보상 신호 전송의 다른 단계에서 다른 신경전달물질 시스템에 의한 변조의 가능성을 도입한다.
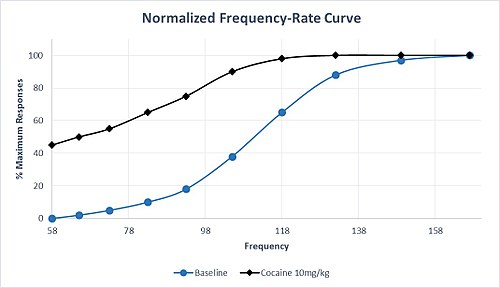
또한 모노아민 전달에 영향을 미치는 약물은 선택성이 다양하다. 예를 들어 세로토닌 전달에 비해 도파민 및 노르에피네프린 투과량을 증가시키는 선택성이 높은 약물은 중독성이 높은 경향이 있다. 암페타민과 코카인은 이러한 선택성 프로파일을 공유하며, 이러한 약물을 투여하면 일반적으로 M50과 θ에서0, 좌회전하여 보상 회로의 민감화와 높은 남용 잠재성을 나타낸다. 코카인의 적정 용량에 대응한 M50의 이러한 특성 좌회전 현상은 그림 1에 설정된 가상 데이터에 설명되어 있다. 최대 응답률은 기준치보다 낮은 주파수로 도달하며, 최저 주파수에서는 유의한 응답률이 존재하며, 이는 기준선 조건에서 응답을 생성하지 않았다는 점에 유의해야 한다. 필로폰이나 코카인을 만성적으로 투여한 후에도 ICSS 촉진에 대한 내성이 거의 또는 전혀 없다. 그러나 만성치료를 중단한 후에는 ICSS 반응에 따른 탈퇴로 인한 우울증이 나타나는데, 이는 약을 다시 투여하면 되돌릴 수 있다.[6]
도파민/노레피네프린과 세로토닌 전달에 보다 균형 잡힌 선택성을 가진 약품 3,4메틸렌디옥시메탐페타민(MDMA)은 중독성이 떨어지는 경향이 있으며, 투여량과 자극 빈도에 따라 ICSS 반응에 복합적인 효과가 있다. 그러나 세로토닌 선택적 약물은 ICSS의 효력이 부족하거나 ICSS 반응의 우울증(주파수율 곡선의 오른쪽 이동)을 초래하는 경향이 있으며, 일반적으로 이러한 약물은 덜 중독적인 것으로 간주된다. 그런 예로는 식욕억제제로 시판된 펜플루라민이 있다.[6] 도파민 대항제는 일반적으로 ICSS 반응의 우울증과 주파수 비율 곡선의 우경화를 초래한다. 이것은 BSR이 감소하고 자극의 역행성이 증가했음을 시사한다. 도파민 길항제 만성치료에 이어 ICSS의 철수에 의한 촉진 작용이 있는데, 이는 각성제를 사용한 만성치료에 이어 관찰되는 것과 반대되는 효과다.[22][1]
오피오이드
오피오이드 시스템에 작용하는 약물은 일반적으로 mu(μ), 델타(Δ), 카파( (pa) 오피오이드 수용체에 대한 선택성이 다양하다. 그들의 중독성 있는 특성은 이러한 선택성에 크게 의존한다. 일반적으로 말해 높은 효력 무오피오이드 수용체(MOR) 작용제는 남용 가능성이 높은 반면, 카파오피오이드 수용체(KOR) 작용제는 일반적으로 난독증을 유발한다. MOR의 작용제인 모르핀은 ICSS와 BSR이 등장했을 때 가장 일찍 연구된 약물들 중 하나였다.[23] 모르핀과 같은 높은 효력 MOR 작용제는 높은 남용 잠재력을 가지고 있음에도 불구하고 ICSS 반응에 다소 다양한 영향을 미치며, 그 결과 위력과 우울증을 모두 유발한다. 이러한 약물이 ICSS 반응에 미치는 영향은 선량, 전처리 시간 및 이전 오피오이드 노출에 크게 의존하는 것으로 밝혀졌다. 모르핀, 헤로인, 펜타닐, 메타돈, 하이드로코돈 등 MOR 선택 약물의 효과에 대한 다양한 연구가 ICSS 대응에서 복합적인 효과를 발견했다. 이러한 약물의 저선량은 ICSS의 약한 활성화를 유도하는 반면, 고선량은 낮은 주파수에서 ICSS에 대한 높은 임계값과 높은 주파수에서 ICSS 전위성으로 구성되는 biphasic ICSS 프로파일을 유발하는 것으로 밝혀졌다. 낮은 용량에서 높은 잠재력 MOR 작용제를 만성 투여할 경우 ICSS 촉진에 대한 내성이 없다.[6][24]
날록손과 같은 오피오이드 수용체 길항제들은 양쪽 오피오이드 수용체 작용제가 ICSS 반응에 미치는 영향과 필로폰과 같은 정신안정제의 효능을 역전시킬 수 있다. 모든 오피오이드 수용체 하위 타입의 경쟁적 대항제인 날록손은 스스로 투여했을 때 ICSS 응답에 영향을 주지 않는다.[25] 일반적으로 난독증과 관련된 KOR의 작용은 ICSS 대응의 우울증을 더 일관되게 초래한다. 예를 들어, KOR 작용제인 salvinorin-A는 낮은 자극 주파수에서 ICSS 응답률이 전반적으로 감소한다. 반복적인 행정은 ICSS 우울증에 대한 내성을 낳지 않는다.[5] 델타 오피오이드 수용체(DOR) 작용제/항생물제가 ICSS에 미치는 영향은 명확하지 않다. 한 DOR 작용제인 SNC80은 ICSS 우울증을 유발하는 것으로 밝혀졌지만, 일부 델타 작용제들이 ICSS 촉진 특성이 약할 수 있다는 반증도 있다.[6]
콜리네르그제약
콜리네르그제는 모노아민이나 오피오이드보다 덜 광범위하게 연구되어 왔다. 가장 일반적으로 연구되는 콜린에르겐 약물은 담배의 고중독성 정신작용 물질인 니코틴이다. 니코틴은 리간드 게이트 이온 통로인 니코틴 아세틸콜린 수용체(nAchRs)의 작용제다. 니코틴의 중독성 특성은 특히 니코틴 수용체의 α4β2 하위 타입의 작용과 관련이 있는 것으로 밝혀졌다.[26] 많은 연구들은 니코틴을 적게 복용하면 ICSS가 촉진되는 반면, 더 많이 복용하면 ICSS 우울증이 생긴다는 것을 확인했다.[27][6] 니코틴을 사용한 만성 치료는 낮은 용량에서 ICSS 촉진에 대한 내성을 초래하지 않지만, 높은 용량의 우울한 효과에 대한 내성을 초래한다. MOR 작용제 및 모노아민 자극제처럼 낮은 용량에서 ICSS 촉진제의 인출 유도 우울증도 관찰된다. 니코틴 치료가 ICSS 반응 임계값과 최대 반응률에 미치는 영향은 중독성 MOR 작용제와 모노아민 자극제가 많은 경우만큼 크지 않다.[28][6]
GABAERG 약물
GABAergic 전송은 억제적이며 GABA의 두 가지 주요 수용체는 GABA와A GABA이다B. 리간드 게이트형 이온 통로인 GABAA 수용체에 작용하는 약물은 일반적으로 진정작용과 불안감에 더 강력한 효과를 내고 치료용으로 처방되기 때문에 더욱 폭넓게 연구되고 있다. 이 약들 중 몇몇은 중독성 있는 성질을 가지고 있는데, 여기에는 몇몇 벤조디아제핀과 바비투라테가 포함된다. 이러한 약물의 저선량은 일반적으로 ICSS 촉진으로 이어지는 반면, 높은 선량은 ICSS의 우울증과 최대 반응률의 전반적인 감소를 초래할 수 있다. 후자는 이들 약물의 진정작용과 최면작용의 특성 때문에 반응 능력이 저하된 것과 관련이 있을 가능성이 높다. 에탄올은 GABA 수용체 활동에 영향을 미치며, 이러한 발견이 일관성이 없다는 오래된 간행물에도 불구하고 ICSS를 적당히 용이하게 하는 것으로 밝혀졌다.[6][29]
GABAB 수용체 작용제 및 양성 알로스테릭 조절제는 ICSS 우울증을 유발하는 것으로 밝혀졌으며 코카인, 필로폰, 니코틴 등 여러 약물의 강화 효과를 억제하는 것으로 밝혀져 이러한 약물이 전형적으로 유발하는 ICSS 촉진 작용을 역전시켰다.[30]
임상 및 임상 전 증거
BSR의 메커니즘은 특히 중독적이고 강박적인 행동에 관하여 동기 부여와 강화를 통해 뇌가 행동을 지배하는 방법에 대한 통찰력을 제공하는 도구를 제공한다. BSR에 대한 ICSS 연구는 보상 민감도의 강력한 척도로 입증되었으며, 다양한 미래 치료법의 남용 책임을 평가하는 데 도움이 될 잠재력을 가지고 있다.[6] 또한 ICSS 연구는 보상 민감도가 중독성 장애와 관련된 유전적 요인에 의해 어떻게 영향을 받는지 측정하는 데 사용될 수 있는 잠재력을 가지고 있다.[31][32][33] ICSS 촉진 방지를 위해 발견된 약물은 임상 환경에서 중독성 질환의 위험을 줄이기 위해 개발 및 치료적으로 구현될 가능성이 있다.[34][18]
참고 항목
참조
- ^ a b c d e f g h i j k l m n o p Wise RA (1996). "Addictive drugs and brain stimulation reward". Annual Review of Neuroscience. 19: 319–40. doi:10.1146/annurev.ne.19.030196.001535. PMID 8833446.
- ^ a b c d e f g h Wise RA (October 2002). "Brain reward circuitry: insights from unsensed incentives". Neuron. 36 (2): 229–40. doi:10.1016/s0896-6273(02)00965-0. PMID 12383779.
- ^ a b c d e f Wise RA, Rompre PP (1989). "Brain dopamine and reward". Annual Review of Psychology. 40: 191–225. doi:10.1146/annurev.ps.40.020189.001203. PMID 2648975.
- ^ Rolls ET (January 1974). "The neural basis of brain-stimulation reward". Progress in Neurobiology. 3 (2): 71–118. doi:10.1016/0301-0082(74)90005-7.
- ^ a b c d e f g h i Carlezon WA, Chartoff EH (2007). "Intracranial self-stimulation (ICSS) in rodents to study the neurobiology of motivation". Nature Protocols. 2 (11): 2987–95. doi:10.1038/nprot.2007.441. PMID 18007634.
- ^ a b c d e f g h i j k l m n Negus SS, Miller LL (July 2014). "Intracranial self-stimulation to evaluate abuse potential of drugs". Pharmacological Reviews. 66 (3): 869–917. doi:10.1124/pr.112.007419. PMC 4081730. PMID 24973197.
- ^ a b c Olds J, Milner P (1954). "Positive reinforcement produced by electrical stimulation of septal area and other regions of rat brain". Journal of Comparative and Physiological Psychology. 47 (6): 419–27. doi:10.1037/h0058775. PMID 13233369.
- ^ a b c d e Milner PM (1991). "Brain-stimulation reward: a review". Canadian Journal of Psychology. 45 (1): 1–36. doi:10.1037/h0084275. PMID 2044020.
- ^ a b c Olds J (1975). "Reward and Drive Neurons". Brain Stimulation Reward. 1: 1–30.
- ^ Heath RG (December 1963). "Electrical self-stimulation of the brain in man". The American Journal of Psychiatry. 120 (6): 571–7. doi:10.1176/ajp.120.6.571. PMID 14086435.
- ^ Berridge, K. C. (2003). "Pleasures of the brain". Brain and Cognition. 52 (1): 106–128. doi:10.1016/S0278-2626(03)00014-9. PMID 12812810.
- ^ "The New Era of Neuromodulation". AMA Journal of Ethics. 17 (1): 74–81. 1 January 2015. doi:10.1001/virtualmentor.2015.17.1.oped2-1501.
- ^ Frank, Lone (21 March 2018). "Can Electrically Stimulating Your Brain Make You Too Happy?". The Atlantic. Retrieved 19 February 2020.
- ^ a b c d Olds J (1958). "Self-stimulation of the brain; its use to study local effects of hunger, sex, and drugs". Science. 127 (3294): 315–24. doi:10.1126/science.127.3294.315. PMID 13506579.
- ^ Bozarth MA, Wise RA (1985). "Toxicity associated with long-term intravenous heroin and cocaine self-administration in the rat". JAMA. 254 (1): 81–3. doi:10.1001/jama.1985.03360010087032. PMID 4039767.
- ^ Kokarovtseva L, Jaciw-Zurakiwsky T, Mendizabal Arbocco R, Frantseva MV, Perez Velazquez JL (2009). "Excitability and gap junction-mediated mechanisms in nucleus accumbens regulate self-stimulation reward in rats". Neuroscience. 159 (4): 1257–63. doi:10.1016/j.neuroscience.2009.01.065. PMID 19409225.
- ^ Sonnenschein B, Conover K, Shizgal P (2003). "Growth of brain stimulation reward as a function of duration and stimulation strength". Behavioral Neuroscience. 117 (5): 978–94. doi:10.1037/0735-7044.117.5.978. PMID 14570548.
- ^ a b Phillips TJ, Reed C (November 2014). "Targeting GABAB receptors for anti-abuse drug discovery". Expert Opinion on Drug Discovery. 9 (11): 1307–17. doi:10.1517/17460441.2014.956076. PMID 25195620.
- ^ Marcus R, Kornetsky C (March 1974). "Negative and positive intracranial reinforcement tresholds [sic] : Effects of morphine". Psychopharmacologia. 38 (1): 1–13. doi:10.1007/BF00421282.
- ^ a b Liebman JM (1983). "Discriminating between reward and performance: a critical review of intracranial self-stimulation methodology". Neuroscience and Biobehavioral Reviews. 7 (1): 45–72. doi:10.1016/0149-7634(83)90007-6. PMID 6132357.
- ^ Phillips AG, Blaha CD, Fibiger HC (1989). "Neurochemical correlates of brain-stimulation reward measured by ex vivo and in vivo analyses". Neuroscience and Biobehavioral Reviews. 13 (2–3): 99–104. doi:10.1016/S0149-7634(89)80017-X. PMID 2530478.
- ^ Barr AM, Markou A, Phillips AG (2002). "A 'crash' course on psychostimulant withdrawal as a model of depression". Trends in Pharmacological Sciences. 23 (10): 475–82. doi:10.1016/S0165-6147(02)02086-2. PMID 12368072.
- ^ Olds J, Travis RP (April 1960). "Effects of chlorpromazine, meprobamate, pentobarbital and morphine on self-stimulation". The Journal of Pharmacology and Experimental Therapeutics. 128: 397–404. PMID 14428622.
- ^ Esposito RU, Kornetsky C (June 1978). "Opioids and rewarding brain stimulation". Neuroscience & Biobehavioral Reviews. 2 (2): 115–122. doi:10.1016/0149-7634(78)90052-0.
- ^ Schaefer GJ (1988). "Opiate antagonists and rewarding brain stimulation". Neuroscience and Biobehavioral Reviews. 12 (1): 1–17. doi:10.1016/s0149-7634(88)80068-x. PMID 3287237.
- ^ Melroy-Greif WE, Stitzel JA, Ehringer MA (January 2016). "Nicotinic acetylcholine receptors: upregulation, age-related effects and associations with drug use". Genes, Brain, and Behavior. 15 (1): 89–107. doi:10.1111/gbb.12251. PMC 4780670. PMID 26351737.
- ^ Itasaka M, Hironaka N, Miyata H (June 2015). "[Behavioral characteristics of nicotine seeking: a role of the nicotine-conditioned effects and other mechanisms]". Nihon Arukoru Yakubutsu Igakkai Zasshi = Japanese Journal of Alcohol Studies & Drug Dependence. 50 (3): 135–43. PMID 26502572.
- ^ Bauzo RM, Bruijnzeel AW (2012). "Animal models of nicotine withdrawal: intracranial self-stimulation and somatic signs of withdrawal". Methods in Molecular Biology. 829: 257–68. doi:10.1007/978-1-61779-458-2_16. ISBN 978-1-61779-457-5. PMID 22231819.
- ^ Kornetsky C, Bain GT, Unterwald EM, Lewis MJ (October 1988). "Brain stimulation reward: effects of ethanol". Alcoholism, Clinical and Experimental Research. 12 (5): 609–16. doi:10.1111/j.1530-0277.1988.tb00250.x. PMID 2852475.
- ^ Vlachou S, Markou A (2010). "GABAB receptors in reward processes". GABABReceptor Pharmacology - A Tribute to Norman Bowery. Advances in Pharmacology. Vol. 58. pp. 315–71. doi:10.1016/S1054-3589(10)58013-X. ISBN 9780123786470. PMID 20655488.
- ^ Yu C, McClellan J (July 2016). "Genetics of Substance Use Disorders". Child and Adolescent Psychiatric Clinics of North America. 25 (3): 377–85. doi:10.1016/j.chc.2016.02.002. PMID 27338962.
- ^ Yang J, Li MD (August 2016). "Converging findings from linkage and association analyses on susceptibility genes for smoking and other addictions". Molecular Psychiatry. 21 (8): 992–1008. doi:10.1038/mp.2016.67. PMC 4956568. PMID 27166759.
- ^ Choi HD, Shin WG (April 2016). "Meta-analysis of the association between a serotonin transporter 5-HTTLPR polymorphism and smoking cessation". Psychiatric Genetics. 26 (2): 87–91. doi:10.1097/YPG.0000000000000116. PMID 26886943.
- ^ Chiamulera C, Padovani L, Corsi M (August 2017). "Drug discovery for the treatment of substance use disorders: novel targets, repurposing, and the need for new paradigms". Current Opinion in Pharmacology. 35: 120–124. doi:10.1016/j.coph.2017.08.009. PMID 28874314.