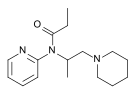
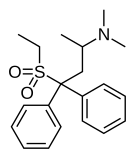
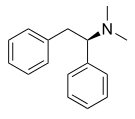
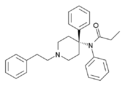
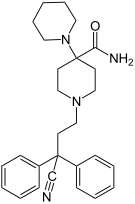
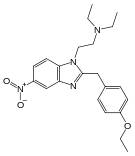
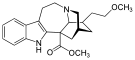
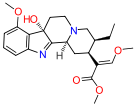
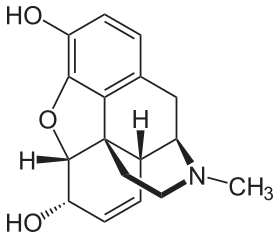
오피오이드
Opioid| 오피오이드 | |
|---|---|
| 드럭 클래스 | |
 | |
| 클래스 식별자 | |
| 사용하다 | 통증완화 |
| ATC코드 | N02A |
| 동작방식 | 오피오이드 수용체 |
| 외부 링크 | |
| MeSH | D000701 |
| 법적지위 | |
| Wikidata | |
오피오이드는 아편 양귀비 식물에서 발견되는 천연 물질에서 유래하거나 모방하는 약물의 한 종류입니다.오피오이드는 통증 완화를 포함한 다양한 효과를 내기 위해 뇌에서 작용합니다.물질의 종류로서 그들은 모르핀과 같은 효과를 내기 위해 오피오이드 수용체에 작용합니다.[2][3]
'opioid'와 'opiate'라는 용어가 혼용되는 경우도 있지만, 이러한 의약품의 제조 과정에 따라 주요한 차이가 있습니다.[4]
의학적으로 그것들은 주로 마취를 포함한 통증 완화를 위해 사용됩니다.[5]다른 의학적 용도로는 설사 억제, 오피오이드 사용 장애 대체 요법, 오피오이드 과다 복용 역전, 기침 억제 등이 있습니다.[5]카르펜타닐과 같은 매우 강력한 오피오이드는 수의학적 용도로만 승인됩니다.[6][7][8]오피오이드는 또한 행복감을 주기 위해 또는 금단현상을 막기 위해 비의료적으로 자주 사용됩니다.[9]오피오이드는 사망의 원인이 될 수 있으며 미국에서 사형에 사용되어 왔습니다.
오피오이드의 부작용으로는 가려움, 진정, 메스꺼움, 호흡 억제, 변비, 행복감 등이 있을 수 있습니다.장기간 사용하면 내성이 생겨 같은 효과를 얻기 위해 용량을 늘려야 하며, 약물을 갑자기 중단하면 불쾌한 금단 증상이 발생하는 신체적 의존성이 발생할 수 있습니다.[10]행복감은 오락적인 사용을 끌어들이고, 빈번하게 증가하는 오피오이드의 오락적인 사용은 일반적으로 중독을 초래합니다.벤조디아제핀과 같은 다른 우울증 약물을 과다 복용하거나 동시에 사용하면 일반적으로 호흡 저하로 사망합니다.[11]
오피오이드는 주로 중추 및 말초 신경계와 위장관에서 발견되는 오피오이드 수용체에 결합함으로써 작용합니다.이러한 수용체는 오피오이드의 정신 활동적인 효과와 신체적인 효과 둘 다를 중재합니다.오피오이드 약물에는 항 설사약인 로퍼아마이드와 같은 부분 작용제와 오피오이드 유도 변비를 위한 날록세골과 같은 길항제가 포함되어 있는데, 이들은 혈액-뇌 장벽을 넘지 않지만, 다른 오피오이드가 장신경총의 수용체에 결합하는 것으로부터 대체할 수 있습니다.
오피오이드는 중독성이 있고 치명적인 과다복용을 초래할 수 있기 때문에 대부분은 통제된 물질입니다.2013년에는 28~3800만 명의 사람들이 불법적으로 오피오이드를 사용했습니다(15~65세 전 세계 인구의 0.6~0.[12]8%).2011년, 미국에서 약 4백만 명의 사람들이 오락적으로 오피오이드를 사용하거나 그것에 의존하고 있습니다.[13]2015년 현재, 오락적 사용과 중독률의 증가는 오피오이드 약물의 과다 처방과 저렴한 불법 헤로인에 기인합니다.[14][15][16]반대로 과도한 처방, 과장된 부작용, 오피오이드로 인한 중독에 대한 두려움도 마찬가지로 통증의 과소 치료의 원인으로 지목되고 있습니다.[17][18]
용어.

오피오이드에는 모르핀 자체를 포함하여 아편에서 파생된 그러한 약물을 지칭하는 오래된 용어인 아편제가 포함됩니다.[19]다른 오피오이드는 히드로코돈, 옥시코돈, 펜타닐과 같은 반합성 및 합성 약물, 날록손과 같은 길항제 약물, 엔도르핀과 같은 내인성 펩타이드입니다.[20]아편과 마약이라는 용어는 때때로 오피오이드의 동의어로 접할 수 있습니다.아편은 아편 양귀비의 수지에서 발견되는 천연 알칼로이드로 적절하게 제한되어 있지만, 일부는 반합성 유도체를 포함합니다.[19][21]마약은 미국의 법적 용어로서 '무수함' 또는 '수면'을 의미하는 단어에서 유래한 것으로 코카인과 오피오이드, 그리고 그 원료 물질을 의미합니다. 그것은 또한 불법적이거나 통제된 정신 활동성 약물에 느슨하게 적용됩니다.[22][23]일부 관할구역에서는 통제되는 모든 마약이 법적으로 마약으로 분류됩니다.이 용어는 경멸적인 의미를 가질 수 있으며 일반적으로 사용이 권장되지 않습니다.[24][25]
의료용
통증
약한 오피오이드 코데인은 저용량이며 하나 이상의 다른 약물과 결합되어 있으며, 가벼운 통증을 치료하기 위한 처방전 없이 처방된 의약품에서 흔히 사용할 수 있습니다.[26][27][28]다른 오피오이드들은 보통 중간 정도에서 심각한 정도의 통증 완화를 위해 남겨집니다.[27]
급성통증
오피오이드는 급성 통증(수술 후 통증 등) 치료에 효과적입니다.[29]중간에서 심각한 급성 통증의 즉각적인 완화를 위해 오피오이드는 빠른 발병, 효능 및 의존 위험 감소로 인해 종종 선택되는 치료법입니다.그러나 새로운 보고서는 수술이나 외상 후 급성 통증 관리를 위해 오피오이드 진통제를 시작할 때 오피오이드 사용이 장기화될 위험이 명백하다는 것을 보여주었습니다.[30]그들은 또한 암과 같은 일부 말기 상태와 류마티스 관절염과 같은 퇴행성 상태에서 발생할 수 있는 중증, 만성, 장애성 통증을 돕는 완화 의료에서 중요한 것으로 밝혀졌습니다.많은 경우 오피오이드는 만성적인 암통증을 가진 사람들에게 성공적인 장기 치료 전략입니다.
미국 내 모든 주의 절반 이상이 급성 통증에 대한 오피오이드의 처방이나 조제를 제한하는 법을 제정했습니다.[31]
만성암외통
가이드라인은 두통, 요통, 섬유근육통을 포함한 대부분의 비암성 만성 질환에 사용될 때 오피오이드의 위험이 그들의 이점보다 더 클 가능성이 높다고 제안했습니다.[32]따라서 만성적인 비암성 통증에 조심스럽게 사용해야 합니다.[33]사용된 경우 최소 3개월마다 유익성 및 위해성을 재평가해야 합니다.[34]
만성 통증을 치료할 때, 오피오이드는 파라세타몰/아세트아미노펜 또는 이부프로펜 또는 나프록센과 같은 NSAID를 포함한 다른 덜 위험한 진통제가 고려된 후에 시도되는 선택입니다.[35]섬유근육통이나 편두통으로 인한 통증을 포함한 만성 통증의 일부 유형은 오피오이드 이외의 약물로 우선적으로 치료됩니다.[36][37]만성 신경병증성 통증을 줄이기 위해 오피오이드를 사용하는 것의 효과는 확실하지 않습니다.[38]
오피오이드는 주의력을 손상시키고 의존의 위험을 가져오며, 일시적 두통이 만성화될 위험을 증가시키기 때문에 두통의 일차 치료법으로 금지됩니다.[39]오피오이드는 두통 통증에 대한 민감도를 높일 수 있습니다.[39]다른 치료법이 실패하거나 사용할 수 없을 때, 만성 두통의 발생을 막기 위해 환자를 관찰할 수 있다면 오피오이드는 두통을 치료하는 데 적절할 수 있습니다.[39]
오피오이드는 비악성 만성 통증 관리에 더 자주 사용되고 있습니다.[40][41][42]이 관행은 이제 오피오이드의 중독과 오남용에 대한 새롭고 증가하는 문제로 이어졌습니다.[33][43]다양한 부정적인 영향 때문에 만성 통증의 장기적인 관리를 위한 오피오이드의 사용은 다른 덜 위험한 진통제가 효과적이지 않다는 것이 발견되지 않는 한 표시되지 않습니다.신경통, 편두통, 섬유근육통과 같이 주기적으로만 발생하는 만성통은 오피오이드 이외의 약물로 치료하는 것이 좋습니다.[36]파라세타몰/타이레놀/아세트아미노펜과 이부프로펜과 나프록센을 포함한 비스테로이드성 소염제가 더 안전한 대안으로 여겨집니다.[44]그것들은 종종 오피오이드와 함께 사용되는데, 예를 들어 옥시코돈(퍼코세트)과 이부프로펜이 하이드로코돈(비코프로펜)과 결합된 파라세타몰과 같이, 통증 완화를 증진시키지만 또한 오락적인 사용을 억제하기 위한 것입니다.[45][46]
다른.
기침
코데인은 한때 기침 억제제의 "금본위제"로 여겨졌지만, 지금은 이 입장에 의문이 제기되고 있습니다.[47]최근 몇몇 위약 대조 실험들은 그것이 아이들의 급성 기침을 포함한 몇몇 원인들에 대해 위약보다 나을 수 없다는 것을 발견했습니다.[48][49] 결과적으로, 그것은 아이들에게 권장되지 않습니다.[49]게다가 하이드로코돈이 어린이들에게 유용하다는 증거는 없습니다.[50]마찬가지로, 급성 기침의 치료에 관한 2012년 네덜란드 지침에서는 사용을 권장하지 않습니다.[51] (오피오이드 유사 덱스트로메토판은 코데인만큼 기침 억제제의 효과가 있다고 오랫동안 주장되어 왔지만,[52] 최근의 몇몇 연구에서는 유사하게 거의 효과가 없다는 것을 보여주었습니다.)[53]
저용량 모르핀은 만성 기침에 도움이 될 수 있지만 부작용으로 인해 사용이 제한됩니다.[54]
설사와 변비
설사가 우세한 과민성 장증후군의 경우 오피오이드가 설사를 억제하는 데 사용될 수 있습니다.로퍼아마이드는 설사를 억제하는 데 사용되는 처방전 없이 사용할 수 있는 말초 선택적 오피오이드입니다.
설사를 억제하는 능력은 오피오이드가 몇 주 이상 사용될 때 변비를 유발하기도 합니다.[55]말초 선택적 오피오이드 길항제인 나록세골은 오피오이드 유도 변비를 치료할 수 있습니다.[56]
호흡곤란
오피오이드는 특히 암이나 만성 폐쇄성 폐질환과 같은 진행성 질환에서 호흡 곤란을 도울 수 있습니다.[57][58]그러나, 문헌에 대한 최근의 두 가지 체계적인 리뷰의 결과는 오피오이드가 진행성 암을 가진 환자들의 호흡 곤란을 치료하는데 반드시 더 효과적인 것은 아니라는 것을 발견했습니다.[59][60]
안절부절못하는 다리 증후군
일반적으로 치료의 첫 번째 단계는 아니지만, 옥시코돈과 메타돈과 같은 오피오이드는 때때로 심각하고 난치성인 다리 증후군의 치료에 사용됩니다.[61]
과알레르기
OIH(Opioid-induced hyperalgesia)는 만성 오피오이드 노출 후 환자들에게 명백하게 나타났습니다.[62][63]
역효과
공통단기
다른.
매년 전 세계적으로 69,000명의 사람들이 오피오이드 과다 복용으로 사망하고, 1,500만 명의 사람들이 오피오이드 중독을 가지고 있습니다.[65]
노인에게서 오피오이드 사용은 "진정, 메스꺼움, 구토, 변비, 요폐, 낙상"과 같은 부작용 증가와 관련이 있습니다.[66]결과적으로 오피오이드를 복용하는 노인들은 부상의 위험이 더 큽니다.[67]오피오이드는 아스피린이나 파라세타몰과 같은 다른 많은 약물들과는 달리 특정한 장기 독성을 일으키지 않습니다.그들은 상부위장관 출혈과 신장 독성과는 관련이 없습니다.[68]
급성요통에 대한 오피오이드 처방 및 골관절염 관리는 장기적인 부작용이[69][70] 있을 것으로 보입니다.
USCDC에 따르면, 메타돈은 1999년부터 2010년 사이에 미국에서 오피오이드 관련 사망의 31%와 관련된 유일한 약물로 40%를 차지했으며, 이는 다른 오피오이드보다 훨씬 높은 수치입니다.[71]장기간의 오피오이드에 대한 연구들은 많은 사람들이 그것들을 중단시키고, 사소한 부작용들이 흔하다는 것을 발견했습니다.[72]중독은 약 0.3%[72]에서 발생했습니다.2016년 미국에서 오피오이드 과다 복용으로 1만 명 중 1.7명이 사망했습니다.[73]
보강장애
공차
내성은 약물 효과를 감소시키는 신경 적응으로 특징지어지는 과정입니다.수용체 상향 조절이 종종 중요한 역할을 할 수 있지만 다른 메커니즘도 알려져 있습니다.[74]관용은 다른 효과들보다 일부 효과들에서 더 두드러집니다; 관용은 기분, 가려움, 요통, 그리고 호흡 억제에 대한 효과들에 천천히 발생하지만, 진통제와 다른 신체적인 부작용들에 더 빨리 발생합니다.그러나 내성은 변비나 근감소증(눈의 동공이 2밀리미터 이하로 수축하는 것)으로 발전하지 않습니다.그러나, 일부 저자들은 내성이 미오시스(miosis)로 발전한다고 주장하면서, 이 아이디어는 도전을 받아왔습니다.[75]
오피오이드에 대한 내성은 다음을 포함한 다양한 물질에 의해 약화됩니다.
- 칼슘 통로 차단제[76][77][78]
- 열내[79][80] 마그네슘과[81] 아연
- 덱스트로메토판, 케타민 및 [82]메만틴과 같은 NMDA 길항제.[83]
- 프로글루마이드와[84][85][86] 같은 콜레시스토키닌 길항제
- 포스포다이에스테라아제 억제제 이부딜라스트와 같은 새로운 제제들도 이 응용을 위해 연구되었습니다.[87]
내성은 신체가 자주 존재하는 약물에 적응하는 생리학적 과정으로, 보통 동일한 효과를 얻기 위해 시간이 지남에 따라 더 많은 양의 동일한 약물을 필요로 합니다.그것은 장기간 동안 많은 양의 오피오이드를 복용하는 사람들에게서 흔히 발생하지만, 오용 또는 중독과의 관계를 예측하지는 않습니다.
물리적 의존성
신체적 의존성은 물질의 존재에 대한 신체의 생리적 적응, 이 경우 오피오이드 약물입니다.물질이 중단되었을 때, 갑자기 용량이 감소되었을 때, 또는 특히 오피오이드의 경우, 길항제(예: 날록손) 또는 작용제-길항제(예: 펜타조신)가 투여되었을 때, 금단 증상의 발생에 의해 정의됩니다.신체적 의존은 특정 약물의 정상적이고 예상되는 측면이며 반드시 환자가 중독되었다는 것을 의미하는 것은 아닙니다.
아편의 금단 증상에는 심한 호흡곤란, 다른 아편 복용에 대한 갈망, 과민성, 발한, 메스꺼움, 코막힘, 떨림, 구토, 근육통 등이 포함될 수 있습니다.오피오이드의 섭취를 며칠, 몇 주에 걸쳐 천천히 줄이면 금단 증상을 줄이거나 없앨 수 있습니다.[88]금단의 속도와 심각성은 오피오이드의 반감기에 달려있습니다; 헤로인과 모르핀 금단은 메타돈 금단보다 더 빨리 일어납니다.급성 금단 단계는 종종 수개월 동안 지속될 수 있는 우울증과 불면증의 장기적인 단계로 이어집니다.오피오이드 금단 증상은 클로니딘과 같은 다른 약물로 치료할 수 있습니다.[89]신체적 의존성은 약물 오남용이나 진정한 중독을 예측하지 않으며, 관용과 같은 메커니즘과 밀접한 관련이 있습니다.이보게인에 대한 유익성에 대한 일화적인 주장이 있는 반면, 물질 의존성에서 이보게인의 사용을 뒷받침하는 데이터는 빈약합니다.[90]
오피오이드를 정기적으로 투여받은 중요한 환자들은 빈번한 증후군으로 의인성 금단현상을 경험합니다.[91]
중독
약물 중독은 일반적으로 특정 약물의 오용과 관련된 복잡한 행동 집합으로, 시간이 지남에 따라 발전하고 약물 용량이 증가합니다.중독은 심리적인 강박증을 포함하는데, 이는 피해를 입은 사람이 위험하거나 건강하지 못한 결과를 초래하는 행동을 지속하는 정도입니다.오피오이드 중독은 의학적인 이유로 처방된 대로 오피오이드를 경구로 복용하는 것이 아니라, 보충제나 주사제를 포함합니다.[88]
오스트리아, 불가리아, 슬로바키아와 같은 유럽 국가에서는 느린 방출 경구 모르핀 제제가 부프레노르핀 또는 메타돈의 부작용을 잘 견디지 못하는 환자를 위한 아편 대체 요법(OST)에 사용됩니다.부프레노핀은 또한 날록손과 함께 더 오랜 중독 치료를 위해 사용될 수 있습니다.영국을 포함한 다른 유럽 국가에서는 다양한 수용 규모를 가지고 있지만 이는 OST에도 합법적으로 사용됩니다.
천천히 방출되는 약의 제형은 오남용을 억제하고 중독률을 낮추는 동시에 통증 환자에게 정당한 통증 완화와 사용 편의성을 제공하기 위한 것입니다.그러나 이러한 유형의 제제의 효과와 안전성에 대해서는 의문이 남아 있습니다.현재 FDA의 시장 승인을 위한 시험과 함께 추가적인 변조 저항성 의약품을 고려 중입니다.[92][93]
이용 가능한 증거의 양은 약한 결론을 내릴 수 있을 뿐이지만, 약물 사용 장애의 과거력이 없는 환자들의 오피오이드 사용을 적절하게 관리하는 의사는 중독이나 다른 심각한 부작용을 일으킬 위험이 거의 없이 장기적인 통증 완화를 줄 수 있음을 시사합니다.[72]
오피오이드의 문제점은 다음과 같습니다.
- 어떤 사람들은 오피오이드가 그들의 모든 고통을 덜어주지는 못한다는 것을 발견합니다.[94]
- 어떤 사람들은 오피오이드 부작용이 치료의 효과를[72] 능가하는 문제를 일으킨다는 것을 발견합니다.
- 일부 사람들은 시간이 지남에 따라 오피오이드에 대한 내성을 키웁니다.이것은 그들이 유익함을 유지하기 위해 약물 복용량을 늘려야 하고, 그것은 또한 원하지 않는 부작용을 증가시킵니다.[72]
- 오피오이드를 장기간 사용하면 오피오이드에 의한 과알러지가 발생할 수 있는데, 이는 환자가 통증에 대한 민감도가 높아진 상태입니다.[95]
모든 오피오이드는 부작용을 일으킬 수 있습니다.[64]통증 완화를 위해 오피오이드를 복용하는 환자들에게 나타나는 흔한 이상 반응으로는 메스꺼움과 구토, 졸림, 가려움, 구강건조증, 어지러움, 변비 등이 있습니다.[64][88]
메스꺼움과 구토
메스꺼움에 대한 내성은 7-10일 이내에 발생하며, 이 기간 동안에는 항구토제(예: 야간에 1회 저용량 할로페리돌)가 매우 효과적입니다.[citation needed]haloperidol은 지각운동장애와 같은 심각한 부작용 때문에 현재 거의 사용되지 않습니다.이와 관련된 약물인 프로클로로페라진은 위험성이 비슷하지만 더 자주 사용됩니다.온단세트론이나 트로피세트론과 같은 더 강한 항생제는 더 큰 비용에도 불구하고 메스꺼움이 심하거나 지속적이고 불안할 때 때때로 사용됩니다.덜 비싼 대안은 돔페리돈과 메토클로프라미드와 같은 도파민 길항제입니다.돔페리돈은 혈액-뇌 장벽을 통과하지 않고 유해한 중앙 해독제 효과를 생성하지 않지만 화학 수용체 유발 영역에서 오피오이드 에메틱 작용을 차단합니다. (미국에서는 이 약을 사용할 수 없습니다.) 항콜린작용 특성을 가진 일부 항히스타민제(예: 오르페나드린 또는 디펜히드라민)도 효과적일 수 있습니다.1세대 항히스타민 히드록시진은 매우 일반적으로 사용되며, 이동 장애를 유발하지 않으며, 진통제를 사용하지 않는 장점이 있습니다.δ-테트라하이드로칸나비놀은 메스꺼움과 구토를 완화합니다; 그것은 또한 메스꺼움과 구토를 감소시키는 오피오이드의 저용량을 허용하는 진통제를 생산합니다.
구토는 뇌의 구토 중심인 뇌의 구토 후 영역의 화학수용체 유발 영역에 대한 직접적인 작용 이외에도 위의 정체(대량 구토, 구토로 인한 짧은 메스꺼움, 식도 역류, 상복부 충만, 조기 포화)로 인해 발생합니다.따라서 구토는 프로키네틱 제제(예: 돔페리돈 또는 메토클로프라미드)에 의해 예방될 수 있습니다.구토가 이미 시작된 경우, 이러한 약물은 경구가 아닌 경로(예: 메토클로프라미드의 경우 피하, 돔페리돈의 경우 직장)로 투여해야 합니다.
오피오이드를 포함한 마취가 수술 후 구역과 구토와 관련이 있다는 증거가 있습니다.[100]
오피오이드를 사용하는 만성 통증 환자들은 통증과 신체적 기능에 있어서 약간의 개선이 있었고 구토 위험이 증가가 있었습니다.[101]
졸음
졸음에 대한 내성은 보통 5-7일에 걸쳐 생기지만, 문제가 있다면 대체 오피오이드로 바꾸는 것이 종종 도움이 됩니다.펜타닐, 모르핀 및 디아모르핀(헤로인)과 같은 특정 오피오이드는 특히 진정되는 경향이 있는 반면, 옥시코돈, 틸리딘 및 메페리딘(페티딘)과 같은 다른 오피오이드는 비교적 적은 진정을 생성하는 경향이 있습니다.그러나 개별 환자의 반응은 현저하게 다를 수 있으며 특정 환자에게 가장 적합한 약물을 찾기 위해서는 어느 정도의 시행착오가 필요할 수 있습니다.그렇지 않으면 일반적으로 CNS 자극제로 치료하는 것이 효과적입니다.[102][103]
가려움증
통증 완화를 위해 오피오이드를 사용할 때 가려움증은 크게 문제되지 않는 경향이 있지만, 가려움증이 발생했을 때 항히스타민제가 효과적입니다.펙소페나딘과 같은 진정성이 없는 항히스타민제는 오피오이드 유도 졸음의 증가를 피하기 때문에 종종 선호됩니다.그러나 오르페나드린과 같은 진정 작용을 하는 항히스타민제는 적은 양의 오피오이드가 사용될 수 있도록 상승적인 통증 완화 효과를 낼 수 있습니다.따라서, 메프로진(메페리딘/프로메타진) 및 디코날(디파논/시클리진)과 같은 여러 오피오이드/항히스타민 조합 제품이 시판되고 있으며, 이들은 또한 오피오이드 유발 구역을 감소시킬 수 있습니다.
- 항히스타민제(예: 펙소페나딘)
변비
오피오이드 유도 변비(OIC)는 오피오이드를 장기적으로 복용하는 사람의 90~95%에서 발생합니다.[104]이 문제에 대한 내성이 일반적으로 생기지 않기 때문에, 장기간 오피오이드를 복용하는 대부분의 사람들은 완하제나 관장제를 복용해야 합니다.[105]
OIC의 치료는 순차적이며 중증도에 따라 다릅니다.[106]첫 번째 치료 방법은 비약물학적이며, 식이 섬유의 증가, 수액 섭취(하루 약 1.5L (51US floz), 신체 활동과 같은 생활 방식의 변화를 포함합니다.[106]비약물학적 조치가 효과적이지 않을 경우 대변 유연제(예: 폴리에틸렌 글리콜), 벌크 형성 완하제(예: 섬유 보충제), 자극성 완하제(예: 비사코딜, 세나) 및/또는 관장을 포함한 완하제를 사용할 수 있습니다.[106]OIC의 일반적인 완하제 요법은 도큐세이트와 비사코딜의 조합입니다.[106][107][108][needs update]락툴로스, 폴리에틸렌 글리콜, 마그네시아의 우유(수산화마그네슘)를 포함한 삼투압성 완하제와 미네랄 오일(윤활제)도 OIC에 일반적으로 사용됩니다.[107][108]
완하제가 충분히 효과적이지 못한 경우(흔히 그렇다),[109] 메틸날트렉손 브로마이드, 날록세골, 알비모판 또는 날록손(옥시코돈/날록손에서와 같이)과 같은 주변 선택적 오피오이드 길항제를 포함하는 오피오이드 제제 또는 제제가 시도될 수 있습니다.[106][108][110]2018년 코크레인 리뷰에 따르면 알비모판, 날록손 또는 메틸날트렉손 브로마이드에 대한 증거가 잠정적인 것으로 나타났습니다.[111][needs update]입으로 하는 나록손이 가장 효과적인 것 같습니다.[112]매일 0.2 mg의 naldemine을 복용하면 OIC 환자의 증상이 상당히 개선되는 것으로 나타났습니다.[113]
오피오이드 회전은 장기간 사용자들의 변비의 영향을 최소화하기 위해 제안된 방법 중 하나입니다.[114]모든 오피오이드가 변비를 유발하지만, 트라마돌, 타펜타돌, 메타돈, 펜타닐이 상대적으로 적은 변비를 유발할 수 있는 반면 코데인, 모르핀, 옥시코돈 또는 하이드로모폰 변비는 상대적으로 더 심각할 수 있음을 시사하는 연구와 함께 약물 간에 약간의 차이가 있습니다.
호흡 저하
호흡 억제는 오피오이드 사용과 관련된 가장 심각한 부작용이지만, 보통 오피오이드-나프 ï브 환자에게 정맥 내 단일 용량을 사용하는 경우에 나타납니다.통증 완화를 위해 오피오이드를 정기적으로 복용하는 환자의 경우 호흡 저하에 대한 내성이 빠르게 나타나 임상적인 문제가 되지 않습니다.호흡 억제를 부분적으로 차단할 수 있는 여러 약물들이 개발되었지만, 현재 이 목적을 위해 승인된 유일한 호흡 자극제는 독사프람이며, 이는 본 출원에서 제한된 효능만을 가지고 있습니다.[115][116]BIMU-8 및 CX-546과 같은 최신 약물이 훨씬 더 효과적일 수 있습니다.[117][118][119][non-primary source needed]
- 호흡 촉진제: 경동맥 화학수용체 작용제(예: 독사프람), 5-HT 작용제(예: BIMU8), δ-오피오이드 작용제(예: BW373U86) 및 AMPKines(예: CX717)는 모두 진통제에 영향을 주지 않고 오피오이드에 의한 호흡 억제를 감소시킬 수 있지만, 이러한 약물의 대부분은 단지 중간 정도의 효과가 있거나 사람에게 사용을 배제하는 부작용을 가지고 있습니다.8-OH-DPAT 및 레피노탄과 같은 5-HT1A 작용제는 또한 오피오이드 유도 호흡 억제에 대항하지만, 동시에 진통제를 감소시키고, 이는 이 적용에 대한 유용성을 제한합니다.
- 오피오이드 길항제(예: 날록손, 날메펜, 디프레노핀)
오피오이드 투여 후 초기 24시간은 생명을 위협하는 OIRD와 관련하여 가장 중요한 것으로 보이지만, 오피오이드 사용에 대한 보다 신중한 접근으로 예방 가능할 수 있습니다.[120]
심장, 호흡기 질환 및/또는 폐쇄성 수면 무호흡증이 있는 환자는 OIRD에 걸릴 위험이 증가합니다.[121]
통증 민감도 증가
오피오이드에 의한 과알러지증 – 역설적으로 고통을 완화하기 위해 오피오이드를 사용하는 사람들이 약물의 결과로 더 많은 고통을 경험하는 것 – 일부 사람들에게서 관찰되었습니다.이런 현상은 흔하지는 않지만 일부 완화의료를 받는 사람들에게서 볼 수 있는데, 대개는 용량이 빠르게 증가할 때 나타납니다.[122][123]여러 가지 오피오이드 진통제 사이를 회전시키면 통증이 증가하는 것을 줄일 수 있습니다.[124][125]오피오이드 유도 과알러지증은 만성적인 사용 또는 짧은 고용량에서 더 흔하게 발생하지만, 일부 연구에 따르면 매우 낮은 용량에서도 발생할 수 있다고 합니다.[126][127]
때때로 신경병증적 통증의 악화를 동반하는 과알레르기증 및 알로디니아와 같은 부작용은 오피오이드 진통제의 장기간 치료의 결과일 수 있으며, 특히 내성이 증가하여 효과가 떨어지고 시간이 지남에 따라 결과적으로 점진적 용량이 증가할 때 더욱 그렇습니다.이는 주로 노시셉틴 수용체, 시그마 수용체 및 Toll-like 수용체 4를 포함하는 3가지 고전적인 오피오이드 수용체 이외의 표적에서 오피오이드 약물의 작용의 결과로 보이며, 각각 J-113,397, BD-1047 또는 (+)-날록손과 같은 표적에서 길항제에 의해 동물 모델에서 반응할 수 있습니다.[128]현재 인간에서 오피오이드 유도 과알레르기증에 대한 반응을 위해 특별히 승인된 약물은 없으며 심한 경우 유일한 해결책은 오피오이드 진통제의 사용을 중단하고 비오피오이드 진통제로 대체하는 것일 수 있습니다.그러나, 이러한 부작용의 발생에 대한 개인의 민감성은 용량에 크게 의존하고 어떤 오피오이드 진통제를 사용하느냐에 따라 달라질 수 있기 때문에, 많은 환자들은 단순히 오피오이드 약물의 용량 감소(일반적으로 보충적인 비오피오이드 진통제의 추가와 동반됨)를 통해, 서로 다른 것들 사이에서 회전함으로써 이러한 부작용을 피할 수 있습니다.엔트 오피오이드 약물, 또는 신경병증성 통증, 특히 트라마돌 또는 타펜타돌에 대항하기도 하는 혼합된 작용 모드를 가진 가벼운 오피오이드로 전환함으로써.[129][130][131]
기타 악영향
성호르몬 수치가 낮음
임상 연구는 지속적으로 의학 및 오락용 오피오이드 사용이 성별에 따라 저식도증(낮은 성호르몬 수치)과 관련이 있습니다.효과는 용량에 따라 달라집니다.대부분의 연구는 만성 오피오이드 사용자의 대다수(아마도 90%)가 저식도증에 걸린다는 것을 시사합니다.2015년 체계적인 리뷰 및 메타 분석에 따르면 오피오이드 치료는 남성의 테스토스테론 수치를 평균 약 165ng/dL(5.7nmol/L) 억제했으며, 이는 테스토스테론 수치를 거의 50%[132] 감소시킨 것입니다.반대로 오피오이드 치료는 여성의 테스토스테론 수치에 유의한 영향을 미치지 않았습니다.[132]그러나 오피오이드는 황체형성호르몬(LH)의 생성을 제한함으로써 여성의 월경을 방해할 수도 있습니다.오피오이드 유도 저나트륨증은 에스트라디올의 결핍으로 인해 오피오이드 사용이 골다공증 및 뼈 골절과 강한 연관성을 일으킬 가능성이 있습니다.또한 통증을 증가시켜 오피오이드 치료의 임상적 효과를 방해할 수도 있습니다.오피오이드 유도 저나트륨증은 시상하부와 뇌하수체에서 오피오이드 수용체의 작용에 의해 발생할 가능성이 있습니다.[citation needed]한 연구는 헤로인 중독자들의 우울한 테스토스테론 수치가 금욕 한 달 만에 정상으로 돌아왔다는 것을 발견했는데, 이것은 그 효과가 쉽게 되돌릴 수 있고 영구적이지 않다는 것을 암시합니다.[citation needed]2013년[update] 현재, 저용량 또는 급성 오피오이드 사용이 내분비계에 미치는 영향은 불분명합니다.[133][134][135][136]오피오이드를 장기간 사용하면 다른 호르몬 체계에도 영향을 미칠 수 있습니다.[133]
업무파행
오피오이드의 사용은 업무 복귀에 실패하는 위험 요소가 될 수 있습니다.[137][138]
안전에 민감한 작업을 수행하는 사람은 오피오이드를 사용해서는 안 됩니다.[139]의료 제공자는 크레인이나 지게차를 포함한 무거운 장비를 운전하거나 사용하는 작업자에게 오피오이드로 만성 또는 급성 통증을 치료할 것을 권고해서는 안 됩니다.[139]안전에 민감한 작업을 수행하는 근로자를 관리하는 작업장은 해당 근로자가 의사의 오피오이드 치료를 받는 한 덜 민감한 작업에 종사자를 배치해야 합니다.[139]
오피오이드를 장기 복용하는 사람들은 실업자가 될 가능성이 높아졌습니다.[140]오피오이드를 복용하는 것은 환자의 삶을 더 방해할 수 있고 오피오이드 자체의 부작용은 환자가 활동적인 삶을 살고, 직장을 얻고, 직업을 유지하는 데 중요한 장벽이 될 수 있습니다.
또한, 고용 부족은 처방된 오피오이드의 비정상적인 사용을 예측할 수 있습니다.[141]
사고발생빈도 증가
오피오이드 사용은 사고 발생 가능성을 높일 수 있습니다.오피오이드는 교통사고와[142][143] 우발적인 추락의 위험을 증가시킬 수 있습니다.[144]
주의력 감소
오피오이드는 항우울제 및/또는 항경련제와 함께 사용할 경우 주의력을 감소시키는 것으로 나타났습니다.[145]
드문 부작용
통증 완화를 위해 오피오이드를 복용하는 환자들에게 드물게 나타나는 부작용으로는 용량 관련 호흡 억제, 혼란, 환각, 섬망, 두드러기, 저체온증, 저체온증, 서맥/타카디아, 기립성 저혈압, 어지럼증, 두통, 요폐, 요통 또는 담도 경련, 근육 경직,미오클로누스(고용량), 홍조(펜타닐 및 레미펜타닐을 제외한 히스타민 방출로 인해).[88]오피오이드의 치료적 사용과 만성적 사용은 면역체계의 기능을 손상시킬 수 있습니다.오피오이드는 대식세포 전구세포와 림프구의 증식을 감소시키고, 세포 분화에 영향을 줍니다(Roy & Loh, 1996).오피오이드는 백혈구 이동을 억제할 수도 있습니다.그러나 통증 완화의 맥락에서 이것의 관련성은 알려져 있지 않습니다.
임신
임신 중 오피오이드 사용은 산모와 발육중인 태아 모두에게 중요한 영향을 미칠 수 있습니다.
오피오이드는 처방 진통제(예: 옥시코돈, 하이드로코돈) 및 헤로인과 같은 불법 물질을 포함하는 약물의 한 종류입니다.임신 중 오피오이드 사용은 조산, 저체중아 출산, 자궁내 성장 제한, 사산의 위험 증가와 관련이 있습니다.오피오이드는 태반을 가로지를 수 있는 물질로, 자라나는 태아를 약물에 노출시킵니다.이러한 노출은 잠재적으로 선천적 결함의 위험 증가를 포함하여 태아 발달에 다양한 부작용을 초래할 수 있습니다.임신 중 산모 오피오이드 사용의 가장 잘 알려진 결과 중 하나는 신생아 절주 증후군(NAS)의 위험입니다.NAS는 신생아가 출생 후 자궁 내 오피오이드에 노출되어 금단 증상을 겪을 때 발생합니다.임신 중의 산모 오피오이드 사용은 아이의 발달에 장기적인 영향을 줄 수도 있습니다.이러한 영향에는 인지적 및 행동적 문제뿐만 아니라 생애 후반에 물질 사용 장애의 위험이 증가할 수 있습니다.상호작용
오피오이드를 다른 약물과 함께 사용하여 환자를 치료하는 의사는 추가 치료가 필요하다는 지속적인 문서화를 유지하고 환자의 상태가 위험성이 낮은 치료법을 사용할 가치가 있는 상태로 바뀌면 치료를 조정할 수 있는 기회를 인식합니다.[146]
다른 우울증 약물들과 함께
벤조디아제핀이나 에탄올과 같은 다른 우울증 약물과 오피오이드를 동시에 사용하면 부작용과 과다 복용의 비율이 증가합니다.[146]그럼에도 불구하고, 오피오이드와 벤조디아제핀은 많은 환경에서 동시에 제공됩니다.[147][148]오피오이드의 과다복용과 마찬가지로, 오피오이드와 또 다른 우울증의 결합은 종종 사망에 이르게 하는 호흡 억제를 촉발할 수 있습니다.[149]이러한 위험은 환자 행동 및 치료 규정 준수의 변화에 대한 지속적인 검사를 수행할 수 있는 의사의 면밀한 모니터링을 통해 감소됩니다.[146]
오피오이드 길항제
오피오이드 효과(악의 또는 다른 방식)는 날록손 또는 날트렉손과 같은 오피오이드 길항제로 되돌릴 수 있습니다.[150]이러한 경쟁적 길항제는 작용제보다 친화력이 높은 오피오이드 수용체에 결합하지만 수용체를 활성화시키지는 않습니다.이는 작용제를 대체하여 작용제 효과를 약화시키거나 반전시킵니다.그러나 날록손의 제거 반감기는 오피오이드 자체의 제거 반감기보다 짧을 수 있으므로 반복 투여 또는 지속적인 주입이 필요하거나 날메펜과 같이 더 오래 작용하는 길항제를 사용할 수 있습니다.오피오이드를 정기적으로 복용하는 환자들은 극심한 고통 속에서 깨어나는 심각하고 고통스러운 반응을 피하기 위해 오피오이드를 부분적으로만 되돌리는 것이 필수적입니다.이는 전체 용량을 투여하지 않고 호흡수가 개선될 때까지 소량씩 투여함으로써 달성됩니다.그런 다음 통증 완화를 유지하면서 반전을 그 수준으로 유지하기 위해 주입을 시작합니다.오피오이드 길항제는 오피오이드 과다복용 후 호흡 억제의 표준 치료법으로 남아 있으며, 가장 일반적으로 사용되는 것은 날록손이지만, 메타돈과 같은 장기간 작용하는 오피오이드의 과다복용을 치료하는 데 사용될 수 있습니다.그리고 디프레노핀은 에토르핀과 카르펜타닐과 같은 수의학에서 사용되는 매우 강력한 오피오이드의 효과를 뒤집기 위해 사용됩니다.그러나, 오피오이드 길항제는 또한 오피오이드 진통제의 유익한 효과를 차단하기 때문에, 부작용을 줄이기 위해 오피오이드 길항제와 함께 오피오이드 길항제를 사용하여, 조심스러운 용량 적정이 필요하고, 종종 진통제가 유지될 수 있을 정도로 충분히 낮은 용량에서 효과가 좋지 않습니다.
Naltrexone은 심각한 부작용의 위험을 증가시키지 않는 것으로 보이며, 이는 경구 Naltrexone의 안전성을 확인합니다.[151]날록손 환자의 반발 독성으로 인한 사망률이나 심각한 부작용은 드물었습니다.[152]
약리학
| 약물 | 관련있는 효력 [153] | 이온화되지 않은 분수 | 단백질 바인딩 | 지질 용해도 [154][155][156] |
|---|---|---|---|---|
| 모르핀 | 1 | ++ | ++ | ++ |
| 페티딘 (메페리딘) | 0.1 | + | +++ | +++ |
| 하이드로모르폰 | 10 | + | +++ | |
| 알펜타닐 | 10–25 | ++++ | ++++ | +++ |
| 펜타닐 | 75–125 | + | +++ | ++++ |
| 레미펜타닐 | 250 | +++ | +++ | ++ |
| 수펜타닐 | 500–1000 | ++ | ++++ | ++++ |
| 에토르핀 | 1000–3000 | |||
| 카르펜타닐 | 10000 |
오피오이드는 신경계와 다른 조직에서 특정한 오피오이드 수용체에 결합합니다.오피오이드 수용체에는 μ, κ, δ(뮤, 카파, 델타)의 세 가지 주요 분류가 있지만, 최대 17개가 보고되었으며, ε, λ, ζ, ι(엡실론, 아이오타, 람다, 제타) 수용체를 포함합니다.반대로, σ(Sigma) 수용체는 그 활성화가 오피오이드 역고곤제 날록손에 의해 역전되지 않고, 고전적인 오피오이드에 대해 고친화성 결합을 나타내지 않기 때문에 더 이상 오피오이드 수용체로 간주되지 않으며,그리고 그것들은 dextro-rototational 이성질체를 위한 스테레오 선택적인 반면, 다른 오피오이드 수용체는 levo-rototational 이성질체를 위한 스테레오 selective입니다.또한 μ-수용체에는 μ와12 μ의 세 가지 아형이 있으며, 새로 발견된3 μ가 있습니다.임상적으로 중요한 또 다른 수용체는 진통제로 사용되는 μ-오피오이드 작용제에 대한 내성의 발달에 주요한 역할을 할 뿐만 아니라 통증 반응에 관여하는 오피오이드 수용체 유사 수용체 1(ORL1)입니다.이것들은 모두 GABAergic 신경전달에 작용하는 G-단백질 결합 수용체입니다.
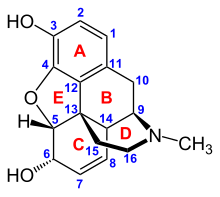
오피오이드에 대한 약역학적 반응은 오피오이드가 결합하는 수용체, 수용체에 대한 친화력, 그리고 오피오이드가 작용제인지 길항제인지에 따라 달라집니다.예를 들어, 오피오이드 작용제 모르핀의 초경추측 진통제 특성은 μ 수용체의 활성화, μ 수용체에 의한 호흡 저하 및 신체적 의존성, 그리고 κ 수용체에 의한 진정 및 척추측만증에 의해 매개됩니다.각 오피오이드 수용체 그룹은 별개의 신경 반응을 유도하는데, 수용체 아형(예를 들어 μ 및1 μ)은2 훨씬 더 구체적인 반응을 제공합니다.각 오피오이드에 고유한 것은 다양한 등급의 오피오이드 수용체에 대한 뚜렷한 결합 친화성입니다(예: μ, κ 및 δ 오피오이드 수용체는 오피오이드의 특정 수용체 결합 친화성에 따라 다른 크기로 활성화됩니다).예를 들어, 아편알칼로이드 모르핀은 μ-오피오이드 수용체에 높은 친화도를 보이는 반면, 케타조신은 ĸ 수용체에 높은 친화도를 보이는 것입니다.이러한 다양한 종류의 오피오이드 및 분자 설계가 존재할 수 있도록 하는 것이 조합 메커니즘이며, 각각 고유한 효과 프로파일을 가지고 있습니다.그들의 개별 분자 구조는 또한 서로 다른 작용 기간에 책임이 있는데, 이로 인해 대사 분해(N-탈알킬화와 같은)가 오피오이드 대사에 책임이 있습니다.

기능선택성
약물 개발의 새로운 전략은 수용체 신호 전달을 고려합니다.이 전략은 바람직하지 않은 경로에 미치는 영향을 줄이면서 바람직한 신호 경로의 활성화를 증가시키기 위해 노력합니다.이 차별화 전략은 기능 선택성과 편향된 작용성을 포함한 여러 가지 이름이 붙여졌습니다.편향된 작용제로서 의도적으로 설계되어 임상 평가에 투입된 첫 번째 오피오이드는 약물 올리세리딘입니다.진통 작용과 부작용을 줄여줍니다.[158]
오피오이드 비교
오피오이드의 상대적 효력을 비교하는 동등성 비율을 결정하기 위해 광범위한 연구가 수행되었습니다.오피오이드의 투여량이 주어지면, 등진표는 다른 오피오이드의 동등한 투여량을 찾기 위해 사용됩니다.이러한 표는 오피오이드 회전 관행에서 사용되며, 기준 오피오이드인 모르핀과 비교하여 오피오이드를 설명합니다.등각성 진통제 표는 일반적으로 약물 반감기, 그리고 때때로 모르핀과 같은 투여 방법에 의한 동일한 약물의 등각성 진통제 용량을 나열합니다: 경구 및 정맥내.
바인딩 프로파일
| 컴파운드 | MOR툴팁 mu-Opioid 수용체 | DOR툴팁 델타-오피오이드 수용체 | KOR툴팁 카파-오피오이드 수용체 | 참조 | |
|---|---|---|---|---|---|
| 7-하이드록시미트라기닌 | 13.5 | 155 | 123 | [159] | |
| β-클로르날트렉사민 | 0.90 | 115 | 0.083 | [160] | |
| β-엔도르핀 | 1.0 | 1.0 | 52 | [160] | |
| β-푸날트렉사민 | 0.33 | 48 | 2.8 | [160] | |
| 알라조신 | 2.7 | 4.1 | 3.2 | [161] | |
| (-)-알라조신 | 3.0 | 15 | 4.7 | [162] | |
| (+)-알라조신 | 1,900 | 19,000 | 1,600 | [162] | |
| 알펜타닐 | 39 | 21,200 | ND | [163] | |
| 바이날토르피민 | 1.3 | 5.8 | 0.79 | [163] | |
| BNTX툴팁 7-벤질리덴 알트렉손 | 18 | 0.66 | 55 | [160] | |
| 브레마조신 | 0.75 | 2.3 | 0.089 | [160] | |
| (-)-브레마조신 | 0.62 | 0.78 | 0.075 | [163] | |
| 부프레노르핀 | 4.18 | 25.8 | 12.9 | [164] | |
| 부토르판올 | 1.7 | 13 | 7.4 | [162] | |
| BW-3734 | 26 | 0.013 | 17 | [160] | |
| 카르펜타닐 | 0.024 | 3.3 | 43 | [161] | |
| 코데인 | 79 | >1,000 | >1,000 | [160] | |
| CTOP | 0.18 | >1,000 | >1,000 | [160] | |
| 시클라조신 | 0.45 | 6.3 | 5.9 | [162] | |
| 사이프로다임 | 9.4 | 356 | 176 | [163] | |
| 다들 | 16 | 0.74 | >1,000 | [160] | |
| 담고 | 2.0 | >1,000 | >1,000 | [160] | |
| [D-Ala2]델토르핀 II | >1,000 | 3.3 | >1,000 | [160] | |
| 더모르핀 | 0.33 | >1,000 | >1,000 | [160] | |
| (+)-데스메트라마돌 | 17 | 690 | 1,800 | [165][166] | |
| 덱스트로폭시펜 | 34.5 | 380 | 1,220 | [164] | |
| 데조신 | 3.6 | 290 | 460 | [161] | |
| 디하이드로에톨핀 | 0.45 | 1.82 | 0.57 | [167] | |
| 디프레노핀 | 0.072 | 0.23 | 0.017 | [160] | |
| DPDPE | >1,000 | 14 | >1,000 | [160] | |
| DSLET | 39 | 4.8 | >1,000 | [160] | |
| 다이노르핀 A | 32 | >1,000 | 0.5 | [160] | |
| 에틸케타조신 | 3.1 | 101 | 0.40 | [160] | |
| (-)-에틸케타조신 | 2.3 | 5.2 | 2.2 | [162] | |
| (+)-에틸케타조신 | 2,500 | >10,000 | 1,600 | [162] | |
| 에토르핀 | 0.23 | 1.4 | 0.13 | [160] | |
| 펜타닐 | 0.39 | >1,000 | 255 | [160] | |
| 히드로코돈 | 11.1 | 962 | 501 | [164] | |
| 하이드로모르폰 | 0.47 | 18.5 | 24.9 | [161] | |
| ICI-204488 | >1,000 | >1,000 | 0.71 | [160] | |
| 레우엥케팔린 | 3.4 | 4.0 | >1,000 | [160] | |
| 레바세틸메타돌 | 9.86 | 169 | 1,020 | [164] | |
| 로펜타닐 | 0.68 | 5.5 | 5.9 | [160] | |
| 메트엥케팔린 | 0.65 | 1.7 | >1,000 | [160] | |
| 메타조신 | 3.8 | 44.3 | 13.3 | [161] | |
| 메타돈 | 1.7 | 435 | 405 | [164] | |
| 덱스트로메다돈 | 19.7 | 960 | 1,370 | [164] | |
| 레보메트하돈 | 0.945 | 371 | 1,860 | [164] | |
| 메탈로판 | ND | ND | ND | ND | |
| 덱스트랄로판 | 1,140 | 2,660 | 34.6 | [164] | |
| 레발로판 | 0.213 | 2.18 | 1,100 | [164] | |
| 메토판 | ND | ND | ND | ND | |
| 덱스트로메토판 | 1,280 | 11,500 | 7,000 | [164] | |
| 레보메토르판 | 11.2 | 249 | 225 | [164] | |
| 미트라기닌 | 7.24 | 60.3 | 1,100 | [159] | |
| 미트라기닌 유사인독실 | 0.087 | 3.02 | 79.4 | [159] | |
| 모판올 | ND | ND | ND | ND | |
| 덱스트로판 | 420 | 34,700 | 5,950 | [164] | |
| 레보르판올 | 0.42 | 3.61 | 4.2 | [164] | |
| 모피셉틴 | 56 | >1,000 | >1,000 | [160] | |
| 모르핀 | 1.8 | 90 | 317 | [163] | |
| 모르핀, (-)- | 1.24 | 145 | 23.4 | [164] | |
| 모르핀, (+)- | >10,000 | >100,000 | >300,000 | [164] | |
| MR-2266 | 1.0 | 3.0 | 0.16 | [161] | |
| 날부핀 | 11 | >1,000 | 3.9 | [160] | |
| 날메페네 | 0.24 | 16 | 0.083 | [168] | |
| 날로핀 | 0.97 | 148 | 1.1 | [160] | |
| 나록소나진 | 0.054 | 8.6 | 11 | [160] | |
| 날록손 | 1.1 | 16 | 12 | [162] | |
| (-)-날록손 | 0.93 | 17 | 2.3 | [160] | |
| (+)-날록손 | >1,000 | >1,000 | >1,000 | [160] | |
| 날트렉손 | 1.0 | 149 | 3.9 | [160] | |
| 날트리벤 | 12 | 0.013 | 13 | [160] | |
| 날트린돌 | 64 | 0.02 | 66 | [160] | |
| 노르비날토르피민 | 2.2 | 65 | 0.027 | [160] | |
| 노르모르핀 | 4.0 | 310 | 149 | [163] | |
| 오메펜타닐 | 0.0079 | 10 | 32 | [163] | |
| 옥시코돈 | 8.69 | 901 | 1,350 | [164] | |
| 옥시모르핀돌 | 111 | 0.7 | 228 | [161] | |
| 옥시모르폰 | 0.78 | 50 | 137 | [163] | |
| 펜타조신 | 5.7 | 31 | 7.2 | [160] | |
| 페티딘 (메페리딘) | 385 | 4,350 | 5,140 | [163] | |
| 페나조신 | 0.20 | 5.0 | 2.0 | [169] | |
| PLO17 | 30 | >1,000 | >1,000 | [160] | |
| 콰다조신 | 0.99 | 2.6 | 0.5 | [170] | |
| 살비노린 A | >10,000 | >10,000 | 16 | [171] | |
| 사미도르판 | 0.052 | 2.6 | 0.23 | [172] | |
| SIOM툴팁 7-스피린디노옥시모폰 | 33 | 1.7 | >1,000 | [160] | |
| 스피라돌린 | 21 | >1,000 | 0.036 | [160] | |
| 수펜타닐 | 0.15 | 50 | 75 | [160] | |
| 티아넵틴 | 383 | >10,000 | >10,000 | [173] | |
| 티플루아돔 | 32 | 189 | 2.1 | [162] | |
| 트라마돌 | 2,120 | 57,700 | 42,700 | [164] | |
| (+)-트라마돌 | 1,330 | 62,400 | 54,000 | [164] | |
| (-)-트라마돌 | 24,800 | 213,000 | 53,500 | [164] | |
| U-50488 | >1,000 | >1,000 | 0.12 | [160] | |
| U-69593 | >1,000 | >1,000 | 0.59 | [160] | |
| 조르판올 | 0.25 | 1.0 | 0.4 | [170] | |
| 특별한 언급이 없는 한 값은 Ki(nM)입니다.값이 작을수록 해당 부위에 약물이 더 강하게 결합하는 것을 의미합니다.분석은 대부분 복제되거나 배양된 설치류 수용체로 수행되었습니다. | |||||
사용.
| 물질. | 베스트 추정 | 낮은 추정 | 높은 추정 |
|---|---|---|---|
| 암페타민.. 활자 자극제 | 34.16 | 13.42 | 55.24 |
| 대마초 | 192.15 | 165.76 | 234.06 |
| 코카인 | 18.20 | 13.87 | 22.85 |
| 엑스터시 | 20.57 | 8.99 | 32.34 |
| 아편스 | 19.38 | 13.80 | 26.15 |
| 오피오이드 | 34.26 | 27.01 | 44.54 |
미국의 오피오이드 처방은 1991년 7600만 건에서 2013년 2억700만 건으로 증가했습니다.[175]
1990년대에 오피오이드 처방은 크게 증가했습니다.한때 암으로 인한 급성 통증이나 통증의 치료를 위해 거의 독점적으로 사용되었던 오피오이드는 이제 만성적인 통증을 경험하는 사람들에게 자유롭게 처방됩니다.이것은 사고로 인한 중독과 사고로 인한 과다복용이 사망에 이르게 하는 비율의 증가를 동반하고 있습니다.국제마약물관리위원회에 따르면 처방 오피오이드의 1인당 소비량은 미국과 캐나다가 주도하고 있습니다.[176]미국과 캐나다의 1인당 오피오이드 처방 건수는 유럽연합, 호주, 뉴질랜드의 두 배입니다.[177]퍼스트 월드 공동체와[178] 저소득층을 포함한 어떤 사람들은 다른 사람들보다 오피오이드 중독 위기에 더 많이 영향을 받았습니다.[179]공중 보건 전문가들은 이것이 만성적인 통증을 해결하기 위한 대안적인 방법을 사용할 수 없거나 높은 비용으로 인해 발생할 수 있다고 말합니다.[180]오피오이드는 만성 통증에 대한 비용 효과적인 치료법으로 설명되어 왔지만, 오피오이드 과다 복용으로 인한 오피오이드 유행과 사망의 영향을 비용 효과를 평가하는 데 고려해야 합니다.[181]2017년 자료에 따르면 미국 인구의 약 3.4%가 매일 통증 관리를 위해 오피오이드를 처방받고 있습니다.[182]오피오이드를 설명해야 한다는 요구는 만성 통증 환자의 안전이나 이익을 지원하기 위한 과학적 증거가 거의 없는 광범위한 오피오이드 축소 관행으로 이어졌습니다.
역사
자연적으로 발생하는 오피오이드

오피오이드는 세계에서 가장 오래된 약물 중 하나입니다.[183]인류 고고학 유적지에서 파파베르 솜니페룸에 대한 최초의 증거는 기원전 5,700년에서 5,500년경 신석기 시대로 거슬러 올라갑니다.그 씨앗은 이베리아 반도의 쿠에바 데 로스 무르시에라고스와 이탈리아 반도의 라 마르모타에서 발견되었습니다.[184][185][186]
아편 양귀비를 의학적, 오락적, 종교적 목적으로 사용한 것은 기원전 4세기로 거슬러 올라갈 수 있는데, 이때 수메르 점토판의 표식에는 "기쁨의 식물"인 "훌 길"의 사용이 언급되어 있습니다.[187][188][189]아편은 이집트인들에게 알려져 있었고, 에베르스 파피루스에 아이들의 진정과 [190][189]유방농양 치료를 위한 혼합물의 성분으로 언급되어 있습니다.[191]
아편은 그리스인들에게도 알려져 있었습니다.[190]그것은 히포크라테스 (기원전 460년–기원전 370년)와 c.그의 제자들에 의해 수면을 유도하는 특성으로 평가되었고, 통증 치료에 사용되었습니다.[192]라틴어 속담 "Sedare doloremopus divinum est", trans."고통을 완화하는 것은 신의 일"은 히포크라테스와 페르가몬의 갈렌에게 다양하게 기인합니다.[193]아편의 의학적 사용은 나중에 로마 군대에서 복무했던 그리스 의사인 페다니우스 디오스코리데스 (c.40–90 AD)가 그의 5권짜리 저서인 De Materia Medica에서 논의했습니다.[194]
이슬람 황금기 동안, 아편의 사용은 아비켄나 c.(980년 – 서기 1037년 6월)에 의해 의학의 경전에서 자세히 논의되었습니다.이 책의 5권에는 아편의 조제에 관한 정보, 일련의 물리적 효과, 다양한 질병을 치료하기 위한 용도, 사용에 대한 금기 사항, 독으로서의 잠재적인 위험 및 중독 가능성이 포함되어 있습니다.아비세나는 진통제로 고통을 최소화하기 보다는 고통의 원인을 해결하는 것을 선호하면서, 최후의 수단으로 아편의 사용을 막았습니다.아비케나의 많은 관찰은 현대 의학 연구에 의해 뒷받침되었습니다.[195][190]
인도와 중국의 아편에 대해 세계가 정확히 언제 알게 되었는지는 확실하지 않지만, 중국의 의학 작품인 카이파오펜츠도(973년)에서 아편이 언급되었습니다.[189] 서기 1590년까지, 아그라 지역의 수바스 지역에서는 아편 양귀비가 봄의 주요 작물이었습니다.[196]
의사 파라셀수스(c.1493–1541)는 독일 르네상스 시기 서유럽에서 아편을 의료용으로 다시 도입한 것으로 종종 인정받고 있습니다.그는 아편의 의료용 혜택을 칭찬했습니다.그는 또한 "아르카눔", 즉 그가 라우다눔이라고 부르는 알약을 가지고 있다고 주장했는데, 이것은 다른 모든 알약들보다 뛰어났으며, 특히 죽음이 사기를 당할 때 더욱 그러했습니다. ("Ich hab'ein Arcanum – Heiss'ich Laudanum, ist über das Alles, weszum Todereichen will.")[197] 후대의 저술가들은 파라켈수스의 라우다눔 조리법에 아편이 들어있다고 주장했습니다.그러나 그 구성은 알려지지 않았습니다.[197]
라우다눔
라우다눔(laudanum)이라는 용어는 17세기까지 일반적으로 유용한 약으로 사용되었습니다.토마스 시덴햄이 아편의 첫 번째 액체 틴크를 소개한 후, "라우다눔"은 아편과 알코올의 혼합물을 의미하게 되었습니다.[197]1669년 Sydenham의 라우다넘 요리법은 아편에 와인, 샤프란, 정향, 계피를 섞었습니다.[198]Sydenham's laudanum은 20세기까지 유럽과 아메리카 대륙에서 널리 사용되었습니다.[190][198]아편을 기반으로 한 다른 인기 있는 약으로는 어린이들을 위한 훨씬 더 부드러운 액상 제제인 파레고릭, 더 강력한 제제인 블랙드롭, 그리고 도버의 분말이 있습니다.[198]
아편무역
아편은 주요 식민지 상품이 되었고, 인도, 포르투갈, 네덜란드, 영국, 중국 등과 관련된 무역 네트워크를 통해 합법적이고 불법적으로 이동했습니다.[199]영국 동인도 회사는 1683년에 아편 무역을 투자의 기회로 여겼습니다.[196]1773년 벵골 총독은 동인도 회사를 대신하여 벵골 아편 생산에 대한 독점권을 확립했습니다.인도 아편의 재배와 제조는 1797년에서 1949년 사이에 일련의 행위를 통해 더욱 중앙 집중화되고 통제되었습니다.[196][200]영국은 중국 정부의 금지를 무시하고 중국으로 밀수입된 인도 아편을 판매함으로써 중국 차 수입으로 인한 경제적인 적자를 균형 잡았습니다.이것은 중국과 영국 사이의 1차 (1839–1842)와 2차 아편 전쟁 (1856–1860)으로 이어졌습니다.[201][200][199][202]
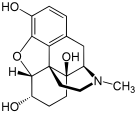
모르핀
19세기에, 광범위한 영향을 미친 두 가지 주요한 과학적 발전이 이루어졌습니다.1804년경, 독일의 약사인 프리드리히 세르튀르너는 아편으로부터 모르핀을 분리했습니다.그는 1817년에 좋은 평가를 받은 논문에서 그것의 결정화, 구조, 그리고 약리학적 특성을 묘사했습니다.[201][203][198][204]모르핀은 어떤 약용 식물로부터도 분리된 최초의 알칼로이드였으며, 이는 현대 과학적 약물 발견의 시작이었습니다.[201][205]
거의 50년이 지난 후, 두 번째 발전은 알렉산더 우드와 다른 사람들에 의한 피하 바늘의 정교화였습니다.피하 바늘을 가진 유리 주사기의 개발은 1차 활성 화합물의 조절된 측정 가능한 용량을 쉽게 투여할 수 있게 했습니다.[206][198][189][207][208]
모르핀은 처음에 통증을 완화시키는 능력으로 인해 놀라운 약으로 환영 받았습니다.[209]그것은 사람들이 잠을 잘 수 있도록 도와줄 수 있고,[201] 기침과 설사의 조절을 포함한 다른 유용한 부작용들을 가지고 있었습니다.[210]그것은 의사들에 의해 광범위하게 처방되었고, 약사들에 의해 제한 없이 조제되었습니다.미국 남북전쟁 동안, 아편과 라우다눔은 군인들을 치료하기 위해 광범위하게 사용되었습니다.[211][209]또한 여성이나 생리통, "신경성"의 질병에 대해서도 자주 처방되었습니다.[212]: 85 처음에는 이 새로운 적용 방법이 중독성이 없을 것이라고 가정했습니다.[201][212]
코데인
코데인은 1832년 피에르 장 로비케에 의해 발견되었습니다.로비케는 스코틀랜드의 화학자 윌리엄 그레고리 (1803–1858)가 기술한 모르핀 추출 방법을 검토하고 있었습니다.로비케는 그레고리의 수술에서 남은 잔여물을 처리하면서 아편의 다른 활성 성분에서 결정질 물질을 분리했습니다.그는 자신의 발견에 대해 다음과 같이 썼습니다: "여기 아편에서 발견된 새로운 물질이 있습니다...우리는 지금까지 아편의 유일한 활성 원리로 여겨져 온 모르핀이 모든 효과를 설명하지 않는다는 것을 알고 있으며 오랫동안 생리학자들은 메워야 할 공백이 있다고 주장하고 있습니다."[213]그의 알칼로이드의 발견은 코데인을 기반으로 한 진해 및 지사제 의약품의 개발로 이어졌습니다.[214]
반합성 및 합성 오피오이드
합성 오피오이드는 20세기에 발명되었고, 그 작용을 위한 생물학적 메커니즘이 발견되었습니다.[189]과학자들은 중독성이 없는 형태의 오피오이드를 찾았지만, 대신 더 강한 오피오이드를 만들어냈습니다.영국에서 찰스 롬리 올더 라이트는 중독성이 없는 아편 유도체를 찾기 위해 수백 개의 아편 화합물을 개발했습니다.1874년에 그는 모르핀을 초산 무수물과 함께 몇 시간 동안 끓이는 아세틸화라고 불리는 과정을 이용하여 디아모르핀을 합성한 최초의 사람이 되었습니다.[201]
헤로인은 바이엘 연구소에서 하인리히 드레서(1860-1924)를 위해 일하는 펠릭스 호프만(1868-1946)에 의해 독립적으로 합성되기 전까지 거의 주목을 받지 못했습니다.[215]드레서는 1898년 결핵, 기관지염, 천식에 대한 진통제와 기침 치료제로 신약을 시장에 내놓았습니다.바이엘은 1913년 헤로인의 중독 가능성이 인정된 후 생산을 중단했습니다.[201][216][217]
1910년대에 독일에서 몇 가지 반합성 오피오이드가 개발되었습니다.최초의 옥시모르폰은 1914년 아편 양귀비에 들어있는 오피오이드 알칼로이드인 베인으로부터 합성되었습니다.[218]그 다음 1916년 마틴 프로운드와 에드먼드 슈파이어는 역시 베인에서 나온 옥시코돈을 프랑크푸르트 대학에서 개발했습니다.[219]1920년, 하이드로코돈은 칼 만니치와 헬레네 뢰벤하임에 의해 제조되었고, 코데인으로부터 유도되었습니다.1924년에 하이드로모르폰은 모르핀에 수소를 첨가하여 합성되었습니다.에토르핀은 1960년에 아편 양귀비 짚의 오리파빈에서 합성되었습니다.부프레노핀은 1972년에 발견되었습니다.[218]
최초의 완전 합성 오피오이드는 1932년 독일의 화학자 오토 아이슬렙(Otto Eisleb)에 의해 우연히 발견된 메페리딘(이후 데메롤)[218]이었습니다.메페리딘은 모르핀과 무관하지만 아편과 유사한 구조를 가진 최초의 아편이었습니다.[189]그것의 진통효과는 1939년 오토 샤우만에 의해 발견되었습니다.[218]또한 IG Farben에 있는 Gustav Ehrhart와 Max Bockmühl는 Eisleb와 Schaumann의 작품을 기반으로 만들었습니다.그들은 1937년경 "Hoechst 10820" (후에 메타돈)을 개발했습니다.[220]1959년 벨기에 의사 Paul Jansen은 헤로인의 30배에서 50배의 효력을 가진 합성 약물인 펜타닐을 개발했습니다.[201][221]현재 거의 150개의 합성 오피오이드가 알려져 있습니다.[218]
범죄화 및 의료이용
아편의 비임상적 사용은 1914년 해리슨 마약세법과 다른 많은 법들에 의해 미국에서 범죄화되었습니다.[222][223]오피오이드의 사용은 오명을 썼고, 사망하는 환자들을 위한 최후의 수단으로만 처방되는 위험한 물질로 여겨졌습니다.[201]1970년의 통제물질법은 결국 해리슨법의 가혹함을 완화시켰습니다.[citation needed]
영국에서는 1926년 왕립 의사 대학의 회장직하에 모르핀과 헤로인 중독에 관한 부서 위원회의 보고서를 통해 의료 통제를 재확인하고 1960년대까지 지속된 "영국의 시스템"을 확립했습니다.[224]
1980년대에 세계보건기구는 오피오이드를 포함한 다양한 수준의 통증에 대한 약물을 처방하는 지침을 발표했습니다.미국에서 캐슬린 폴리와 러셀 포테노이는 오피오이드를 "난치한 비악성 통증" 사례의 진통제로 자유롭게 사용하는 것에 대한 주요 지지자가 되었습니다.[225][226]그들의 주장을 뒷받침할 과학적 증거가 거의 없거나 전혀 없는 가운데, 산업 과학자들과 옹호자들은 만성적인 통증을 가진 사람들은 중독에 저항력이 있을 것이라고 제안했습니다.[201][227][225]
1996년 옥시콘틴의 출시는 통증 완화를 위한 오피오이드의 사용을 장려하는 적극적인 마케팅 캠페인을 수반했습니다.오피오이드의 처방이 늘어남에 따라 헤로인에 대한 암시장의 성장을 부채질했습니다.2000년과 2014년 사이에 "전국적으로 헤로인 사용의 놀라운 증가와 약물 과다 복용 사망의 유행"이 있었습니다.[227][201][228]
결과적으로, 책임감 있는 오피오이드 처방을 위한 의사회와 같은 보건 단체들과 공중 보건 단체들은 오피오이드 처방의 감소를 요구해 왔습니다.[227]2016년 질병통제예방센터(CDC)는 "적극적인 암 치료, 완화적 치료 및 말기 치료 이외의 만성 통증에 대한" 오피오이드 처방 및 오피오이드 테이퍼링 증가에 대한 새로운 지침을 발표했습니다.[229]
"위험 제거"
2019년 4월 미국 식품의약국은 미국인들이 가정에서 사용하지 않는 처방 오피오이드를 제거하고 적절하게 처리하는 데 있어 그들이 수행하는 중요한 역할을 이해하도록 돕기 위한 새로운 교육 캠페인의 시작을 발표했습니다.이 새로운 계획은 전국적인 오피오이드 위기를 해결하기 위한 FDA의 지속적인 노력의 일부이며(아래 참조), 오피오이드에 대한 불필요한 노출을 줄이고 새로운 중독을 예방하는 것을 목표로 합니다."위험 제거" 캠페인은 가정의 건강 관리 결정을 감독하고 가정에서 종종 오피오이드와 다른 처방약의 문지기 역할을 하는 35세에서 64세 사이의 여성을 대상으로 합니다.[230]
사회와 문화
정의.
"오피오이드"라는 용어는 1950년대에 유래되었습니다.[231]"아편" + "-oid"는 "아편과 유사한" ("아편"은 모르핀과 아편에서 파생된 유사한 약물)을 의미합니다.1963년에 최초로 사용된 과학적 출판물에는 "이 논문에서 'opioid'라는 용어는 조지 H가 원래 제안한 의미로 사용됩니다.애치슨(개인적인 의사소통)은 모르핀과 유사한 활성을 가진 모든 화학적 화합물을 가리킵니다."[232]1960년대 후반까지, 연구는 아편 효과가 신경계에서 특정 분자 수용체의 활성화에 의해 매개된다는 것을 발견했고, 이것을 "오피오이드 수용체"라고 불렀습니다.[233]"오피오이드"의 정의는 나중에 오피오이드 수용체의 활성화에 의해 매개되는 모르핀과 유사한 활성을 갖는 물질을 지칭하도록 정제되었습니다.현대의 한 약리학 교과서는 다음과 같이 기술하고 있습니다."오피오이드라는 용어는 모르핀 유사 활성을 가진 모든 작용제와 길항제, 그리고 자연적으로 발생하는 합성 오피오이드 펩타이드에 적용됩니다."[234]또 다른 약리학적 언급은 모르핀과 유사한 요건을 제거합니다: "현대적 용어인 오피오이드는 오피오이드 수용체(길항제 포함)에 결합하는 모든 물질을 천연 및 합성으로 지정하는 데 사용됩니다."[2]일부 출처는 아편제를 배제하기 위해 오피오이드라는 용어를 정의하고, 다른 출처는 오피오이드 대신 포괄적으로 오피오이드를 사용하지만, 포괄적으로 사용되는 오피오이드는 현대적이고 선호되며 널리 사용되고 있습니다.[19]
미국의 오락적 이용을 줄이기 위한 노력
2011년 오바마 행정부는 오피오이드 위기에 대처하기 위한 행정부의 계획을 설명하는 백서를 발표했습니다.중독과 우발적 과다복용에 대한 행정부의 우려는 전 세계의 수많은 의료 및 정부 자문 단체들에 의해 반복되고 있습니다.[180][235][236][237]
2015년 현재 미주리주를 제외한 모든 주에 처방약 모니터링 프로그램이 존재합니다.[238]이 프로그램들은 약사들과 처방사들이 의심스러운 사용처를 알아내기 위해 환자들의 처방전 내역에 접근할 수 있게 해줍니다.그러나 2015년에 발표된 미국 의사들을 대상으로 한 설문조사에서 의사들의 53%만이 이러한 프로그램을 사용하고 있는 반면, 22%는 프로그램이 사용 가능한지 알지 못하는 것으로 나타났습니다.[239]질병통제예방센터는 새로운 가이드라인을 수립하고 발표하는 임무를 맡았고, 많은 로비를 받았습니다.[240]2016년, 미국 질병통제예방센터는 만성 통증에 대한 오피오이드 처방 가이드라인을 발표하였는데, 오피오이드는 통증과 기능에 대한 이익이 위험을 초과할 것으로 예상되는 경우에만 사용하고, 그 후 가장 낮은 유효 용량으로 사용할 것을 권고하고 있습니다.가능할 때마다 오피오이드와 벤조디아제핀의 동시 사용을 피할 수 있습니다.[34]연구에 따르면 만성 오피오이드 치료법(COT)과 관련된 고용량 오피오이드 처방은 자원을 투입하고 고용량 감량에 대한 공유된 기대를 확립하는 주 입법 지침과 보건 계획에 의한 노력을 통해 때때로 예방될 수 있다고 합니다.[241]
2017년 8월 10일 도널드 트럼프는 오피오이드 위기를 국가 공중보건 비상사태로 선포했습니다.[242]
전 세계적인 부족 현상
세계보건기구는 모르핀과 다른 양귀비를 원료로 하는 의약품들을 심한 통증 치료에 필수적인 것으로 확인했습니다.2002년 현재 7개국(미국, 영국, 이탈리아, 호주, 프랑스, 스페인, 일본)이 전 세계 모르핀 공급의 77%를 사용하고 있어 많은 신흥국들이 진통제가 부족한 실정입니다.[243]양귀비계 의약품을 제조하기 위한 현재 양귀비 원료의 공급 체계는 1961년 마약성 의약품에 관한 단일 협약의 규정에 따라 국제 마약 통제 위원회에 의해 규제되고 있습니다.이러한 조항에 근거하여 각 국가가 매년 요구할 수 있는 양귀비 원자재의 양은 이전 2년 이내의 국가 소비에서 추출한 국가의 수요 추정치에 해당해야 합니다.많은 나라에서, 높은 가격과 양귀비를 사용한 약의 처방에 대한 훈련의 부족 때문에 모르핀의 저처방이 만연하고 있습니다.세계보건기구는 현재 여러 나라의 정부들과 협력하여 보건 종사자들을 양성하고 양귀비를 기반으로 한 의약품의 더 많은 처방을 용이하게 하기 위해 의약품 처방에 관한 국가 규정을 개발하고 있습니다.[244]
Senlis Council에 의해 모르핀의 이용가능성을 높이기 위한 또 다른 아이디어가 제안되었습니다. Senlis Council은 아프간 모르핀에 대한 그들의 제안을 통해,아프가니스탄이 심각한 고통을 겪고 있고 양귀비 계열의 의약품에 접근할 수 없는 사람들에게 완제품 모르핀을 제공하면서, 현재의 INCB 규제 체계를 보완하는 2단계 공급 체계의 일부로서 신흥국들에게 값싼 통증 완화 솔루션을 제공할 수 있을 것입니다.현행 제도하에서는
레크리에이션용

오피오이드는 강한 행복감을[245] 유발할 수 있고 자주 오락적으로 사용됩니다.전통적으로 헤로인과 같은 불법 오피오이드와 관련된 처방 오피오이드는 오락적으로 잘못 사용됩니다.
의약품 오남용 및 의약외품 사용에는 처방받은 것 이외의 이유 또는 용량으로 의약품을 사용하는 것이 포함됩니다.오피오이드 오남용에는 처방되지 않은 사람들에게 약을 제공하는 것도 포함될 수 있습니다.이러한 주의전환은 범죄로 취급될 수 있으며, 많은 나라에서 징역형에 처해질 수 있습니다.[246][247]2014년에는 거의 2백만 명의 미국인들이 처방된 오피오이드를 남용하거나 의존했습니다.[248][249]
분류
다양한 종류의 오피오이드가 있습니다.[250]
- 천연 아편제: 아편 양귀비의 수지에 포함된 알칼로이드, 주로 모르핀, 코데인 및 베인이 포함되어 있으나 작용기전이 다른 파파베린 및 노스카핀은 포함되어 있지 않음
- 모르핀 아편제의 에스터: 화학적으로 약간 변형되었지만 대부분이 모르핀 프로약, 디아세틸모르핀(모르핀 디아세테이트; 헤로인), 니코르핀(모르핀 디니코틴), 디프로파닐모르핀(모르핀 디프로피오네이트), 데소르핀, 아세틸프로피오닐모르핀, 디벤조일모르핀, 디아세틸디하이드로모르핀,[251][252]
- 반합성 오피오이드: 하이드로모르폰, 하이드로코돈, 옥시코돈, 옥시모르폰, 에틸모르핀 및 부프레노핀과 같은 천연 아편 또는 모르핀 에스테르로부터 생성됨.
- 완전 합성 오피오이드: 펜타닐, 페티딘, 레보르판올, 메타돈, 트라마돌, 타펜타돌 및 덱스트로폭시펜과 같은
- 엔도르핀, 엔케팔린, 디노르핀, 엔도르핀 등 체내에서 자연적으로 생성되는 내인성 오피오이드 펩타이드.
- 내인성 오피오이드, 비펩타이드:모르핀, 그리고 체내에서 소량 생성되는 일부 오피오이드가 이 범주에 포함됩니다.
- 천연 오피오이드, 비동물성, 비오피오이드: Mitragyna speciosa(크라톰)의 잎에는 Mu- 및 Delta 수용체를 통해 활성화된 몇 가지 자연 발생 오피오이드가 포함되어 있습니다.살비아 디비노룸 식물에서 자연적으로 발견되는 살비노린 A는 카파-오피오이드 수용체 작용제입니다.[253]
모노아민 흡수 억제제로서 작용하는 트라마돌과 타펜타돌은 또한 μ-오피오이드 수용체의 경증 및 강력한 작용제로서 작용합니다.[254]두 약물 모두 오피오이드 길항제인 날록손을 투여해도 진통을 일으킵니다.[255]
크라톰, 코리달리스, 살비아 디비노룸 식물에 존재하는 분자와 파파베르 솜니페룸을 제외한 양귀비의 일부 종을 포함한 몇몇 사소한 아편 알칼로이드와 오피오이드 작용을 가진 다양한 물질들은 다른 곳에서도 발견됩니다.또한 많은 반합성 및 합성 오피오이드를 만드는 중요한 원료인 다량의 베인을 생성하는 균주도 있습니다.120종이 넘는 양귀비 종들 중 단 2종만이 모르핀을 생산합니다.
진통제 중에는 중추신경계에는 작용하지만 오피오이드 수용체 시스템에는 작용하지 않는 소수의 작용제가 있으며, 따라서 통증을 완화함으로써 행복감을 생성할 수 있지만 오피오이드의 다른 (마카틱) 특성은 없습니다. - 오피오이드가 생성되는 방식 때문에 습관화의 기초를 형성하지 않는 행복감, 물리학아이칼 의존, 즉 중독.이것들 중 가장 중요한 것은 네포팜, 오르페나드린, 그리고 아마도 페닐톨록사민 또는 다른 항히스타민입니다.삼환계 항우울제도 진통 효과가 있지만, 간접적으로 내인성 오피오이드 시스템을 활성화함으로써 진통 효과가 있다고 생각됩니다.파라세타몰은 주로 중앙에서 작용하는 진통제(비마약성)로, 5-HT 방출(통증 매개물질의 방출을 억제하는)을 증가시키기 위해 내려오는 세로토닌에 대한 작용에 의해 효과를 매개합니다.또한 사이클로-산소효소의 활성을 감소시킵니다.최근 파라세타몰의 치료 효능의 대부분 또는 전부가 세로토닌의 분비를 증가시키고 아난다마이드의 섭취를 억제하는 대사산물인 AM404에 기인하는 것으로 밝혀졌습니다.[citation needed]
다른 진통제는 말초적으로 작용합니다. (즉, 뇌나 척수가 아니라)연구에 따르면 모르핀과 관련된 약물들이 화상에 작용하는 모르핀 겔과 같은 말초적인 효과도 있을 수 있다고 합니다.최근의 연구는 말초 감각 뉴런에서 오피오이드 수용체를 발견했습니다.[256]오피오이드 진통제의 상당한 부분(최대 60%)은 특히 관절염, 외상성 또는 수술적 통증과 같은 염증 상태에서 이러한 말초 오피오이드 수용체에 의해 매개될 수 있습니다.[257]염증성 통증은 또한 말초 오피오이드 수용체를 활성화시키는 내인성 오피오이드 펩타이드에 의해 무뎌집니다.[258]
1953년에 인간과 일부 동물들은 자연적으로 소량의 모르핀, 코데인, 그리고 아마도 헤로인과 디하이드로모르핀과 같은 단순한 유도체들 중 일부를 내인성 오피오이드 펩타이드와 함께 생산한다는 [citation needed]것이 발견되었습니다.몇몇 박테리아는 각각 모르핀이나 코데인을 포함한 용액에서 살 때 히드로모르폰과 히드로코돈과 같은 반합성 오피오이드를 생성할 수 있습니다.
아편 양귀비의 많은 알칼로이드와 다른 유도체들은 오피오이드나 마약이 아닙니다. 가장 좋은 예는 부드러운 근육 이완제 파파베린입니다.Noscapine은 CNS 효과가 있지만 모르핀과 반드시 유사한 것은 아니기 때문에 약간의 경우이며, 아마도 그것은 그 자체로 하나의 범주에 속할 것입니다.
덱스트로메토르판(반합성 오피오이드 작용제인 레보메토르판의 입체 이성질체)과 그 대사 물질 덱스트로판은 다른 오피오이드와 구조적 유사성에도 불구하고 전혀 오피오이드 진통 효과가 없으며 대신 강력한 NMDA 길항제와 시그마 1, 2 수용체 작용제이며 많은 처방전 없이 사용할 수 있는 기침 억제제에 사용됩니다.
살비노린 A는 독특한 선택적이고 강력한 ĸ-오피오이드 수용체 작용제입니다.그럼에도 불구하고 다음과 같은 이유로 오피오이드로 적절하게 간주되지 않습니다.
- 화학적으로 알칼로이드가 아닙니다.
- 전형적인 오피오이드 특성이 없습니다. 항불안제나 기침 suppress제 효과가 전혀 없습니다.그것은 대신 강력한 환각제입니다.
| 오피오이드 펩타이드 | 골격 분자상 |
|---|---|
| 아드레노르핀 |  |
| 아미도르핀 |  |
| 카소모르핀 | |
| 다들 | |
| 담고 |  |
| 더모르핀 | |
| 엔도모르핀 |  |
| 모피셉틴 |  |
| 노셉틴 |  |
| 옥트레오타이드 |  |
| 오피오르핀 |  |
| TRIMU 5 |  |
내인성 오피오이드
체내에서 생성되는 오피오이드 펩타이드는 다음과 같습니다.
β-엔도르핀은 궁상핵의 Pro-opiomelanocortin (POMC) 세포, 뇌간 및 면역 세포에서 발현되며 μ-opioid 수용체를 통해 작용합니다.β-엔도르핀은 성적 행동과 식욕에 대한 영향을 포함하여 많은 영향을 미칩니다.β-엔도르핀은 또한 뇌하수체 코르티코트로프와 멜라노트로프에서 순환으로 분비됩니다.α-네오엔도르핀은 궁상핵의 POMC 세포에서도 발현됩니다.
메트-엔케팔린은 CNS와 면역세포에 널리 분포합니다; [메트]-엔케팔린은 프로엔케팔린 유전자의 산물이고, μ와 δ-오피오이드 수용체를 통해 작용합니다.또한 프로엔케팔린 유전자의 산물인 류엔케팔린은 δ opio이드 수용체를 통해 작용합니다.
다이노르핀은 κ-오피오이드 수용체를 통해 작용하며, 척수와 시상하부를 포함한 CNS에 널리 분포하며, 특히 궁상핵을 포함하여 그리고 초광자핵의 옥시토신과 바소프레신 뉴런 모두에 존재합니다.
엔도모르핀은 μ-오피오이드 수용체를 통해 작용하며, 이러한 수용체에서 다른 내인성 오피오이드보다 더 강력합니다.
아편알칼로이드 및 유도체
아편알칼로이드
파파베레툼을 포함한 혼합 아편 알칼로이드 제제는 여전히 때때로 사용됩니다.
모르핀에스테르
- 디아세틸모핀(디아세틴 디아세테이트, 헤로인)
- 니코모핀(모르핀디니코틴)
- 디프로파노일모르핀(모르핀 디프로피오네이트)
- 디아세틸디히드로모르핀
- 아세틸프로피오닐모르핀
- 데소모르핀
- 메틸데소르핀
- 디벤조일모르핀
모르핀에테르류
반합성 알칼로이드 유도체
합성 오피오이드
아니도피페리딘스
벤즈이미다졸
벤즈이미다졸 오피오이드는 니타젠으로도 알려져 있습니다.
페닐피페리딘
디페닐프로필아민 유도체
벤조모르판 유도체
오리파빈 유도체
모피난 도함수
다른이들
알로스테릭 조절제
일반적인 알로스테릭 조절제는 오피오이드에 속하지 않으며, 대신 오피오이드로 분류됩니다.
오피오이드 길항제
오피오이드 표
오피오이드 모피나 표
| 오피오이드의 모피나 표: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
비모르핀 오피오이드 표
| 비모르핀 오피오이드 표: 클릭하기 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
참고 항목
참고문헌
- ^ Ogura T, Egan TD (2013). "Chapter 15 – Opioid Agonists and Antagonists". Pharmacology and physiology for anesthesia : foundations and clinical application. Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-1679-5.
- ^ a b Hemmings HC, Egan TD (2013). Pharmacology and Physiology for Anesthesia: Foundations and Clinical Application: Expert Consult – Online and Print. Elsevier Health Sciences. p. 253. ISBN 978-1437716795.
Opiate is the older term classically used in pharmacology to mean a drug derived from opium. Opioid, a more modern term, is used to designate all substances, both natural and synthetic, that bind to opioid receptors (including antagonists).
- ^ "Opioids". www.hopkinsmedicine.org. 11 May 2023. Retrieved 2 November 2023.
- ^ "Alcohol and Drug Policy Commission : Opiates or Opioids — What's the difference? : State of Oregon". www.oregon.gov. Retrieved 2 November 2023.
- ^ a b Stromgaard K, Krogsgaard-Larsen P, Madsen U (2009). Textbook of Drug Design and Discovery, Fourth Edition. CRC Press. ISBN 9781439882405.
- ^ Walzer C (2014). "52 Nondomestic Equids". In West G, Heard D, Caulkett N (eds.). Zoo Animal and Wildlife Immobilization and Anesthesia. pp. 723, 727. doi:10.1002/9781118792919. ISBN 9781118792919. PMC 2871358. Retrieved 8 July 2019.
{{cite book}}:journal=무시됨(도움말) - ^ "Carfentanil". www.drugbank.ca. Retrieved 8 July 2019.
- ^ Sterken J, Troubleyn J, Gasthuys F, Maes V, Diltoer M, Verborgh C (October 2004). "Intentional overdose of Large Animal Immobilon". European Journal of Emergency Medicine. 11 (5): 298–301. doi:10.1097/00063110-200410000-00013. PMID 15359207.
- ^ Lembke A (2016). Drug Dealer, MD: How Doctors Were Duped, Patients Got Hooked, and Why It's So Hard to Stop. Johns Hopkins University Press. ISBN 978-1421421407.
- ^ "Drug Facts: Prescription Opioids". NIDA. June 2019. Archived from the original on 12 June 2019. Retrieved 5 July 2019.
- ^ "FDA requires strong warnings for opioid analgesics, prescription opioid cough products, and benzodiazepine labeling related to serious risks and death from combined use". FDA. 31 August 2016. Retrieved 1 September 2016.
- ^ "Status and Trend Analysis of Illict [sic] Drug Markets" (PDF). World Drug Report 2015. Retrieved 26 June 2015.
- ^ "Report III: FDA Approved Medications for the Treatment of Opiate Dependence: Literature Reviews on Effectiveness & Cost- Effectiveness, Treatment Research Institute". Advancing Access to Addiction Medications: Implications for Opioid Addiction Treatment. p. 41. Archived from the original on 24 February 2021. Retrieved 14 February 2016.
- ^ Tetrault JM, Butner JL (September 2015). "Non-Medical Prescription Opioid Use and Prescription Opioid Use Disorder: A Review". The Yale Journal of Biology and Medicine. 88 (3): 227–33. PMC 4553642. PMID 26339205.
- ^ Tarabar AF, Nelson LS (April 2003). "The resurgence and abuse of heroin by children in the United States". Current Opinion in Pediatrics. 15 (2): 210–5. doi:10.1097/00008480-200304000-00013. PMID 12640281. S2CID 21900231.
- ^ Gray E (4 February 2014). "Heroin Gains Popularity as Cheap Doses Flood the U.S". TIME.com. Retrieved 12 February 2016.
- ^ Maltoni M (January 2008). "Opioids, pain, and fear". Annals of Oncology. 19 (1): 5–7. doi:10.1093/annonc/mdm555. PMID 18073220.
[A] number of studies, however, have also reported inadequate pain control in 40%–70% of patients, resulting in the emergence of a new type of epidemiology, that of 'failed pain control', caused by a series of obstacles preventing adequate cancer pain management.... The cancer patient runs the risk of becoming an innocent victim of a war waged against opioid abuse and addiction if the norms regarding the two kinds of use (therapeutic or nontherapeutic) are not clearly distinct. Furthermore, health professionals may be worried about regulatory scrutiny and may opt not to use opioid therapy for this reason.
- ^ McCarberg BH (March 2011). "Pain management in primary care: strategies to mitigate opioid misuse, abuse, and diversion". Postgraduate Medicine. 123 (2): 119–30. doi:10.3810/pgm.2011.03.2270. PMID 21474900. S2CID 25935364.
- ^ a b c Offermanns S (2008). Encyclopedia of Molecular Pharmacology. Vol. 1 (2 ed.). Springer Science & Business Media. p. 903. ISBN 9783540389163.
In the strict sense, opiates are drugs derived from opium and include the natural products morphine, codeine, thebaine and many semi-synthetic congeners derived from them. In the wider sense, opiates are morphine-like drugs with non-peptidic structures. The older term opiates is now more and more replaced by the term opioids which applies to any substance, whether endogenous or synthetic, peptidic or non-peptidic, that produces morphine-like effects through action on opioid receptors.
- ^ Freye E (2008). "Part II. Mechanism of action of opioids and clinical effects". Opioids in Medicine: A Comprehensive Review on the Mode of Action and the Use of Analgesics in Different Clinical Pain States. Springer Science & Business Media. p. 85. ISBN 9781402059476.
Opiate is a specific term that is used to describe drugs (natural and semi-synthetic) derived from the juice of the opium poppy. For example morphine is an opiate but methadone (a completely synthetic drug) is not. Opioid is a general term that includes naturally occurring, semi-synthetic, and synthetic drugs, which produce their effects by combining with opioid receptors and are competitively antagonized by nalaxone. In this context the term opioid refers to opioid agonists, opioid antagonists, opioid peptides, and opioid receptors.
- ^ Davies PS, D'Arcy YM (26 September 2012). Compact Clinical Guide to Cancer Pain Management: An Evidence-Based Approach for Nurses. Springer Publishing Company. ISBN 9780826109743.
- ^ "21 U.S. Code § 802 – Definitions". LII / Legal Information Institute. Retrieved 12 February 2016.
- ^ "Definition of NARCOTIC". www.merriam-webster.com. Retrieved 12 February 2016.
- ^ Satoskar RS, Rege N, Bhandarkar SD (2015). Pharmacology and Pharmacotherapeutics. Elsevier Health Sciences. ISBN 9788131243718.
- ^ Ebert MH, Kerns RD (2010). Behavioral and Psychopharmacologic Pain Management. Cambridge University Press. ISBN 9781139493543.
- ^ Moore RA, Wiffen PJ, Derry S, Maguire T, Roy YM, Tyrrell L (November 2015). "Non-prescription (OTC) oral analgesics for acute pain - an overview of Cochrane reviews". The Cochrane Database of Systematic Reviews. 11 (11): CD010794. doi:10.1002/14651858.CD010794.pub2. PMC 6485506. PMID 26544675.
- ^ a b Fleisher GR, Ludwig S (2010). Textbook of Pediatric Emergency Medicine. Lippincott Williams & Wilkins. p. 61. ISBN 9781605471594.
- ^ "Codeine". Drugs.com. 15 May 2022. Retrieved 31 January 2023.
- ^ Alexander GC, Kruszewski SP, Webster DW (November 2012). "Rethinking opioid prescribing to protect patient safety and public health". JAMA. 308 (18): 1865–6. doi:10.1001/jama.2012.14282. PMID 23150006.
- ^ Mohamadi A, Chan JJ, Lian J, Wright CL, Marin AM, Rodriguez EK, et al. (August 2018). "Risk Factors and Pooled Rate of Prolonged Opioid Use Following Trauma or Surgery: A Systematic Review and Meta-(Regression) Analysis". The Journal of Bone and Joint Surgery. American Volume. 100 (15): 1332–1340. doi:10.2106/JBJS.17.01239. PMID 30063596. S2CID 51891341.
- ^ Davis, Corey S.; Lieberman, Amy Judd; Hernandez-Delgado, Hector; Suba, Carli (1 January 2019). "Laws limiting the prescribing or dispensing of opioids for acute pain in the United States: A national systematic legal review". Drug and Alcohol Dependence. 194: 166–172. doi:10.1016/j.drugalcdep.2018.09.022. ISSN 1879-0046. PMID 30445274. S2CID 53567522.
- ^ Franklin GM (September 2014). "Opioids for chronic noncancer pain: a position paper of the American Academy of Neurology". Neurology. 83 (14): 1277–84. doi:10.1212/WNL.0000000000000839. PMID 25267983.
- ^ a b Okie S (November 2010). "A flood of opioids, a rising tide of deaths". The New England Journal of Medicine. 363 (21): 1981–5. doi:10.1056/NEJMp1011512. PMID 21083382. S2CID 7092234.
오키의 관점에 대한 응답: - ^ a b Dowell D, Haegerich TM, Chou R (April 2016). "CDC Guideline for Prescribing Opioids for Chronic Pain--United States, 2016". JAMA. 315 (15): 1624–45. doi:10.1001/jama.2016.1464. PMC 6390846. PMID 26977696.
- ^ Yang J, Bauer BA, Wahner-Roedler DL, Chon TY, Xiao L (17 February 2020). "The Modified WHO Analgesic Ladder: Is It Appropriate for Chronic Non-Cancer Pain?". Journal of Pain Research. 13: 411–417. doi:10.2147/JPR.S244173. PMC 7038776. PMID 32110089.
- ^ a b 편두통 치료를 위한 오피오이드의 사용 및 남용에 대한 정보는 다음을 참조하십시오.
- Silberstein SD (September 2000). "Practice parameter: evidence-based guidelines for migraine headache (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. 55 (6): 754–62. doi:10.1212/WNL.55.6.754. PMID 10993991.
- Evers S, Afra J, Frese A, Goadsby PJ, Linde M, May A, Sándor PS (September 2009). "EFNS guideline on the drug treatment of migraine--revised report of an EFNS task force". European Journal of Neurology. 16 (9): 968–81. doi:10.1111/j.1468-1331.2009.02748.x. PMID 19708964. S2CID 9204782.
- Institute for Clinical Systems Improvement (2011), Headache, Diagnosis and Treatment of, Institute for Clinical Systems Improvement, archived from the original on 29 October 2013, retrieved 18 December 2013
- ^ Painter JT, Crofford LJ (March 2013). "Chronic opioid use in fibromyalgia syndrome: a clinical review". Journal of Clinical Rheumatology. 19 (2): 72–7. doi:10.1097/RHU.0b013e3182863447. PMID 23364665.
- ^ McNicol ED, Midbari A, Eisenberg E (August 2013). "Opioids for neuropathic pain". The Cochrane Database of Systematic Reviews. 8 (8): CD006146. doi:10.1002/14651858.CD006146.pub2. PMC 6353125. PMID 23986501.
- ^ a b c American Headache Society (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Headache Society, archived from the original on 3 December 2013, retrieved 10 December 2013American Headache Society (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Headache Society, archived from the original on 3 December 2013, retrieved 10 December 2013다음을 인용합니다.
- Bigal ME, Lipton RB (April 2009). "Excessive opioid use and the development of chronic migraine". Pain. 142 (3): 179–82. doi:10.1016/j.pain.2009.01.013. PMID 19232469. S2CID 27949021.
- Bigal ME, Serrano D, Buse D, Scher A, Stewart WF, Lipton RB (September 2008). "Acute migraine medications and evolution from episodic to chronic migraine: a longitudinal population-based study". Headache. 48 (8): 1157–68. doi:10.1111/j.1526-4610.2008.01217.x. PMID 18808500.
- Scher AI, Stewart WF, Ricci JA, Lipton RB (November 2003). "Factors associated with the onset and remission of chronic daily headache in a population-based study". Pain. 106 (1–2): 81–9. doi:10.1016/S0304-3959(03)00293-8. PMID 14581114. S2CID 29000302.
- Katsarava Z, Schneeweiss S, Kurth T, Kroener U, Fritsche G, Eikermann A, et al. (March 2004). "Incidence and predictors for chronicity of headache in patients with episodic migraine". Neurology. 62 (5): 788–90. doi:10.1212/01.WNL.0000113747.18760.D2. PMID 15007133. S2CID 20759425.
- ^ Manchikanti L, Helm S, Fellows B, Janata JW, Pampati V, Grider JS, Boswell MV (July 2012). "Opioid epidemic in the United States". Pain Physician. 15 (3 Suppl): ES9-38. doi:10.36076/ppj.2012/15/ES9. PMID 22786464.
- ^ Chou R, Ballantyne JC, Fanciullo GJ, Fine PG, Miaskowski C (February 2009). "Research gaps on use of opioids for chronic noncancer pain: findings from a review of the evidence for an American Pain Society and American Academy of Pain Medicine clinical practice guideline". The Journal of Pain. 10 (2): 147–59. doi:10.1016/j.jpain.2008.10.007. PMID 19187891.
- ^ "PAIN". Painjournalonline.com. 1 September 2015. Retrieved 7 January 2016.
- ^ Kissin I (28 September 2015). "Long-term opioid treatment of chronic nonmalignant pain: unproven efficacy and neglected safety?". Journal of Pain Research. 6: 513–29. doi:10.2147/JPR.S47182. PMC 3712997. PMID 23874119.
- ^ Dhalla IA, Gomes T, Mamdani MM, Juurlink DN (January 2012). "Opioids versus nonsteroidal anti-inflammatory drugs in noncancer pain". Canadian Family Physician. 58 (1): 30. PMC 3264005. PMID 22267615.
- ^ Marret E, Beloeil H, Lejus C (March 2009). "[What are the benefits and risk of non-opioid analgesics combined with postoperative opioids?]". Annales Françaises d'Anesthésie et de Réanimation. 28 (3): e135-51. doi:10.1016/j.annfar.2009.01.006. PMID 19304445.
- ^ Franceschi F, Iacomini P, Marsiliani D, Cordischi C, Antonini EF, Alesi A, et al. (August 2013). "Safety and efficacy of the combination acetaminophen-codeine in the treatment of pain of different origin" (PDF). European Review for Medical and Pharmacological Sciences. 17 (16): 2129–35. PMID 23893177.
- ^ Chung KF, Widdicombe J (2008). Pharmacology and therapeutics of cough. Berlin: Springer. p. 248. ISBN 9783540798422.
- ^ Bolser DC, Davenport PW (February 2007). "Codeine and cough: an ineffective gold standard". Current Opinion in Allergy and Clinical Immunology. 7 (1): 32–6. doi:10.1097/ACI.0b013e3280115145. PMC 2921574. PMID 17218808.
- ^ a b Goldman RD (December 2010). "Codeine for acute cough in children". Canadian Family Physician. 56 (12): 1293–4. PMC 3001921. PMID 21156892.
- ^ Paul IM (February 2012). "Therapeutic options for acute cough due to upper respiratory infections in children". Lung. 190 (1): 41–4. doi:10.1007/s00408-011-9319-y. PMID 21892785. S2CID 23865647.
- ^ Verlee L, Verheij TJ, Hopstaken RM, Prins JM, Salomé PL, Bindels PJ (2012). "[Summary of NHG practice guideline 'Acute cough']". Nederlands Tijdschrift voor Geneeskunde. 156: A4188. PMID 22917039.
- ^ Matthys H, Bleicher B, Bleicher U (1983). "Dextromethorphan and codeine: objective assessment of antitussive activity in patients with chronic cough". The Journal of International Medical Research. 11 (2): 92–100. doi:10.1177/030006058301100206. PMID 6852361. S2CID 30521239.
- ^ Van Amburgh JA. "Do Cough Remedies Work?". Medscape. Retrieved 10 April 2016.
- ^ Bolser DC (February 2010). "Pharmacologic management of cough". Otolaryngologic Clinics of North America. 43 (1): 147–55, xi. doi:10.1016/j.otc.2009.11.008. PMC 2827356. PMID 20172264.
- ^ Webster LR (October 2015). "Opioid-Induced Constipation". Pain Medicine. 16 (Suppl 1): S16-21. doi:10.1111/pme.12911. PMID 26461071.
- ^ "Press Announcements - FDA approves Movantik for opioid-induced constipation". www.fda.gov. Retrieved 18 February 2016.
- ^ Gallagher R (July 2011). "The use of opioids for dyspnea in advanced disease". CMAJ. 183 (10): 1170. doi:10.1503/cmaj.110024. PMC 3134725. PMID 21746829.
- ^ Wiseman R, Rowett D, Allcroft P, Abernethy A, Currow DC (March 2013). "Chronic refractory dyspnoea--evidence based management". Australian Family Physician. 42 (3): 137–40. PMID 23529525.
- ^ Dy, Sydney M.; Gupta, Arjun; Waldfogel, Julie M.; Sharma, Ritu; Zhang, Allen; Feliciano, Josephine L.; Sedhom, Ramy; Day, Jeff; Gersten, Rebecca A.; Davidson, Patricia M.; Bass, Eric B. (19 November 2020). "Interventions for Breathlessness in Patients With Advanced Cancer". JAMA Oncology. doi:10.23970/ahrqepccer232. PMID 33289989.
- ^ Feliciano JL, Waldfogel JM, Sharma R, Zhang A, Gupta A, Sedhom R, et al. (February 2021). "Pharmacologic Interventions for Breathlessness in Patients With Advanced Cancer: A Systematic Review and Meta-analysis". JAMA Network Open. 4 (2): e2037632. doi:10.1001/jamanetworkopen.2020.37632. PMC 7907959. PMID 33630086.
- ^ "Restless Legs Syndrome Baylor Medicine". www.bcm.edu. Retrieved 6 November 2023.
- ^ Higgins C, Smith BH, Matthews K (June 2019). "Evidence of opioid-induced hyperalgesia in clinical populations after chronic opioid exposure: a systematic review and meta-analysis" (PDF). British Journal of Anaesthesia. 122 (6): e114–e126. doi:10.1016/j.bja.2018.09.019. PMID 30915985. S2CID 81293413.
- ^ Yang, David Z.; Sin, Billy; Beckhusen, Joshua; Xia, Dawei; Khaimova, Rebecca; Iliev, Ilia (May–June 2019). "Opioid-Induced Hyperalgesia in the Nonsurgical Setting: A Systematic Review". American Journal of Therapeutics. 26 (3): e397–e405. doi:10.1097/MJT.0000000000000734. ISSN 1536-3686. PMID 29726847. S2CID 19181545.
- ^ a b c d e f g h Furlan AD, Sandoval JA, Mailis-Gagnon A, Tunks E (May 2006). "Opioids for chronic noncancer pain: a meta-analysis of effectiveness and side effects". CMAJ. 174 (11): 1589–94. doi:10.1503/cmaj.051528. PMC 1459894. PMID 16717269.
- ^ Parthvi R, Agrawal A, Khanijo S, Tsegaye A, Talwar A (May–June 2019). "Acute Opiate Overdose: An Update on Management Strategies in Emergency Department and Critical Care Unit". American Journal of Therapeutics. 26 (3): e380–e387. doi:10.1097/MJT.0000000000000681. PMID 28952972. S2CID 24720660.
- ^ Baumann S (2009). "A nursing approach to pain in older adults". Medsurg Nursing. 18 (2): 77–82, quiz 83. PMID 19489204.
- ^ Buckeridge D, Huang A, Hanley J, Kelome A, Reidel K, Verma A, et al. (September 2010). "Risk of injury associated with opioid use in older adults". Journal of the American Geriatrics Society. 58 (9): 1664–70. doi:10.1111/j.1532-5415.2010.03015.x. PMID 20863326. S2CID 25941322.
- ^ Schneider JP (2010). "Rational use of opioid analgesics in chronic musculoskeletal pain". J Musculoskel Med. 27: 142–148.
- ^ Sanger N, Bhatt M, Singhal N, Ramsden K, Baptist-Mohseni N, Panesar B, et al. (March 2019). "Adverse Outcomes Associated with Prescription Opioids for Acute Low Back Pain: A Systematic Review and Meta-Analysis". Pain Physician. 22 (2): 119–138. PMID 30921976.
- ^ Fuggle N, Curtis E, Shaw S, Spooner L, Bruyère O, Ntani G, et al. (April 2019). "Safety of Opioids in Osteoarthritis: Outcomes of a Systematic Review and Meta-Analysis". Drugs & Aging. 36 (Suppl 1): 129–143. doi:10.1007/s40266-019-00666-9. PMC 6509215. PMID 31073926.
- ^ Stephens E (23 November 2015). "Opioid Toxicity". Medscape. Retrieved 24 February 2016.
The CDC reported that methadone contributed to 31.4% of opioid-related deaths in the United States from 1999–2010. Methadone also accounted for 39.8% of all single-drug opioid-related deaths. The overdose death rate associated with methadone was significantly higher than that associated with other opioid-related deaths among multidrug and single-drug deaths.
- ^ a b c d e Noble M, Treadwell JR, Tregear SJ, Coates VH, Wiffen PJ, Akafomo C, Schoelles KM (January 2010). Noble M (ed.). "Long-term opioid management for chronic noncancer pain". The Cochrane Database of Systematic Reviews. 2018 (1): CD006605. doi:10.1002/14651858.CD006605.pub2. PMC 6494200. PMID 20091598.
- ^ "Drug Overdose Deaths in the United States, 1999–2016" (PDF). CDC. Retrieved 23 December 2017.
- ^ Pradhan AA, Walwyn W, Nozaki C, Filliol D, Erbs E, Matifas A, et al. (December 2010). "Ligand-directed trafficking of the δ-opioid receptor in vivo: two paths toward analgesic tolerance". The Journal of Neuroscience. 30 (49): 16459–68. doi:10.1523/JNEUROSCI.3748-10.2010. PMC 3086517. PMID 21147985.
- ^ Kollars JP, Larson MD (March 2005). "Tolerance to miotic effects of opioids". Anesthesiology. 102 (3): 701. doi:10.1097/00000542-200503000-00047. PMID 15731628.
- ^ Santillán R, Maestre JM, Hurlé MA, Flórez J (July 1994). "Enhancement of opiate analgesia by nimodipine in cancer patients chronically treated with morphine: a preliminary report". Pain. 58 (1): 129–32. doi:10.1016/0304-3959(94)90192-9. PMID 7970835. S2CID 35138704.
- ^ Santillán R, Hurlé MA, Armijo JA, de los Mozos R, Flórez J (May 1998). "Nimodipine-enhanced opiate analgesia in cancer patients requiring morphine dose escalation: a double-blind, placebo-controlled study". Pain. 76 (1–2): 17–26. doi:10.1016/S0304-3959(98)00019-0. PMID 9696455. S2CID 30963675.
- ^ Smith FL, Dombrowski DS, Dewey WL (February 1999). "Involvement of intracellular calcium in morphine tolerance in mice". Pharmacology, Biochemistry, and Behavior. 62 (2): 381–8. doi:10.1016/S0091-3057(98)00168-3. PMID 9972707. S2CID 37434490.
- ^ McCarthy RJ, Kroin JS, Tuman KJ, Penn RD, Ivankovich AD (April 1998). "Antinociceptive potentiation and attenuation of tolerance by intrathecal co-infusion of magnesium sulfate and morphine in rats". Anesthesia and Analgesia. 86 (4): 830–6. doi:10.1097/00000539-199804000-00028. PMID 9539610.
- ^ Morrison AP, Hunter JM, Halpern SH, Banerjee A (May 2013). "Effect of intrathecal magnesium in the presence or absence of local anaesthetic with and without lipophilic opioids: a systematic review and meta-analysis". British Journal of Anaesthesia. 110 (5): 702–12. doi:10.1093/bja/aet064. PMID 23533255.
- ^ Larson AA, Kovács KJ, Spartz AK (November 2000). "Intrathecal Zn2+ attenuates morphine antinociception and the development of acute tolerance". European Journal of Pharmacology. 407 (3): 267–72. doi:10.1016/S0014-2999(00)00715-9. PMID 11068022.
- ^ Wong CS, Cherng CH, Luk HN, Ho ST, Tung CS (February 1996). "Effects of NMDA receptor antagonists on inhibition of morphine tolerance in rats: binding at mu-opioid receptors". European Journal of Pharmacology. 297 (1–2): 27–33. doi:10.1016/0014-2999(95)00728-8. PMID 8851162.
- ^ Malec D, Mandryk M, Fidecka S (March–April 2008). "Interaction of memantine and ketamine in morphine- and pentazocine-induced antinociception in mice" (PDF). Pharmacological Reports. 60 (2): 149–55. PMID 18443375.
- ^ McCleane GJ (2003). "The cholecystokinin antagonist proglumide enhances the analgesic effect of dihydrocodeine". The Clinical Journal of Pain. 19 (3): 200–1. doi:10.1097/00002508-200305000-00008. PMID 12792559. S2CID 29229782.
- ^ Watkins LR, Kinscheck IB, Mayer DJ (April 1984). "Potentiation of opiate analgesia and apparent reversal of morphine tolerance by proglumide". Science. 224 (4647): 395–6. Bibcode:1984Sci...224..395W. doi:10.1126/science.6546809. PMID 6546809.
- ^ Tang J, Chou J, Iadarola M, Yang HY, Costa E (June 1984). "Proglumide prevents and curtails acute tolerance to morphine in rats". Neuropharmacology. 23 (6): 715–8. doi:10.1016/0028-3908(84)90171-0. PMID 6462377. S2CID 33168040.
- ^ Ledeboer A, Hutchinson MR, Watkins LR, Johnson KW (July 2007). "Ibudilast (AV-411). A new class therapeutic candidate for neuropathic pain and opioid withdrawal syndromes". Expert Opinion on Investigational Drugs. 16 (7): 935–50. doi:10.1517/13543784.16.7.935. PMID 17594181. S2CID 22321634.
- ^ a b c d Doyle D, Hanks G, Cherney I, Calman K, eds. (2004). Oxford Textbook of Palliative Medicine (3rd ed.). Oxford University Press. ISBN 978-0198566984.
- ^ Hermann D, Klages E, Welzel H, Mann K, Croissant B (June 2005). "Low efficacy of non-opioid drugs in opioid withdrawal symptoms". Addiction Biology. 10 (2): 165–9. doi:10.1080/13556210500123514. PMID 16191669. S2CID 8017503.
- ^ Brown TK (March 2013). "Ibogaine in the treatment of substance dependence". Current Drug Abuse Reviews. 6 (1): 3–16. doi:10.2174/15672050113109990001. PMID 23627782.
- ^ Duceppe, Marc-Alexandre; Perreault, Marc M.; Frenette, Anne Julie; Burry, Lisa D.; Rico, Philippe; Lavoie, Annie; Gélinas, Céline; Mehta, Sangeeta; Dagenais, Maryse; Williamson, David R. (April 2019). "Frequency, risk factors and symptomatology of iatrogenic withdrawal from opioids and benzodiazepines in critically Ill neonates, children and adults: A systematic review of clinical studies". Journal of Clinical Pharmacy and Therapeutics. 44 (2): 148–156. doi:10.1111/jcpt.12787. ISSN 1365-2710. PMID 30569508.
- ^ Bannwarth B (September 2012). "Will abuse-deterrent formulations of opioid analgesics be successful in achieving their purpose?". Drugs. 72 (13): 1713–23. doi:10.2165/11635860-000000000-00000. PMID 22931520. S2CID 26082561.
- ^ Schneider JP, Matthews M, Jamison RN (October 2010). "Abuse-deterrent and tamper-resistant opioid formulations: what is their role in addressing prescription opioid abuse?". CNS Drugs. 24 (10): 805–10. doi:10.2165/11584260-000000000-00000. PMID 20839893. S2CID 17830622.
- ^ Xu Y, Johnson A (2013). "Opioid therapy pharmacogenomics for noncancer pain: efficacy, adverse events, and costs". Pain Research and Treatment. 2013: 943014. doi:10.1155/2013/943014. PMC 3791560. PMID 24167729.
- ^ Brush DE (December 2012). "Complications of long-term opioid therapy for management of chronic pain: the paradox of opioid-induced hyperalgesia". Journal of Medical Toxicology. 8 (4): 387–92. doi:10.1007/s13181-012-0260-0. PMC 3550256. PMID 22983894.
- ^ Malik Z, Baik D, Schey R (February 2015). "The role of cannabinoids in regulation of nausea and vomiting, and visceral pain". Current Gastroenterology Reports. 17 (2): 429. doi:10.1007/s11894-015-0429-1. PMID 25715910. S2CID 32705478.
- ^ Abrams DI, Guzman M (June 2015). "Cannabis in cancer care". Clinical Pharmacology and Therapeutics. 97 (6): 575–86. doi:10.1002/cpt.108. PMID 25777363. S2CID 2488112.
- ^ "UCSF Study Finds Medical Marijuana Could Help Patients Reduce Pain with Opiates". UC San Francisco. 6 December 2011. Retrieved 4 March 2016.
- ^ Abrams DI, Couey P, Shade SB, Kelly ME, Benowitz NL (December 2011). "Cannabinoid-opioid interaction in chronic pain". Clinical Pharmacology and Therapeutics. 90 (6): 844–51. doi:10.1038/clpt.2011.188. PMID 22048225. S2CID 4823659.
- ^ Frauenknecht J, Kirkham KR, Jacot-Guillarmod A, Albrecht E (May 2019). "Analgesic impact of intra-operative opioids vs. opioid-free anaesthesia: a systematic review and meta-analysis". Anaesthesia. 74 (5): 651–662. doi:10.1111/anae.14582. PMID 30802933. S2CID 73469631.
- ^ Busse, Jason W.; Wang, Li; Kamaleldin, Mostafa; Craigie, Samantha; Riva, John J.; Montoya, Luis; Mulla, Sohail M.; Lopes, Luciane C.; Vogel, Nicole; Chen, Eric; Kirmayr, Karin (18 December 2018). "Opioids for Chronic Noncancer Pain: A Systematic Review and Meta-analysis". JAMA. 320 (23): 2448–2460. doi:10.1001/jama.2018.18472. ISSN 0098-7484. PMC 6583638. PMID 30561481.
- ^ Reissig JE, Rybarczyk AM (April 2005). "Pharmacologic treatment of opioid-induced sedation in chronic pain". The Annals of Pharmacotherapy. 39 (4): 727–31. doi:10.1345/aph.1E309. PMID 15755795. S2CID 39058371.
- ^ Corey PJ, Heck AM, Weathermon RA (December 1999). "Amphetamines to counteract opioid-induced sedation". The Annals of Pharmacotherapy. 33 (12): 1362–6. doi:10.1345/aph.19024. PMID 10630837. S2CID 23733242.
- ^ Canadian Agency for Drugs and Technologies in Health (26 June 2014). "Dioctyl Sulfosuccinate or Docusate (Calcium or Sodium) for the Prevention or Management of Constipation: A Review of the Clinical Effectiveness". PMID 25520993.
- ^ McCarberg BH (July 2013). "Overview and treatment of opioid-induced constipation". Postgraduate Medicine. 125 (4): 7–17. doi:10.3810/pgm.2013.07.2651. PMID 23782897. S2CID 42872181.
- ^ a b c d e Kumar L, Barker C, Emmanuel A (2014). "Opioid-induced constipation: pathophysiology, clinical consequences, and management". Gastroenterology Research and Practice. 2014: 141737. doi:10.1155/2014/141737. PMC 4027019. PMID 24883055.
- ^ a b Alguire PC, American College of Physicians, Clerkship Directors in Internal Medicine (2009). Internal Medicine Essentials for Clerkship Students 2. ACP Press. pp. 272–. ISBN 978-1-934465-13-4.
- ^ a b c Elliott JA, Smith HS (19 April 2016). Handbook of Acute Pain Management. CRC Press. pp. 89–. ISBN 978-1-4665-9635-1.
- ^ Poulsen JL, Brock C, Olesen AE, Nilsson M, Drewes AM (November 2015). "Evolving paradigms in the treatment of opioid-induced bowel dysfunction". Therapeutic Advances in Gastroenterology. 8 (6): 360–72. doi:10.1177/1756283X15589526. PMC 4622283. PMID 26557892.
- ^ Davis MP, Goforth HW (2016). "Oxycodone with an opioid receptor antagonist: A review". Journal of Opioid Management. 12 (1): 67–85. doi:10.5055/jom.2016.0313. PMID 26908305.
- ^ Candy B, Jones L, Vickerstaff V, Larkin PJ, Stone P (June 2018). "Mu-opioid antagonists for opioid-induced bowel dysfunction in people with cancer and people receiving palliative care". The Cochrane Database of Systematic Reviews. 2018 (6): CD006332. doi:10.1002/14651858.CD006332.pub3. PMC 6513061. PMID 29869799.
- ^ Luthra P, Burr NE, Brenner DM, Ford AC (May 2018). "Efficacy of pharmacological therapies for the treatment of opioid-induced constipation: systematic review and network meta-analysis" (PDF). Gut. 68 (3): 434–444. doi:10.1136/gutjnl-2018-316001. PMID 29730600. S2CID 13677764.
- ^ Esmadi M, Ahmad D, Hewlett A (March 2019). "Efficacy of naldemedine for the treatment of opioid-induced constipation: A meta-analysis". Journal of Gastrointestinal and Liver Diseases. 28 (1): 41–46. doi:10.15403/jgld.2014.1121.281.any. PMID 30851171.
- ^ Dorn S, Lembo A, Cremonini F (September 2014). "Opioid-induced bowel dysfunction: epidemiology, pathophysiology, diagnosis, and initial therapeutic approach". The American Journal of Gastroenterology Supplements. 2 (1): 31–7. doi:10.1038/ajgsup.2014.7. PMID 25207610.
- ^ Yost CS (2006). "A new look at the respiratory stimulant doxapram". CNS Drug Reviews. 12 (3–4): 236–49. doi:10.1111/j.1527-3458.2006.00236.x. PMC 6506195. PMID 17227289.
- ^ Tan ZM, Liu JH, Dong T, Li JX (August 2006). "[Clinical observation of target-controlled remifentanil infusion combined with propofol and doxapram in painless artificial abortion]". Nan Fang Yi Ke da Xue Xue Bao = Journal of Southern Medical University. 26 (8): 1206–8. PMID 16939923.
- ^ Manzke T, Guenther U, Ponimaskin EG, Haller M, Dutschmann M, Schwarzacher S, Richter DW (July 2003). "5-HT4(a) receptors avert opioid-induced breathing depression without loss of analgesia". Science. 301 (5630): 226–9. Bibcode:2003Sci...301..226M. doi:10.1126/science.1084674. PMID 12855812. S2CID 13641423.
- ^ Wang X, Dergacheva O, Kamendi H, Gorini C, Mendelowitz D (August 2007). "5-Hydroxytryptamine 1A/7 and 4alpha receptors differentially prevent opioid-induced inhibition of brain stem cardiorespiratory function". Hypertension. 50 (2): 368–76. doi:10.1161/HYPERTENSIONAHA.107.091033. PMID 17576856.
- ^ Ren J, Poon BY, Tang Y, Funk GD, Greer JJ (December 2006). "Ampakines alleviate respiratory depression in rats". American Journal of Respiratory and Critical Care Medicine. 174 (12): 1384–91. doi:10.1164/rccm.200606-778OC. PMID 16973981.
- ^ Cozowicz, Crispiana; Chung, Frances; Doufas, Anthony G.; Nagappa, Mahesh; Memtsoudis, Stavros G. (October 2018). "Opioids for Acute Pain Management in Patients With Obstructive Sleep Apnea: A Systematic Review". Anesthesia and Analgesia. 127 (4): 988–1001. doi:10.1213/ANE.0000000000003549. ISSN 1526-7598. PMID 29958218. S2CID 49614405.
- ^ Gupta, Kapil; Nagappa, Mahesh; Prasad, Arun; Abrahamyan, Lusine; Wong, Jean; Weingarten, Toby N.; Chung, Frances (14 December 2018). "Risk factors for opioid-induced respiratory depression in surgical patients: a systematic review and meta-analyses". BMJ Open. 8 (12): e024086. doi:10.1136/bmjopen-2018-024086. ISSN 2044-6055. PMC 6303633. PMID 30552274.
- ^ Wilson GR, Reisfield GM (2003). "Morphine hyperalgesia: a case report". The American Journal of Hospice & Palliative Care. 20 (6): 459–61. doi:10.1177/104990910302000608. PMID 14649563. S2CID 22690630.
- ^ Vella-Brincat J, Macleod AD (2007). "Adverse effects of opioids on the central nervous systems of palliative care patients". Journal of Pain & Palliative Care Pharmacotherapy. 21 (1): 15–25. doi:10.1080/J354v21n01_05. PMID 17430825. S2CID 17757207.
- ^ Mercadante S, Arcuri E (2005). "Hyperalgesia and opioid switching". The American Journal of Hospice & Palliative Care. 22 (4): 291–4. doi:10.1177/104990910502200411. PMID 16082916. S2CID 39647898.
- ^ Fine PG (2004). "Opioid insights:opioid-induced hyperalgesia and opioid rotation". Journal of Pain & Palliative Care Pharmacotherapy. 18 (3): 75–9. doi:10.1080/J354v18n03_08. PMID 15364634. S2CID 45555785.
- ^ Lee M, Silverman SM, Hansen H, Patel VB, Manchikanti L (2011). "A comprehensive review of opioid-induced hyperalgesia". Pain Physician. 14 (2): 145–61. doi:10.36076/ppj.2011/14/145. PMID 21412369.
- ^ Tompkins DA, Campbell CM (April 2011). "Opioid-induced hyperalgesia: clinically relevant or extraneous research phenomenon?". Current Pain and Headache Reports. 15 (2): 129–36. doi:10.1007/s11916-010-0171-1. PMC 3165032. PMID 21225380.
- ^ Díaz JL, Zamanillo D, Corbera J, Baeyens JM, Maldonado R, Pericàs MA, et al. (September 2009). "Selective sigma-1 (sigma1) receptor antagonists: emerging target for the treatment of neuropathic pain". Central Nervous System Agents in Medicinal Chemistry. 9 (3): 172–83. doi:10.2174/1871524910909030172. PMID 20021351.
- ^ Mitra S (2018). "Opioid-induced hyperalgesia: pathophysiology and clinical implications". Journal of Opioid Management. 4 (3): 123–30. doi:10.5055/jom.2008.0017. PMID 18717507.
- ^ Baron R (2009). "Neuropathic Pain: A Clinical Perspective". Sensory Nerves. Handbook of Experimental Pharmacology. Vol. 194. pp. 3–30. doi:10.1007/978-3-540-79090-7_1. ISBN 978-3-540-79089-1. PMID 19655103.
- ^ Candiotti KA, Gitlin MC (July 2010). "Review of the effect of opioid-related side effects on the undertreatment of moderate to severe chronic non-cancer pain: tapentadol, a step toward a solution?". Current Medical Research and Opinion. 26 (7): 1677–84. doi:10.1185/03007995.2010.483941. PMID 20465361. S2CID 9713245.
- ^ a b Bawor M, Bami H, Dennis BB, Plater C, Worster A, Varenbut M, Daiter J, Marsh DC, Steiner M, Anglin R, Coote M, Pare G, Thabane L, Samaan Z (April 2015). "Testosterone suppression in opioid users: a systematic review and meta-analysis". Drug Alcohol Depend. 149: 1–9. doi:10.1016/j.drugalcdep.2015.01.038. PMID 25702934.
- ^ a b Fountas A, Chai ST, Kourkouti C, Karavitaki N (October 2018). "MECHANISMS OF ENDOCRINOLOGY: Endocrinology of opioids". European Journal of Endocrinology. 179 (4): R183–R196. doi:10.1530/EJE-18-0270. PMID 30299887.
- ^ Brennan MJ (March 2013). "The effect of opioid therapy on endocrine function". The American Journal of Medicine. 126 (3 Suppl 1): S12-8. doi:10.1016/j.amjmed.2012.12.001. PMID 23414717.
- ^ Colameco S, Coren JS (January 2009). "Opioid-induced endocrinopathy". The Journal of the American Osteopathic Association. 109 (1): 20–5. PMID 19193821.
- ^ Smith HS, Elliott JA (July 2012). "Opioid-induced androgen deficiency (OPIAD)". Pain Physician. 15 (3 Suppl): ES145-56. PMID 22786453.
- ^ Brede E, Mayer TG, Gatchel RJ (February 2012). "Prediction of failure to retain work 1 year after interdisciplinary functional restoration in occupational injuries". Archives of Physical Medicine and Rehabilitation. 93 (2): 268–74. doi:10.1016/j.apmr.2011.08.029. PMID 22289236.
- ^ Volinn E, Fargo JD, Fine PG (April 2009). "Opioid therapy for nonspecific low back pain and the outcome of chronic work loss". Pain. 142 (3): 194–201. doi:10.1016/j.pain.2008.12.017. PMID 19181448.
- ^ a b c American College of Occupational and Environmental Medicine (February 2014), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American College of Occupational and Environmental Medicine, retrieved 24 February 2014American College of Occupational and Environmental Medicine (February 2014), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American College of Occupational and Environmental Medicine, retrieved 24 February 2014다음을 인용합니다.
- Weiss MS, Bowden K, Branco F, et al. (2011). "Opioids Guideline". In Hegmann KT (ed.). Occupational medicine practice guidelines : evaluation and management of common health problems and functional recovery in workers (online March 2014) (3rd ed.). Elk Grove Village, IL: American College of Occupational and Environmental Medicine. p. 11. ISBN 978-0615452272.
- ^ Cherubino P, Sarzi-Puttini P, Zuccaro SM, Labianca R (February 2012). "The management of chronic pain in important patient subgroups". Clinical Drug Investigation. 32 (Suppl 1): 35–44. doi:10.2165/11630060-000000000-00000. PMID 23389874. S2CID 47576095.
- ^ White KT, Dillingham TR, González-Fernández M, Rothfield L (December 2009). "Opiates for chronic nonmalignant pain syndromes: can appropriate candidates be identified for outpatient clinic management?". American Journal of Physical Medicine & Rehabilitation. 88 (12): 995–1001. doi:10.1097/PHM.0b013e3181bc006e. PMID 19789432. S2CID 43241757.
- ^ Kaye AM, Kaye AD, Lofton EC (2013). "Basic concepts in opioid prescribing and current concepts of opioid-mediated effects on driving". The Ochsner Journal. 13 (4): 525–32. PMC 3865831. PMID 24358001.
- ^ Orriols L, Delorme B, Gadegbeku B, Tricotel A, Contrand B, Laumon B, et al. (November 2010). Pirmohamed M (ed.). "Prescription medicines and the risk of road traffic crashes: a French registry-based study". PLOS Medicine. 7 (11): e1000366. doi:10.1371/journal.pmed.1000366. PMC 2981588. PMID 21125020.
- ^ Miller M, Stürmer T, Azrael D, Levin R, Solomon DH (March 2011). "Opioid analgesics and the risk of fractures in older adults with arthritis". Journal of the American Geriatrics Society. 59 (3): 430–8. doi:10.1111/j.1532-5415.2011.03318.x. PMC 3371661. PMID 21391934.
- ^ Allegri N, Mennuni S, Rulli E, Vanacore N, Corli O, Floriani I, et al. (March 2019). "Systematic Review and Meta-Analysis on Neuropsychological Effects of Long-Term Use of Opioids in Patients With Chronic Noncancer Pain". Pain Practice. 19 (3): 328–343. doi:10.1111/papr.12741. PMID 30354006. S2CID 53023743.
- ^ a b c Gudin JA, Mogali S, Jones JD, Comer SD (July 2013). "Risks, management, and monitoring of combination opioid, benzodiazepines, and/or alcohol use". Postgraduate Medicine. 125 (4): 115–30. doi:10.3810/pgm.2013.07.2684. PMC 4057040. PMID 23933900.
- ^ Islam MM, Wollersheim D (2019). "A comparison of opioids and benzodiazepines dispensing in Australia". PLOS ONE. 14 (8): e0221438. Bibcode:2019PLoSO..1421438I. doi:10.1371/journal.pone.0221438. PMC 6699700. PMID 31425552.
- ^ Islam MM, Wollersheim D (2020). "Trends and Variations in Concurrent Dispensing of Prescription Opioids and Benzodiazepines in Australia: A Retrospective Analysis". Contemporary Drug Problems. 47 (2): 136–148. doi:10.1177/0091450920919443. S2CID 218780209.
- ^ Stuth EA, Stucke AG, Zuperku EJ (2012). "Effects of anesthetics, sedatives, and opioids on ventilatory control". Comprehensive Physiology. 2 (4): 2281–2367. doi:10.1002/cphy.c100061. ISBN 9780470650714. PMID 23720250.
- ^ Gowing L, Ali R, White JM (May 2017). "Opioid antagonists with minimal sedation for opioid withdrawal". The Cochrane Database of Systematic Reviews. 2017 (5): CD002021. doi:10.1002/14651858.CD002021.pub4. PMC 6481395. PMID 28553701.
- ^ Bolton, Monica; Hodkinson, Alex; Boda, Shivani; Mould, Alan; Panagioti, Maria; Rhodes, Sarah; Riste, Lisa; van Marwijk, Harm (15 January 2019). "Serious adverse events reported in placebo randomised controlled trials of oral naltrexone: a systematic review and meta-analysis". BMC Medicine. 17 (1): 10. doi:10.1186/s12916-018-1242-0. ISSN 1741-7015. PMC 6332608. PMID 30642329.
- ^ Greene, Jennifer Anne; Deveau, Brent J.; Dol, Justine S.; Butler, Michael B. (April 2019). "Incidence of mortality due to rebound toxicity after 'treat and release' practices in prehospital opioid overdose care: a systematic review". Emergency Medicine Journal. 36 (4): 219–224. doi:10.1136/emermed-2018-207534. ISSN 1472-0213. PMID 30580317.
- ^ Miller RD (2010). Miller's Anesthesia (7th ed.). Elsevier Health Sciences. ISBN 978-0-443-06959-8.
- ^ Morgan GE, Mikhail MS, Murray MJ (2006). Clinical Anesthesiology (4th ed.). McGraw Hill. ISBN 978-0-07-110515-6.
- ^ Chestnut DH, Wong CA, Tsen LC, Kee WD, Beilin Y, Mhyre J (2014). Chestnut's Obstetric Anesthesia: Principles and Practice. Elsevier Health Sciences. p. 468. ISBN 9780323113748.
The lipid solubility of hydromorphone lies between morphine and fentanyl, but is closer to that of morphine.
- ^ Musazzi UM, Matera C, Dallanoce C, Vacondio F, De Amici M, Vistoli G, et al. (July 2015). "On the selection of an opioid for local skin analgesia: Structure-skin permeability relationships". International Journal of Pharmaceutics. 489 (1–2): 177–85. doi:10.1016/j.ijpharm.2015.04.071. PMID 25934430.
- ^ Le Naour M, Lunzer MM, Powers MD, Kalyuzhny AE, Benneyworth MA, Thomas MJ, Portoghese PS (August 2014). "Putative kappa opioid heteromers as targets for developing analgesics free of adverse effects". Journal of Medicinal Chemistry. 57 (15): 6383–92. doi:10.1021/jm500159d. PMC 4136663. PMID 24978316.
- ^ DeWire SM, Yamashita DS, Rominger DH, Liu G, Cowan CL, Graczyk TM, et al. (March 2013). "A G protein-biased ligand at the μ-opioid receptor is potently analgesic with reduced gastrointestinal and respiratory dysfunction compared with morphine". The Journal of Pharmacology and Experimental Therapeutics. 344 (3): 708–17. doi:10.1124/jpet.112.201616. PMID 23300227. S2CID 8785003.
- ^ a b c Takayama H, Ishikawa H, Kurihara M, Kitajima M, Aimi N, Ponglux D, et al. (April 2002). "Studies on the synthesis and opioid agonistic activities of mitragynine-related indole alkaloids: discovery of opioid agonists structurally different from other opioid ligands". Journal of Medicinal Chemistry. 45 (9): 1949–56. doi:10.1021/jm010576e. PMID 11960505.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an Raynor K, Kong H, Chen Y, Yasuda K, Yu L, Bell GI, Reisine T (February 1994). "Pharmacological characterization of the cloned kappa-, delta-, and mu-opioid receptors". Molecular Pharmacology. 45 (2): 330–4. PMID 8114680.
- ^ a b c d e f g Filizola M, Villar HO, Loew GH (January 2001). "Molecular determinants of non-specific recognition of delta, mu, and kappa opioid receptors". Bioorganic & Medicinal Chemistry. 9 (1): 69–76. doi:10.1016/S0968-0896(00)00223-6. PMID 11197347.
- ^ a b c d e f g h Tam SW (February 1985). "(+)-[3H]SKF 10,047, (+)-[3H]ethylketocyclazocine, mu, kappa, delta and phencyclidine binding sites in guinea pig brain membranes". European Journal of Pharmacology. 109 (1): 33–41. doi:10.1016/0014-2999(85)90536-9. PMID 2986989.
- ^ a b c d e f g h i Corbett AD, Paterson SJ, Kosterlitz HW (1993). "Selectivity of Ligands for Opioid Receptors". Opioids. Handbook of Experimental Pharmacology. Vol. 104 / 1. pp. 645–679. doi:10.1007/978-3-642-77460-7_26. ISBN 978-3-642-77462-1. ISSN 0171-2004.
- ^ a b c d e f g h i j k l m n o p q r s Codd EE, Shank RP, Schupsky JJ, Raffa RB (September 1995). "Serotonin and norepinephrine uptake inhibiting activity of centrally acting analgesics: structural determinants and role in antinociception". The Journal of Pharmacology and Experimental Therapeutics. 274 (3): 1263–70. PMID 7562497.
- ^ Frink MC, Hennies HH, Englberger W, Haurand M, Wilffert B (November 1996). "Influence of tramadol on neurotransmitter systems of the rat brain". Arzneimittel-Forschung. 46 (11): 1029–36. PMID 8955860.
- ^ Potschka H, Friderichs E, Löscher W (September 2000). "Anticonvulsant and proconvulsant effects of tramadol, its enantiomers and its M1 metabolite in the rat kindling model of epilepsy". British Journal of Pharmacology. 131 (2): 203–12. doi:10.1038/sj.bjp.0703562. PMC 1572317. PMID 10991912.
- ^ Katsumata S, Minami M, Nakagawa T, Iwamura T, Satoh M (November 1995). "Pharmacological study of dihydroetorphine in cloned mu-, delta- and kappa-opioid receptors". European Journal of Pharmacology. 291 (3): 367–73. doi:10.1016/0922-4106(95)90078-0. PMID 8719422.
- ^ Bart G, Schluger JH, Borg L, Ho A, Bidlack JM, Kreek MJ (December 2005). "Nalmefene induced elevation in serum prolactin in normal human volunteers: partial kappa opioid agonist activity?". Neuropsychopharmacology. 30 (12): 2254–62. doi:10.1038/sj.npp.1300811. PMID 15988468.
- ^ Wentland MP, Lou R, Lu Q, Bu Y, VanAlstine MA, Cohen DJ, Bidlack JM (January 2009). "Syntheses and opioid receptor binding properties of carboxamido-substituted opioids". Bioorganic & Medicinal Chemistry Letters. 19 (1): 203–8. doi:10.1016/j.bmcl.2008.10.134. PMID 19027293.
- ^ a b Gharagozlou P, Demirci H, David Clark J, Lameh J (January 2003). "Activity of opioid ligands in cells expressing cloned mu opioid receptors". BMC Pharmacology. 3: 1. doi:10.1186/1471-2210-3-1. PMC 140036. PMID 12513698.Gharagozlou P, Demirci H, Clark JD, Lameh J (November 2002). "Activation profiles of opioid ligands in HEK cells expressing delta opioid receptors". BMC Neuroscience. 3: 19. doi:10.1186/1471-2202-3-19. PMC 137588. PMID 12437765.Gharagozlou P, Hashemi E, DeLorey TM, Clark JD, Lameh J (January 2006). "Pharmacological profiles of opioid ligands at kappa opioid receptors". BMC Pharmacology. 6: 3. doi:10.1186/1471-2210-6-3. PMC 1403760. PMID 16433932.
- ^ Roth BL, Baner K, Westkaemper R, Siebert D, Rice KC, Steinberg S, et al. (September 2002). "Salvinorin A: a potent naturally occurring nonnitrogenous kappa opioid selective agonist". Proceedings of the National Academy of Sciences of the United States of America. 99 (18): 11934–9. Bibcode:2002PNAS...9911934R. doi:10.1073/pnas.182234399. PMC 129372. PMID 12192085.
- ^ Wentland MP, Lou R, Lu Q, Bu Y, Denhardt C, Jin J, et al. (April 2009). "Syntheses of novel high affinity ligands for opioid receptors". Bioorganic & Medicinal Chemistry Letters. 19 (8): 2289–94. doi:10.1016/j.bmcl.2009.02.078. PMC 2791460. PMID 19282177.
- ^ Gassaway MM, Rives ML, Kruegel AC, Javitch JA, Sames D (July 2014). "The atypical antidepressant and neurorestorative agent tianeptine is a μ-opioid receptor agonist". Translational Psychiatry. 4 (7): e411. doi:10.1038/tp.2014.30. PMC 4119213. PMID 25026323.
- ^ "Annual prevalence of use of drugs, by region and globally, 2016". World Drug Report 2018. United Nations Office on Drugs and Crime. 2018. Retrieved 7 July 2018.
- ^ Volkow ND. "America's Addiction to Opioids: Heroin and Prescription Drug Abuse". DrugAbuse.GOV. National Institute on Drug Abuse. Retrieved 30 April 2017.
- ^ "Narcotic Drugs Stupéfiants Estupefacientes" (PDF). INTERNATIONAL NARCOTICS CONTROL BOARD. 2012. Retrieved 6 March 2017.
- ^ "Opioid Consumption Data Pain & Policy Studies Group". Painpolicy.wisc.edu. Archived from the original on 30 January 2019. Retrieved 7 January 2016.
- ^ Dell CA, Roberts G, Kilty J, Taylor K, Daschuk M, Hopkins C, Dell D (2012). "Researching Prescription Drug Misuse among First Nations in Canada: Starting from a Health Promotion Framework". Substance Abuse. 6: 23–31. doi:10.4137/SART.S9247. PMC 3411531. PMID 22879752.
- ^ "Socially disadvantaged Ontarians being prescribed opioids on an ongoing basis and at doses that far exceed Canadian guidelines". Ices.on.ca. 25 January 2011. Archived from the original on 12 November 2019. Retrieved 7 January 2016.
- ^ a b "Avoiding Abuse, Achieving a Balance: Tackling the Opioid Public Health Crisis" (PDF). College of Physicians and Surgeons of Ontario. 8 September 2010. Archived from the original (PDF) on 7 June 2016. Retrieved 6 March 2017.
- ^ Backhaus I, Mannocci A, La Torre G (2019). "A Systematic Review of Economic Evaluation Studies of Drug-Based Non-Malignant Chronic Pain Treatment". Current Pharmaceutical Biotechnology. 20 (11): 910–919. doi:10.2174/1389201020666190717095443. PMID 31322067. S2CID 197664630.
- ^ Mojtabai R (May 2018). "National trends in long-term use of prescription opioids". Pharmacoepidemiology and Drug Safety. 27 (5): 526–534. doi:10.1002/pds.4278. PMID 28879660. S2CID 19047621.
- ^ Manglik A, Kruse AC, Kobilka TS, Thian FS, Mathiesen JM, Sunahara RK, et al. (March 2012). "Crystal structure of the µ-opioid receptor bound to a morphinan antagonist". Nature. 485 (7398): 321–6. Bibcode:2012Natur.485..321M. doi:10.1038/nature10954. PMC 3523197. PMID 22437502.
Opium is one of the world's oldest drugs, and its derivatives morphine and codeine are among the most used clinical drugs to relieve severe pain.
- ^ Colledge S, Conolly J (10 August 2007). The Origins and Spread of Domestic Plants in Southwest Asia and Europe. Walnut Creek, CA: Left Coast Press. pp. 179–181. ISBN 978-1598749885. Retrieved 28 August 2018.
- ^ Kunzig R, Tzar J (1 November 2002). "La Marmotta". Discover. Retrieved 28 August 2018.
- ^ Chevalier A, Marinova E, Pena-Chocarro L (1 April 2014). Plants and People: Choices and Diversity through Time. Oxbow Books. pp. 97–99. ISBN 978-1842175149. Retrieved 28 August 2018.
- ^ Kritikos PG, Papadaki SP (1967). "The history of the poppy and of opium and their expansion in antiquity in the eastern Mediterranean area". Bulletin on Narcotics. XIX (4). Retrieved 23 August 2018.
- ^ Sonnedecker G (1962). "Emergence of the Concept of Opiate Addiction". Journal Mondial de Pharmacie. 3: 275–290.
- ^ a b c d e f Brownstein MJ (June 1993). "A brief history of opiates, opioid peptides, and opioid receptors". Proceedings of the National Academy of Sciences of the United States of America. 90 (12): 5391–3. Bibcode:1993PNAS...90.5391B. doi:10.1073/pnas.90.12.5391. PMC 46725. PMID 8390660.
- ^ a b c d Duarte DF (February 2005). "Uma breve história do ópio e dos opióides" (PDF). Revista Brasileira de Anestesiologia. 55 (1). doi:10.1590/S0034-70942005000100015.
- ^ Rosso AM (2010). "Poppy and Opium in Ancient Times: Remedy or Narcotic?". Biomedicine International. 1: 81–87. CiteSeerX 10.1.1.846.221.
- ^ Astyrakaki E, Papaioannou A, Askitopoulou H (January 2010). "References to anesthesia, pain, and analgesia in the Hippocratic Collection". Anesthesia and Analgesia. 110 (1): 188–94. doi:10.1213/ane.0b013e3181b188c2. PMID 19861359. S2CID 25919738.
- ^ Türe H, Türe U, Gögüs FY, Valavanis A, Yasargil MG (September 2006). "987 The Art of Alleviating Pain in Greek Mythology". European Journal of Pain (Abstracts of Pain in Europe V 5th Congress of the European Federation of IASP Chapters (EFIC)). 10 (S1): S255b–S255. doi:10.1016/S1090-3801(06)60990-7. S2CID 26539333.
Sedare dolorem opus divinum est – an old Latin inscription – means "alleviating pain is the work of the divine". This inscription is often attributed to either Hippocrates of Kos or Galen of Pergamum, but it is most likely an anonymous proverb
- ^ Osbaldeston TA (2000). Dioscorides (translation). Johannesburg, South Africa: Ibidis Press. pp. 607–611. ISBN 978-0-620-23435-1.
- ^ Heydari M, Hashempur MH, Zargaran A (2013). "Medicinal aspects of opium as described in Avicenna's Canon of Medicine". Acta medico-historica Adriatica. 11 (1): 101–12. PMID 23883087.
- ^ a b c Asthana SN (1954). "The Cultivation of the Opium Poppy in India". Bulletin on Narcotics (3). Retrieved 5 September 2018.
- ^ a b c Sigerist HE (1941). "Laudanum in the Works of Paracelsus" (PDF). Bull. Hist. Med. 9: 530–544. Retrieved 5 September 2018.
- ^ a b c d e Hamilton GR, Baskett TF (April 2000). "In the arms of Morpheus the development of morphine for postoperative pain relief". Canadian Journal of Anaesthesia. 47 (4): 367–74. doi:10.1007/BF03020955. PMID 10764185.
- ^ a b Farooqui A (December 2016). "The Global Career of Indian Opium and Local Destinies" (PDF). Almanack (14): 52–73. doi:10.1590/2236-463320161404. Retrieved 5 September 2018.
- ^ a b Deming S (2011). "The Economic Importance of Indian Opium and Trade with China on Britain's Economy, 1843–1890". Economic Working Papers. 25 (Spring). Archived from the original (PDF) on 12 November 2020. Retrieved 5 September 2018.
- ^ a b c d e f g h i j k Rinde M (2018). "Opioids' Devastating Return". Distillations. 4 (2): 12–23. Retrieved 23 August 2018.
- ^ Mills JH (2016). Review of 'Opium and Empire in Southeast Asia: Regulating Consumption in British Burma'. doi:10.14296/RiH/2014/2010. ISBN 9780230296466. Retrieved 5 September 2018.
{{cite book}}:journal=무시됨(도움말) - ^ Krishnamurti C, Rao SC (November 2016). "The isolation of morphine by Serturner". Indian Journal of Anaesthesia. 60 (11): 861–862. doi:10.4103/0019-5049.193696. PMC 5125194. PMID 27942064.
- ^ Courtwright DT (2009). Forces of habit drugs and the making of the modern world (1 ed.). Cambridge, Mass.: Harvard University Press. pp. 36–37. ISBN 9780674029903.
- ^ Atanasov AG, Waltenberger B, Pferschy-Wenzig EM, Linder T, Wawrosch C, Uhrin P, et al. (December 2015). "Discovery and resupply of pharmacologically active plant-derived natural products: A review". Biotechnology Advances. 33 (8): 1582–1614. doi:10.1016/j.biotechadv.2015.08.001. PMC 4748402. PMID 26281720.
- ^ Kotwal A (March 2005). "Innovation, diffusion and safety of a medical technology: a review of the literature on injection practices". Social Science & Medicine. 60 (5): 1133–47. doi:10.1016/j.socscimed.2004.06.044. PMID 15589680.
- ^ Mosher CJ (2013). Drugs and Drug Policy: The Control of Consciousness Alteration. SAGE Publications. p. 123. ISBN 9781483321882.
- ^ Fisher GL (2009). Encyclopedia of substance abuse prevention, treatment, & recovery. Los Angeles: SAGE. p. 564. ISBN 9781452266015.
- ^ a b Trickey E (4 January 2018). "Inside the Story of America's 19th-Century Opiate Addiction". Smithsonian. Retrieved 6 September 2018.
- ^ Schechter NL (1993). Pain in Infants, Children, and Adolescents. Williams & Wilkins. ISBN 9780683075885. Retrieved 6 September 2018.
- ^ Hicks RD (2011). "Frontline Pharmacies". Chemical Heritage Magazine. Chemical Heritage Foundation. Retrieved 29 October 2018.
- ^ a b Booth M (12 June 1999). Opium : a history (1st U.S. ed.). St. Martin's Press. ISBN 978-0312206673.
- ^ Wisniak J (March 2013). "Pierre-Jean Robiquet". Educación Química. 24: 139–149. doi:10.1016/S0187-893X(13)72507-2.
- ^ Filan K (2011). The power of the poppy : harnessing nature's most dangerous plant ally. Park Street Press. p. 69. ISBN 9781594773990. Retrieved 30 October 2018.
- ^ "Felix Hoffmann". Science History Institute. June 2016. Retrieved 21 March 2018.
- ^ Cooper R, Deakin JJ (22 February 2016). Botanical miracles : chemistry of plants that changed the world. CRC Press. p. 137. ISBN 9781498704281.
- ^ Sneader W (November 1998). "The discovery of heroin" (PDF). Lancet. 352 (9141): 1697–9. doi:10.1016/S0140-6736(98)07115-3. PMID 9853457. S2CID 1819676.
Bayer registered the name heroin in June, 1898.
- ^ a b c d e Newton DE (2016). Youth substance abuse : a reference handbook. Santa Barbara, CA: ABC-CLIO. pp. 41–60. ISBN 9781440839832. Retrieved 30 October 2018.
- ^ Crow JM (3 January 2017). "Addicted to the cure". Chemistry World. Retrieved 30 October 2018.
- ^ Methadone Matters: Evolving Community Methadone Treatment of Opiate Addiction. CRC Press. 2003. p. 13. ISBN 9780203633090. Archived from the original on 23 December 2015.
- ^ "Fact Sheet: Fentanyl and Synthetic Opioids" (PDF). Drug Policy Alliance. September 2016. Archived from the original (PDF) on 29 August 2020. Retrieved 30 October 2018.
- ^ "Laws Learn about the laws concerning opioids from the 1800s until today". The National Alliance of Advocates for Buprenorphine Treatment. Retrieved 30 October 2018.
- ^ White WL. "The Early Criminalization of Narcotic Addiction" (PDF). William White Papers. Archived from the original (PDF) on 26 October 2020. Retrieved 30 October 2018.
- ^ Mars S (2003). "Peer pressure and imposed consensus: the making of the 1984 Guidelines of Good Clinical Practice in the Treatment of Drug Misuse". Clio Medica. 75 (2): 149–83. doi:10.1163/9789004333109_009. ISBN 9789004333109. PMID 16212730.
- ^ a b Jacobs H (26 May 2016). "This one-paragraph letter may have launched the opioid epidemic". Business Insider. Retrieved 30 October 2018.
- ^ Portenoy RK, Foley KM (May 1986). "Chronic use of opioid analgesics in non-malignant pain: report of 38 cases". Pain. 25 (2): 171–86. doi:10.1016/0304-3959(86)90091-6. PMID 2873550. S2CID 23959703.
- ^ a b c Meldrum ML (August 2016). "The Ongoing Opioid Prescription Epidemic: Historical Context". American Journal of Public Health. 106 (8): 1365–6. doi:10.2105/AJPH.2016.303297. PMC 4940677. PMID 27400351.
- ^ Quinones S (2015). Dreamland : the true tale of America's opiate epidemic. Bloomsbury Press. ISBN 9781620402511.
- ^ Dowell D, Haegerich TM, Chou R (March 2016). "CDC Guideline for Prescribing Opioids for Chronic Pain - United States, 2016". MMWR. Recommendations and Reports. 65 (1): 1–49. doi:10.15585/mmwr.rr6501e1. PMID 26987082.
- ^ FDA, 2019년 4월 25일 PM FDA, 2019년 5월 10일 회수, 가정에서 사용되지 않는 오피오이드 통증 의약품의 안전한 제거를 장려하기 위한 공공 교육 캠페인 시작
- ^ "opioid: definition of opioid in Oxford dictionary (American English) (US)". www.oxforddictionaries.com. Archived from the original on 27 June 2014. Retrieved 14 February 2016.
Opioid: 1950s: from opium + -oid.
- ^ Wikler A, Martin WR, Pescor FT, Eades CG (October 1963). "Factors regulating oral consumption of an opioid (Etonitazene) by morphine-addicted rats". Psychopharmacologia. 5: 55–76. doi:10.1007/bf00405575. PMID 14082382. S2CID 38073529.
In this paper, the term, 'opioid', is used in the sense originally proposed by DR. GEORGE H. ACHESON (personal communication) to refer to any chemical compound with morphine-like activities.
- ^ Martin WR (December 1967). "Opioid antagonists". Pharmacological Reviews. 19 (4): 463–521. PMID 4867058.
- ^ Mehdi B (2008). "Opioid analgesics and antagonists". In Seth SD, Seth V (eds.). Textbook of Pharmacology. Elsevier India. p. III.137. ISBN 9788131211588.
- ^ "Epidemic: Responding to America's Prescription Drug Abuse Crisis" (PDF). The White House. 2011. Archived from the original (PDF) on 3 March 2012.
- ^ "First Do No Harm: Responding to Canada's Prescription Drug Crisis" (PDF). March 2013. Retrieved 8 March 2017.
- ^ "UK: Task Force offers ideas for opioid addiction solutions". Delhidailynews.com. 11 June 2014. Archived from the original on 6 June 2017. Retrieved 7 January 2016.
- ^ Kite A (29 April 2018). "Every state but Missouri has opioid drug tracking. Why are senators against it?". The Kansas City Star. Retrieved 5 November 2018.
- ^ Rutkow L, Turner L, Lucas E, Hwang C, Alexander GC (March 2015). "Most primary care physicians are aware of prescription drug monitoring programs, but many find the data difficult to access". Health Affairs. 34 (3): 484–92. doi:10.1377/hlthaff.2014.1085. PMID 25732500.
- ^ Perrone M (20 December 2015). "Painkiller politics: Effort to curb prescribing under fire". Philly.com. Associated Press. Retrieved 7 January 2016.
- ^ Von Korff M, Dublin S, Walker RL, Parchman M, Shortreed SM, Hansen RN, Saunders K (January 2016). "The Impact of Opioid Risk Reduction Initiatives on High-Dose Opioid Prescribing for Patients on Chronic Opioid Therapy". The Journal of Pain. 17 (1): 101–10. doi:10.1016/j.jpain.2015.10.002. PMC 4698093. PMID 26476264.
- ^ Achenbach J, Wagner J, Bernstein L. "Trump says opioid crisis is a national emergency, pledges more money and attention". Washington Post. Retrieved 11 August 2017.
- ^ "Feasibility Study on Opium Licensing in Afghanistan for the Production of Morphine and Other Essential Medicines". ICoS. September 2005.
- ^ "Assuring Availability of Opioid Analgesics" (PDF). World Health Organization. Archived from the original (PDF) on 1 December 2009.
- ^ Ghelardini C, Di Cesare Mannelli L, Bianchi E (2015). "The pharmacological basis of opioids". Clinical Cases in Mineral and Bone Metabolism. 12 (3): 219–21. doi:10.11138/ccmbm/2015.12.3.219. PMC 4708964. PMID 26811699.
The opioid effects transcending analgesia include sedation, respiratory depression, constipation and a strong sense of euphoria.
- ^ Barrett SP, Meisner JR, Stewart SH (November 2008). "What constitutes prescription drug misuse? Problems and pitfalls of current conceptualizations" (PDF). Current Drug Abuse Reviews. 1 (3): 255–62. doi:10.2174/1874473710801030255. PMID 19630724. Archived from the original (PDF) on 15 June 2010.
- ^ McCabe SE, Boyd CJ, Teter CJ (June 2009). "Subtypes of nonmedical prescription drug misuse". Drug and Alcohol Dependence. 102 (1–3): 63–70. doi:10.1016/j.drugalcdep.2009.01.007. PMC 2975029. PMID 19278795.
- ^ "Prescription Opioid Overdose Data Drug Overdose CDC Injury Center". www.cdc.gov. 31 August 2018. Retrieved 17 January 2017.
- ^ "Chronic Pain Management and Opioid Misuse: A Public Health Concern (Position Paper)". American Academy of Family Physicians. Retrieved 9 September 2023.
- ^ "Opioid drug". Science Daily. Retrieved 25 June 2021.
- ^ "Esters of Morphine". United Nations Office on Drugs and Crime. 1953. Retrieved 10 March 2012.
- ^ "Esters of Morphine Opioids". eOpiates. 28 May 2014. Retrieved 12 February 2016.[영구 데드링크]
- ^ Roth, Bryan L.; Baner, Karen; Westkaemper, Richard; Siebert, Daniel; Rice, Kenner C.; Steinberg, SeAnna; Ernsberger, Paul; Rothman, Richard B. (3 September 2002). "Salvinorin A: A potent naturally occurring nonnitrogenous κ opioid selective agonist". Proceedings of the National Academy of Sciences of the United States of America. 99 (18): 11934–11939. Bibcode:2002PNAS...9911934R. doi:10.1073/pnas.182234399. ISSN 0027-8424. PMC 129372. PMID 12192085.
- ^ Raffa RB, Buschmann H, Christoph T, Eichenbaum G, Englberger W, Flores CM, et al. (July 2012). "Mechanistic and functional differentiation of tapentadol and tramadol". Expert Opinion on Pharmacotherapy. 13 (10): 1437–49. doi:10.1517/14656566.2012.696097. PMID 22698264. S2CID 24226747.
- ^ Rojas-Corrales MO, Gibert-Rahola J, Micó JA (1998). "Tramadol induces antidepressant-type effects in mice". Life Sciences. 63 (12): PL175-80. doi:10.1016/S0024-3205(98)00369-5. PMID 9749830.
- ^ Stein C, Schäfer M, Machelska H (August 2003). "Attacking pain at its source: new perspectives on opioids". Nature Medicine. 9 (8): 1003–8. doi:10.1038/nm908. PMID 12894165. S2CID 25453057.
- ^ Stein C, Lang LJ (February 2009). "Peripheral mechanisms of opioid analgesia". Current Opinion in Pharmacology. 9 (1): 3–8. doi:10.1016/j.coph.2008.12.009. PMID 19157985.
- ^ Busch-Dienstfertig M, Stein C (July 2010). "Opioid receptors and opioid peptide-producing leukocytes in inflammatory pain--basic and therapeutic aspects". Brain, Behavior, and Immunity. 24 (5): 683–94. doi:10.1016/j.bbi.2009.10.013. PMID 19879349. S2CID 40205179.
- ^ Odell LR, Skopec J, McCluskey A (March 2008). "Isolation and identification of unique marker compounds from the Tasmanian poppy Papaver somniferum N. Implications for the identification of illicit heroin of Tasmanian origin". Forensic Science International. 175 (2–3): 202–8. doi:10.1016/j.forsciint.2007.07.002. PMID 17765420.
외부 링크
- 오피오이드 금단 증상 2018년 8월 10일 웨이백 머신에서 보관—오피오이드 및 아편 금단 문제에 대한 정보
- 통제물질의 가용성 및 접근성에 대한 세계보건기구 지침
- 만성 통증에 대한 오피오이드 처방 CDC 가이드라인 — 미국, 2016
- 이전 간행물 참조 목록
- 이전 출판물의 모든 언어 버전에 대한 링크
- 비디오: 오피오이드 부작용 (Vimeo) (유튜브)—오피오이드 부작용의 실질적인 관리에 관한 짧은 교육 영화