플루오르화 크로밀
Chromyl fluoride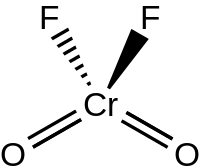 | |
| 이름 | |
|---|---|
| IUPAC 이름 디플루오로(다이옥소)크롬 | |
| 기타 이름 크롬 플루오르화, 이산화 크롬 디플루오르화 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
| |
| |
| 특성. | |
| CRF2O2 | |
| 어금질량 | 121.991 g·1911−1 |
| 외관 | 보랏빛 결정체 |
| 녹는점 | 31.6°C(88.9°F, 304.8K) |
| 비등점 | 30°C(86°F; 303K)[1] 하위 시간 |
| 구조 | |
| 단색의 | |
| 14번 P21/c | |
| C2v | |
공식 단위(Z) | 4 |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 산화제 |
| 관련 화합물 | |
관련 화합물 | 염화 크롬 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
크로밀 플루오르화물은 CROF라는22 공식을 가진 무기 화합물이다.그것은 보라색 붉은 색의 결정체 고체로, 주황색 붉은 색의 액체로 녹는다.[2]
구조
액체와 기체성 CROF는22 염화 크로밀과 같이 C2v 대칭의 사면 기하학을 가지고 있다.[3]크롬 플루오르화물은 고체 상태의 불소교(OCr2(μ-F)4CrO2)를 통해 조광화되며, Z = 4의 P21/c 우주군에서 결정된다.Cr=O 본드 길이는 약 157pm이며, Cr-F 본드 길이는 181.7, 186.7, 209.4pm이다.크롬은 조정 번호가 6인 왜곡된 팔면 위치에 있다.[4]
역사와 준비
순수 크로밀 플루오르화물은 1952년 알프레드 엥겔브레히트와 아리스티드 폰 그로스가 보고한 바와 같이 처음 격리되었다.[5]19세기 초 플루오르파(CaF2), 염색체, 황산을 혼합하여 가열하면서 붉은 증기로 처음 관측되었다.일부 화학자들은 CROCl과22 유사한 CROF22 구조를 가정했지만, 이 붉은 증기는 처음에는 CRF로6 생각되었다.[5]처음으로 적당히 성공한 크롬 플루오르화합성은 알칼리 크로마이트와 플루오르화 수소 반응을 조사한 프레덴하겐에 의해 보고되었다.이후 폰 바텐베르크(Von Bartenberg)가 염화 크롬을 원소 불소로 처리하여 불순물 CROF를22 준비하는 시도를 보았다.[6]또 다른 시도는 위쳇이 HF를 디크롬산염으로 치료하면서 불순물인 CROF를22 -40℃에서 방출하는 것이었다.
엥겔브레히트와 폰 그로스의 크로오프22 합성, 그리고 대부분의 연속 합성에는 삼산화 크롬을 불소화제로 치료하는 것이 포함된다.[5]
- CrO3 + 2HF → CrOF22 + HO2
물은 쉽게 CrOF를22 다시 CrO로3 가수 분해하기 때문에 반응은 되돌릴 수 있다.
게오르그 브라워가 <준비 무기[1] 화학 지침서>에 발표한 접근법은 바로 불소화라는 폰 바텐베르크의 접근법에[6] 근거했다.
- CrOCl222 + F → CrOF22 + Cl2
다른 방법으로는 염소 플루오르화, 카보닐 플루오르화 또는 일부 금속 육불화물이 있다.
- CrO3 + 2 ClF → CrOF22 + Cl22 + O
- CrO3 + COF2 → CrOF22 + COO2
- CrO3 + MF6 → CrOF22 + MOF4 (M = Mo, W)
텅스텐과 몰리브덴의 불소와 관련된 마지막 방법은 그린과 가드에 의해 순수한 CrOF의22 다량으로 가는 매우 간단하고 효과적인 경로라고 보고되었다.[2]그들은 120 °C에서 반응이 일어났을 때 100% 수율을 보고했다.MoF와6 WF의6 상대적 반응에서 예상한 대로, 몰리브덴 반응은 텅스텐보다 더 쉽게 진행되었다.[7]
반응
크롬 플루오르화물은 탄화수소를 케톤과 카르복실산으로 전환할 수 있는 강한 산화제다.다른 크롬 화합물 준비 시 시약으로도 사용할 수 있다.[2]다른 불소화합물과 마찬가지로 CrOF도22 유리, 석영과 반응하기 때문에 이 화합물을 취급하기 위해서는 실리콘이 없는 플라스틱이나 금속 용기가 필요하다.무기체계의 산화력 또한 탐구되었다.[8]크롬 플루오르화물은 플루오린 원자와 금속 산화물을 교환할 수 있다.
- CROF22 + MO → MF2 + CrO3
크롬 플루오르화물은 또한 붕소와 실리콘의 산화물을 플루오르화물로 변환시킬 것이다.[8]
크롬 플루오르화물은 과불화헥탄(솔벤트)에서 알칼리 및 알칼리성 접지금속 플루오르화물과 반응하여 주황색 플루오로크롬을 생성한다.[8]
- CROF22 + 2 MF → MCrOF224
크롬 플루오르화물은 또한 루이스 산과 반응하여 유기산 무수화물에서 카르복실산화물 리간드를 끌어내고 아킬 플루오르화 부산물을 생성한다.[8]
- CROF22 + 2 (CFCO3)2O → CRO2(CFCOO3)2 + 2 CFCOF3
크롬 플루오르화물은 염기 NO2, NO2, SO가 약한 유도체를 형성한다.
참조
- ^ a b Brauer, Georg (1963) [1960]. "Chromyl Fluoride – CrO
2F
2". Handbook of Preparative Inorganic Chemistry, Volume 1 (2nd ed.). Stuttgart; New York: Ferdinand Enke Verlag; Academic Press, Inc. pp. 258–259. ISBN 978-0-32316127-5. - ^ a b c 가드, G. L. (1986) "이산화 크롬 디플루오리드 이산화크롬(Chromium Difluoride Iscoto, Chromyl Fluoride)", 이노그. 신스, 24, 67-69, doi:10.1002/9780470132555.ch20.
- ^ 홉스, W. E. (1958) "크롬 플루오르화 및 크롬 염화물의 적외선 흡수 스펙트럼," J. Chem. 물리적 28(6), 1220-1222, doi:10.1063/1.1744372.
- ^ Supew, J.; Abram; Hagenbach; Seppelt, K.(2007) "Tecetium Fluoride Tricoxide, TcOF3, 준비 및 속성"inorg. Chem, 46(14), 5591–5595, doi:10.1021/ic070333y.
- ^ a b c 엥겔브레히트, A.; 폰 그로세, A. (1952) "푸레 크로밀 플루오르화," J. Am. Chem. Soc. 74(21), 5262–5264, doi:10.1021/ja01141a007.
- ^ a b 폰 바텐베르크, H. (1941) "위버 호헤어 크롬플루오라이드(CrF
4, CrF
5 und CrOF
2
2)" [더 높은 크롬 플루오르화물(CrF
4, CrF
5, CrOF
2
2) 정보], Z. 아노그, 알그 Chem. [독일어], 247(1-2), 135–146, doi:10.1002/zaac.19470112. - ^ 그린, P. J.; 가드, G. L. (1977) "크로밀 플루오르화 화학. 5.CROF로22 가는 새로운 준비 경로," Inorg. 화학. 16(5), 1243–1245, doi:10.1021/ic50171a055.
- ^ a b c d 브라운, S.D.; 그린, P.J.; 가드, G.L. (1975) "크로밀 플루오르화이트 III: 무기계와의 반응", J. 플루오린 화학. 5(3), 203-219, doi:10.1016/S0022-1139(00)82482-3.


