비스포네이트의 발견과 개발
Discovery and development of bisphosphonates비스포네이트는 약 반세기 전에 처음 도입된 중요한 약품이다.그것들은 골다공증과 뼈의 연약성과 뼈의 재흡수가 과도한 질병을 일으키는 다른 뼈 질환의 치료에 사용된다.골다공증은 비포스폰산염이 가치 있는 치료제임이 입증되고 파제트병, 골수종, 뼈 전이 및 고칼슘혈증에 성공적으로 사용되는 폐경 후 여성 및 코르티코스테로이드 치료 환자들에게 흔하다.비스포네이트는 골세포를 억제함으로써 뼈의 붕괴를 줄여주고, 오랜 사용 역사를 가지고 있으며, 오늘날 전 세계적으로 몇 가지 다른 종류의 비스포네이트 약물이 시판되고 있다.
검출
비스포네이트는 원래 19세기에 합성되어 비늘 방지 및 부식 방지 특성으로 산업에서 사용되었습니다.1960년대 후반, 뼈의 신진대사와 관련된 질병을 치료할 수 있는 그들의 잠재력이 분명해졌다.비스포스포네이트의 1세대에는 1970년대와 1980년대에 도입된 에티드론산과 클로드론산이 포함되었다.그것들은 [1]클리닉에서 성공적으로 사용된 최초의 비스포네이트 약물이었다.그 후, 그것들은 더욱 강력해지고, 뼈 내부의 분포를 향상시키고, 작용 기간을 연장하기 위한 의도로 더욱 개발되었습니다.이에 따라 시장에 출시된 최신 비스포스포네이트 약인 조레드로네이트를 정맥주사로 [2]연간 1회 투여할 수 있게 됐다.
발전
원래의 비스포스포네이트(1세대)는 단일 원자 또는 알킬 사슬의 작은 그룹이 R과2 R 위치에1 있는 단순 분자였다.그들은 뼈의 흡수를 억제하는 효과가 다소 약했다.아미노기의 포함은 높은 효력을 가진 비스포네이트 2세대의 시작을 알렸다.첫 번째는 파미드로네이트였고, 옆사슬에서 질소의 위치가 더 강력한 약물의 핵심이었던 유사한 유사점이 뒤따랐다.나중에 질소는 반드시 알킬사슬에 연결될 필요가 없으며, 대신 복소환기를 사용할 필요가 있다는 것이 명백해졌다.그런 약들이 개발되어 가장 주목할 만한 것들 중 하나가 조레드로네이트이다.미노드론산은 더욱 강력하여 일본에서 시판되고 있다.그들의 효능은 [3]피코몰 농도에서도 효과가 있다.
추가적인 개발로 인해 동일한 효능의 화합물이 시장에 출시되지는 않았습니다.파미드로네이트의 아릴알킬 치환기는 안정성을 [1]확보하기 위해 위치2 R의 수산기가 생략된 임상적으로 가장 최근에 사용되는 비스포스포네이트 중 하나이다.
이 분야의 최근 연구는 새로운 비스포네이트 약물 치료법을 개발할 수 있는 기회를 열어주었다.
친유성이 높은 비스포네이트가 개발되어 종양 억제제로서의 가능성을 나타내고 있다.이들은 메발론산 경로의 핵심 효소인 파르네실 피로인산합성효소(FPPS)뿐만 아니라 메발론산 경로에 위치한 효소인 게라닐게라닐 피로인산합성효소(GGPS)도 억제하는 약간 다른 메커니즘에 의해 작동한다.그들은 뼈 [4]미네랄에 대해 같은 친화력을 가지고 있지 않다.
이후 GGPS는 트리아졸기가 R 내에2 있고 메틸기가 R 내에1 있는 새로운 비스포네이트 화합물에 의해 성공적으로 억제되었다.이것은 다발성 [5]골수종과 같은 악성 종양에 대한 치료에 유용할 수 있다.
2018년에는 3개의 비스포네이트 단위를 포함하는 덴드라이트 비스포네이트가 도입되었다.비스포네이트와 뼈 미네랄의 높은 친화력을 이용하여 큰 치료 분자의 뼈 특이적 전달 가능성을 보여주었다.
작용 메커니즘
비스포스포네이트(BP)의 작용 메커니즘은 새로운 세대의 약물이 개발됨에 따라 진화해 왔다.1세대 비스포네이트의 기능은 BP를 포함하는 최근의 질소와 다르지만, 두 가지 모두 Ca 이온과 복합체2+ 내에서 약물이 가장 가능성이 높은 막 결합 소포의 내핵증(endocytosis)에 의해 내부화된다.이것은 [3]골세포의 선택적 흡수에 의해 이루어지기 때문에 뼈의 다른 세포와 관련이 없다.
모든 비스포스포네이트 약물에 적용되는 일반적인 기능은 골세포에 의한 뼈의 물리적 재흡수를 방지하기 위한 뼈 미네랄과의 물리화학적 상호작용이다.이는 뼈 재모델링이 가장 활발한 [7][8]부위에 특히 적합합니다.비스포스포네이트는 내인성 피로인산염과 마찬가지로 뼈 미네랄의 칼슘 이온(히드록시아파타이트)에 대한 내적 친화력을 가지고 있다.차이는 비스포스포네이트의 비 가수분해성 탄소-인 결합에 있으며, 비스포스포네이트는 신진대사를 방해함과 동시에 위장관에서 [9]효과적인 흡수를 보장한다.
골아세포에 대한 비스포네이트 1세대의 1차 억제 작용은 아포토시스를 유도하는 것이다.작용 메커니즘은 명백히 ATP 유사체 또는 에티드론산 및 클로드론산과 같은 비스포스포네이트의 대사물 형성에 의해 형성된다.ATP 유사체는 세포독성 [10]효과와 함께 골세포의 세포에 축적된다.
그러나 비스포스포네이트를 포함한 보다 발달된 질소의 주요 작용 메커니즘은 메발론산 경로의 억제를 통한 골아세포에 대한 세포 효과, 특히 이소프레노이드 지질의 후속 형성에 의한 것이다.억제 작용은 파르네실 피로인산합성효소(FPPS)[11]에 의해 촉매되는 경로의 주요 분기점에서 일어난다.이소프레노이드 지질은 Ras 슈퍼패밀리의 Rac, Rho 및 Ras와 같은 작은 GTP 결합 조절 단백질의 번역 후 수정에 필요하다.골세포의 기능은 [12]아포토시스와 같은 다양한 세포 과정을 위해 그것들에 의존한다.
구조 활동 관계
약초
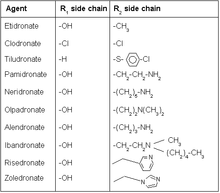
비스포스포네이트는 산소 골격이 탄소로 치환된 내인성 무기 피로인산염(P-O-P의 경우 P-C-P)을 모방한다.카본 백본의 2개의 추가 그룹 또는 사이드 체인은 보통 R과2 R로 불립니다1.R은1 일반적으로 인산기와 함께 삼등분배위자를 형성하여 칼슘에 대한 친화력을 높이는 수산기이다.R 그룹의2 구조를 최적화하여 골격 [13]재흡수를 가장 잘 억제함으로써 화합물을 더욱 강력하게 만들 수 있습니다.
포스폰산염
화학 구조의 포스폰산염기는 표적 효소에 대한 약물의 결합에 중요하다.연구에 따르면 포스폰산기를 제거하거나 카르본산으로 치환하면 약물의 효력이 급격히 떨어지고 효소억제제는 더 이상 이성화 [14]상태가 되지 않는다.
히드록실기1(R측쇄)
비스포스포네이트에 대한 R1 측쇄의 변형은 오늘날 매우 미미하며, 그 위치에서 단일 수산기는 활성 측면에서 가장 좋은 결과를 제공하는 것으로 보인다.히드록실기는 표적 효소에서 글루타민(Gln240)과 물 유도 결합을 형성하는 역할을 한다.처음에 수산기가 없는 약물은 모화합물보다 더 나은 억제를 유발하며, 수산기가 없는 약물은 열린 활성 부위에 더 쉽게 들어맞는 것으로 보인다.그러나 히드록실기의 부재는 표적 효소 복합체를 이성화 상태로 유지하는 능력을 감소시킨다.따라서 히드록실기를 가진 비스포네이트의 생물학적 활성은 오랜 시간에 [14]걸쳐 나타난다.
질소(R2 사이드 체인)
비스포네이트를 함유한 질소는 그 [15]효능 때문에 클래스 내에서 현재 가장 많이 사용되는 약물이다.연구에 따르면 비스포스포네이트의 질소는 표적 효소의 트레오닌(Thr201)과 리신의 카르보닐 부분(Lys200)과 수소 결합을 형성하여 복합체의 결합을 강화한다.질소의 위치를 변경하면 질소 수소 결합의 [14]발생 능력이 크게 달라질 수 있습니다.
| 비스포스포네이트 | 효력(표준) |
|---|---|
| 아렌드로네이트 | 1-5 |
| 리세드로네이트 | 10 |
| 졸레드로네이트(IV) | 50 |
질소함유 사이드 체인(R2 사이드 체인)의 개조
질소2 R 측쇄의 탄소 길이가 증가하면 활성도가 변화합니다.3개의 탄소로 이루어진 사이드 체인은 활성의 측면에서 가장 이상적인 길이인 것으로 입증되었으며, 거기서부터 체인의 길이를 늘리거나 줄이는 것은 생물학적 활동에 부정적인 영향을 미칩니다.예를 [17]들어 일반적인 비스포스포네이트 약물인 알렌드로네이트는 3개의 탄소 길이의 측쇄를 가지고 있다.리세드로네이트는 질소를 포함한 복소환 구조를 가진다.비스포스포네이트를 포함한 복소환 질소는 탄소 사슬에 결합된 질소를 가진 초기 비스포네이트에 비해 활성 면에서 더 나은 결과를 보였다.링에 질소를 다르게 배치한 것과 유사한 리세드로네이트에 대한 연구는 생물학적 활성에 대해 측정 가능한 차이를 보여주지 않았다.고리에 연결된 탄소 사슬의 길이가 증가하여 음성 [18]결과가 나타났습니다.Zoledronate는 오늘날 정맥주사로만 이용 가능한 가장 강력한 비스포네이트 약물이다.비스포스포네이트 약물 중 유일하게 측쇄에 두 개의 질소 그룹이 있으므로 효능과 투여 경로가 같은 [16]등급의 다른 약물과 다르다.
레퍼런스
- ^ a b Widler, Leo; Jaeggi, Knut A.; Glatt, Markus; Müller, Klaus; Bachmann, Rolf; Bisping, Michael; Born, Anne-Ruth; Cortesi, Reto; Guiglia, Gabriela; Jeker, Heidi; Klein, Rémy (2002-08-01). "Highly Potent Geminal Bisphosphonates. From Pamidronate Disodium (Aredia) to Zoledronic Acid (Zometa)". Journal of Medicinal Chemistry. 45 (17): 3721–3738. doi:10.1021/jm020819i. ISSN 0022-2623. PMID 12166945.
- ^ Reid, Ian R.; Brown, Jacques P.; Burckhardt, Peter; Horowitz, Zebulun; Richardson, Peter; Trechsel, Ulrich; Widmer, Albert; Devogelaer, Jean-Pierre; Kaufman, Jean-Marc; Jaeger, Philippe; Body, Jean-Jacques (2002-02-28). "Intravenous Zoledronic Acid in Postmenopausal Women with Low Bone Mineral Density". New England Journal of Medicine. 346 (9): 653–661. doi:10.1056/NEJMoa011807. ISSN 0028-4793.
- ^ a b Thompson, Keith; Rogers, Michael J. (2007-09-01). "The Molecular Mechanisms of Action of Bisphosphonates". Clinical Reviews in Bone and Mineral Metabolism. 5 (3): 130–144. doi:10.1007/s12018-007-9004-0. ISSN 1559-0119.
- ^ US 8012949, Oldfield, Eric; Zhang, Yonghui & In, Fenlin, "FPS, GGPS, DPS를 포함한 여러 표적에 대해 향상된 효력을 가진 비스포네이트 화합물 및 방법", 2011-09-06년 일리노이 대학 이사회에 배정됨
- ^ Matthiesen, Robert A.; Varney, Michelle L.; Xu, Pauline C.; Rier, Alex S.; Wiemer, David F.; Holstein, Sarah A. (January 2018). "α-Methylation enhances the potency of isoprenoid triazole bisphosphonates as geranylgeranyl diphosphate synthase inhibitors". Bioorganic & Medicinal Chemistry. 26 (2): 376–385. doi:10.1016/j.bmc.2017.10.023. PMC 5752576. PMID 29248353.
- ^ Shimoda, Kazuma; Mitsuoka, Takahiro; Ueda, Kenta; Suemune, Hiroshi; Hirai, Go; Aso, Mariko (2018-12-19). "Synthesis of dendritic bisphosphonates as bone targeting ligands". Tetrahedron Letters. 59 (51): 4528–4531. doi:10.1016/j.tetlet.2018.11.028. ISSN 0040-4039.
- ^ Masarachia, P.; Weinreb, M.; Balena, R.; Rodan, G. A. (1996-09-01). "Comparison of the distribution of 3H-alendronate and 3H-Etidronate in rat and mouse bones". Bone. 19 (3): 281–290. doi:10.1016/8756-3282(96)00182-2. ISSN 8756-3282. PMID 8873969.
- ^ Sato, M; Grasser, W; Endo, N; Akins, R; Simmons, H; Thompson, D D; Golub, E; Rodan, G A (1991-12-01). "Bisphosphonate action. Alendronate localization in rat bone and effects on osteoclast ultrastructure". Journal of Clinical Investigation. 88 (6): 2095–2105. doi:10.1172/JCI115539. ISSN 0021-9738. PMC 295810. PMID 1661297.
- ^ Benford, Helena L.; Frith, Julie C.; Auriola, Seppo; Mönkkönen, Jukka; Rogers, Michael J. (1999-07-01). "Farnesol and Geranylgeraniol Prevent Activation of Caspases by Aminobisphosphonates: Biochemical Evidence for Two Distinct Pharmacological Classes of Bisphosphonate Drugs". Molecular Pharmacology. 56 (1): 131–140. doi:10.1124/mol.56.1.131. ISSN 0026-895X. PMID 10385693.
- ^ Selander, K. S.; Mönkkönen, J.; Karhukorpi, E. K.; Härkönen, P.; Hannuniemi, R.; Väänänen, H. K. (1996-11-01). "Characteristics of clodronate-induced apoptosis in osteoclasts and macrophages". Molecular Pharmacology. 50 (5): 1127–1138. ISSN 0026-895X. PMID 8913344.
- ^ Ebetino, Frank H.; Hogan, Anne-Marie L.; Sun, Shuting; Tsoumpra, Maria K.; Duan, Xuchen; Triffitt, James T.; Kwaasi, Aaron A.; Dunford, James E.; Barnett, Bobby L.; Oppermann, Udo; Lundy, Mark W. (2011-07-01). "The relationship between the chemistry and biological activity of the bisphosphonates". Bone. Bisphosphonates. 49 (1): 20–33. doi:10.1016/j.bone.2011.03.774. ISSN 8756-3282. PMID 21497677.
- ^ Coxon, F.P.; Rogers, M.J. (2003-01-01). "The Role of Prenylated Small GTP-Binding Proteins in the Regulation of Osteoclast Function". Calcified Tissue International. 72 (1): 80–84. doi:10.1007/s00223-002-2017-2. ISSN 0171-967X. PMID 12370802.
- ^ Widler, Leo; Jaeggi, Knut A.; Glatt, Markus; Müller, Klaus; Bachmann, Rolf; Bisping, Michael; Born, Anne-Ruth; Cortesi, Reto; Guiglia, Gabriela; Jeker, Heidi; Klein, Rémy (August 2002). "Highly Potent Geminal Bisphosphonates. From Pamidronate Disodium (Aredia) to Zoledronic Acid (Zometa)". Journal of Medicinal Chemistry. 45 (17): 3721–3738. doi:10.1021/jm020819i. ISSN 0022-2623.
- ^ a b c Dunford, James E.; Kwaasi, Aaron A.; Rogers, Michael J.; Barnett, Bobby L.; Ebetino, Frank H.; Russell, R. Graham G.; Oppermann, Udo; Kavanagh, Kathryn L. (April 2008). "Structure–Activity Relationships Among the Nitrogen Containing Bisphosphonates in Clinical Use and Other Analogues: Time-Dependent Inhibition of Human Farnesyl Pyrophosphate Synthase". Journal of Medicinal Chemistry. 51 (7): 2187–2195. doi:10.1021/jm7015733. ISSN 0022-2623. PMID 18327899.
- ^ Dunford, James E.; Kwaasi, Aaron A.; Rogers, Michael J.; Barnett, Bobby L.; Ebetino, Frank H.; Russell, R. Graham G.; Oppermann, Udo; Kavanagh, Kathryn L. (2008-04-01). "Structure–Activity Relationships Among the Nitrogen Containing Bisphosphonates in Clinical Use and Other Analogues: Time-Dependent Inhibition of Human Farnesyl Pyrophosphate Synthase". Journal of Medicinal Chemistry. 51 (7): 2187–2195. doi:10.1021/jm7015733. ISSN 0022-2623. PMID 18327899.
- ^ a b Tripathi, KD (2013), "Chapter-09 Adrenergic System and Drugs", Essentials of Medical Pharmacology, Jaypee Brothers Medical Publishers (P) Ltd., pp. 124–139, doi:10.5005/jp/books/12021_10, ISBN 9789350259375
- ^ Fleisch, Herbert (2002). "Development of bisphosphonates". Breast Cancer Research. 4 (1): 30–34. doi:10.1186/bcr414. ISSN 1465-5411. PMC 138713. PMID 11879557.
- ^ van Beek, E. R.; Löwik, C. W. G. M.; Ebetino, F. H.; Papapoulos, S. E. (1998-11-01). "Binding and antiresorptive properties of heterocycle-containing bisphosphonate analogs: structure-activity relationships". Bone. 23 (5): 437–442. doi:10.1016/S8756-3282(98)00120-3. ISSN 8756-3282. PMID 9823450.