엘리아스 제임스 코리
Elias James CoreyE.J. 코리 | |
|---|---|
 2007년 코리 | |
| 태어난 | 엘리아스 제임스 코리 1928년 7월 12일 ) |
| 모교 | 매사추세츠 공과대학교 |
| 로 알려져 있다. | 역합성분석 |
| 수상 | |
| 과학 경력 | |
| 필드 | 유기 화학 |
| 기관 | 일리노이 대학교 어바나 샴페인 하버드 대학교 |
| 논문 | 페니실린의 N, Diacylamino산 및 아날로그 합성 (1951) |
| 박사학위 자문위원 | 존 C. 쉬한 |
| 저명한 학생 | |
| 웹사이트 | chemistry |
E.J. 코리(Elias James "E.J. Corey, 1928년 7월 12일 출생)는 미국의 유기화학자다. 1990년에 그는 "유기합성의 이론과 방법론의 발전,[3] 특히 역합성 분석"으로 노벨 화학상을 받았다.[4][5] 많은 사람들에게 살아있는 화학자들 중 가장 위대한 것으로 여겨지는 그는 수많은 합성 시약, 방법론, 총합성을 개발했고 유기합성의 과학을 상당히 발전시켰다.
전기
E.J. 코리(이 성은 레바논 아랍어 Khoury에서 유래한 것으로, 성직자는 성직자라는 뜻)는 보스턴에서 북쪽으로 50km(31mi) 떨어진 매사추세츠주 메투엔에서 레바논의 그리스 정교 이민자들 사이에서 태어났다.[6] 그의 어머니는 코레이가 태어난 지 18개월 만에 세상을 떠난 아버지를 기리기 위해 그의 이름을 "엘리아스"로 바꾸었다. 그의 홀어머니, 형, 두 자매, 이모, 삼촌은 모두 대공황을 겪으며 고군분투하며 넓은 집에서 함께 살았다. 어렸을 때 코리는 독립적이고 야구, 축구, 하이킹과 같은 스포츠를 즐겼다. 그는 매사추세츠주 로렌스의 가톨릭 초등학교와 로렌스 고등학교를 다녔다.
16살의 나이에 코리는 MIT에 입학했고, 그곳에서 1948년에 학사 학위를 받았고 존 C 교수 밑에서 박사 학위를 받았다. 1951년 셰한. MIT에 입학하자마자 코레이의 과학 경험은 수학뿐이었고, 그는 공학 학위를 따기 위해 대학 생활을 시작했다. 2학년 때 첫 화학 수업을 받은 후 그는 장기적인 직업 계획에 대해 다시 생각하기 시작했고 화학 학사 학위를 받고 졸업했다. 그 직후, 존 C교수의 초청으로. 시한, 코리는 박사학위를 위해 MIT에 남았다. 졸업 후 그는 일리노이 대학교 어바나 샴페인의 일리노이 대학에서 임용 제의를 받았고, 1956년 27세의 나이로 화학과 전문 교수가 되었다. 1952년 일리노이 대학교의 알파치 시그마 제타 지부의 일원으로 시작되었다.[7] 1959년 하버드 대학교로 옮겨 현재 활동 중인 코리 그룹 연구 프로그램으로 유기화학 명예교수로 재직 중이다. 그는 "그 본질적인 아름다움과 인간의 건강과 큰 관련성" 때문에 유기 화학 분야에서 일하기로 선택했다.[8] 화이저 고문도 50년 넘게 해오고 있다.[9]
수많은 영예 가운데 코레이는 1988년 국가과학훈장,[10] 1990년 노벨화학상,[5] 2004년 미국화학회의 최고 영예인 프리스틀리 메달을 받았다.[11]
주요기부금
시약
코리는 몇 가지 새로운 합성 시약을 개발했다.
- 코리-수그 시약이라고도 불리는 피리디늄 클로로크롬산염(PCC)은 해당 케톤과 알데히드에 알코올을 산화시키는 데 널리 사용된다.[12] PCC는 다른 상업용 산화제보다 몇 가지 장점이 있다.
이러한 장점 중 하나는 이 화합물이 매우 저습하지 않은 공기안정성 황색 고체로 이용 가능하다는 것이다. 다른 산화제와 달리 PCC는 1.5개 정도의 등가물(구성표 1)만으로 단일 산화를 수행할 수 있다. 알코올은 염소를 대체하는 전기 크로미엄(VI) 금속을 대상으로 핵포화성 공격을 수행한다. 염화 음이온은 알데히드 제품과 크롬(IV)을 공급할 수 있는 베이스 역할을 한다. PCC의 약간 산성적인 특성은 알코올과 알케인을 이용한 사이클링 반응에 유용하다([13]Scheme 2)
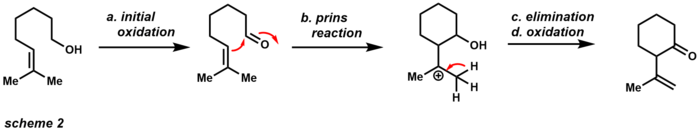
초기 산화는 그에 상응하는 알데히드를 생산하고, 알데히드는 이웃 알켄과 프린 반응을 일으킬 수 있다. 제거와 추가 산화 후 제품은 순환 케톤이다. 이 제품이 원치 않을 경우 아세트산나트륨 분말을 완충제로 사용해 초기 산화만 할 수 있다. 산화제로서의 PCC의 강건성은 총합성의 영역에서도 유용하게 만들었다(Scheme 3) 이 예는 PCC가 [3,3]-시그마틴성 재배열을 통해 3차 알코올로 다우벤 산화재배열을 수행할 수 있음을 보여준다.[14]
- t-Butyldimethylsilyl ether(TBS),[15] triisopropylsilyl ether(TIPS), methoxyethoxymethyl(MEM): 인기 있는 알코올 보호 그룹이다. 이러한 보호 그룹의 개발은 표준 화학적 변환을 견딜 수 있는 기능적 그룹 호환성을 갖지 못한 여러 천연 제품의 합성을 가능하게 했다. 비록 합성 공동체가 현재 보호 집단의 사용에서 멀어지고 있지만, 자연 생산물의 출판된 합성이 그것들을 생략하는 것은 여전히 드문 일이다. 1972년부터 TBS 그룹은 가장 인기 있는 실리콘 보호 그룹이 되었다. TBS는 크로마토그래피에 안정적이며 기초 및 산성 조건에서 갈라질 수 있을 만큼 충분히 분리가 가능하다. 더 중요한 것은 TBS 에테르가 그리나드 시약이나 에놀레이트 같은 일부 탄소 핵물질에 안정적이라는 점이다.[16][17][18]
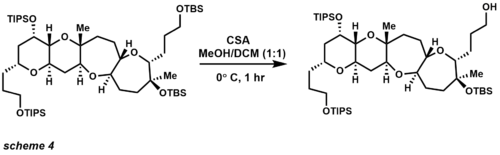
복잡한 분자 합성 분야에서 TBS는 실리콘 기반 보호 그룹 중 가장 다재다능한 그룹(scheme 4) 중 하나로 널리 사용되어 왔다.[19][20] CSA를 사용하면 3차 TBS 에테르와 TIPS 에테르가 있는 곳에서 1차 TBS 에테르를 선택적으로 제거할 수 있다. TBS 제제의 다른 수단으로는 산(Lewis acids)과 불소가 있다. TIPS 보호 그룹도 코리에 의해 개척되었으며 2차 및 3차 알코올 보호에 비해 1차 알코올 보호의 선택성이 향상되었다. TIPS 에테르들은 산성과 기본 조건에서 더 안정적이며, TBS 에테르에 비해 이 보호 집단의 단점은 그 집단이 방제할 가능성이 적다는 것이다.[21] 분할에 사용되는 가장 일반적인 시약은 TBS 에테르와 같은 조건을 사용하지만 일반적으로 긴 반응 시간이 필요하다.
보통 TBS 에테르들은 TBAF에 의해 절단되지만, 위의 방해받은 TBS 에테르들은 1차 TIPS 제거 시 반응 조건(구성표 5)에서 살아남는다.[22] MEM 보호 그룹은 1976년에 코리에 의해 처음 설명되었다.[23] 이 보호 그룹은 산성 조건에서 다른 알코시 메틸 에테르와 반응성과 안정성이 유사하다. MEM 보호 그룹의 절개는 보통 산성 조건에서 이루어지지만, 금속 할로겐화물과 조율은 보조 절개(scheme 6)를 통해 노동력을 크게 향상시킨다.[24]
- 1,3-디티아누스는 1965년 E.J. 코리에 의해 변위 및 추가 반응에서 카보닐 집단을 임시로 개조하여 개척하였다. 디티안의 형성은 Umpolung 화학물질을 도입한 초기 발전으로 반응성의 역전에 널리 이용되고 있다. 디티안의 형성은 Lewis acid (scheme 7) 또는 카보닐 화합물에서 직접 이루어질 수 있다.[25]
디티아누스의 pKa는 대략 30이며, 일반적으로 n-butyllithium인 알킬 리튬 시약으로 감응이 가능하다. 디티아누스와 알데히드와의 반응은 현재 코리-세바흐 반응으로 알려져 있다. 디티안은 한 때 감압된 적이 있는 전기세포를 공격하는 데 사용되는 아틸 음이온의 역할을 한다. 보통 HgO와 함께 디티아네를 분해한 후 마스크된 아킬 디티아네 음이온에서 케톤 제품이 관찰된다. 그러한 반응의 효용성은 합성 화학자들이 총합성(scheme 8)에서 Umpolung 분리를 사용할 수 있게 함으로써 유기합성의 영역을 확장시켰다.[26] 1,3디티안들은 또한 이 기능 그룹의 다용성과 효용성을 표현하는 카보닐 화합물의 보호 그룹으로도 사용된다.
- 또한, 코리는 간단한 식물 테르펜에서 콜레스테롤의 효소 생성에 이용되는 양이온성 폴리올레핀 사이클화에 대한 자세한 연구를 시작했다.[27] 코리는 먼저 스칼렌에서 추출한 스테롤의 생물학적 합성을 연구함으로써 주목할 만한 사이클링 과정의 세부사항을 확립했다.
방법론
코리의 연구실에서 발달한 몇 가지 반응은 현대 합성 유기 화학에서 흔한 일이 되었다. 코리 그룹에서는 1950년부터 적어도 302가지 방법이 개발되었다.[28] 그의 이름을 딴 몇 가지 반응이 있다.
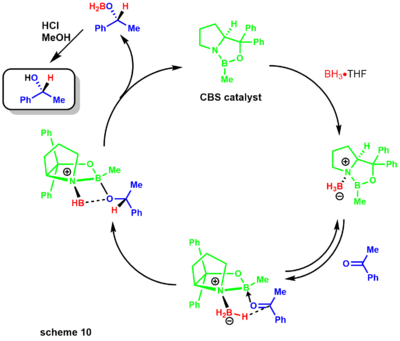
- 코리-박시-시바타 환원제로도 알려진 코리-이츠노 환원제는 옥사보리딘 촉매와 다양한 붕소를 이용하여 알코올에 케톤을 항항제 환원하는 것이다.[29] 코리 그룹은 먼저 보란과 치랄 아미노알코올을 이용한 촉매 합성을 시연했다. 반응은 치랄 아미노산 프로라인을 사용하며, 보란이 있으면 CBS 촉매로 이어진다(scheme 9).[30][31]
나중에, 코리는 대체된 붕소들이 준비하기가 더 쉽고 훨씬 더 안정적이라는 것을 보여주었다. 감소 메커니즘은 옥사조보롤리딘이 [니트로겐]에서 약간 기초적인 것으로 시작하여 붕소 아민 콤플렉스(scheme 10)의 스토오치메트릭 붕소와 조정된다.[31] 질소로부터 붕소로의 기부가 부족하면 루이스 산도가 높아져 케톤 기질과의 조화가 가능하다. 기질 복합화는 가장 접근하기 쉬운 산소 쌍에서 발생하여 강직적으로 인접한 페닐 그룹 때문에 B-O 결합 주위의 회전이 제한된다.[32]
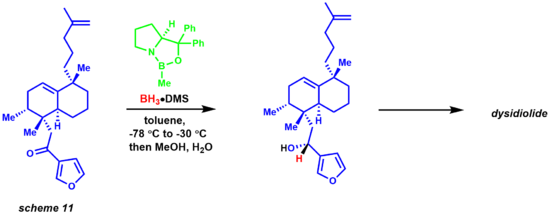
보란에서 전기영양 케톤 센터로의 수화물의 이동은 6-membed 링 전환 상태를 통해 발생하며, 궁극적으로 4-membed 링 중간이 키랄 제품을 제공하고 촉매의 재생성을 제공한다. 이 반응은 천연물 화학자들에게도 큰 도움이 되었다.[33][34] 코레이와 동료들이 이디돌라이드를 합성하는 것은 붕소-디메틸슬황화물 복합체를 이용한 항억제 CBS 감소를 통해 이루어졌다.
- 코리-푸흐스 알카인 합성은 트리페닐인산염과 카본 테트라브로미드를 이용한 알데히드의 1탄소 호몰로네이션을 통해 단자 알카인스를 합성하는 것이다.[30][35] 이 메커니즘은 트리페닐인산염과 카본 사트라브로미드를 가진 인 이라이드 형성에 의한 위티그 반응과 유사하다. 인산염과 알데히드 기질을 반응시키면 디브로모울레핀이 생성된다.[36]
n-buLi의 두 등가물로 처리한 경우, 리튬 할로겐 교환과 감응은 단자 알킨 제품(scheme 12)을 생산하기 위해 가수분해를 겪는 아세틸라이드 리튬 종을 산출한다.[30] 보다 최근에는 변형된 절차를 이용한 원팟 합성이 개발되었다.[37] 이러한 합성 변환은 W.J. 커와 동료(scheme 13)의 총합성(+-taylorione)에서 성공적인 것으로 입증되었다.[38]
- 코리-김 산화는 알코올을 해당 알데하이드와 케톤으로 변환하기 위해 새롭게 개발된 변형이었다.[30][39] 이 공정은 염화 NCS, 디메틸설피드(DMS), 트리에틸아민(TEA)의 사용으로 크롬 기반 산화에 대한 독성 대안으로 제공된다. 코리-킴 시약은 NCS와 DMS가 반응하여 디메틸설프시니도설포늄 염화종(scheme 14)을 형성할 때 자리에서 형성된다.[30]
알코시 설포늄 소금은 산화 제품을 공급할 수 있도록 트리에틸아민으로 알파 위치에서 감압된다. 그 반응은 광범위한 기능 그룹을 수용하지만, 동맹과 벤질릭 알코올은 전형적으로 동맹과 벤질릭 염소화물로 변형된다. 그것의 종합적 적용은 가벼운 프로토콜 조건과 기능 및 그룹 호환성을 보호하는 것에 기초한다. 인제놀 총합에서 쿠와지마와 동료들은 장애가 덜 된 2차 알코올(도표 15)을 선택적으로 산화시켜 코리-김 산화를 이용했다.[40]
- 코리-윈터 올레피케이션은 디올 기질, 티오카르보닐디미다졸, 초과 삼알킬인산염 등이 포함된 알케인으로 1,2다이올을 입체적으로 변형한 것이다.[30][41] 그 메커니즘은 가능한 두 개의 경로로 좁혀졌지만, 정확한 메커니즘은 알려지지 않았다.[42] 구체적으로 티오노카르본산염과 삼알킬인산염 사이의 반응은 인산염 이라이드 종이나 카바노이드 중간 종 형성을 통해 진행된다. 그럼에도 불구하고, 제품이 극도로 긴장된 구조로 이어지지 않는 한 대부분의 기판에 대한 반응은 입체적이다. 7-membed 링에 존재하는 강직하게 방해를 받는 트랜스 알켄의 형성은 코리와 동료들에 의해 시도되었지만, 이 새로운 합성 방법론을 채택하여 엄청난 링 부담을 야기시켰음에도 불구하고 성공하지 못했다. 더 중요한 것은 이 방법이 일련의 복잡한 기판을 산출하기 위해 계속해서 이용되고 있기 때문에 여러 천연물에는 입체적인 연산이 존재한다. T.K.교수님.M 싱 외 연구진은 코리-윈터 올레피네이션 반응을 이용하여 (+-Boesnoxide, scheme 16) 합성하였다.[43]
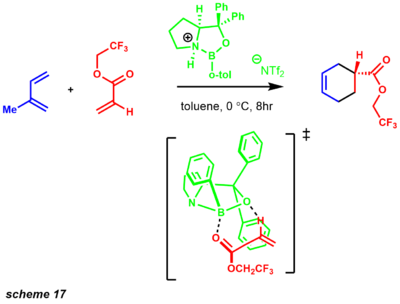
- CBS의 항정신성 디엘스-알더 반응은 항정신성 CBS 감소와 유사한 비계를 사용하여 개발되었다.[31] 이 반응이 개발된 후 CBS 시약은 일련의 강력한 합성 변환을 위한 매우 다용도 시약임이 입증되었다. CBS 촉매와 같은 키랄 루이스 산의 사용은 광범위한 불포화 에논 기판을 포함한다. 반응은 고도로 조직화된 6-membed ring pre-transition state를 통해 진행되어 높은 인텐시오가 풍부한 제품을 전달할 수 있을 것이다(scheme 17).[44]
이러한 전환 상태는 페닐 대체제를 사용한 유리한 파이 스택 때문에 발생할 수 있다.[31][45] 그 과정의 항항성성은 페닐 대체물의 반대편 얼굴에서 디엔오피드에 접근하는 디엔에서 촉진된다. 디엘-알데르 반응은 합성 화학에서 가장 강력한 변형 중 하나이다. 디엘-알데르 반응을 변형으로 이용한 천연물의 합성은 특히 6엠베드 링(scheme 18)의 형성에 적용되었다.[46]
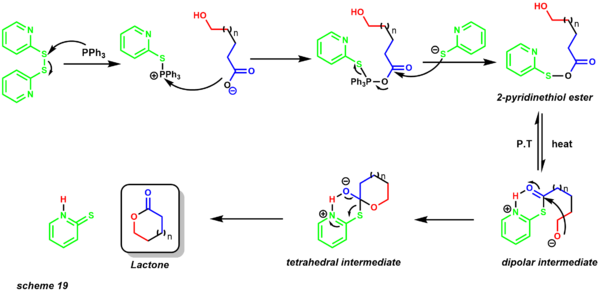
- 코리-니콜라우 마크로락톤화(Corey-Nicolaou macrolactonization)는 중간에서 큰 사이즈의 락톤을 준비하는 첫 번째 방법을 제공한다.[30][47] 기존에는 낮은 농도에서도 분자간 유당이 경쟁적으로 경쟁했다. 이 반응의 한 가지 큰 장점은 산과 염기성 기능 그룹의 존재를 허용하는 중립 조건 하에서 수행된다는 것이다. 7~48개 멤버의 데이트 링은 이 방법을 사용하여 성공적으로 합성되었다.[48]
반응은 2,2'-디피리딜 이황화물 및 트리페닐인산염의 존재에서 발생한다. 그 반응은 일반적으로 벤젠과 같은 무극성 용매에서 환류된다. 메커니즘은 2피리디네티올 에스테르(scheme 19)의 형성으로 시작한다. 양성자 전달은 알카산화핵이 전기영양성 카보닐 중심을 공격하는 이극성 중간물질을 제공하여 마크로락톤 제품을 산출하는 사면중간을 제공한다. 이 프로토콜의 첫 번째 예 중 하나는 zearalenone의 총합성에 적용되었다(scheme 20).[49]
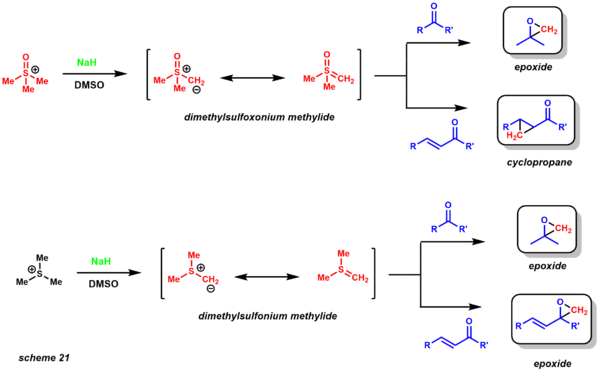
- 존슨-코리-체이코프스키 반응은 에폭시드와 사이클로프로페인의 합성에 유용하다.[30] 그 반응은 에논, 케톤, 알데히드, 이미인과 반응하여 그에 상응하는 에폭시드, 사이클로프로판, 아지리딘을 형성하는 자리에서 유황 이라이드를 형성한다.[50] 서로 다른 화학적 자극성 제품을 제공하는 두 가지 황 일라이드 변형이 채택되었다(구성표 21).디메틸설프옥소늄 메틸라이드는 케톤으로부터 에폭시드를 공급하지만 에논이 사용되면 사이클로프로판스를 산출한다. 디메틸설포늄 메틸라이드는 케톤과 에논을 해당 에폭시드로 변형시킨다. 디메틸설폰메틸라이드는 디메틸설프옥소늄메틸라이드보다 훨씬 반응성이 좋고 안정성이 떨어지기 때문에 저온에서 생성된다.[51]
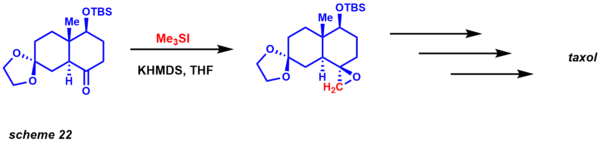
이 두 변종의 또 다른 뚜렷한 장점은 반응성에 기초하여 동역학적으로 이질회수성의 차이를 제공한다는 것이다. 반응은 매우 잘 확립되어 있으며, 항항체 변형(촉매 및 스토이치계)도 달성되었다. 역합성 분석의 관점에서, 이 반응은 연금술(scheme 22)에 대한 기존의 에폭시드 반응에 대한 합리적인 대안을 제공한다. Danishefsky는 이 방법론을 택솔의 합성에 활용했다. 이질회수성은 에폭시드 폐쇄에 필요한 전환 상태의 1,3 상호작용에 의해 확립된다.[52]
총합성
E. J. Corey와 그의 연구 그룹은 많은 총합물을 완성했다. 1950년 이후 코리 그룹에서는 최소 265개의 화합물이 합성되었다.[53]
그의 1969년 몇 개의 프로스타글랜딘을 합성한 총합은 고전으로 여겨진다.[54][55][56][57] 특히 프로스타글란딘 F의2α 합성은 몇 가지 난제를 제시한다. 5개의 비대칭 탄소 원자와 함께 시스와 트랜스 올레핀이 존재한다는 것은 이 분자가 유기 화학자들에게 바람직한 도전에 직면하게 한다. 코리의 역합성 분석은 단순화된 전구체(scheme 23)로 이어지는 몇 가지 주요 단절을 개략적으로 보여준다.
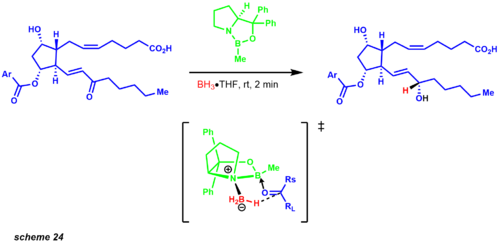
분자 단순화는 우선 위티그 반응과 호너-워즈워스 에몬스 수정으로 두 탄소 사슬을 모두 분리함으로써 시작되었다. 위티그 반응은 시스 제품을 제공하고 호너-워즈워스 에몬스는 트랜스 올레핀을 생산한다. 공개된 합성물은 아연 보로하이드레이드를 사용한 카르보닐 환원제의 1:1 이질성 혼합물을 보여준다. 그러나 몇 년 후 코리와 동료들은 CBS 감축을 설립했다. 이 프로토콜을 예시한 예들 중 하나는 원하는 이산화질소(scheme 24)의 9:1 혼합을 나타내는 프로스타글란딘 합성의 중간이었다.[33]
요오드화합 변환은 핵심 배이어-빌라이거 중간으로 이어지는 우방 알코올을 제공한다. 이 산화 작용은 케톤과 전자가 가장 풍부한 부위 사이에 산소 원자를 섭생적으로 삽입한다. 중추적인 중간은 Diels-Alder 구조 목표로의 직접적인 전환으로 이어지며, 이 구조 목표는 기능화된 사이클로펜탄 링에 탄소 프레임워크를 제공한다. 이후 코리는 키랄옥사조보롤리딘을 이용한 비대칭 디엘-알데르 반응을 개발하여 프로스타글란딘으로의 합성 경로를 크게 단순화했다.
기타 주목할 만한 합성 자료:
출판물
E.J. 코리는 1100개 이상의 출판물을 보유하고 있다.[67] 2002년 미국화학협회(ACS)는 그를 '화학분야에서 가장 많이 인용된 작가'로 인정했다. 2007년에는 제1회 ACS 간행물 부문 '우수성 고영향 기고자상'[68]을 수상하였으며, 허쉬지수(h-index)에 의해 연구 영향 면에서 화학자 1위에 올랐다.[69] 그의 저서로는 다음과 같은 것들이 있다.
- Corey, E. J. (2010). Enantioselective chemical synthesis : methods, logic and practice. Dallas, Texas: Direct Book Publishing. ISBN 978-0-615-39515-9. OCLC 868975499.
- Corey, E. J. (1995). The logic of chemical synthesis. New York: John Wiley. ISBN 0-471-11594-0. OCLC 45734016.
- Corey, E. J. (2007). Molecules and medicine. Hoboken, N.J: John Wiley & Sons. ISBN 978-0-470-26096-8. OCLC 156819246.
- Li, Jie (2011). Name Reactions in Heterocyclic Chemistry II. Hoboken, N.J: Wiley. ISBN 978-0-470-08508-0. OCLC 761319808.
- Li, Jie (2007). Name reactions for functional group transformations. Hoboken, N.J: Wiley-Interscience. ISBN 978-0-471-74868-7. OCLC 85851580.
알톰 자살
코리의 학생 중 한 명인 제이슨 알톰은 1998년에 자살했다.[70] 알톰의 자살은 자신의 연구 고문인 코리를 자살의 원인으로 명시적으로 지목해 논란을 일으켰다.[71] 알톰은 1998년 고별 노트에서 자신의 목숨을 앗아간 이유 중 하나로 "유혹적인 연구 감독관"을 꼽았다. 알톰의 유서에는 학생들과 그들의 감독관들 사이의 관계를 어떻게 개혁할 것인가에 대한 명시적인 지침도 들어 있었다.
알톰이 코리의 연구실에서 몇 년 만에 두 번째 자살한 반면, 코리는 제자의 죽음에 망연자실하고 당황했다.[72][73] 코리는 "그 편지는 말이 안 된다. 결국 제이슨은 극도로 망상적이거나 비이성적이었을 겁니다." 코리는 또한 알톰의 지적 공헌에 대해 결코 의문을 제기하지 않았다고 주장했다. "산악 가이드라면 누군가 등산을 안내해 줄 것처럼 제이슨을 안내하기 위해 최선을 다했다. 코리는 "나는 매 단계마다 최선을 다했다"고 말했다. "내 양심은 분명하다. 제이슨이 한 모든 일은 우리의 파트너쉽에서 나온 것이다. 우리는 조금도 이견을 보인 적이 없다."[70] 미국자살예방재단(AFSP)은 뉴욕타임스(NYT)의 알톰 자살 기사를 문제 보도 사례로 꼽으며 알톰이 우울증과 자살이념의 경고 신호를 제시했고, 이 기사가 코리 교수의 행동이 기여했다는 2차적 증거가 부족함에도 불구하고 코리 씨를 희생양으로 삼았다고 주장했다. 알톰의 고통으로 [74][75]말이야 보스턴 글로브의 보도에 따르면 학생들과 교수들은 알톰이 실제로 코리의 지지를 유지했다고 말했다.[73]
알톰의 사망으로 화학과는 대학원생들이 논문 작성에 있어 작은 자문역할을 할 수 있도록 2명의 추가 교수진에게 요청할 수 있는 제안을 받아들였다.[76][71]
코리 그룹 멤버
2010년 현재, 주목할 만한 학생인 라젠더 레디 레티, 에릭 블록, 데일 L. 보거, 웨스턴 T를 포함한 약 700명의 사람들이 코리 그룹 멤버들이다. 보든, 데이비드 E. Cane, Rick L. Danheiser, William L. Jorgensen, John Katzenellenbogen, Alan P. Kozikowski, Bruce H. Lipshutz, David R. 류, 알버트 마이어스, K. C. 니콜라우, 노요리 료지, 포스너, 벵트 1세. 사무엘손, 디터 시바흐, 비노드 K. 싱, 브라이언 스톨츠, 야마모토 히사시, 유 진취안. 2008년 7월 코리의 80번째 생일을 위해 580명의 이전 회원들과 현재 소속된 회원들의 데이터베이스가 개발되었다.[77]
우드워드-호프만 규칙
2004년 프리스틀리 메달을 수여했을 때 E. J. 코리는 우드워드-호프만 룰의 개발에 앞서 로버트 번스 우드워드에 영감을 줬다는 주장으로 논란을 일으켰다. 코리는 이렇게 썼다.
"1964년 5월 4일, 나는 동료 R. B. 우드워드에게 이러한 사상이 우드로 알려지게 된 것에 대한 추가 개발의 기초를 제공한 스테레오셀렉터 시클로부틴 → 1,3-부타디엔 → 1,5-헥사틴 → 시클로헥사디엔 변환에 대한 퍼터베드(HOMO) 분자 궤도의 대칭과 관련된 간단한 설명을 제안했다.워드-호프만 룰."[78]
이는 1964년 5월 5일부터 우드워드가 코리와 5월 4일의 대화에 대한 언급 없이 코리의 설명을 자신의 생각대로 내세웠다는 그의 주장에 대한 첫 공개 성명이었다. 코리는 1964년부터 호프만과 가까운 동료들과 그의 주장을 비공개로 논의해 왔다. 코리는 그가 프리스틀리 성명에 대해 "역사적 기록이 정확할 것"이라고 말했다고 언급한다.[79]
코리의 주장과 기여는 로알드 호프만(Roald Hoffmann)이 잡지 안젤완트 케미에(Angewandte Chemie)에서 공개적으로 반박했다. 이 반박에서 호프만은 왜 코리가 이 문제를 공론화하지 않았는지에 대한 오랜 논의 과정에서 코리에게 요청했다고 말한다. 코리는 그러한 대중의 의견이 하버드에 피해를 줄 것이라고 생각했으며 "내가 그렇게 헌신적이고 헌신적인 하버드를 상대로 어떤 것도 하는 것을 고려하지 않을 것"이라고 대답했다. 코리 역시 우드워드 자신이 "나이가 들고, 사려가 깊어지고, 자신의 양심에 더욱 민감해짐에 따라"[80] 역사 기록을 바로잡기를 바랐다. 우드워드는 1979년 수면 중에 심장마비로 갑자기 사망했다.
수상 및 수상
E. 코리는 라이너스 폴링 상(1973년), 프랭클린 메달(1978년), 사면체 상(1983년), 울프상 화학상(1986년), 국가 메달 과학(1988년)의, 일본상(1989년), 노벨 화학 상(1990년), 황금 플레이트 상 미국 아카데미의 성과의(1991년)[81]로저 애덤스 상(등 40여 주요 상을 받았다.1993년(), 그리고 프리스틀리 메달(2004)을 수여한다.[11] 그는 1998년에 알파치 시그마 명예의 전당에 헌액되었다.[7] 2008년 현재 옥스퍼드대(영국), 케임브리지대(영국), 국립충청대 등 세계 대학으로부터 19개의 명예학위를 수여받고 있다.[82] 2013년 중국 장쑤성 장옌에 E.J.코리 바이오의학연구소(CIBR)가 문을 열었다.[83]
코리는 1998년 영국 왕립학회(ForMemRS)의 외국인 회원으로 선출되었다.[2]
참조
- ^ 일본상 수상자들은 2016년 4월 7일 웨이백머신에 보관되었다.JP
- ^ a b "Professor Elias Corey ForMemRS Foreign Member". London: Royal Society. Archived from the original on October 18, 2015.
- ^ "The Nobel Prize in Chemistry 1990". Nobelprize.org. Retrieved July 25, 2015.
- ^ E. J. 코리, X-M. 쳉, 화학 합성의 논리, Wiley, 1995년 뉴욕, ISBN 0-471-11594-0.
- ^ a b Corey, E.J. (1991). "The Logic of Chemical Synthesis: Multistep Synthesis of Complex Carbogenic Molecules (Nobel Lecture)". Angew. Chem. Int. Ed. Engl. 30 (5): 455–465. doi:10.1002/anie.199104553.
- ^ Elias James Corey – 2008년 7월 6일 웨이백 머신에 보관된 Autobiography. nobelprize.org
- ^ a b 동호인 – 수상 – 명예의 전당 – 2016년 1월 26일 웨이백 머신에 보관된 알파 치 시그마
- ^ Corey, E.J. (1990). "Nobel Prize Autobiography". Nobelprize.org: The Official Site of the Nobel Prize. Retrieved September 9, 2010.
- ^ "Compiled Works of Elias J. Corey, Notes, Pfizer, Celebrating your 80th birthday". June 27, 2008. Retrieved November 15, 2013.
- ^ National Science Foundation – Wayback Machine에 보관된 2012년 10월 15일 대통령 국가 과학 훈장
- ^ a b E.J. Corey, About E.J. Corey, Major Awards 탭을 참조하십시오.
- ^ Corey, E.J.; Suggs, W. (1975). "Pyridinium chlorochromate. An efficient reagent for oxidation of primary and secondary alcohols to carbonyl compounds". Tetrahedron Lett. 16 (31): 2647–2650. doi:10.1016/s0040-4039(00)75204-x.
- ^ Corey, E. J.; Boger, D. (1978). "Oxidative cationic cyclization reactions effected by pyridinium chlorochromate". Tetrahedron Lett. 19 (28): 2461–2464. doi:10.1016/s0040-4039(01)94800-2.
- ^ Yang; et al. (2010). "Asymmetric Total Synthesis of Caribenol A". JACS. 132 (39): 13608–13609. doi:10.1021/ja106585n. PMID 20831198.
- ^ Corey, E. J.; Venkateswarlu, A. (1972). "Protection of hydroxyl groups as tert-butyldimethylsilyl derivatives". J. Am. Chem. Soc. 94 (17): 6190–6191. doi:10.1021/ja00772a043.
- ^ Kocienski, P.J. 보호 단체; Georg Tieme Verlag: 독일, 2000
- ^ Friesen, R. W.; et al. (1991). "A highly stereoselective conversion of α-allenic alcohols to 1,2-syn amino alcohol derivatives via iodocarbamation". Tetrahedron Lett. 31 (30): 4249–4252. doi:10.1016/S0040-4039(00)97592-0.
- ^ Imanieh; et al. (1992). "A facile generation of α-silyl carbanions". Tetrahedron Lett. 33 (4): 543–546. doi:10.1016/s0040-4039(00)93991-1.
- ^ Mori; et al. (1998). "Formal Total Synthesis of Hemibrevetoxin B by an Oxiranyl Anion Strategy". J. Org. Chem. 63 (18): 6200–6209. doi:10.1021/jo980320p. PMID 11672250.
- ^ Furstner; et al. (2001). "Alkyne Metathesis: Development of a Novel Molybdenum-Based Catalyst System and Its Application to the Total Synthesis of Epothilone A and C". Chem. Eur. J. 7 (24): 5299–5317. doi:10.1002/1521-3765(20011217)7:24<5299::aid-chem5299>3.0.co;2-x. PMID 11822430.
- ^ Ogilvie; et al. (1974). "Selective protection of hydroxyl groups in deoxynucleosides using alkylsilyl reagents". Tetrahedron Lett. 116 (33): 2865–2868. doi:10.1016/s0040-4039(01)91764-2.
- ^ Kadota; et al. (1998). "Stereocontrolled Total Synthesis of Hemibrevetoxin B". J. Org. Chem. 63 (19): 6597–6606. doi:10.1021/jo9807619.
- ^ Corey; et al. (1976). "A new general method for protection of the hydroxyl function". Tetrahedron Lett. 17 (11): 809–812. doi:10.1016/s0040-4039(00)92890-9.
- ^ Chiang; et al. (1989). "Total synthesis of L-659,699, a novel inhibitor of cholesterol biosynthesis". J. Org. Chem. 54 (24): 5708–5712. doi:10.1021/jo00285a017.
- ^ Corey, E. J.; Seebach, D. (1965). "Synthesis of 1,n-Dicarbonyl Derivates Using Carbanions from 1,3-Dithianes". Angew. Chem. Int. Ed. 4 (12): 1077–1078. doi:10.1002/anie.196510771.
- ^ Corey; et al. (1982). "Total synthesis of aplasmomycin". JACS. 104 (24): 6818–6820. doi:10.1021/ja00388a074.
- ^ Wendt, K.U.; Schulz, G.E.; Liu, D.R.; Corey, E.J. (2000). "Enzyme Mechanisms for Polycyclic Triterpene Formation". Angewandte Chemie International Edition in English. 39 (16): 2812–2833. doi:10.1002/1521-3773(20000818)39:16<2812::aid-anie2812>3.3.co;2-r. PMID 11027983.
- ^ 메서드"Compiled Works of Elias J. Corey". July 12, 2008. Retrieved November 15, 2013. 탭
- ^ Corey, E. J.; et al. (1998). "Reduction of Carbonyl Compounds with Chiral Oxazaborolidine Catalysts: A New Paradigm for Enantioselective Catalysis and a Powerful New Synthetic Method". Angew. Chem. Int. Ed. 37 (15): 1986–2012. doi:10.1002/(sici)1521-3773(19980817)37:15<1986::aid-anie1986>3.0.co;2-z. PMID 29711061.
- ^ a b c d e f g h Kürti, L.; Czako, B. 유기 합성에서의 명명된 반응의 전략적 적용; Exvier: 2005년 벌링턴.
- ^ a b c d 코리, E.J.; 쿠르티, L. 엔항독성 화학 합성; 직접 출판: 댈러스, 2010
- ^ Corey, E.J.; Bakshi, R.K.; Shibata, S. (1987). "Highly enantioselective borane reduction of ketones catalyzed by chiral oxazaborolidines. Mechanism and synthetic implications". JACS. 109 (18): 5551–5553. doi:10.1021/ja00252a056.
- ^ a b Corey; et al. (1987). "A stable and easily prepared catalyst for the enantioselective reduction of ketones. Applications to multistep syntheses". JACS. 109 (25): 7925–7926. doi:10.1021/ja00259a075.
- ^ Corey, E. J.; Roberts, B. E. (1997). "Total Synthesis of Dysidiolide". JACS. 119 (51): 12425–12431. doi:10.1021/ja973023v.
- ^ 코리, E.J.; 푸치, P.L. 테트라헤드론 레트. 1972, 3769
- ^ Eymery et al 합성 2000, 185
- ^ Michel; et al. (1999). "A one-pot procedure for the synthesis of alkynes and bromoalkynes from aldehydes". Tetrahedron Lett. 40 (49): 8575–8578. doi:10.1016/s0040-4039(99)01830-4.
- ^ Donkervoot; et al. (1996). "Development of modified Pauson-Khand reactions with ethylene and utilisation in the total synthesis of (+)-taylorione". Tetrahedron. 52 (21): 7391–7420. doi:10.1016/0040-4020(96)00259-1.
- ^ Corey, E.J.; Kim, C. U. (1972). "New and highly effective method for the oxidation of primary and secondary alcohols to carbonyl compounds". JACS. 94 (21): 7586–7587. doi:10.1021/ja00776a056.
- ^ Kuwajima; et al. (2003). "Total Synthesis of Ingenol". JACS. 125 (6): 1498–1500. doi:10.1021/ja029226n. PMID 12568608.
- ^ Corey, E. J.; Winter, A. E. (1963). "A New, Stereospecific Olefin Synthesis from 1,2-Diols". JACS. 85 (17): 2677–2678. doi:10.1021/ja00900a043.
- ^ Block; et al. (1984). "Olefin Synthesis by Deoxygenation of Vicinal Diols". Organic Reactions. Org. React. 30. p. 457. doi:10.1002/0471264180.or030.02. ISBN 978-0-471-26418-7.
- ^ Shing; et al. (1998). "Enantiospecific Syntheses of (+)-Crotepoxide, (+)-Boesenoxide, (+)-β-Senepoxide, (+)-Pipoxide Acetate, (−)- iso -Crotepoxide, (−)-Senepoxide, and (−)-Tingtanoxide from (−)-Quinic Acid 1". J. Org. Chem. 63 (5): 1547–1554. doi:10.1021/jo970907o.
- ^ Nair; et al. (2007). "Intramolecular 1,3-dipolar cycloaddition reactions in targeted syntheses". Tetrahedron. 63 (50): 12247–12275. doi:10.1016/j.tet.2007.09.065.
- ^ Corey, E. J.; et al. (2004). "Enantioselective and Structure-Selective Diels−Alder Reactions of Unsymmetrical Quinones Catalyzed by a Chiral Oxazaborolidinium Cation. Predictive Selection Rules". J. Am. Chem. Soc. 126 (15): 4800–4802. doi:10.1021/ja049323b. PMID 15080683.
- ^ Corey; et al. (1994). "Demonstration of the Synthetic Power of Oxazaborolidine-Catalyzed Enantioselective Diels-Alder Reactions by Very Efficient Routes to Cassiol and Gibberellic Acid". J. Am. Chem. Soc. 116 (8): 3611–3612. doi:10.1021/ja00087a062.
- ^ Corey; et al. (1975). "Synthesis of novel macrocyclic lactones in the prostaglandin and polyether antibiotic series". JACS. 97 (3): 653–654. doi:10.1021/ja00836a036. PMID 1133366.
- ^ Nicolaou, K. C. (1977). "Synthesis of macrolides". Tetrahedron. 33 (7): 683–710. doi:10.1016/0040-4020(77)80180-4.
- ^ Corey, E. J.; Nicolaou, K. C. (1974). "Efficient and mild lactonization method for the synthesis of macrolides". JACS. 96 (17): 5614–5616. doi:10.1021/ja00824a073.
- ^ Corey, E. J.; Chaykovsky (1962). "Dimethylsulfoxonium Methylide". JACS. 84 (5): 867–868. doi:10.1021/ja00864a040.
- ^ Corey, E. J.; Chaykovsky (1965). "Dimethyloxosulfonium Methylide ((CH3)2SOCH2) and Dimethylsulfonium Methylide ((CH3)2SCH2). Formation and Application to Organic Synthesis". JACS. 87 (6): 1353–1364. doi:10.1021/ja01084a034.
- ^ Danishefsky; et al. (1996). "Total Synthesis of Baccatin III and Taxol". JACS. 118 (12): 2843–2859. doi:10.1021/ja952692a.
- ^ 통합"Compiled Works of Elias J. Corey". ejcorey.org. July 12, 2008. Retrieved November 15, 2013. 탭 참조
- ^ Corey, E. J.; Weinshenker, N. M.; Schaaf, T. K.; Huber, W. (1969). "Stereo-controlled synthesis of dl-prostaglandins F2.alpha. and E2". J. Am. Chem. Soc. 91 (20): 5675–5677. doi:10.1021/ja01048a062. PMID 5808505.
- ^ K. C. 니콜라우, E. J. 소렌센, VCH, 1996년 뉴욕, ISBN 3-527-29231-4.
- ^ Corey, E. J.; Schaaf, T. K.; Huber, W.; Koelliker,V.; Weinshenker, N. M. (1970). "Total Synthesis of Prostaglandins F2α and E2 as the Naturally Occurring Forms". Journal of the American Chemical Society. 92 (2): 397–8. doi:10.1021/ja00705a609. PMID 5411057.
- ^ 리뷰는 The Total Composition of Natural Products, Vol. 1, ApSimon, J. W. W. (ed.) New York Wiley에서 Axen; Pike, J. E. 및 Schneider, P. 페이지 81를 참조한다.
- ^ Corey, E. J.; Ohno, M.; Vatakencherry, P. A.; Mitra, R. B. (1961). "TOTAL SYNTHESIS OF d,l-LONGIFOLENE". J. Am. Chem. Soc. 83 (5): 1251–1253. doi:10.1021/ja01466a056.
- ^ Corey, E. J.; Ohno, M.; Mitra, R. B.; Vatakencherry, P. A. (1964). "Total Synthesis of Longifolene". J. Am. Chem. Soc. 86 (3): 478–485. doi:10.1021/ja01057a039.
- ^ Corey, E. J.; Ghosh, A. K. (1988). "Total synthesis of ginkgolide a". Tetrahedron Lett. 29 (26): 3205–3206. doi:10.1016/0040-4039(88)85122-0. PMC 6781876. PMID 31595095.
- ^ Corey, E. J.; Kang, M.; Desai, M. C.; Ghosh, A. K.; Houpis, I. N. (1988). "Total synthesis of (.+-.)-ginkgolide B". J. Am. Chem. Soc. 110 (2): 649–651. doi:10.1021/ja00210a083. PMC 6746322. PMID 31527923.
- ^ Corey, E. J. (1988). "Robert Robinson Lecture. Retrosynthetic thinking?essentials and examples". Chem. Soc. Rev. 17: 111–133. doi:10.1039/cs9881700111.
- ^ Corey, E. J.; Reichard, G. A. (1992). "Total Synthesis of Lactacystin". J. Am. Chem. Soc. 114 (26): 10677–10678. doi:10.1021/ja00052a096.
- ^ Corey, E. J.; Wu, L. I. (1993). "Enantioselective Total Synthesis of Miroestrol". J. Am. Chem. Soc. 115 (20): 9327–9328. doi:10.1021/ja00073a074.
- ^ Corey, E. J.; Gin, D. Y.; Kania, R. S. (1996). "Enantioselective Total Synthesis of Ecteinascidin 743". J. Am. Chem. Soc. 118 (38): 9202–9203. doi:10.1021/ja962480t.
- ^ Reddy Leleti, Rajender; Corey, E. J. (2004). "A Simple Stereocontrolled Synthesis of Salinosporamide A". J. Am. Chem. Soc. 126 (20): 6230–6232. CiteSeerX 10.1.1.472.2554. doi:10.1021/ja048613p. PMID 15149210.
- ^ 다음에서 간행물 참조
- ^ Baum, Rudy (August 21, 2007). "E.J. Corey: Chemist Extraordinaire". C&EN Meeting Weblog, 234th ACS National Meeting &Exposition, August 19–23, 2007, Boston, Massachusetts. Retrieved September 8, 2010.
- ^ Van Noorden, Richard (April 23, 2007). "Hirsch index ranks top chemists". RSC: Advancing the Chemical Sciences, Chemistry World. Retrieved September 9, 2010.
- ^ a b Schneider, Alison (1998). "Harvard Faces the Aftermath of a Graduate Student's Suicide". The Chronicle of Higher Education. Retrieved August 21, 2010.
- ^ a b Hall, Stephen S. (November 29, 1998). "Lethal Chemistry at Harvard". The New York Times.
- ^ Hall, Stephen (December 29, 1998). "Lethal Chemistry at Harvard". New York Times. Retrieved September 26, 2020.
- ^ a b 영어, 벨라. "Grad-student suicides spur big changes at Harvard chem labs". Archived from the original on January 24, 2001. Retrieved November 24, 2010.CS1 maint: bot: 원본 URL 상태를 알 수 없음(링크), The Boston Globe by Archive.org(2001년 1월 2일).
- ^ "For the Media: Examples of Good and Problematic Reporting, Scapegoating, New York Times Magazine: Lethal Chemistry at Harvard". American Foundation for Suicide Prevention (AFSP). 2010. Archived from the original on September 25, 2006. Retrieved November 4, 2012.
- ^ AFSP는 뉴욕타임스 기사의 작성자와 날짜를 키스 B로 잘못 파악하고 있다. 리치버그와 1998년 11월 28일. 저자는 스티븐 S였다. 홀과 출판일은 1998년 11월 29일이었다.H, H; M.A. (2010). "For the Media: Problematic Reporting, Scapegoating". American Foundation for Suicide Prevention (AFSP). Archived from the original on September 25, 2006. Retrieved August 21, 2010.
- ^ Disciplined Minds A Critical Look at Salaried Professionals and Soul-Battering System that Shapes Their Lives. Rowman and Littlefield Publishers, Inc. 2000.
- ^ "Group Members: Elias James Corey". ejcorey.org. Retrieved 22 July 2021.
- ^ E. J. Corey, Impossible Dreams 탭 참조Corey, E.J. (April 30, 2004). "Impossible Dreams". 69 (9). JOC Perspective. pp. 2917–2919. Retrieved September 10, 2010.
- ^ Johnson, Carolyn Y. (March 1, 2005). "Whose idea was it?". Boston Globe. Archived from the original on January 11, 2012. Retrieved September 10, 2010.
- ^ Hoffman, Roald (December 10, 2004). "A Claim on the Development of the Frontier Orbital Explanation Electrocyclic Reactions". Angewandte Chemie International Edition. 43 (48): 6586–6590. doi:10.1002/anie.200461440. PMID 15558636.
- ^ "Golden Plate Awardees of the American Academy of Achievement". www.achievement.org. American Academy of Achievement.
- ^ E.J. Corey, About E.J. Corey, 명예 학위 탭을"Compiled Works of Elias J. Corey". July 12, 2008. Retrieved November 15, 2013. 참조하십시오.
- ^ "The grand opening ceremony of E.J. Corey Institute of Biomedical Research (CIBR)". E.J. Corey Institute of Biomedical Research. June 29, 2013. Archived from the original on June 20, 2015. Retrieved August 26, 2013.
외부 링크
| 위키미디어 커먼즈에는 E.J.코리 관련 미디어가 있다. |
| Wikiquote는 다음과 관련된 인용구를 가지고 있다: Elias James Corey |

![[3,3] rearrangement with PCC](http://upload.wikimedia.org/wikipedia/commons/thumb/8/87/PCC_rearrangement3.png/700px-PCC_rearrangement3.png)