EnvZ/OmpR 2개 구성 요소 시스템
EnvZ/OmpR two-component systemEvenZ/OmpR은 박테리아에 널리 분포하는 2개 성분의 규제 시스템으로 특히 대장균에 잘 특징이 있다.외막포린 OmpF와 OmpC의 발현을 조절해 환경 삼몰리성의 변화에 대응하는 오스모어겔레이션(osmoregulation)에 기능한다.EnvZ는 히스티딘키나아제로 세포질 오스모센소리 도메인을 갖고 있으며, OmpR은 이에 상응하는 반응 조절기 단백질이다.[1][2]null
개요
EvenZ는 내부 세포막에 걸쳐 있는 센서 전송기로 역사적으로 감각 영역과 송신 영역이라는 두 개의 영역으로 나뉘어져 왔다.[3][4]단백질은 경막의 짧은 N단자 꼬리, 간섭성 경막 루프가 있는 두 개의 투과성 영역, 그리고 희미한 4헬릭스 번들에 위치한 자인산화 히스티딘 잔류물을 포함하는 세포질 영역으로 구성되어 있다.[5][6]삼졸성의 변화는 세포질 4헬릭스 번들로 국부화되었고 OmpR로 인광 전달에 영향을 미치는 EnvZ의 순응적 변화를 유발한다.[5][6]인산화 시 OmpR은 ompC와 ompF 유전자에 특화된 향상된 DNA 결합 능력을 보이는 능동형 조광기가 된다.신호 캐스케이드는 다음과 같이 설명할 수 있다.[7]
ompF와 ompC는 항상 일정한 수준으로 표현되지만, 개별 포린 OmpF와 ompC는 중간 삼몰리티에 기초한 다양한 상대적 교차로 존재한다.또한 OmpF와 OmpC의 양은 각각 다양한 메커니즘에 의해 제어된다. 예를 들어, OmpF의 합성도 높은 온도에 의해 억제된다.마찬가지로 EnvZ-OmpR 쌍은 삼투압 제어에서 완전히 자유로운 삼투성 투과효소 시스템에 관여한다.그러나 OmpF와 OmpC를 통한 EnvZ-OmpR의 제어는 중요한 메커니즘이다.null
낮은 삼투성 응답
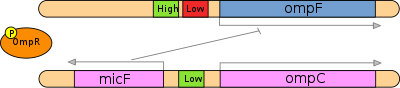
중간 삼몰리티가 낮을 때 EvenZ는 OmpR에 대해 상대적으로 낮은 키나아제 활성(즉, 높은 인산아제 활성)을 나타낸다.따라서 세포 내 인산염 형태의 OmpR의 양은 상대적으로 적다.[7]이러한 특수한 상황에서 OmpR-P 콤플렉스는 ompF 유전자의 F1, F2, F3 활성제 부지에 협력적으로 결합하고 그 전사량을 상향 조정한다.이들 사이트는 OmpC의 C1, C2 및 C3 활성제 사이트와 비교하여 OmpR-P 복합체에 대한 상대적 친화력이 높다.따라서 낮은 삼투성 조건에서 ompF에 비해 ompC의 전사 수준은 낮다.이러한 현상은 OmpF가 OmpC(1.08nm)보다 모공 지름(1.12nm)이 커서 부족한 영양소를 신속하게 발굴할 수 있도록 낮은 삼몰리티에서 선택적 우위를 제공하는 확산 속도가 10배 빨라졌기 때문으로 분석됐다.null
높은 삼투성 응답
고중간 삼몰래성의 경우 EvenZ는 능동적으로 자동인산화를 거친 후 Evz-OmpR 복합형성을 통해 OmpR의 N-단자 수신기 영역으로 인광 그룹을 효율적으로 전달한다.인산염 OmpR 단백질 분자의 수가 증가함에 따라 다음 두 가지 사건이 발생한다.OmpR은 ompF 프로모터의 업스트림에서 높은 선호도 바인딩 사이트뿐만 아니라 하나의 낮은 선호도 바인딩 사이트에도 바인딩된다.이 낮은 친화력 사이트에 결합하면 ompF 유전자가 억제된다.또한 OmpR은 OmpC 유전자 발현이 자극되고 세포 외막에 더 많은 OmpC 포린 단백질이 발현됨에 따라 OmpC 촉진자 업스트림 3개 저 친화 활성 사이트에 결합한다.또한, micF 반직접 mRNA의 전사는 고중간 삼투명성에서 시작된다. micF는 ompF mRNA의 상호보완적인 순서에 결합하여 번역을 차단한다.[7]이 두 가지 메커니즘은 높은 중형 삼몰래성 조건에서 OmpF에 비해 OmpC의 발현이 상대적으로 높게 유지되도록 한다.null
참조
- ^ Aiba, H; Mizuno, T (12 February 1990). "Phosphorylation of a bacterial activator protein, OmpR, by a protein kinase, EnvZ, stimulates the transcription of the ompF and ompC genes in Escherichia coli". FEBS Letters. 261 (1): 19–22. doi:10.1016/0014-5793(90)80626-t. PMID 2407554.
- ^ Cai, SJ; Inouye, M (5 July 2002). "EnvZ-OmpR interaction and osmoregulation in Escherichia coli". The Journal of Biological Chemistry. 277 (27): 24155–61. doi:10.1074/jbc.m110715200. PMID 11973328.
- ^ Srividhya, K. V.; Krishnaswamy, Sankaran (2004-11-30). "A simulation model of Escherichia coli osmoregulatory switch using E-CELL system". BMC Microbiology. 4: 44. doi:10.1186/1471-2180-4-44. ISSN 1471-2180. PMC 543474. PMID 15571621.
- ^ Gross, R.; Aricò, B.; Rappuoli, R. (1989-11-01). "Families of bacterial signal-transducing proteins". Molecular Microbiology. 3 (11): 1661–1667. doi:10.1111/j.1365-2958.1989.tb00152.x. ISSN 1365-2958. PMID 2559300.
- ^ a b Wang, Loo Chien; Morgan, Leslie K.; Godakumbura, Pahan; Kenney, Linda J.; Anand, Ganesh S. (2012-05-30). "The inner membrane histidine kinase EnvZ senses osmolality via helix‐coil transitions in the cytoplasm". The EMBO Journal. 31 (11): 2648–2659. doi:10.1038/emboj.2012.99. ISSN 0261-4189. PMC 3365433. PMID 22543870.
- ^ a b Foo, Yong Hwee; Gao, Yunfeng; Zhang, Hongfang; Kenney, Linda J. (2015-09-01). "Cytoplasmic sensing by the inner membrane histidine kinase EnvZ". Progress in Biophysics and Molecular Biology. Mechanism of Transmembrane Signaling. 118 (3): 119–129. doi:10.1016/j.pbiomolbio.2015.04.005. PMC 5080436. PMID 25937465.
- ^ a b c Egger, L. A.; Park, H.; Inouye, M. (1997-03-01). "Signal transduction via the histidyl-aspartyl phosphorelay". Genes to Cells: Devoted to Molecular & Cellular Mechanisms. 2 (3): 167–184. doi:10.1046/j.1365-2443.1997.d01-311.x. ISSN 1356-9597. PMID 9189755.