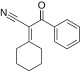
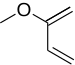
역전자 수요 디엘-알더 반응
Inverse electron-demand Diels–Alder reaction역전자 수요 디엘스-알더 반응 또는INV DA 또는 IEDDA는[1] 유기 화학 반응으로 두 개의 새로운 화학 결합과 여섯 개의 embed 링이 형성된다.디엘스-알데르 반응과 관련이 있지만 디엘스-알데르(또는 DA)[2] 반응과 달리 DA는INV 전자가 풍부한 디엔과 전자가 빈약한 디엔 사이의 사이클로어다.DAINV 반응 중에 파이본드 3개가 깨지고 시그마 본드 2개와 새로운 파이본드 1개가 형성된다.오른쪽에는 전형적인 DAINV 반응이 나타나 있다.
DAINV 반응은 종종 이질화합물을 포함하며, 이질화합물을 형성하는 데 사용될 수 있다.이것은 대상 화합물이 종종 이성질체를 포함하는 천연물 합성물에 특히INV DA 반응을 유용하게 만든다.최근, DAINV 반응은 전립선 암을 대상으로 하는 약물 수송 시스템을 합성하는 데 사용되고 있다.[3]
역사
Diels-Alder 반응은 오토 디엘스와 커트 알더에 의해 1928년에 처음 보고되었다. 그들은 1950년에 그들의 업적으로 노벨 화학상을 받았다.그 이후 디엘-알데르 반응의 이용이 널리 퍼졌다.반대로 DA는INV 개시일이 명확하지 않고 표준 Diels-Alder 반응의 비교우위가 부족하다.DA는INV 화학자들이 현대적인 계산법이 등장하기 전에 반 전자 수요 디엘-알더 반응과 정상 반응을 구별하는 데 어려움을 겪었기 때문에 명확한 발견 날짜를 가지고 있지 않다.[4]다른 작가들이 이 주제에 대한 수많은 논문을 발표했음에도 불구하고, 이 분야의 많은 작품들은 데일 보거 덕분이다.[2][5]
메커니즘
형식 메커니즘
DAINV 반응의 메커니즘은 논란의 여지가 있다.형식적인 [4+2] 사이클로어 추가로 받아들여지지만, 그 반응이 진정으로 일치하는지 여부는 잘 파악되지 않는다.대부분의 DAINV 반응은 비동기 메커니즘을 통해 발생한다는 것이 일반적인 견해다.반응은 하나의 전환 상태를 통해 진행되지만, 결합 메커니즘에서처럼 모든 결합이 동시에 형성되거나 깨지는 것은 아니다.[2]
아크로레인과 메틸비닐에테르 반응에 대한 공식 DAINV 메커니즘은 오른쪽 그림에서 볼 수 있다.완전히 정확한 것은 아니지만, 반응에 유용한 모델을 제공한다.반응 과정에서 3개의 파이본드(빨간색 라벨)가 깨지고, 2개의 시그마 본드와 1개의 새로운 파이본드(파란색 라벨)가 새로 형성된다.[6]
전환 상태
표준 DA와 마찬가지로, DAINV 반응은 결합되지 않았음에도 불구하고 단일 보트 전환 상태를 통해 진행된다.단일 보트 전환 상태는 단순화되지만, DFT 계산에 따르면
채권 소멸과 형성의 시차가 미미하며, 잠재적 비동기성에도 불구하고 반응이 일치하며, 관련 채권은 반응 중 어느 시점에 부분적으로 깨지거나 부분적으로 형성된다.[7]DA의INV 거의 동시성은 표준 Diels-Alder 반응과 유사하게 처리될 수 있다는 것을 의미한다.[2]
이 반응은 모든 결합이 어느 특정 지점에서 형성되거나 깨지는 과정에 있는 보트 같은 폐쇄적인 전환 상태를 사용하여 모델링될 수 있으므로 우드워드-호프만 일반 선택 규칙을 준수해야 한다.즉, 3개의 성분인 6개의 전자계통의 경우 모든 성분은 초임파적 방식(또는 초임파적 방식 1개와 안타르식 방식 2개)으로 상호작용해야 한다.모든 구성요소가 비대칭인 상태에서, 허용된 전이 상태는 보트 같다; 의자와 같은 전이 상태는 세 개의 전자 난타성 구성요소를 야기할 것이다.의자 같은 케이스는 우드워드-호프만 규정에 의해 열적으로 허용되지 않는다.[6]
분자 궤도 이론
표준 DA 반응
표준 디엘-알더 반응에는 전자 부자인 디엔과 전자 빈민인 디엔의 두 가지 성분이 있다.반응물질의 상대적인 전자적 풍부함과 전자적 결핍은 분자 궤도 다이어그램에서 시각적으로 가장 잘 설명할 수 있다.표준 Diels-Alder에서, 전자 리치 디엔은 분자 궤도가 빈약한 전자 디엔오필리의 궤도보다 더 높은 에너지를 가지고 있다.상대 궤도 에너지의 차이는, 국경 지역의 분자 궤도의 HOMO은 디엔(HOMOdiene)과 루모는 친 디엔체(LUMOdienophile)을 더 에너지의 HOMOdienophile고 LUMOdiene보다 유사점을 의미한다.[2][8]가장 강한 궤도 상호 작용이 가장 비슷한 개척자 분자 궤도:HOMOdiene과 LUMOdienophile 사이에 있다.
[4+2] 조광 반응
조광 반응은 보통 또는 반비례적으로 가속되지 않으며, 일반적으로 항복률이 낮다.이 경우 두 명의 모노머가 DA 방식으로 반응한다.궤도 에너지는 동일하기 때문에, 디엔이나 디엔오필드의 호모나 루모의 상호작용에 대한 선호도는 없다.조광 반응의 낮은 수율은 2차 섭동 이론에 의해 설명된다.각 종의 LUMO와 HOMO는 보통 또는 역가속된 Diels-Alder보다 조광화에서 에너지에서 더 멀리 떨어져 있다.이는 궤도상의 교호작용이 적고, 조광화를 위한 열역학적 구동력이 낮다는 것을 의미한다.[2]

전자 수요가 역방향인 Diels-Alder
조광 반응에서 디엔과 디엔오필은 똑같이 전자 부(또는 똑같이 전자 빈약)가 많았다.만약 디엔이 조금이라도 덜 전자가 풍부해진다면, 혹은 더 이상 디엔오필드가 된다면, 가능한 [4+2] 사이클로어드 추가 반응은 DAINV 반응일 것이다.DAINV 반응에서 LUMO와diene HOMO는dienophile HOMO와diene LUMO보다dienophile 에너지에 더 가깝기 때문에, LUMO와dienedienophile HOMO는 가장 강하게 상호작용하는 프런티어 궤도로서, 가장 정력적으로 유리한 결합 형성을 초래한다.[2][7][9]
DA의INV 레지화학 및 입체화학
레지화학
DAINV 반응에서의 레지화학은 많은 경우에 신뢰성 있게 예측될 수 있다.이것은 정전기(충전) 제어 또는 궤도 제어를 통해 두 가지 방법 중 하나를 수행할 수 있다.[2][7][9]전하 제어를 통해 섭생화학을 예측하려면 반응제의 공명 형태를 고려해야 한다.이 공진 형태는 각 원자에 부분 전하를 할당하는 데 사용될 수 있다.디엔의 부분적인 음의 원자는 디엔오피스의 부분적인 양의 원자와 결합하며, 그 반대도 마찬가지다.
궤도 제어를 통해 반응의 역화학성을 예측하려면 반응 물질의 각 원자에 대한 상대 궤도 계수를 계산해야 한다.[7]디에노파일의 호모(HOMO)는 디엔의 루모와 반응한다.각 원자의 상대 궤도 크기는 프론티어 분자 궤도 이론(FMO)의 궤도 계수로 표현된다.궤도는 접합 상호작용을 최대화하고 접합 방지 상호작용을 최소화하도록 정렬된다.
알더-슈타인 원리
알더-슈타인 원리는 디엘-알더 반응 시 반응물질의 입체화학이 제품의 입체화학에서 유지된다는 것을 말한다.이는 제품에서 출발 물질에서 서로 관련되었던 그룹이 서로 동기화되고, 출발 물질에서 서로 교환된 그룹은 제품에서 반대가 된다는 것을 의미한다.
알더-슈타인 원칙은 두 개의 출발 물질에 대한 그룹의 상대적 방향과는 아무런 관계가 없다는 점에 유의해야 한다.이 원리를 통해서 다이엔의 대체물이 다이엔의 대체물이 다이엔의 대체물과 동조될 것인지 아니면 반대할 것인지 예측할 수 없다.알더-슈타인 원칙은 동일한 출발 재료에 걸쳐 일관성이 있을 뿐이다.그 관계는 다이엔에 있는 그룹이나, 디엔오피스에 있는 그룹에만 유효하다.두 반응제 사이의 상대적 방향은 엔도 선택 규칙에 의해 예측할 수 있다.
Endo 선택 규칙
표준 Diels-Alder 반응과 유사하게, DA는INV 일반적인 엔도 선택 규칙을 준수한다.표준 Diels-Alder에서는 디엔에 대해 디엔에노필드에서 전자 인출 그룹이 엔도에 접근하는 것으로 알려져 있다.이러한 선택성의 정확한 원인은 여전히 논의되고 있지만, 가장 많이 받아들여지는 견해는 엔도 접근법이 2차 궤도 중첩을 최대화한다는 것이다.[10]
DA는INV 전자 기부 대체물을 디에노필드에 제공하는 엔도 방향성을 선호한다.모든 디엘-알데르 반응은 보트 전환 상태를 통해 진행되기 때문에 전환 상태의 "내부"와 "외부"가 있다("보트 안과 밖").다이노필드의 대체물은 배 안쪽에 '엔도'가 있고, 외부에 있으면 '엑소'가 된다.
엑소 통로는 스테틱스가 선호하기 때문에 엔도 제품의 일반적인 우세를 정당화하기 위해 다른 설명이 필요하다.프런티어 분자 궤도 이론은 이 결과를 설명하는데 사용될 수 있다.다이노필드의 대체물이 엑소일 때, 그 대체물과 다이엔 사이에는 상호작용이 없다.그러나, 이뇨제 대체물이 엔도일 때, 이뇨제와 상당한 궤도 중첩이 있다.DA의INV 경우, 전자 인출 대체물과 디엔의 궤도의 겹침은 우호적인 결합 상호작용을 일으켜 엑소 전환 상태에 상대적인 전환 상태를 안정화시킨다.[7]낮은 활성화 에너지에 대한 반응은 더 큰 속도로 진행될 것이다.[7]
코먼다이엔
역전자 수요 디엘-알데르에 사용되는 디엔은 전자 결핍 종으로 디엔이 전자가 풍부한 표준 디엘-알데르에 비해 상대적으로 전자 결핍 종이다.전자가 부족한 이 종들은 표준 DA보다 낮은 분자 궤도 에너지를 가지고 있다.이러한 감소된 에너지는 A) 전자 인출 그룹 또는 B) 전기적 이질성 중 하나를 포함함으로써 발생한다.방향성 화합물은 또한 3가지나 테트라진과 같은 DAINV 반응에서도 반응할 수 있다.디엔의 다른 흔한 계급은 황소와 아자 부타디엔이다.[9][11]
좋은 DAINV diene의 핵심 품질은 표준 DA dienes에 비해 현저히 낮은 HOMO와 LUMO이다.아래 표는 일반적으로 사용되는 몇 개의 DA dienesINV, 그들의 HOMO 및 LUMO 에너지, 그리고 몇몇 표준 DA dienes를 각각의 MO 에너지와 함께 보여준다.[2][12][13][14]
| 디엔 | 이름 | 호모 에너지(eV) | LUMO 에너지(eV) | 반응 경로(DA/DAINV) |
|---|---|---|---|---|
| 2-사이클로헥실리덴-3-옥소-3-제스틸프로파니트릴레 | -9.558 | 2.38 | DAINV | |
| 아크로리인 | -14.5 | 2.5 | DAINV | |
| 5-사이클로펜틸리딘-1,3-디메틸피리미딘-2,4,6(1H,3H,5H)-트리온 | -10.346 | 1.879 | DAINV | |
| 부타디엔 | -10.346 | 1.879 | DA 또는 DAINV | |
| 1-메톡시부타디엔 | -8.21 | 3.77 | D A | |
| 2,3-아세틸부타디엔 | -8.76 | 2.18 | D A |
공동이열성체
역전자 수요 디엘-알더 반응에 사용되는 디엔로필드는 표준 DA와 달리 전자 기부가 매우 풍부하며, 1개 이상의 전자 기증 그룹을 포함하고 있다.이것은 더 높은 궤도 에너지를 초래하고, 따라서 더 많은 궤도 에너지가 디엔의 LUMO와 겹치게 된다.DAINV 반응을 위한 디네오필드의 일반적인 등급은 비닐에테르와 비닐 아세탈, 이미네, 에나민, 알키네, 그리고 매우 긴장된 올레핀을 포함한다.[11][14]
디에노필드를 선택할 때 가장 중요한 고려사항은 상대 궤도 에너지다.HOMO와 LUMO 모두 반응의 속도와 선택성에 영향을 미친다.일반적인 DAINV dienophiles, 표준 DA dienophiles 및 각 MO 에너지의 표를 아래에서 확인할 수 있다.[2][7][12]
| 디에노필레 | 이름 | 호모 에너지(eV) | LUMO 에너지(eV) | 반응 경로(DA/DAINV) |
|---|---|---|---|---|
| 에틸 비닐에테르 | -9.006 | 5.313 | DAINV | |
| 2-메틸넷트라하이드로-2H피란 | -8.939 | 5.140 | DAINV | |
| 1,1'-bis(사이클로펜틸리덴) | -8.242 | 4.749 | DAINV | |
| 아크로리인 | -14.5 | 2.5 | D A | |
| 사이클로헥센 | -8.94 | 2.1 | D A | |
| 프로펜 | -9.13 | 1.8 | D A | |
| 에틸렌 | -10.52 | 1.5 | D A |
두 번째 표는 디에노필드의 전자 풍부함이 매우 전자적으로 빈약한 디엔, 즉 헥사클로클로프로펜타디엔과의 반응 속도에 어떻게 영향을 미치는지 보여준다.디에노파일이 전자적으로 풍부할수록 반응속도는 더 높아질 것이다.이것은 스티렌과 덜 풍부한 전자 p-니트로스티렌의 상대적인 반응 비율을 비교할 때 매우 명백하다; 전자에 풍부한 스티렌은 p-니트로스티렌보다 대략 40% 더 빨리 반응한다.[5]
| 디에노필레 | 상대 반응 속도: |
|---|---|
| 사이클로펜타디엔 | 15200 |
| p-메톡시스티렌 | 1580 |
| 스티렌 | 750 |
| p-니트로스티렌 | 538 |
| 2,3-디히드로푸란 | 333 |
| 노르보르네 | 70.8 |
| 사이클로펜틴 | 59.0 |
| 말레틱 무수화물 | 29.1 |
| 사이클로헥센 | 3.0 |
범위 및 애플리케이션
DAINV 반응은 풍부한 합성 대상 도서관으로 가는 길을 제공하며,[7][11] 설탕 화학 분야에 중요한 공헌인 선택적으로 보호되는 당분을 포함한 많은 고기능화된 시스템을 형성하는데 이용되어 왔다.[15]또한, DAINV 반응은 테트라진과 같은 단일 시작 재료에서 다양한 제품을 생산할 수 있다.[2][13]
두오카미신 시리즈의 모화합물(--CC-1065)을 포함한 여러 천연물의 합성에 DA반응이INV 활용되어 항암치료제로 활용되고 있다.이 시리즈의 몇몇 약물 후보자들이 임상시험에 진출했다.DAINV 반응은 (--CC-1065)의 PDE-I와 PDE-II 부분을 합성하는 데 사용되었다.이 시퀀스의 첫 번째 반응은 테트라진과 비닐 아세트 사이의 DAINV 반응이며, 1,2-다이아진 제품을 구입할 수 있는 레트로-딜-알데르 반응이다.몇 걸음 더 걸으면 인돌린 제품을 살 수 있는 복고 디엘-알더에 이어 근육내 DA 반응이INV 일어난다.이 인돌린은 몇 가지 합성 단계에서 PDE-I 또는 PDE-II로 변환된 것이다.
2,3,4,5-tetrachlorothiophene-1,1-dioxide(다이엔)와 4,7-dihydroisoindole(다이엔) 파생상품(다이노필레) 사이의INV DA 반응은 과염소화 방향성 링을 포함하는 테트라나프톨포폴피린(TNP)의 새로운 전구제를 제공했다.이 전구체는 방향성 알데히드를 포함한 루이스 산성화 응축과 DDQ에 의해 상응하는 포르피린으로 변형될 수 있다.TNP 시스템의 폴리염소화효과는 용해도에 매우 유리하다.부모 사타입포폴피린들의 무거운 집적과 빈약한 용해성은 잠재적으로 매우 가치가 있는 이 포피린 계열의 유용성을 심각하게 떨어뜨린다.따라서 폴리염소화효과는 매우 환영할 만하다.용해도에 미치는 영향 외에도 폴리염소화효과는 광산화효소에 대한 이들 화합물의 안정성을 실질적으로 향상시키는 것으로 나타났는데, 이는 테트라나프톨포폴피린(tetranaphtholpolphyrin)의 또 다른 심각한 단점으로 알려져 있다.[16]
참고 항목
외부 링크
참조
- ^ Bodwell, Graham J.; Zulan Pi; Ian R. Pottie (1999). "Electron Deficient Dienes. 2. One Step Synthesis of a Coumarin-Fused Electron Deficient Diene and its Inverse Electron Demand Diels–Alder Reactions with Enamines" (PDF). Synlett. 1999 (4): 477–479. CiteSeerX 10.1.1.532.5783. doi:10.1055/s-1999-2645. Archived from the original (PDF) on 25 August 2005. Retrieved 31 March 2013.
- ^ a b c d e f g h i j k Boger, Dale (1989). Progress in heterocyclic chemistry (1st ed.). New York: Pergamon. ISBN 978-0-08-037044-6.
- ^ Weissler, M (2010). "The Diels-Alder-Reaction with inverse-Electron-Demand, a very efficient versatile Click-Reaction Concept for proper Ligation of variable molecular Partners" (PDF). International Journal of Medical Sciences. 7 (1): 19–28. doi:10.7150/ijms.7.19. PMC 2792734. PMID 20046231.
- ^ Fleischhauer J, Asaad AN, Schleker W, Scharf HD (1981). "Zur Problematik der Einteilung von Diels-Alder-Reaktionen in "normale" und "inverse"" [On the Difficulty of Classifying Diels-Alder-Reactions into “Normal” and “Inverse”]. Liebigs Annalen der Chemie (in German). 1981 (2): 306–311. doi:10.1002/jlac.198119810214. ISSN 0170-2041.
- ^ a b Sauer, J.; Wiest, H. (21 May 1962). "Diels-Alder-Additionen mit "inversem" Elektronenbedarf". Angewandte Chemie. 74 (10): 353. doi:10.1002/ange.19620741006.
- ^ a b Woodward, R (1 January 1959). "The mechanism of the Diels-Alder reaction". Tetrahedron. 5 (1): 70–89. doi:10.1016/0040-4020(59)80072-7.
- ^ a b c d e f g h Rooshenas, Parham; Hof, Kira; Schreiner, Peter R.; Williams, Craig M. (1 February 2011). "1,2,4-Triazine vs. 1,3- and 1,4-Oxazinones in Normal- and Inverse-Electron-Demand Hetero-Diels-Alder Reactions: Establishing a Status Quo by Computational Analysis". European Journal of Organic Chemistry. 2011 (5): 983–992. doi:10.1002/ejoc.201001365.
- ^ Hoffmann, Roald; Woodward, Robert B. (1 January 1968). "Conservation of orbital symmetry". Accounts of Chemical Research. 1 (1): 17–22. doi:10.1021/ar50001a003.
- ^ a b c Dang, Anh-Thu; Miller, David O.; Dawe, Louise N.; Bodwell, Graham J. (1 January 2008). "Electron-Deficient Dienes. 5. An Inverse-Electron-Demand Diels−Alder Approach to 2-Substituted 4-Methoxyxanthones and 3,4-Dimethoxyxanthones". Organic Letters. 10 (2): 233–236. doi:10.1021/ol702614b. PMID 18092790.
- ^ García JI, Mayoral JA, Salvatella L (2005). "The Source of the endoRule in the Diels−Alder Reaction: Are Secondary Orbital Interactions Really Necessary?". European Journal of Organic Chemistry. 2005 (1): 85–90. doi:10.1002/ejoc.200400424. ISSN 1434-193X.
- ^ a b c Pottie, Ian; Nandaluru, Penchal; Bodwell, Graham (30 August 2011). "An Inverse Electron-Demand Diels-Alder-Based Total Synthesis of Urolithin M7". Synlett. 2011 (15): 2245–2247. doi:10.1055/s-0030-1261203.
- ^ a b Flemming, Ian (2010). Molecular Orbitals and Organic Chemical Reactions. Great Britain: Wiley. ISBN 978-0-470-74658-5.
- ^ a b Figeys, H.P.; Mathy, A. (1 January 1981). "Diels-alder reactions with inverse electron demand. II. The reaction of benzamidine with π-deficient heteroaromatic compounds". Tetrahedron Letters. 22 (15): 1393–1396. doi:10.1016/S0040-4039(01)90330-2.
- ^ a b Pałasz, Aleksandra; Pałasz, Tadeusz (18 February 2011). "Knoevenagel condensation of cyclic ketones with benzoylacetonitrile and N,N′-dimethylbarbituric acid. Application of sterically hindered condensation products in the synthesis of spiro and dispiropyrans by hetero-Diels–Alder reactions". Tetrahedron. 67 (7): 1422–1431. doi:10.1016/j.tet.2010.12.053.
- ^ Boger, Dale L.; Robarge, Kirk D. (1 November 1988). "Divergent de novo synthesis of carbohydrates based on an accelerated inverse electron demand Diels-Alder reaction of 1-oxa-1,3-butadienes". The Journal of Organic Chemistry. 53 (24): 5793–5796. doi:10.1021/jo00259a040.
- ^ Filatov, M.A.; Cheprakov, A. V. (2011). "The synthesis of new tetrabenzo- and tetranaphthoporphyrins via the addition reactions of 4,7-dihydroisoindole". Tetrahedron. 67 (19): 3559–3566. doi:10.1016/j.tet.2011.01.052.