장기위력
Long-term potentiation
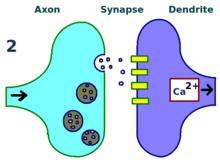
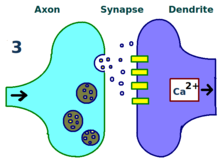
신경과학에서 장기전위제(LTP)는 최근의 활동 패턴을 바탕으로 시냅스를 지속적으로 강화하는 것이다.이것들은 두 뉴런 사이의 신호 전달의 지속적 증가를 만들어 내는 시냅스 활동의 패턴이다.[2]LTP의 반대는 장기불황으로 시냅스 강도의 감소가 오래 지속된다.
그것은 화학적 시냅스의 강도를 변화시키는 능력인 시냅스 가소성의 기초가 되는 몇 가지 현상 중 하나이다.기억은 시냅스 강도의 변경에 의해 암호화되는 것으로 생각되기 때문에 LTP는 학습과 기억의 기초가 되는 주요한 세포 메커니즘 중 하나로 널리 여겨진다.[3][2][3]
LTP는 1966년 테르예 뢰모에 의해 토끼해마에서 발견되었고 그 이후로도 인기 있는 연구 주제로 남아있다.많은 현대 LTP 연구들은 그것의 기본적인 생물학을 더 잘 이해하려고 하는 반면, 다른 연구들은 LTP와 행동 학습 사이의 인과 관계를 이끌어 내는 것을 목표로 한다.그럼에도 불구하고, 다른 사람들은 학습과 기억력을 향상시키기 위해 LTP를 향상시키는 방법을 약리학적이든 그렇지 않든 개발하려고 노력한다.LTP는 예를 들어 알츠하이머병과 중독의학 분야에서 임상연구의 대상이기도 하다.
역사
학문의 초기이론
19세기 말에 과학자들은 일반적으로 성인의 뇌에 있는 뉴런의 수(1000억[4] 개)가 나이가 들면서 크게 증가하지 않는다는 것을 인식하여 신경생물학자들이 기억은 일반적으로 새로운 뉴런 생산의 결과가 아니라고 믿을 만한 충분한 이유를 제공하였다.[5]이러한 깨달음과 함께 새로운 뉴런이 없을 때 기억들이 어떻게 형성될 수 있는지를 설명할 필요가 생겼다.
스페인의 신경 원자학자 산티아고 라몬 이 카잘은 새로운 뉴런의 형성을 요구하지 않는 학습 메커니즘을 최초로 제안한 사람들이다.1894년 크로오니아 강의에서 그는 기존의 뉴런들 사이의 연결을 강화하여 대신 기억들이 형성되어 의사소통의 효과를 향상시킬 수 있을 것이라고 제안했다.[5]도날드 헵이 1949년 도입한 헤비안 이론은 라몬 이 카잘의 생각을 그대로 반영하면서, 세포가 새로운 연결고리를 자라게 하거나 의사소통 능력을 향상시키고 경험의 신경망을 만드는 대사 및 시냅스적 변화를 겪게 할 것을 추가로 제안했다.[6]
잔향 활동의 지속성 또는 반복성(또는 "추적")이 그 안정성을 더하는 지속적인 세포 변화를 유도하는 경향이 있다고 가정해 보자....세포 A의 축이 세포 B를 흥분시킬 만큼 가까이 있고 그것을 발사하는 데 반복적으로 또는 집요하게 참여할 때, 어떤 성장 과정이나 신진대사의 변화가 하나 또는 두 개의 세포에서 일어나, 세포 중 하나가 B를 발사하는 것처럼 A의 효율이 높아진다.[7]
에릭 칸델(1964)과 동료들은 바다 민달팽이 압리시아와 함께 일하는 동안 장기적 위력을 발견한 최초의 연구자들 중 일부였다.그들은 슬러그의 신경망에 있는 다른 세포에 행동 조건화를 적용하려고 시도했다.그들의 결과는 시냅스 강도의 변화를 보여주었고 연구원들은 이것이 슬러그 안에서 일어나는 기본적인 형태의 학습 때문일 수 있다고 제안했다.[8][9]
이러한 기억 형성에 대한 이론들이 지금은 잘 정립되어 있지만, 그들은 그 시대 동안 원시적인 것이었다: 19세기 말과 20세기 초의 신경과학자들과 심리학자들은 동물에서의 학습의 생물학적 기초를 해명하는 데 필요한 신경생리학 기술을 갖추지 못했다.이러한 기술들은 20세기 후반에 이르러서야, 장기적 위력의 발견과 거의 동시에 도래할 것이다.
디스커버리
LTP는 페르 안데르센의 실험실인 노르웨이 오슬로에서 1966년 테르예 뢰모가 처음 관찰한 것이다.[10][11]그곳에서 뢰모는 마취된 토끼에 대해 일련의 신경생리학 실험을 실시해 단기 기억에서 해마의 역할을 탐색했다.
뢰모의 실험은 천공 경로에서 덴트산 회오리까지의 연결부 또는 시냅스에 초점을 맞췄다.이러한 실험은 천공 경로의 사전 시냅스 섬유들을 자극하고, 덴트산 회색의 시냅스 후 세포들의 집합으로부터 반응을 기록함으로써 수행되었다.예상대로 천공 경로의 섬유에 대한 전기 자극의 한 맥박은 덴트산 회루의 세포에 흥분성 후 전위(EPSP)를 일으켰다.뢰모가 예기치 않게 관찰한 것은 그가 먼저 시냅스 섬유에 자극의 고주파 열차를 전달하면 이러한 단펄스 자극에 대한 시냅스 후 세포의 반응이 장기간 향상될 수 있다는 것이었다.그러한 일련의 자극이 적용되었을 때, 후속 단일 펄스 자극은 시냅스 세포군에서 더 강하고 장기적인 EPSP를 이끌어냈다.고주파 자극에 의해 시냅스 후 세포의 후속 단펄스 자극에 대한 반응에 장기간의 강화가 발생할 수 있는 이 현상을 처음에는 "장기 지속력"이라고 불렀다.[12][13]
1968년 안데르센 연구소에 입사한 티모시 블리스는 [10]뢰모와 협력했고 1973년 두 사람은 토끼해마에서 오래 지속되는 힘을 가진 최초의 특성화를 발표했다.[12]Bliss와 Tony Gardner-Medwin은 Bliss와 Lømo 보고서와 같은 이슈에 나타난 깨어있는 동물에서 오래 지속되는 위력에 대한 유사한 보고서를 발표했다.[13]1975년 더글라스와 고다드는 "장기적인 위력"을 오랫동안 지속되는 위력 현상의 새로운 이름으로 제안했다.[14][15]안데르센은 저자들이 "장기적 위력"을 선택한 이유는 쉽게 발음되는 약어 "LTP"[16] 때문일 것이라고 제안했다.
모델과 이론
LTP의 물리적, 생물학적 메커니즘은 여전히 이해되지 않지만, 일부 성공적인 모델은 개발되었다.[1] 덴드라이트의 돌출된 구조물인 덴드라이트성 척추에 대한 연구는 세포내 칼슘 과도현상과의 관계로 인해 척추의 전기 저항과 효과적인 시냅스 강도의 관계를 제시했다.NMDA 수용체 전압 게이트와 관련해서도 세포내 칼슘에 의존하는 BCM 이론과 같은 수학적 모델은 1980년대부터 개발되어 생물학적, 실험적 정당성을 모두 갖춘 전통적인 아에비안 학습 모델을 수정하고 있다.그러나 다른 이들은 수용체 조절, LTP, 시냅스 강도의 관계를 재구성하거나 동기화할 것을 제안했다.[17]
종류들
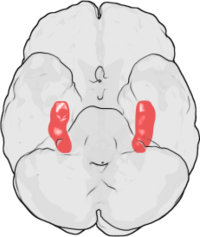
토끼해마에서 처음 발견된 이후 LTP는 대뇌피질,[18] 소뇌,[19] 편도 [20]등 다양한 신경구조에서 관찰됐다.저명한 LTP 연구원인 로버트 말렌카는 LTP가 포유류 뇌의 모든 흥분성 시냅스에서도 발생할 수 있다고 제안했다.[21]
뇌의 다른 부위는 다른 형태의 LTP를 나타낸다.뉴런 사이에 나타나는 LTP의 구체적인 유형은 여러 가지 요인에 따라 다르다.그러한 요소 중 하나는 LTP가 관찰되는 유기체의 나이다.예를 들어, 미성숙 해마에서 LTP의 분자 메커니즘은 성인 해마의 LTP에 기초하는 메커니즘과 다르다.[22]특정 셀이 사용하는 신호 전달 경로도 존재하는 LTP의 특정 유형에 기여한다.예를 들어, 해마의 일부 유형은 NMDA 수용체에 의존하고, 다른 유형은 메타보틱 글루타민 수용체(mGluR)에 의존할 수 있지만, 다른 유형은 다른 분자에 전적으로 의존한다.[21]LTP에 기여하는 다양한 신호 경로와 뇌의 이러한 다양한 경로의 광범위한 분포는 뉴런 사이에 나타나는 LTP 유형이 LTP가 관찰되는 해부학적 위치에만 의존하는 이유들이다.예를 들어 해마의 샤퍼 측부 경로에 있는 LTP는 NMDA 수용체 의존적이다. 이는 NMDA 수용체에 대한 길항제인 AP5를 적용하여 이 경로에서 LTP를 방지함으로써 증명되었다.[23]반대로 이끼가 낀 섬유 경로의 LTP는 NMDA 수용체 독립적이며, 두 경로 모두 해마에 있다.[24]
LTP 유도에 필요한 시냅스 전 및 후 활동은 LTP를 분류하는 다른 기준이다.대체로 이것은 Hebbian, 비 Hebbian, 반 Hebbian 메커니즘으로 LTP를 분류할 수 있다.헤비안 LTP는 "함께 불을 지르는 세포"라는 격언으로 요약된 헵의 추론에서 그 이름을 빌려, 그 유도를 위해 시냅스 전후 동시 분극화를 요구한다.[25]비헤비안 LTP는 시냅스 전 세포와 후 세포를 동시에 탈극화할 필요가 없는 LTP의 한 유형이다. 그 예는 이끼 낀 섬유 해마 경로에서 발생한다.[26]헤비안 LTP가 아닌 특별한 경우, 헤비안 LTP는 그 유도를 위해 동시 사전 시냅스 탈분극화와 상대적 시냅스 후 고폴라화를 명시적으로 요구한다.[27]
예측 가능한 조직과 쉽게 유도할 수 있는 LTP 때문에, CA1 해마는 포유류 LTP 연구의 원형 현장이 되었다.특히 성인 CA1 해마에서 NMDA 수용체 의존성 LTP는 가장 널리 연구된 LTP 유형으로,[21] 따라서 이 글의 초점이다.
특성.
NMDA 수용체 의존성 LTP는 입력 특이성, 연관성, 협력성, 지속성 등 여러 특성을 보인다.
- 입력특성
- 일단 유도되면, 한 시냅스의 LTP는 다른 시냅스로 확산되지 않는다. 오히려 LTP는 입력된다.장기적 위력은 연상성과 협력성의 규칙에 따라서만 그 시냅스에 전파된다.단, LTP의 입력 특수성은 단거리에서 불완전할 수 있다.[citation needed]LTP의 입력 특이성을 설명하는 하나의 모델은 1997년 Frey와 Morris에 의해 제시되었으며 시냅스 태깅과 캡쳐 가설이라고 불린다.[28]
- 연관성
- 연관성은 단일 경로의 약한 자극이 LTP 유도에 불충분할 때 다른 경로의 동시 강한 자극이 양쪽 경로에서 LTP를 유도한다는 관찰을 말한다.[29]
- 협력성
- LTP는 시냅스로 가는 단일 경로의 강한 사탄 자극에 의해 유도되거나 다수의 약한 자극을 통해 협력적으로 유도될 수 있다.시냅스로 들어가는 한 통로가 약하게 자극되면 시냅스 후 탈분극화가 불충분해 LTP를 유도한다.대조적으로, 약한 자극이 시냅스 후 막의 단일 패치에 수렴되는 많은 경로에 적용될 때, 생성된 개별 시냅스 후 탈분극화는 LTP를 협력적으로 유도할 수 있을 만큼 시냅스 후 셀을 집단적으로 탈분극화할 수 있다.나중에 논의되는 시냅스 태깅은 연관성과 협력성에 기초하는 일반적인 메커니즘일 수 있다.브루스 맥노튼은 연상성과 협력성의 어떤 차이도 엄밀히 말하면 의미적이라고 주장한다.[30]일련의 개별 덴드리틱 가시를 자극하여 수행된 실험에서는 인접한 두 개의 덴드리틱 가시가 시냅스 공동성을 발휘하면 LTD(장기 우울증)를 예방하여 LTP만 허용하는 것으로 나타났다.[31]
초기 단계
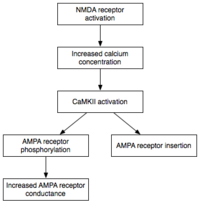
유지 관리
유도에는 CaMKIII와 PKC의 일시적 활성화가 수반되지만, E-LTP(초기형 LTP)의 유지보수는 지속적인 활성화가 특징이다.이 단계에서는 칼슘에 의존하지 않는 PKMz(Protein kinase Mζ)가 자율적으로 활동하게 된다.따라서 그들은 E-LTP 표현의 기초가 되는 인산화 이벤트를 수행할 수 있다.[34]
표현
인산염은 작은 인산염 그룹이 다른 분자에 첨가되어 그 분자의 활동을 변화시키는 화학 반응이다.자율적으로 활동하는 CaMKII와 PKC는 인산화를 사용하여 E-LTP의 발현에 기초하는 두 가지 주요 메커니즘을 수행한다.첫째, 그리고 가장 중요한 것은 기존 AMPA 수용체를 인산화하여 활동성을 증가시킨다.[21]둘째, 그들은 추가적인 AMPA 수용체들의 삽입을 시냅스 후 막에 중재하거나 변조한다.[21]중요한 것은 E-LTP 중 시냅스에 대한 AMPA 수용체 전달은 단백질 합성과 무관하다는 점이다.이것은 시냅스 후 막에 인접한 비시냅스 AMPA 수용체를 보유함으로써 달성된다.적절한 LTP 유도 자극이 도착하면 비시냅스 AMPA 수용체는 단백질 키나제의 영향으로 시냅스 후 막으로 빠르게 밀거래된다.[35]앞서 언급한 바와 같이 AMPA 수용체는 뇌에서 가장 풍부한 글루탐산염 수용체로서 그 흥분 활동의 대부분을 매개한다.시냅스에서 AMPA 수용체의 효율과 수를 증가시킴으로써, 미래의 흥분 자극은 시냅스 후 반응을 더 크게 만든다.
상기 E-LTP 모델은 유도, 유지 및 표현에 대한 시냅스 후 메커니즘을 전체적으로 기술하고 있지만, 표현의 추가 구성요소는 사전적응적으로 발생할 수 있다.[36]이러한 사전 시냅스 촉진에 대한 하나의 가설은 지속적인 CaMK이다.E-LTP 동안 시냅스 후 셀에서의 II 활동은 나중에 논의된 "역행 메신저"의 합성을 초래할 수 있다.이 가설에 따르면 새로 합성된 메신저는 시냅스 후에서 시냅스 전세포로 시냅스 구분을 가로질러 이동하며, 이후 자극에 대한 사전 시냅스 반응을 촉진하는 일련의 사건들로 이어진다.이러한 사건에는 신경전달물질 음소수 증가, 음소 방출 확률 또는 둘 다 포함될 수 있다.초기 LTP에서 사전 시냅스 표현에 기초하는 역행성 메신저 외에, 역행성 메신저도 후기 LTP 표현에 역할을 할 수 있다.
후기상
후기 LTP(Late LTP, L-LTP)는 E-LTP의 자연적 확장이다.단백질 합성과 독립적인 E-LTP와 달리 L-LTP는 시냅스 후 세포에서 유전자 전사와[37] 단백질 합성을[38] 요구한다.L-LTP의 두 가지 단계가 존재한다. 첫 번째 단계는 단백질 합성에 의존하는 반면, 두 번째 단계는 유전자 전사와 단백질 합성에 의존한다.[33]이 단계들은 때때로 각각 LTP2와 LTP3로 불리며, E-LTP는 이 명칭에 따라 LTP1로 언급된다.
유도
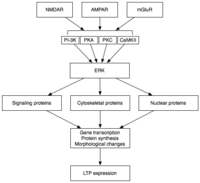
후기 LTP는 MAPK와 같은 E-LTP 동안 활성화된 단백질 키나제의 지속적인 활성화에 의해 발생된 유전자 발현과 단백질 합성의 변화에 의해 유도된다.[33][34][39]사실 MAPK - 특히 MAPKs의 세포외 신호조절키나제(ERK) 하위 제품군 - CaMK를 포함하여 E-LTP와 관련된 많은 신호 캐스케이드가 E-LTP와 L-LTP 사이의 분자 연결일 수 있다.II와 PKC는 ERK에 수렴할 수 있다.[39]최근의 연구에 따르면 L-LTP의 유도는 cAMP 응답 요소 결합 단백질(CREB)을 위한 강력한 전사적 공동 활성제인 CRTC1(TORC1)에 수렴되는 동시 분자 사건, 즉 PKA 활성화와 칼슘 유입에 의존할 수 있다고 한다.[40]분자적 우연의 일치에 대한 이 요구사항은 LTP의 연관성을 완벽하게 설명하며, 아마도 학습에 대한 연관성을 설명한다.
유지 관리
활성화 시 ERK는 L-LTP에서 관찰된 단백질 합성과 형태학적 변화를 궁극적으로 초래하는 다수의 세포질 및 핵 분자를 인산화할 수 있다.[33]이러한 세포질 분자와 핵 분자는 CREB와 같은 전사 인자를 포함할 수 있다.[34] 전사 인자 활성의 ERK 매개 변화는 L-LTP의 유지에 기초하는 단백질의 합성을 유발할 수 있다.그러한 분자 중 하나는 단백질 키나아제 Mζ (PKMζ)일 수 있는데, 이는 LTP 유도에 따라 합성이 증가하는 끈질긴 활성 키나아제다.[41][42]PKMζ은 PKC의 비정형적인 이소 형태로 규제 하위 장치가 부족하여 구성적으로 활성 상태를 유지하고 있다.[41]LTP를 중재하는 다른 키나제와는 달리, PKM³은 LTP 유도 후 처음 30분 동안만 활성화되는 것이 아니라, LTP 후기 동안에만 LTP 유지보수를 위한 요건이 된다.[41]따라서 PKM³은 메모리의 지속성을 위해 중요해 보이며 장기 메모리의 유지관리에 중요할 것으로 예상된다.실제로 PKM hipp 억제제를 쥐의 해마에 투여하면 온전한 단기 기억력을 가진 역행 기억상실증을 초래하게 되는데, PKMζ은 단기 기억력의 확립에 역할을 하지 못한다.[42]PKMζ은 최근 L-LTP의 발현에 기초하는 시냅스 비계 내의 단백질 밀거래와 재구성을 지시함으로써 L-LTP 유지보수의[41][42] 기초가 되는 것으로 나타났다.[41]더욱 최근에는 PKM lacking이 부족한 유전자변형 생쥐가 PKMζ의 필요성에 의문을 제기하며 정상적인 LTP를 입증하고 있다.[43]
시냅스 변화의 장기적 안정화는 축 부톤, 둔부 척추, 시냅스 후 밀도와 같은 시냅스 전후 구조의 병렬적 증가에 의해서도 결정된다.[44]분자 수준에서 시냅스 후 비계단백질 PSD-95와 호머1c의 증가는 시냅스 확장의 안정화와 관련이 있는 것으로 나타났다.[44]
표현
L-LTP 기간 동안 합성된 몇 가지 단백질의 정체만 알려져 있다.신분과 관계없이 L-LTP표현과 관련된 신경전달물질에 대한 덴드리트 척추수, 표면적, 시냅스 후 민감도의 증가에 기여한다고 생각된다.[33]후자는 L-LTP 동안 AMPA 수용체들의 강화된 합성에 의해 부분적으로 야기될 수 있다.[33]후기 LTP는 시냅토타그민의 사전 시냅스 합성 및 시냅스 수 증가와도 연관되어 있어 L-LTP는 사후 시냅스 세포뿐만 아니라 사전 시냅스 세포에서도 단백질 합성을 유도한다는 것을 시사한다.[33]앞에서 언급한 바와 같이 시냅스 후 LTP 유도가 사전 시냅스 단백질 합성을 유발하기 위해서는 사후 시냅스로부터 사전 시냅스 세포로의 통신이 있어야 한다.이것은 나중에 논의된 역행 메신저 합성을 통해 발생할 수 있다.
심지어 시냅스 후 사건으로 제한된 연구에서도 조사자들은 L-LTP의 기초가 되는 단백질 합성의 위치를 결정하지 못했다.구체적으로는 단백질 합성이 시냅스 후 세포체에서 이루어지는지 또는 그 덴드라이트에서 이루어지는지는 불분명하다.[39]1960년대 초반부터 덴드라이트에서 리보솜(단백합성기계의 주요 성분)을 관찰했음에도 불구하고, 세포체가 뉴런에서 단백질 합성의 지배적인 부위라는 지혜가 지배적이었다.[39]이러한 추론은 1980년대에 이르러서야 심각한 도전을 받지 않았는데, 그 때 조사자들은 세포체와의 연결이 끊어진 덴드라이트의 단백질 합성을 관찰했다고 보고했다.[39]좀 더 최근에, 조사자들은 이러한 유형의 국소 단백질 합성이 LTP의 일부 유형에 필요하다는 것을 증명했다.[45][46]
국소 단백질 합성 가설이 인기 있는 한 가지 이유는 그것이 LTP와 관련된 특수성에 대한 가능한 메커니즘을 제공하기 때문이다.[39]특히, 실제로 국소 단백질 합성이 L-LTP의 기초가 된다면 LTP 유도 자극을 받는 덴드리트릭 척추만 LTP를 받게 되며, 그 위력은 인접한 시냅스로 전파되지 않는다.이와는 대조적으로 세포체에서 일어나는 지구 단백질 합성은 단백질을 LTP 유도 자극을 받지 못한 시냅스를 포함한 세포의 모든 영역으로 내보내도록 요구한다.국소 단백질 합성이 특수성을 위한 메커니즘을 제공하는 반면에, 전지구 단백질 합성은 그것을 직접적으로 손상시키는 것처럼 보일 것이다.그러나, 나중에 논의한 바와 같이, 시냅스 태깅 가설은 글로벌 단백질 합성, 시냅스 특이성, 연관성을 성공적으로 조정한다.
역행 신호
역행 신호는 LTP가 유도되어 시냅스 후 표현되는 반면, 일부 증거에서는 사전시뮬레이션으로도 표현된다는 것을 설명하려는 가설이다.[21][36][47]이 가설은 정상적인 시냅스 전달이 방향성이기 때문에 그 이름을 얻게 되고 사전 시냅스로부터 사후 시냅스 세포로 진행되게 된다.유도가 시냅스 후 발생하여 부분적으로 사전 적응적으로 표현되려면 메시지는 시냅스 후 셀에서 역방향(역방향)으로 시냅스 전 셀로 이동해야 한다.일단 그곳에 도착하면, 메시지는 아마도 신경전달물질 음낭 방출의 증가 확률과 같은 표현의 사전 시냅스 구성 요소로 이어지는 일련의 사건들을 시작하게 될 것이다.[48]
역행 신호는 일부 조사자들이 사전 시냅스 세포가 LTP의 표현에 전혀 기여하지 않는다고 믿기 때문에 현재 논쟁의 대상이 되고 있다.[21]심지어 그 가설을 지지하는 사람들 사이에서도 배달원의 신원에 대한 논란이 있다.초기 생각은 질소산화물에 초점을 맞춘 반면, 최근의 대부분의 증거는 세포 접착 단백질을 가리킨다.[21]
시냅스 태깅
국소 단백질 합성 가설이 상당한 지지를 얻기 전에는 L-LTP의 기초가 되는 단백질 합성이 세포체에서 발생했다는 일반적인 합의가 있었다.또한, 이 합성의 제품은 세포 전체에 걸쳐 비특이적으로 배송되었다고 생각되었다.따라서 LTP의 입력 특이성을 훼손하지 않고 세포 체내에서 단백질 합성이 어떻게 일어날 수 있는지를 설명할 필요가 있게 되었다.시냅스 태깅 가설은 세포 체내에서 단백질을 합성하는 세포의 어려운 문제를 해결하기 위해 시도하지만 그것들이 LTP를 유발하는 자극을 받은 시냅스에만 도달하도록 보장한다.
시냅스 태깅 가설은 LTP를 유발하는 자극을 받은 시냅스에서 "시냅스 태그"가 합성되며, 이 시냅스 태그가 세포체로부터 세포 전체로 전달된 가소성 관련 단백질을 포획하는 역할을 할 수 있다고 제안한다.[49]바다 달팽이 Aplysia califorica의 LTP에 대한 연구는 LTP의 입력 특이성을 위한 메커니즘으로 시냅스 태깅을 포함시켰다.[50][51]넓게 분리된 두 개의 시냅스를 주어, 한 시냅스에서 LTP를 유도하는 자극이 세포핵에서 유전자 발현을 시작하는 여러 신호 계단식(앞에서 설명)을 유발한다는 증거가 있다.동일한 시냅스(비절연 시냅스는 아님)에서 국소 단백질 합성은 수명이 짧은(3시간 미만) 시냅스 태그를 생성한다.유전자 발현의 산물은 세포 전체에 걸쳐 전세계적으로 출하되지만 시냅스 태그를 표현하는 시냅스에 의해서만 포획된다.따라서 LTP를 유발하는 자극을 받는 시냅스만 힘을 주어 LTP의 입력 특수성을 입증한다.
시냅스 태그 가설은 또한 LTP의 연관성과 협력성을 설명할 수 있다.연관성(특성 참조)은 한 시냅스가 LTP 유도 자극으로 흥분한 상태에서 별도의 시냅스가 약하게 자극될 때 관찰된다.강하게 자극된 시냅스만이 LTP를 겪을 것으로 예상할 수 있는 반면(약화된 자극만으로는 어느 시냅스에서도 LTP를 유도할 수 없기 때문에), 두 시냅스는 실제로 LTP를 겪게 될 것이다.약한 자극은 세포 체내에서 단백질 합성을 유도할 수 없는 반면, 그것들은 시냅스 태그의 합성을 촉진할 수 있다.세포체 단백질 합성을 유도할 수 있는 별도의 경로에 대한 강한 자극은 세포 전체로 운송되는 가소성 관련 단백질의 생성을 촉진할 수 있다.두 시냅스가 시냅스 태그를 표현하면, 두 시냅스 모두 강한 자극과 약하게 자극된 경로 모두에서 LTP의 발현을 초래하는 단백질 제품을 포착할 수 있다.
협력성은 개별 자극 시 LTP를 유도할 수 없는 약한 자극에 의해 두 개의 시냅스가 활성화되었을 때 관찰된다.그러나 동시에 약한 자극을 받으면 두 시냅스는 협력적인 방식으로 LTP를 겪는다.시냅스 태깅은 어떻게 여러 개의 약한 자극이 LTP를 유도하기에 충분한 집단 자극이 될 수 있는지 설명하지 않는다(이것은 앞에서 설명한 EPSP의 시냅스 후 합산으로 설명된다).오히려 시냅스 태깅은 약하게 자극된 시냅스의 능력을 설명하는데, 이들 중 어느 것도 LTP를 독립적으로 생성할 수 없는 시냅스는 집단적으로 시작된 단백질 합성의 제품을 공급받을 수 없다.이전과 같이 이것은 약한 시냅스 자극에 따른 국소 시냅스 태그의 합성을 통해 이루어질 수 있다.
변조
| 변조기 | 목표하다. |
|---|---|
| β-아드레날린 수용체 | cAMP, MAPK 증폭 |
| 질소산화물 신타아제 | Guanyll cyclase, PKG, NMDAR |
| 도파민수용체 | cAMP, MAPK 증폭 |
| 메타보틱성 글루탐산염 수용체 | PKC, MAPK 증폭 |
앞에서 설명한 것처럼 LTP의 기반이 되는 분자는 중재자 또는 조절자로 분류할 수 있다.LTP의 중재자는 NMDA 수용체 또는 칼슘과 같은 분자로, 거의 모든 조건에서 LTP를 생성하기 위해 존재와 활동이 필요하다.대조적으로, 변조기는 LTP를 바꿀 수 있지만 그것의 생성이나 표현에 필수적이지는 않은 분자다.[21]
위에서 설명한 신호 경로 외에도 해마 LTP는 다양한 조절기에 의해 변경될 수 있다.예를 들어 스테로이드 호르몬 에스트라디올은 CREB 인산화 작용과 그에 따른 덴드리트 척추 성장을 촉진하여 LTP를 향상시킬 수 있다.[52]또한, 노레피네프린과 같은 β-아드레날린 수용체 작용제는 LTP의 단백질 합성에 의존하는 후기 단계를 변경할 수 있다.[53]질소산화물 싱타아제 활성은 또한 구아닐 사이클라아제와 PKG의 후속 활성화로 이어질 수 있다.[54]마찬가지로 도파민 수용체 활성화는 cAMP/PKA 신호 경로를 통해 LTP를 향상시킬 수 있다.[55][56]
행동기억과의 관계
세포 배양에서 시냅스의 장기적 위력은 학습과 기억력에 우아한 기질을 제공하는 것처럼 보이지만, 행동 학습에 대한 LTP의 기여, 즉 전체 유기체의 수준에서 학습하는 것은 단순히 체외 연구로부터 추론할 수 없다.이 때문에 LTP가 살아있는 동물에 대한 학습과 기억의 요건인지를 규명하는 데 상당한 노력을 기울였다.이 때문에 LTP는 공포 처리에도 결정적인 역할을 한다.
공간기억
1986년, 리차드 모리스는 체내 기억의 형성에 LTP가 실제로 필요하다는 최초의 증거를 제공했다.[57]그는 쥐의 공간적 기억력을 약리학적으로 변형시켜 실험했는데, 이는 공간학습의 역할이 잘 확립된 두뇌구조다.쥐들은 모리스 물 미로에서 훈련을 받았는데, 그것은 쥐들이 표면 아래에 숨겨진 플랫폼을 찾을 때까지 어두운 물 웅덩이에서 헤엄치는 공간 기억 작업이었다.이 연습 동안, 정상적인 쥐들은 숨겨진 플랫폼의 위치를 미로 둘레에 있는 특정 위치에 놓여진 두드러진 단서와 연관시킬 것으로 예상된다.훈련 후, 쥐의 한 그룹은 해마를 NMDA 수용체 차단기 APV로 목욕시켰고, 다른 그룹은 대조군 역할을 했다.이후 두 그룹 모두 물 미로 공간 기억 과제에 시달렸다.제어 그룹의 쥐들은 플랫폼의 위치를 파악하여 수영장에서 탈출할 수 있었고, APV 처리된 쥐의 성능은 현저히 저하되었다.더욱이, 해마 조각이 두 그룹에서 모두 채취되었을 때, LTP는 쉽게 제어에서 유도되었지만, APV로 처리된 쥐의 뇌에서는 유도될 수 없었다.이는 NMDA 수용체(그리고 나아가 LTP)가 적어도 일부 유형의 학습과 기억력에 요구된다는 초기 증거를 제공했다.
마찬가지로 톤가와 스스무는 1996년 해마의 CA1 지역이 살아있는 생쥐의 공간적 기억 형성에 결정적이라는 것을 입증했다.[58]이 지역에 위치한 소위 장소 세포는 쥐가 환경의 특정 위치인 장소 필드(place field)에 있을 때만 활동하게 된다.이러한 장소 영역은 환경 전체에 분포하기 때문에, 하나의 해석은 장소 세포의 그룹이 해마에서 지도를 형성한다는 것이다.이 지도들의 정확성은 쥐가 환경에 대해 얼마나 잘 배우고 따라서 쥐를 얼마나 잘 탐색할 수 있는지를 결정한다.톤가와 교수는 NMDA 수용체를 손상시킴으로써, 특히 CA1 지역에서 NR1 하위 단위를 유전적으로 제거함으로써, 생성된 장소 필드가 대조군보다 실질적으로 덜 구체적이라는 것을 발견했다.즉, 생쥐는 NMDA 수용체가 손상되었을 때 잘못된 공간 지도를 만들었다.예상대로 이들 생쥐는 제어에 비해 공간 과제 수행이 매우 저조해 공간 학습에서 LTP의 역할을 더욱 뒷받침했다.
해마에서 강화된 NMDA 수용체 활성도 또한 향상된 LTP와 전체적인 공간 학습 개선을 생성하는 것으로 나타났다.1999년 탕 등은 해마의 NR2B 하위 단위를 과도하게 눌러 NMDA 수용체 기능을 강화한 생쥐 라인을 생산했다.[59][60]허구의 거장 두기 하우서의 이름을 따서 "두기 마우스"라는 별명을 얻은 결과 영리한 쥐들은 LTP가 더 크고 공간 학습 과제에 뛰어났으며, 해마에 의존하는 기억 형성에 있어 LTP의 중요성을 강화했다.
억제 회피
2006년에 조나단 휘트록과 동료들은 행동 기억에서 LTP의 역할에 대한 가장 강력한 증거를 제공하는 일련의 실험에 대해 보고했는데, LTP가 행동 학습의 기초가 된다고 결론짓기 위해서는 두 과정이 서로 모방하고 은폐해야 한다고 주장했다.[61]억제 회피 학습 패러다임을 이용하여, 연구원들은 쥐를 빛과 어둠의 챔버가 있는 두 개의 챔버로 된 장비로 훈련시켰고, 후자는 입장 시 쥐에게 발 충격을 주는 장치를 장착했다.CA1 해마 시냅스를 분석한 결과 억제 회피 훈련이 체외 LTP에서 볼 수 있는 것과 동일한 유형의 생체내 AMPA 수용체 인산화(phosphylation)를 유도했다는 것이 밝혀졌다. 즉 억제 회피 훈련은 LTP를 모방했다.또한, 훈련 중 힘을 발휘하는 시냅스는 LTP를 유도했을 실험 조작에 의해 더 이상 힘을 발휘할 수 없었다. 즉, 억제 회피 훈련은 LTP를 방해했다.기사에 대한 응답으로, 티모시 블리스와 동료들은 이러한 그리고 관련 실험들이 "기억의 신경 메커니즘으로서 LTP에 대한 사례를 실질적으로 진전시킨다"[62]고 언급했다.
임상적 유의성
질병에서 LTP의 역할은 시냅스 가소성의 기본적인 메커니즘에서의 역할보다 덜 명확하다.그러나 LTP의 변경은 우울증, 파킨슨병, 간질, 신경병통 등 여러 신경질환의 원인이 될 수 있다.[63]손상된 LTP는 또한 알츠하이머병과 약물 중독에도 영향을 미칠 수 있다.
알츠하이머병
LTP는 두드러진 인지 저하와 치매를 유발하는 신경퇴행성 질환인 알츠하이머병(AD)을 연구하는 사람들 사이에서 많은 관심을 받아왔다.이러한 퇴행성의 대부분은 해마와 다른 내측두엽 구조의 퇴행성 변화와 연관되어 발생한다.해마가 LTP에서 잘 확립된 역할 때문에, 일부는 AD를 가진 개인에서 보이는 인지적 감퇴가 LTP의 손상에서 비롯될 수 있다고 제안했다.
2003년 문헌 리뷰에서 로완 외는 AD에서 LTP가 어떻게 영향을 받을 수 있는지에 대한 한 가지 모델을 제안했다.[64]AD는 적어도 부분적으로는 아밀로이드 전구단백질(APP)의 잘못된 처리에서 비롯되는 것으로 보인다.이 비정상적인 처리의 결과는 아밀로이드 β(Aβ)라고 불리는 이 단백질의 파편이 축적된 것이다.Aβ는 수용성 및 섬유질 형태로 존재한다.APP를 잘못 처리하면 수용성 Aβ가 축적되어 Rowan의 가설에 따르면 해마 LTP를 손상시키고 AD 초기에 보이는 인지 저하로 이어질 수 있다.
AD는 또한 Aβ와 구별되는 메커니즘을 통해 LTP를 손상시킬 수 있다.예를 들어, 한 연구는 효소 PKMζ이 AD의 병리학적 표식인 신경섬유질 엉키기에 축적된다는 것을 증명했다.PKMζ은 후기 LTP의 유지에 있어 매우 중요한 효소다.[65]
약물중독
중독의학 분야의 연구도 최근[when?] LTP에 초점을 돌리고 있는데, 이는 약물 중독이 학습과 기억의 강력한 형태를 나타낸다는 가설 때문이다.[66]중독은 복측티그먼트 영역(VTA), 핵 억양(NAC) 등 뇌의 다양한 부분이 관여하는 복잡한 신경행동 현상이다.연구는 VTA와 NAc 시냅스가 LTP를[66] 겪을 수 있고 이 LTP가 중독을 특징짓는 행동에 책임이 있을 수 있다는 것을 증명했다.[67]
참고 항목
참조
- ^ Paradiso MA, Bear MF, Connors BW (2007). Neuroscience: Exploring the Brain. Hagerstwon, MD: Lippincott Williams & Wilkins. p. 718. ISBN 978-0-7817-6003-4.
- ^ a b Cooke SF, Bliss TV (July 2006). "Plasticity in the human central nervous system". Brain. 129 (Pt 7): 1659–73. doi:10.1093/brain/awl082. PMID 16672292.
- ^ a b Bliss TV, Collingridge GL (January 1993). "A synaptic model of memory: long-term potentiation in the hippocampus". Nature. 361 (6407): 31–9. Bibcode:1993Natur.361...31B. doi:10.1038/361031a0. PMID 8421494. S2CID 4326182.
- ^ Williams RW, Herrup K (1988). "The control of neuron number". Annual Review of Neuroscience. 11 (1): 423–53. doi:10.1146/annurev.ne.11.030188.002231. PMID 3284447.
- ^ a b Santiago Ry (1894). "The Croonian Lecture: La Fine Structure des Centres Nerveux". Proceedings of the Royal Society of London. 55 (331–335): 444–468. Bibcode:1894RSPS...55..444C. doi:10.1098/rspl.1894.0063.
- ^ Hebb D (1949). The Organization of Behavior: A NEUROPSYCHOLOGICAL THEORY. New York: JOHN WILEY if SONS, Inc. ISBN 978-0805843002.
- ^ Hebb DO (1949). Organization of Behavior: a Neuropsychological Theory. New York: John Wiley. ISBN 978-0-471-36727-7.
- ^ Kandel ER, Tauc L (November 1965). "Heterosynaptic facilitation in neurones of the abdominal ganglion of Aplysia depilans". The Journal of Physiology. 181 (1): 1–27. doi:10.1113/jphysiol.1965.sp007742. PMC 1357435. PMID 5866283.
- ^ Patihis L (October 2018). "The historical significance of the discovery of long-term potentiation: an overview and evaluation for nonexperts". American Journal of Psychology. 131 (3): 369–80. doi:10.5406/amerjpsyc.131.3.0369.
- ^ a b Lømo T (April 2003). "The discovery of long-term potentiation". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 617–20. doi:10.1098/rstb.2002.1226. PMC 1693150. PMID 12740104.
- ^ Lømo T (1966). "Frequency potentiation of excitatory synaptic activity in the dentate area of the hippocampal formation". Acta Physiologica Scandinavica. 68 (Suppl 277): 128.
- ^ a b Bliss TV, Lomo T (July 1973). "Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path". The Journal of Physiology. 232 (2): 331–56. doi:10.1113/jphysiol.1973.sp010273. PMC 1350458. PMID 4727084.
- ^ a b Bliss TV, Gardner-Medwin AR (July 1973). "Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path". The Journal of Physiology. 232 (2): 357–74. doi:10.1113/jphysiol.1973.sp010274. PMC 1350459. PMID 4727085.
- ^ '장기적 위력'이라는 용어는 원래의 블리스와 뢰모 논문에서 한 번 나타났지만, 더글라스·고다드 논문까지는 그 현상에 대해 공식적으로 제안되지 않았다.
- ^ Douglas RM, Goddard GV (March 1975). "Long-term potentiation of the perforant path-granule cell synapse in the rat hippocampus". Brain Research. 86 (2): 205–15. doi:10.1016/0006-8993(75)90697-6. PMID 163667. S2CID 43260928.
- ^ Andersen P (April 2003). "A prelude to long-term potentiation". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 613–5. doi:10.1098/rstb.2002.1232. PMC 1693144. PMID 12740103.
- ^ McEachern JC, Shaw CA (June 1996). "An alternative to the LTP orthodoxy: a plasticity-pathology continuum model". Brain Research. Brain Research Reviews. 22 (1): 51–92. doi:10.1016/0165-0173(96)00006-9. PMID 8871785. S2CID 41680613. 8871785.
- ^ Bear MF (1996). "A synaptic basis for memory storage in the cerebral cortex". Proceedings of the National Academy of Sciences. 93 (24): 13453–13459. Bibcode:1996PNAS...9313453B. doi:10.1073/pnas.93.24.13453. PMC 33630. PMID 8942956.
- ^ Ouardouz M, Sastry BR (2000). "Mechanisms underlying LTP of inhibitory synaptic transmission in the deep cerebellar nuclei". Journal of Neurophysiology. 84 (3): 1414–1421. doi:10.1152/jn.2000.84.3.1414. PMID 10980014.
- ^ Clugnet MC, LeDoux JE (August 1990). "Synaptic plasticity in fear conditioning circuits: induction of LTP in the lateral nucleus of the amygdala by stimulation of the medial geniculate body". The Journal of Neuroscience. 10 (8): 2818–24. doi:10.1523/JNEUROSCI.10-08-02818.1990. PMC 6570263. PMID 2388089.
- ^ a b c d e f g h i Malenka RC, Bear MF (September 2004). "LTP and LTD: an embarrassment of riches". Neuron. 44 (1): 5–21. doi:10.1016/j.neuron.2004.09.012. PMID 15450156. S2CID 79844.
- ^ Yasuda H, Barth AL, Stellwagen D, Malenka RC (January 2003). "A developmental switch in the signaling cascades for LTP induction". Nature Neuroscience. 6 (1): 15–6. doi:10.1038/nn985. PMID 12469130. S2CID 28913342.
- ^ Collingridge GL, Kehl SJ, McLennan H (January 1983). "Excitatory amino acids in synaptic transmission in the Schaffer collateral-commissural pathway of the rat hippocampus". The Journal of Physiology. 334: 33–46. doi:10.1113/jphysiol.1983.sp014478. PMC 1197298. PMID 6306230.
- ^ Harris EW, Cotman CW (September 1986). "Long-term potentiation of guinea pig mossy fiber responses is not blocked by N-methyl D-aspartate antagonists". Neuroscience Letters. 70 (1): 132–7. doi:10.1016/0304-3940(86)90451-9. PMID 3022192. S2CID 42647125.
- ^ Wigström H, Gustafsson B (1986). "Postsynaptic control of hippocampal long-term potentiation". Journal de Physiologie. 81 (4): 228–36. PMID 2883309.
- ^ Urban NN, Barrionuevo G (July 1996). "Induction of hebbian and non-hebbian mossy fiber long-term potentiation by distinct patterns of high-frequency stimulation". The Journal of Neuroscience. 16 (13): 4293–9. doi:10.1523/JNEUROSCI.16-13-04293.1996. PMC 6579001. PMID 8753890.
- ^ Kullmann DM, Lamsa K (March 2008). "Roles of distinct glutamate receptors in induction of anti-Hebbian long-term potentiation". The Journal of Physiology. 586 (6): 1481–6. doi:10.1113/jphysiol.2007.148064. PMC 2375711. PMID 18187472.
- ^ Frey, Uwe; Morris, Richard G. M. (February 1997). "Synaptic tagging and long-term potentiation". Nature. 385 (6616): 533–536. Bibcode:1997Natur.385..533F. doi:10.1038/385533a0. PMID 9020359. S2CID 4339789.
- ^ Hao, Lijie; Yang, Zhuoqin; Lei, Jinzhi (1 May 2018). "Underlying Mechanisms of Cooperativity, Input Specificity, and Associativity of Long-Term Potentiation Through a Positive Feedback of Local Protein Synthesis". Frontiers in Computational Neuroscience. 12: 25. doi:10.3389/fncom.2018.00025. PMC 5938377. PMID 29765314.
- ^ McNaughton BL (April 2003). "Long-term potentiation, cooperativity and Hebb's cell assemblies: a personal history". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 629–34. doi:10.1098/rstb.2002.1231. PMC 1693161. PMID 12740107.
- ^ Tazerart S, Mitchell DE, Miranda-Rottmann S, Araya R (August 2020). "A spike-timing-dependent plasticity rule for dendritic spines". Nature Communications. 11 (1): 4276. Bibcode:2020NatCo..11.4276T. doi:10.1038/s41467-020-17861-7. PMC 7449969. PMID 32848151.
- ^ Abraham WC (April 2003). "How long will long-term potentiation last?". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 735–44. doi:10.1098/rstb.2002.1222. PMC 1693170. PMID 12740120.
- ^ a b c d e f g h Lynch MA (January 2004). "Long-term potentiation and memory". Physiological Reviews. 84 (1): 87–136. doi:10.1152/physrev.00014.2003. PMID 14715912.
- ^ a b c d Sweatt JD (1999). "Toward a molecular explanation for long-term potentiation". Learning & Memory. 6 (5): 399–416. doi:10.1101/lm.6.5.399. PMID 10541462.
- ^ Malinow R (April 2003). "AMPA receptor trafficking and long-term potentiation". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 707–14. doi:10.1098/rstb.2002.1233. PMC 1693162. PMID 12740116.
- ^ a b Emptage NJ, Reid CA, Fine A, Bliss TV (June 2003). "Optical quantal analysis reveals a presynaptic component of LTP at hippocampal Schaffer-associational synapses". Neuron. 38 (5): 797–804. doi:10.1016/S0896-6273(03)00325-8. PMID 12797963. S2CID 13629691.
- ^ Frey U, Frey S, Schollmeier F, Krug M (February 1996). "Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro". The Journal of Physiology. 490. 490 ( Pt 3) (Pt 3): 703–11. doi:10.1113/jphysiol.1996.sp021179. PMC 1158708. PMID 8683469.
- ^ Frey U, Krug M, Reymann KG, Matthies H (June 1988). "Anisomycin, an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro". Brain Research. 452 (1–2): 57–65. doi:10.1016/0006-8993(88)90008-X. PMID 3401749. S2CID 39245231.
- ^ a b c d e f Kelleher RJ, Govindarajan A, Tonegawa S (September 2004). "Translational regulatory mechanisms in persistent forms of synaptic plasticity". Neuron. 44 (1): 59–73. doi:10.1016/j.neuron.2004.09.013. PMID 15450160. S2CID 1511103.
- ^ Kovács KA, Steullet P, Steinmann M, Do KQ, Magistretti PJ, Halfon O, Cardinaux JR (March 2007). "TORC1 is a calcium- and cAMP-sensitive coincidence detector involved in hippocampal long-term synaptic plasticity". Proceedings of the National Academy of Sciences of the United States of America. 104 (11): 4700–5. Bibcode:2007PNAS..104.4700K. doi:10.1073/pnas.0607524104. PMC 1838663. PMID 17360587.
- ^ a b c d e Serrano P, Yao Y, Sacktor TC (February 2005). "Persistent phosphorylation by protein kinase Mzeta maintains late-phase long-term potentiation". The Journal of Neuroscience. 25 (8): 1979–84. doi:10.1523/JNEUROSCI.5132-04.2005. PMC 6726070. PMID 15728837.
- ^ a b c Pastalkova E, Serrano P, Pinkhasova D, Wallace E, Fenton AA, Sacktor TC (August 2006). "Storage of spatial information by the maintenance mechanism of LTP". Science. 313 (5790): 1141–4. Bibcode:2006Sci...313.1141P. CiteSeerX 10.1.1.453.2136. doi:10.1126/science.1128657. PMID 16931766. S2CID 7260010.
- ^ Volk LJ, Bachman JL, Johnson R, Yu Y, Huganir RL (January 2013). "PKM-ζ is not required for hippocampal synaptic plasticity, learning and memory". Nature. 493 (7432): 420–3. Bibcode:2013Natur.493..420V. doi:10.1038/nature11802. PMC 3830948. PMID 23283174.
- ^ a b Meyer D, Bonhoeffer T, Scheuss V (April 2014). "Balance and stability of synaptic structures during synaptic plasticity". Neuron. 82 (2): 430–43. doi:10.1016/j.neuron.2014.02.031. PMID 24742464.
- ^ Kang H, Schuman EM (September 1996). "A requirement for local protein synthesis in neurotrophin-induced hippocampal synaptic plasticity". Science. 273 (5280): 1402–6. Bibcode:1996Sci...273.1402K. doi:10.1126/science.273.5280.1402. PMID 8703078. S2CID 38648558.
- ^ Steward O, Worley PF (June 2001). "A cellular mechanism for targeting newly synthesized mRNAs to synaptic sites on dendrites". Proceedings of the National Academy of Sciences of the United States of America. 98 (13): 7062–8. Bibcode:2001PNAS...98.7062S. doi:10.1073/pnas.131146398. PMC 34623. PMID 11416188.
- ^ Pavlidis P, Montgomery J, Madison DV (June 2000). "Presynaptic protein kinase activity supports long-term potentiation at synapses between individual hippocampal neurons". The Journal of Neuroscience. 20 (12): 4497–505. doi:10.1523/JNEUROSCI.20-12-04497.2000. PMC 6772468. PMID 10844019.
- ^ Zakharenko SS, Patterson SL, Dragatsis I, Zeitlin SO, Siegelbaum SA, Kandel ER, Morozov A (September 2003). "Presynaptic BDNF required for a presynaptic but not postsynaptic component of LTP at hippocampal CA1-CA3 synapses". Neuron. 39 (6): 975–90. doi:10.1016/S0896-6273(03)00543-9. PMID 12971897. S2CID 7117772.
- ^ Frey U, Morris RG (February 1997). "Synaptic tagging and long-term potentiation". Nature. 385 (6616): 533–6. Bibcode:1997Natur.385..533F. doi:10.1038/385533a0. PMID 9020359. S2CID 4339789.
- ^ Martin KC, Casadio A, Zhu H, Yaping E, Rose JC, Chen M, Bailey CH, Kandel ER (December 1997). "Synapse-specific, long-term facilitation of aplysia sensory to motor synapses: a function for local protein synthesis in memory storage". Cell. 91 (7): 927–38. doi:10.1016/S0092-8674(00)80484-5. PMID 9428516. S2CID 16423304.
- ^ Casadio A, Martin KC, Giustetto M, Zhu H, Chen M, Bartsch D, Bailey CH, Kandel ER (October 1999). "A transient, neuron-wide form of CREB-mediated long-term facilitation can be stabilized at specific synapses by local protein synthesis". Cell. 99 (2): 221–37. doi:10.1016/S0092-8674(00)81653-0. PMID 10535740.
- ^ Segal M, Murphy DD (1999). "CREB activation mediates plasticity in cultured hippocampal neurons". Neural Plasticity. 6 (3): 1–7. doi:10.1155/NP.1998.1. PMC 2565317. PMID 9920677.
- ^ Straube T, Frey JU (2003). "Involvement of beta-adrenergic receptors in protein synthesis-dependent late long-term potentiation (LTP) in the dentate gyrus of freely moving rats: the critical role of the LTP induction strength". Neuroscience. 119 (2): 473–9. doi:10.1016/S0306-4522(03)00151-9. PMID 12770561. S2CID 23436714.
- ^ Lu YF, Kandel ER, Hawkins RD (December 1999). "Nitric oxide signaling contributes to late-phase LTP and CREB phosphorylation in the hippocampus". The Journal of Neuroscience. 19 (23): 10250–61. doi:10.1523/JNEUROSCI.19-23-10250.1999. PMC 6782403. PMID 10575022.
- ^ Frey U, Matthies H, Reymann KG, Matthies H (August 1991). "The effect of dopaminergic D1 receptor blockade during tetanization on the expression of long-term potentiation in the rat CA1 region in vitro". Neuroscience Letters. 129 (1): 111–4. doi:10.1016/0304-3940(91)90732-9. PMID 1833673. S2CID 45084596.
- ^ Otmakhova NA, Lisman JE (December 1996). "D1/D5 dopamine receptor activation increases the magnitude of early long-term potentiation at CA1 hippocampal synapses". The Journal of Neuroscience. 16 (23): 7478–86. doi:10.1523/JNEUROSCI.16-23-07478.1996. PMC 6579102. PMID 8922403.
- ^ Morris RG, Anderson E, Lynch GS, Baudry M (1986). "Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5". Nature. 319 (6056): 774–6. Bibcode:1986Natur.319..774M. doi:10.1038/319774a0. PMID 2869411. S2CID 4356601.
- ^ McHugh TJ, Blum KI, Tsien JZ, Tonegawa S, Wilson MA (December 1996). "Impaired hippocampal representation of space in CA1-specific NMDAR1 knockout mice". Cell. 87 (7): 1339–49. doi:10.1016/S0092-8674(00)81828-0. PMID 8980239. S2CID 5131226.
- ^ Tang YP, Shimizu E, Dube GR, Rampon C, Kerchner GA, Zhuo M, Liu G, Tsien JZ (1999). "Genetic enhancement of learning and memory in mice". Nature. 401 (6748): 63–69. Bibcode:1999Natur.401...63T. doi:10.1038/43432. PMID 10485705. S2CID 481884.
- ^ Tang Y, Wang H, Feng R, Kyin M, Tsien J (2001). "Differential effects of enrichment on learning and memory function in NR2B transgenic mice". Neuropharmacology. 41 (6): 779–90. doi:10.1016/S0028-3908(01)00122-8. PMID 11640933. S2CID 23602265.
- ^ Whitlock JR, Heynen AJ, Shuler MG, Bear MF (August 2006). "Learning induces long-term potentiation in the hippocampus". Science. 313 (5790): 1093–7. Bibcode:2006Sci...313.1093W. doi:10.1126/science.1128134. PMID 16931756. S2CID 612352.
- ^ Bliss TV, Collingridge GL, Laroche S (August 2006). "Neuroscience. ZAP and ZIP, a story to forget". Science. 313 (5790): 1058–9. doi:10.1126/science.1132538. PMID 16931746. S2CID 27735098.
- ^ Cooke SF, Bliss TV (July 2006). "Plasticity in the human central nervous system". Brain. 129 (Pt 7): 1659–73. doi:10.1093/brain/awl082. PMID 16672292.
- ^ a b Rowan MJ, Klyubin I, Cullen WK, Anwyl R (April 2003). "Synaptic plasticity in animal models of early Alzheimer's disease". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 821–8. doi:10.1098/rstb.2002.1240. PMC 1693153. PMID 12740129.
- ^ Crary JF, Shao CY, Mirra SS, Hernandez AI, Sacktor TC (April 2006). "Atypical protein kinase C in neurodegenerative disease I: PKMzeta aggregates with limbic neurofibrillary tangles and AMPA receptors in Alzheimer disease". Journal of Neuropathology and Experimental Neurology. 65 (4): 319–26. doi:10.1097/01.jnen.0000218442.07664.04. PMID 16691113.
- ^ a b Kauer JA, Malenka RC (November 2007). "Synaptic plasticity and addiction". Nature Reviews. Neuroscience. 8 (11): 844–58. doi:10.1038/nrn2234. PMID 17948030. S2CID 38811195.
- ^ Wolf ME (August 2003). "LTP may trigger addiction". Molecular Interventions. 3 (5): 248–52. doi:10.1124/mi.3.5.248. PMID 14993438.
읽고 추가
- Bliss T, Collingridge G, Morris R (2004). Long-term potentiation: enhancing neuroscience for 30 years. Oxford: Oxford University Press. ISBN 978-0-19-853030-5.
외부 링크
- 곰과 동료들의 2006년 연구에 대한 PhysOrg.com의 보고서인, 연구자들은 학습 메커니즘에 대한 첫 번째 증거를 제공한다.
- 두기 마우스에 대한 짧은 비디오 다큐멘터리 (RealPlayer 형식)
- '스마트 마우스'는 두기 쥐에 관한 퀀텀 ABC TV 에피소드다.
- 미국 국립 의학 도서관의 장기+잠재학(MesH) 제목