골아세포
Osteoblast| 골아세포 | |
|---|---|
 | |
 단일 골아세포를 보여주는 그림 | |
| 세부 사항 | |
| 위치 | 뼈. |
| 기능. | 골조직 형성 |
| 식별자 | |
| 그리스어 | 골아세포 |
| 메쉬 | D010006 |
| TH | H2.00.03.7.00002 |
| FMA | 66780 |
| 미세해부술의 해부학적 용어 | |
골아세포는 뼈를 합성하는 단일 핵을 가진 세포이다.그러나 골형성 과정에서 골아세포는 연결된 세포 집단에서 기능한다.각각의 세포는 뼈를 만들 수 없다.세포 단위로 만들어진 뼈와 함께 조직화된 골아세포의 그룹을 보통 골격이라고 부릅니다.
골아세포는 간엽 줄기세포의 [1]전문적이고 말단적으로 분화된 산물이다.그들은 골격의 유기 매트릭스를 구성하는 오스테오칼린과 오스테오폰틴을 포함한 훨씬 적은 양으로 고밀도, 가교된 콜라겐과 전문화된 단백질을 합성한다.
골아세포는 유기매트릭스 내에 고도로 조절된 방식으로 축적된 골미네랄인 히드록실라파타이트를 생성해 강하고 밀도가 높은 광물조직인 광물화매트릭스를 형성한다.광물화된 골격은 공기 호흡 척추동물의 몸을 지탱하는 주요 지지대이다.또한 산-염기 균형과 칼슘 또는 인산염 [2][3]유지를 포함한 생리적인 항상성을 위한 미네랄의 중요한 저장고입니다.
골격 구조
골격은 공기를 호흡하는 척추동물에서 생명체를 통해 형성되고 분해되는 큰 장기이다.종종 골격계라고 불리는 골격은 지지 구조로서 그리고 전체 [4]유기체의 칼슘, 인산염, 산염기 상태를 유지하는 데 모두 중요하다.뼈의 기능적인 부분인 뼈 매트릭스는 완전히 세포 외입니다.뼈 매트릭스는 단백질과 미네랄로 구성되어 있다.단백질은 유기 기질을 형성한다.그것은 합성되고 그리고 나서 미네랄이 첨가된다.유기 매트릭스의 대부분은 인장 강도를 제공하는 콜라겐입니다.매트릭스는 히드록시아파타이트(hydroxyapatite, 다른 이름)의 증착에 의해 광물화된다.이 광물은 단단하고 압축력이 있다.따라서 콜라겐과 미네랄은 인장강도와 압축강도가 뛰어난 복합재료로서 스트레인에 의해 휘어져 손상 없이 형태를 회복할 수 있다.이것을 탄성 변형이라고 합니다.뼈의 용량을 초과하는 힘이 탄력적으로 작용하면 기능 상실을 일으킬 수 있으며, 일반적으로 뼈 골절을 일으킬 수 있습니다.
뼈 리모델링
뼈는 기질단백질을 생산하고 분비하는 골아세포와 조직을 분해하는 골아세포에 의해 지속적으로 변형되는 동적 조직이다.
골아세포
골아세포는 뼈의 주요 세포 성분이다.골아세포는 중간엽 줄기세포에서 발생한다.MSC는 다른 세포 유형 중에서 골아세포, 지방세포 및 근구를 발생시킨다.골아세포의 양은 골수지방조직(MAT)을 구성하는 골수지방세포의 양과 반비례하는 것으로 이해된다.골아세포는 골막, 뼈 바깥 표면의 얇은 결합 조직층, 그리고 내막에 많이 발견됩니다.
보통 공기 호흡 척추동물의 거의 모든 뼈 기질은 골아세포에 의해 광물화된다.유기 기질이 광물화되기 전에, 그것은 골상질이라고 불린다.기질 속에 파묻힌 골아세포를 골세포라고 한다.뼈를 형성하는 동안, 골아세포의 표면층은 활성 골아세포라고 불리는 입방체 세포로 구성됩니다.골형성 단위가 뼈를 활발하게 합성하지 않을 때 표면 골아세포가 평평해지고 이를 비활성 골아세포라고 합니다.골세포는 살아있고 세포과정을 통해 골아세포의 표면층과 연결된다.골세포는 골격 유지에 중요한 기능을 한다.
골아세포
골아세포는 골수의 조혈구로부터 파생된 다핵세포로 말초혈액에서 [5]단구도 일으킨다.골아세포는 뼈 조직을 분해하고 골아세포와 함께 뼈의 구조적 구성요소를 형성합니다.뼈 안의 구멍에는 많은 다른 종류의 골수가 있다.골아세포 뼈 형성에 필수적인 구성 요소로는 간엽 줄기세포(골아세포 전구체)와 뼈 형성에 필요한 산소와 영양분을 공급하는 혈관이 있다.뼈는 고혈관 조직이며, 간엽 줄기세포에서도 혈관 세포의 활발한 형성은 뼈의 대사 활동을 지원하기 위해 필수적이다.뼈 형성과 뼈 재흡수의 균형은 나이가 들수록 부정적인 경향이 있으며, 특히 폐경 후 [6]여성들에게서 종종 골절을 일으킬 정도로 심각한 뼈 손실을 초래하는데, 이것은 골다공증이라고 불립니다.
골형성
뼈는 연골 골화 또는 뇌내 골화라는 두 가지 과정 중 하나에 의해 형성된다.연골내 골화는 연골에서 뼈가 형성되는 과정으로 일반적인 방법이다.뼈 발달의 이러한 형태는 더 복잡한 형태이다: 그것은 연골세포에 의해 만들어진 연골의 첫 번째 골격의 형성을 따르고, 연골세포는 골아세포에 의해 제거되고 뼈로 대체된다.뇌내 골화는 두개골 등의 [7]막뼈 형성 중에 발생하는 간엽의 직접 골화이다.
골아세포 분화 중 발달하는 전구세포는 조절전사인자 Cbfa1/Runx2를 발현한다.두 번째로 필요한 전사인자는 Sp7 [8]전사인자이다.조직 배양에서 분리된 간엽 줄기세포는 또한 비타민 C와 알칼리 포스파타아제 기질을 포함하는 허용 조건 하에서 골아세포를 형성할 수 있지만, 골연골원성 세포는 성장 인자의 영향을 받아 분화된다.를 클릭합니다.[1]
뼈형태생성단백질
연골 골격 분화의 주요 성장 인자는 연골세포 분화가 일어나는 곳과 뼈 사이에 공간이 있는 곳을 결정하는 뼈 형태 발생 단백질(BMP)을 포함한다.뼈에 의한 연골 치환 시스템은 복잡한 조절 시스템을 가지고 있다.BMP2는 또한 초기 골격 패턴을 조절합니다.TGF-β 변환 성장인자 베타(TGF-β)는 TGF 베타 신호 경로에서 공통 신호 요소를 가진 BMP를 포함하는 단백질 슈퍼 패밀리의 일부이다.TGF-β는 연골 분화에 있어 특히 중요하며, 연골 분화는 일반적으로 내연골 골화를 위한 뼈 형성에 선행한다.피부와 관련하여 골격 요소가 발생하는 위치를 결정하는 섬유아세포 성장인자(FGF)는 필수 조절인자의 추가 패밀리입니다.
스테로이드 및 단백질 호르몬
다른 많은 규제 시스템들은 연골에서 뼈로의 전환과 뼈 유지에 관여한다.특히 중요한 뼈 표적 호르몬 조절기는 부갑상선 호르몬(PTH)이다.부갑상선 호르몬은 혈청 칼슘의 [3]활성 조절 하에 부갑상선에 의해 만들어지는 단백질이다.PTH는 또한 칼슘 섭취에 관계없이 혈청 칼슘 농도를 거의 일정하게 유지하는 것을 포함한 중요한 전신 기능을 가지고 있다.식칼슘의 증가는 혈중 칼슘의 경미한 증가를 가져온다.그러나, 이것은 낮은 식칼슘 상태를 제외하고 골아세포 뼈 형성을 지원하는 중요한 메커니즘은 아니다. 또한 비정상적으로 높은 식칼슘은 심장마비와 [9]뇌졸중을 포함한 뼈 덩어리와 직접적으로 관련이 없는 심각한 건강상의 결과를 초래할 위험을 증가시킨다.PTH는 2관능적이며 고농도에서 골격의 저하를 매개하지만 간헐적인 PTH 자극은 골아세포 활동을 증가시킨다.
골격은 생식을 위해 그리고 영양과 다른 호르몬 스트레스에 반응하여 변형됩니다; 그것은 생식 및 에너지 대사 조절에 중요한 에스트로겐과 글루코콜티코이드를 포함한 스테로이드제에 반응합니다.뼈의 회전은 뇌하수체 호르몬을 포함한 많은 추가 신호와 함께 합성과 열화를 위한 에너지의 주요 소비를 포함합니다.이들 중 두 가지는 부신피질자극호르몬([11]ACTH)[10]과 모낭자극호르몬이다.ACTH는 PTH와 같이 2관능적이고 주기적인 ACTH 스파이크로 뼈 형성을 지원하지만 고농도로 뼈 파괴를 일으킬 수 있지만, 이러한 반응과 다른 여러 당단백질 호르몬에 대한 생리학적 역할은 완전히 이해되지 않는다.마우스에서는 부신에서 ACTH 유도 글루코콜티코이드 생성의 효율성을 감소시키는 돌연변이가 골격을 조밀하게 만든다(골격경화성 뼈).[12][13]
조직 및 초인프라스트럭처
전자현미경을 통해 고배율로 연구된 잘 보존된 뼈에서는 개별 골아세포가 밀착 접합으로 연결되어 세포외액의 통로를 막고 일반 세포외액과 [14]분리된 골격실을 형성한다.골아세포는 골아세포를 연결하는 작은 모공인 틈새 접합에 의해 연결되며, 하나의 코호트의 세포가 하나의 단위로 [15]기능할 수 있습니다.갭 접합부는 또한 세포들의 더 깊은 층을 표면층과 연결한다.이는 골아세포에 저분자량 형광 염료를 주입하여 직접 입증되었으며,[16] 이 염료가 골형성단위의 주변 세포와 더 깊은 세포로 확산되었음을 보여주었다.뼈는 시멘트 라인으로 불리는 세포 연결이 없는 불침투성 구역으로 구분되는 이러한 단위들 중 다수로 구성되어 있습니다.
콜라겐 및 부속 단백질
뼈의 거의 모든 유기(비광물) 성분은 촘촘한 콜라겐 타입 [17]I로 뼈에 인장 강도를 부여하는 촘촘한 가교 로프를 형성합니다.여전히 불분명한 메커니즘에 의해 골아세포는 배향된 콜라겐 층을 분비하며, 몇 마이크로미터마다 뼈의 장축과 직각으로 층을 번갈아 가며 뼈의 장축에 평행한 층을 분비한다.콜라겐 타입 I의 결함은 골형성불완전증이라고 불리는 가장 흔한 유전성 골질환을 일으킨다.[18]
뼈의 유기 [19]매트릭스에서 골칼신과 골포틴을 포함한 작지만 중요한 소량의 단백질이 분비된다.오스테오칼신은 뼈 이외에는 유의한 농도로 발현되지 않으므로 오스테오칼신은 뼈 매트릭스 [20]합성을 위한 특정 마커이다.이 단백질들은 뼈 [21]매트릭스의 유기물과 미네랄 성분을 연결한다.단백질은 미네랄과 콜라겐 사이의 중간 위치 때문에 매트릭스 강도를 최대화하기 위해 필요합니다.
그러나 각각의 유전자(녹아웃 마우스)의 표적 교란으로 오스테오칼린 또는 오스테오폰틴의 발현이 제거된 마우스에서는 미네랄 축적이 현저하게 영향을 받지 않아 매트릭스 구성이 미네랄 수송과 [22][23]유의미한 관계가 없음을 알 수 있다.
뼈 대 연골
원시 골격은 연골이며, 개별 연골 매트릭스 분비 세포, 즉 연골세포가 발생하는 (혈관이 없는) 고체 무혈관 조직입니다.연골세포는 세포간 연결을 가지고 있지 않으며 단위 단위로 배위되어 있지 않다.연골은 물을 흡수하는 단백질인 친수성 프로테오글리칸에 [24]의해 긴장된 콜라겐 타입 II의 네트워크로 구성되어 있다.이것은 상어 등 연골 어류의 성체 골격입니다.그것은 더 발달한 동물 계급에서 초기 골격으로 발달한다.
공기를 마시는 척추동물에서 연골은 세포뼈로 대체된다.전이조직은 광화된 연골이다.연골은 높은 국소 농도의 칼슘과 인산염을 [24]침전시키는 인산염 생성 효소의 대량 발현에 의해 광물화된다.이 미네랄화된 연골은 밀도가 높지도 튼튼하지도 않다.공기호흡 척추동물에서는 골아세포에 의한 세포골 형성을 위한 발판으로 사용되며, 그 후 광물화된 조직을 분해하는 것을 전문으로 하는 골아세포에 의해 제거된다.
골아세포는 콜라겐 [25]로프 주위에 채워진 고밀도 불규칙한 히드록시아파타이트 결정으로 구성된 고급 형태의 골기질을 생성합니다.골격을 주로 중공 튜브 형태로 만들 수 있는 튼튼한 복합 재료입니다.긴 뼈를 튜브로 줄임으로써 체중을 줄이면서 강도를 유지할 수 있습니다.
뼈의 광물질화
광물화의 메커니즘은 완전히 이해되지 않았다.테트라사이클린이나 칼세인과 같은 형광성 저분자 화합물은 단기간 투여될 때 뼈 미네랄에 강하게 결합합니다.그런 다음 그들은 새로운 [26]뼈에 좁은 띠 모양으로 축적된다.이 띠들은 뼈를 형성하는 골아세포의 연속된 그룹에 걸쳐 있다.그것들은 좁은 (미크로미터 이하의) 광물질화 전선은 마이크로미터 이하입니다.대부분의 뼈 표면은 새로운 뼈 형성, 테트라사이클린 흡수, 미네랄 형성을 나타내지 않습니다.이것은 뼈 형성 그룹 전체에 걸쳐 조정된 촉진 또는 활성 수송이 뼈 형성에 관여하고 세포 매개 광물 형성이만 발생함을 강하게 시사한다.즉, 식이 칼슘은 질량 작용에 의해 미네랄을 생성하지 않습니다.
뼈에서 미네랄 형성의 메커니즘은 연골이 광물화되는 계통학적으로 오래된 과정과는 분명히 다릅니다.테트라사이클린은 좁은 띠나 특정 부위에서 미네랄화된 연골에 라벨을 붙이지 않지만, 수동적인 광물화 [25]메커니즘에 따라 확산됩니다.
골아세포는 조절된 수송에 의한 엄격한 접합에 의해 세포외액으로부터 뼈를 분리한다.연골과 달리 인산염과 칼슘은 골아세포 접합부가 골형성 공간을 분리하기 때문에 수동 확산에 의해 안팎으로 이동할 수 없다.칼슘은 골아세포를 통해 운반됩니다(즉,[25] 경사로에 대해 칼슘을 펌프하지 않는 수동적 운반체에 의해).반면 인산염은 ATP를 포함한 인산염 함유 화합물의 분비물과 인산염을 분해하여 광화전선에서 높은 인산염 농도를 생성하는 인산염 분해효소와의 조합에 의해 활발하게 생성된다.알칼리성 인산가수분해효소는 활성 골아세포의 꼭대기(분비) 면에 다량으로 발현되는 특징적인 표지자인 막 고정 단백질이다.
적어도 1개의 규제된 수송 프로세스가 관련되어 있습니다.골질 미네랄의 화학측정법은 기본적으로 약간 알칼리성 [27]pH로 인산염, 칼슘 및 물에서 침전되는 히드록시아파타이트의 측정법이다.
642− HPO + 22 HO + 102+ Ca † Ca10(PO4)(6OH)2 + 8 H+ 광물이 침전함에 따라 폐쇄된 시스템에서는 산이 축적되어 pH가 급격히 낮아지고 더 이상의 침전이 멈춥니다.연골은 확산에 장벽이 없고 산성도 확산돼 강수량이 계속된다.촘촘한 접합에 의해 기질이 세포외액과 분리되는 골온에서는 이러한 현상이 발생할 수 없습니다.제어되고 밀폐된 구획에서 H를 제거하면+ 매트릭스 [28]구획에서 칼슘과 인산염이 사용 가능한 한 다양한 세포 외 조건에서 침전이 발생합니다.산이 장벽층을 통과하는 메커니즘은 여전히 불확실하다.골아세포는 중복 Na/H 교환기, NHE1 및 NHE6를 [29]통해 Na/H+ 교환할 수 있는 용량이+ 있습니다.H가 매트릭스 공간에서 장벽 골아세포로 운반되는 메커니즘은+ 알려져 있지 않지만, 이+ H 교환은 산 제거의 주요 요소입니다.
골제거에서 역수송기구는 광물질화된 매트릭스에 공급된 산을 사용하여 히드록시아파타이트를 [30]용액으로 구동한다.
골세포 피드백
신체 활동으로부터의 피드백은 골질량을 유지하는 반면, 골세포로부터의 피드백은 골형성 [31][32][33]단위의 크기를 제한합니다.중요한 추가 메커니즘은 골아세포 활동을 유지하는 경로를 억제하는 단백질인 스켈로스틴의 기질에 매장된 골세포에 의한 분비이다.따라서 골격이 제한된 크기에 도달하면 뼈 [34]합성이 비활성화됩니다.
형태학 및 조직학적 염색
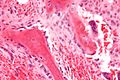
헤마톡실린과 에오신염색(H&E)은 활성골아세포의 세포질이 거친 소포체의 실질적인 존재로 인해 약간 호염기성이 있음을 나타낸다.활성 골아세포는 I형 콜라겐을 상당히 많이 생성한다.골격의 약 10%는 콜라겐과 미네랄 [27]밸런스입니다.골아세포의 핵은 구체적이고 크다.활성골아세포는 조직학적으로 핵에 인접한 투명영역으로서 나타나는 두드러진 골지장치에 의해 형태학적으로 특징지어진다.세포의 산물은 대부분 비광물화 매트릭스인 골상질(steoid)로 운반하기 위한 것이다.활성골아세포는 I형 콜라겐에 대한 항체에 의해 표시되거나 알칼리성 인산인산나프톨염료 및 빠른 파란색 디아조늄염료를 사용하여 알칼리성 포스파타아제 효소 활성을 직접 나타낼 수 있다.
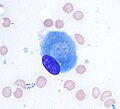
기본적인 골조직을 능동적으로 합성하는 골아세포를 표시하는 미결정 조직의 라이트 마이크로그래프(가운데).
골아세포의 분리
- 미세해부 방법에 의한 첫 번째 격리 기술은 Fell [35]등에 의해 원래 설명되었다.골막과 남은 부분으로 분리된 병아리 사지를 사용했어요그녀는 골막과 남은 부분으로 분리된 병아리 사지를 이용해 배양된 조직으로부터 골형성을 가진 세포를 얻었다.그녀는 배양된 조직으로부터 골형성 특성을 가진 세포를 얻었다.
- 효소 소화는 골세포 집단을 분리하고 골아세포를 얻기 위한 가장 진보된 기술 중 하나이다.펙 외 연구진(1964년)[36]은 현재 많은 연구자들에 의해 자주 사용되는 원래의 방법을 설명했다.
- 1974년 존스 외 [37]연구진은 골아세포가 서로 다른 실험 조건에서 생체 내 및 체외에서 횡방향으로 이동한다는 것을 발견하고 이동 방법을 상세히 기술했다.그러나 골아세포는 혈관 개구부에서 이동하는 세포에 의해 오염되었으며, 이는 내피세포와 섬유아세포를 포함할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR (April 1999). "Multilineage potential of adult human mesenchymal stem cells". Science. 284 (5411): 143–7. Bibcode:1999Sci...284..143P. doi:10.1126/science.284.5411.143. PMID 10102814.
- ^ Arnett T (2003). "Regulation of bone cell function by acid-base balance". Proc Nutr Soc. 62 (2): 511–20. doi:10.1079/pns2003268. PMID 14506899.
- ^ a b Blair HC, Zaidi M, Huang CL, Sun L (November 2008). "The developmental basis of skeletal cell differentiation and the molecular basis of major skeletal defects". Biol Rev Camb Philos Soc. 83 (4): 401–15. doi:10.1111/j.1469-185X.2008.00048.x. PMID 18710437. S2CID 20459725.
- ^ Blair HC, Sun L, Kohanski RA (November 2007). "Balanced regulation of proliferation, growth, differentiation, and degradation in skeletal cells". Ann. N. Y. Acad. Sci. 1116 (1): 165–73. Bibcode:2007NYASA1116..165B. doi:10.1196/annals.1402.029. PMID 17646258. S2CID 22605157.
- ^ Loutit, J.F.; Nisbet, N.W. (January 1982). "The Origin of Osteoclasts". Immunobiology. 161 (3–4): 193–203. doi:10.1016/S0171-2985(82)80074-0. PMID 7047369.
- ^ Nicks KM, Fowler TW, Gaddy D (June 2010). "Reproductive hormones and bone". Curr Osteoporos Rep. 8 (2): 60–7. doi:10.1007/s11914-010-0014-3. PMID 20425612. S2CID 43825140.
- ^ Larsen, William J. (2001). Human embryology (3. ed.). Philadelphia, Pa.: Churchill Livingstone. pp. 355–357. ISBN 0-443-06583-7.
- ^ Karsenty G (2008). "Transcriptional control of skeletogenesis". Annu Rev Genom Hum Genet. 9: 183–96. doi:10.1146/annurev.genom.9.081307.164437. PMID 18767962.
- ^ Reid IR, Bristow SM, Bolland MJ (April 2015). "Cardiovascular complications of calcium supplements". J. Cell. Biochem. 116 (4): 494–501. doi:10.1002/jcb.25028. PMID 25491763. S2CID 40654125.
- ^ Zaidi M, Sun L, Robinson LJ, Tourkova IL, Liu L, Wang Y, Zhu LL, Liu X, Li J, Peng Y, Yang G, Shi X, Levine A, Iqbal J, Yaroslavskiy BB, Isales C, Blair HC (May 2010). "ACTH protects against glucocorticoid-induced osteonecrosis of bone". Proc. Natl. Acad. Sci. U.S.A. 107 (19): 8782–7. Bibcode:2010PNAS..107.8782Z. doi:10.1073/pnas.0912176107. PMC 2889316. PMID 20421485.
- ^ Sun L, Peng Y, Sharrow AC, Iqbal J, Zhang Z, Papachristou DJ, Zaidi S, Zhu LL, Yaroslavskiy BB, Zhou H, Zallone A, Sairam MR, Kumar TR, Bo W, Braun J, Cardoso-Landa L, Schaffler MB, Moonga BS, Blair HC, Zaidi M (April 2006). "FSH directly regulates bone mass". Cell. 125 (2): 247–60. doi:10.1016/j.cell.2006.01.051. PMID 16630814. S2CID 7544706.
- ^ Hoekstra M, Meurs I, Koenders M, Out R, Hildebrand RB, Kruijt JK, Van Eck M, Van Berkel TJ (April 2008). "Absence of HDL cholesteryl ester uptake in mice via SR-BI impairs an adequate adrenal glucocorticoid-mediated stress response to fasting". J. Lipid Res. 49 (4): 738–45. doi:10.1194/jlr.M700475-JLR200. PMID 18204096.
- ^ Martineau C, Martin-Falstrault L, Brissette L, Moreau R (January 2014). "The atherogenic Scarb1 null mouse model shows a high bone mass phenotype". Am. J. Physiol. Endocrinol. Metab. 306 (1): E48–57. doi:10.1152/ajpendo.00421.2013. PMC 3920004. PMID 24253048.
- ^ a b Arana-Chavez VE, Soares AM, Katchburian E (August 1995). "Junctions between early developing osteoblasts of rat calvaria as revealed by freeze-fracture and ultrathin section electron microscopy". Arch. Histol. Cytol. 58 (3): 285–92. doi:10.1679/aohc.58.285. PMID 8527235.
- ^ Doty SB (1981). "Morphological evidence of gap junctions between bone cells". Calcif. Tissue Int. 33 (5): 509–12. doi:10.1007/BF02409482. PMID 6797704. S2CID 29501339.
- ^ Yellowley CE, Li Z, Zhou Z, Jacobs CR, Donahue HJ (February 2000). "Functional gap junctions between osteocytic and osteoblastic cells". J. Bone Miner. Res. 15 (2): 209–17. doi:10.1359/jbmr.2000.15.2.209. PMID 10703922. S2CID 7632980.
- ^ Reddi AH, Gay R, Gay S, Miller EJ (December 1977). "Transitions in collagen types during matrix-induced cartilage, bone, and bone marrow formation". Proc. Natl. Acad. Sci. U.S.A. 74 (12): 5589–92. Bibcode:1977PNAS...74.5589R. doi:10.1073/pnas.74.12.5589. PMC 431820. PMID 271986.
- ^ Kuivaniemi H, Tromp G, Prockop DJ (April 1991). "Mutations in collagen genes: causes of rare and some common diseases in humans". FASEB J. 5 (7): 2052–60. doi:10.1096/fasebj.5.7.2010058. PMID 2010058. S2CID 24461341.
- ^ Aubin JE, Liu F, Malaval L, Gupta AK (August 1995). "Osteoblast and chondroblast differentiation". Bone. 17 (2 Suppl): 77S–83S. doi:10.1016/8756-3282(95)00183-E. PMID 8579903.
- ^ Delmas PD, Demiaux B, Malaval L, Chapuy MC, Meunier PJ (April 1986). "[Osteocalcin (or bone gla-protein), a new biological marker for studying bone pathology]". Presse Med (in French). 15 (14): 643–6. PMID 2939433.
- ^ Roach HI (June 1994). "Why does bone matrix contain non-collagenous proteins? The possible roles of osteocalcin, osteonectin, osteopontin and bone sialoprotein in bone mineralisation and resorption". Cell Biol. Int. 18 (6): 617–28. doi:10.1006/cbir.1994.1088. PMID 8075622. S2CID 20913443.
- ^ Boskey AL, Gadaleta S, Gundberg C, Doty SB, Ducy P, Karsenty G (September 1998). "Fourier transform infrared microspectroscopic analysis of bones of osteocalcin-deficient mice provides insight into the function of osteocalcin". Bone. 23 (3): 187–96. doi:10.1016/s8756-3282(98)00092-1. PMID 9737340.
- ^ Thurner PJ, Chen CG, Ionova-Martin S, Sun L, Harman A, Porter A, Ager JW, Ritchie RO, Alliston T (June 2010). "Osteopontin deficiency increases bone fragility but preserves bone mass". Bone. 46 (6): 1564–73. doi:10.1016/j.bone.2010.02.014. PMC 2875278. PMID 20171304.
- ^ a b Blair HC, Zaidi M, Schlesinger PH (June 2002). "Mechanisms balancing skeletal matrix synthesis and degradation". Biochem. J. 364 (Pt 2): 329–41. doi:10.1042/BJ20020165. PMC 1222578. PMID 12023876.
- ^ a b c Blair HC, Robinson LJ, Huang CL, Sun L, Friedman PA, Schlesinger PH, Zaidi M (2011). "Calcium and bone disease". BioFactors. 37 (3): 159–67. doi:10.1002/biof.143. PMC 3608212. PMID 21674636.
- ^ Frost HM (1969). "Tetracycline-based histological analysis of bone remodeling". Calcif Tissue Res. 3 (1): 211–37. doi:10.1007/BF02058664. PMID 4894738. S2CID 9373656.
- ^ a b Neuman WF, Neuman MW (1958-01-01). The Chemical Dynamics of Bone Mineral. University of Chicago Press. ISBN 0-226-57512-8.[페이지 필요]
- ^ Schartum S, Nichols G (May 1962). "Concerning pH gradients between the extracellular compartment and fluids bathing the bone mineral surface and their relation to calcium ion distribution". J. Clin. Invest. 41 (5): 1163–8. doi:10.1172/JCI104569. PMC 291024. PMID 14498063.
- ^ Liu L, Schlesinger PH, Slack NM, Friedman PA, Blair HC (June 2011). "High capacity Na+/H+ exchange activity in mineralizing osteoblasts". J. Cell. Physiol. 226 (6): 1702–12. doi:10.1002/jcp.22501. PMC 4458346. PMID 21413028.
- ^ Blair HC, Teitelbaum SL, Ghiselli R, Gluck S (August 1989). "Osteoclastic bone resorption by a polarized vacuolar proton pump". Science. 245 (4920): 855–7. Bibcode:1989Sci...245..855B. doi:10.1126/science.2528207. PMID 2528207.
- ^ Klein-Nulend J, Nijweide PJ, Burger EH (June 2003). "Osteocyte and bone structure". Curr Osteoporos Rep. 1 (1): 5–10. doi:10.1007/s11914-003-0002-y. PMID 16036059. S2CID 9456704.
- ^ Dance, Amber (23 February 2022). "Fun facts about bones: More than just scaffolding". Knowable Magazine. doi:10.1146/knowable-022222-1. Retrieved 8 March 2022.
- ^ Robling, Alexander G.; Bonewald, Lynda F. (10 February 2020). "The Osteocyte: New Insights". Annual Review of Physiology. 82 (1): 485–506. doi:10.1146/annurev-physiol-021119-034332. ISSN 0066-4278. PMC 8274561. PMID 32040934. Retrieved 8 March 2022.
- ^ Baron, Roland; Rawadi, Georges; Roman‐Roman, Sergio (2006). "WNT Signaling: A Key Regulator of Bone Mass". Current Topics in Developmental Biology. Vol. 76. pp. 103–127. doi:10.1016/S0070-2153(06)76004-5. ISBN 978-0-12-153176-8. PMID 17118265.
- ^ Fell, HB (January 1932). "The Osteogenic Capacity in vitro of Periosteum and Endosteum Isolated from the Limb Skeleton of Fowl Embryos and Young Chicks". Journal of Anatomy. 66 (Pt 2): 157–180.11. PMC 1248877. PMID 17104365.
- ^ Peck, W. A.; Birge, S. J.; Fedak, S. A. (11 December 1964). "Bone Cells: Biochemical and Biological Studies after Enzymatic Isolation". Science. 146 (3650): 1476–1477. Bibcode:1964Sci...146.1476P. doi:10.1126/science.146.3650.1476. PMID 14208576. S2CID 26903706.
- ^ Jones, S.J.; Boyde, A. (December 1977). "Some morphological observations on osteoclasts". Cell and Tissue Research. 185 (3): 387–97. doi:10.1007/bf00220298. PMID 597853. S2CID 26078285.
추가 정보
- 윌리엄 F. 뉴먼과 마가렛 W.Neuman. (1958)뼈 광물의 화학적 역학시카고:시카고 대학 출판부입니다.ISBN 0-226-57512-8.
- 네터, 프랭크 H.(1987년).근골격계: 해부학, 생리학 및 대사 장애.서밋(뉴저지): Ciba-Geigy Corporation ISBN 0-914168-88-6.