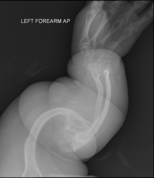
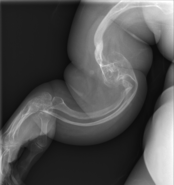
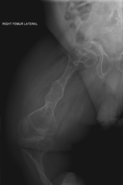
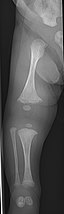
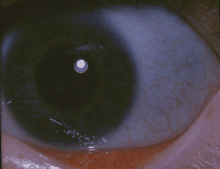
골생성 불완전성
Osteogenesis imperfecta| 골생성 불완전성 (OI) | |
|---|---|
| 기타 이름 | 부서지기 쉬운 뼈 질환,[1] 로브스타인 증후군,[1]: 5 프래실리타스 오시움,[2] 브롤릭병,[1]: 5 골수병증 특발병[3]: 347 |
 | |
| 위 소녀의 눈에서와 같이 푸른 sclerae는 OI의 고전적인 비경향적 기호다. | |
| 발음 | |
| 전문 | 소아과, 의학유전학, 정형외과 |
| 증상 | 쉽게 부서지는 뼈, 파란색이 슬레라(눈의 흰자위), 짧은 키, 관절 과이동성, 청력 손실[5] |
| 시작 | 출생 |
| 기간 | 장기 |
| 원인들 | 유전적(자율 우성 또는 de novo 돌연변이)[6] |
| 진단법 | 증상에 따라 DNA 검사 |
| 예방 | 이식 전 유전자 진단 |
| 관리 | 건강한 생활습관(운동, 금연), 긴 뼈를 관통하는 금속봉 |
| 약물 | 비스포스포네이트[7] |
| 예후 | 종류에 따라 다름 |
| 빈도 | 1만5000[8]~2만명 중 1명 |
골인성 불완전증(IPA: /ˌɒstioʊddnəsɪsɪs ˌɪmpmpssssssssss ˌɪmpmprr///////;;[4] OI)은 모두 뼈가 쉽게 부러지는 유전 질환의 집단이다.[1]: 85 [9] 뼈와 신체의 다른 장기에 나타나는 증상의 범위는 온화하거나 심각할 수 있다.[5]: 1512 다양한 종류의 OI에서 발견되는 증상으로는 대신 푸른색인 눈의 흰자위(시골)와 짧은 키, 느슨한 관절, 청력 상실, 호흡 장애[10], 치아 문제(치아의 결함) 등이 있다.[5] 보다 심한 OI에서 더 흔하게 나타나는 잠재적으로 생명을 위협하는 합병증에는 대동맥과 같은 주요 동맥의 찢어짐(파열),[1]: 333 [11] 늑골 왜곡에 따른 2차 폐판막 부족,[1]: 335–341 [12] 기저귀 침윤 등이 포함된다.[13]: 106–107
기초적인 메커니즘은 대개 타입 I 콜라겐의 부족 또는 불완전하게 형성되어 있는 결합조직에 문제가 있다.[5]: 1513 90%이상의 경우 COL1A1 또는 COL1A2 유전자의 돌연변이로 OI가 발생한다.[14] 이러한 돌연변이는 사람의 부모로부터 자가 지배적인 방식으로 유전될 수 있지만 자연적으로 발생할 수도 있다(de novo).[9][15] 임상적으로 정의된 유형에는 4가지가 있다: 가장 덜 심각한 유형인 I형, 적당히 심각한 유형인 IV형, 심각하고 점진적으로 변형되는 유형인 III형, 그리고 치명적인 유형이다.[9] 2021년[update] 9월 현재 19개의 서로 다른 유전자가 21개의 유전적으로 정의된 OI의 원인이 되는 것으로 알려져 있는데, 이 중 다수는 극히 드물고 소수의 개인에게만 기록되어 있다.[16][17] 진단은 흔히 증상에 근거하며 콜라겐 생검이나 DNA 염기서열 분석을 통해 확인할 수 있다.[10]
치료법은 없지만 OI의 경우 대부분 기대수명에 큰 영향을 미치지 않고,[1]: 461 [15] 이로 인한 유년기의 사망은 드물며,[10] OI를 가진 많은 성인이 장애에도 불구하고 상당한 수준의 자율성을 달성할 수 있다.[10][18] 운동을 통해 건강한 생활습관을 유지하고, 비타민D와 칼슘이 충분히 함유된 균형 잡힌 식사를 하며, 흡연을 피하는 것이 골절 예방에 도움이 될 수 있다.[19] OI를 가진 사람들은 그들의 자녀가 그들로부터 장애를 물려받는 것을 막기 위해 유전적 상담을 받을 수 있다.[1]: 101 치료에는 부러진 뼈의 급성 관리, 진통 약물, 물리치료, 다리 교정기와 휠체어 같은 이동 보조기구,[10] 비타민 D 보충제, 특히 어린 시절에 설치 수술 등이 포함될 수 있다.[20] 로드딩(Rodding)[10]은 긴 뼈(예: 대퇴골)를 따라 금속 내 막대(Metal intrimary lod)를 삽입한 것으로, 이를 강화하려는 시도다. 의학 연구는 또한 골밀도를 높이기 위해 파미드로네이트와 같은 비스포스포네이트 등급의 약물 사용을 지원한다.[21] 비스포스포네이트는 특히 어린이들에게 효과적이지만,[22] 그것들이 삶의 질을 높이거나 골절 발생률을 낮출지는 불분명하다.[7]
OI는 1만5000~2만 명 중 1명 정도만 감염돼 희귀 유전질환이다.[8] 결과는 장애의 유전적 원인(유형)에 따라 달라진다. 제1형(가장 심하지 않음)이 가장 흔하며, 그 밖의 유형은 소수의 사례로 구성된다.[15][23][24] 보통에서 심각까지의 OI는 주로 이동성에 영향을 미친다; 어린 시절에 로드딩 수술을 한다면, 좀 더 심각한 유형의 OI를 가진 사람들 중 일부는 걸을 수 있는 능력을 얻을 수 있다.[25] 그 병세는 고대부터 서술되어 왔다.[26] 라티네이트 용어 골형성 불완전성은 네덜란드 해부학자 윌렘 브롤릭이 1849년에 만든 말로 '불완전한 뼈 형성'[26][27]: 683 을 의미한다.
징후 및 증상
정형외과
OI의 주요 증상은 연약하고 낮은 광물 밀도 뼈다귀다. 모든 종류의 OI는 뼈와 관련이 있다.[5] 온건하고 특히 심한 OI에서는 긴 뼈가 고개를 숙일 수도 있고, 때로는 극히 그럴 수도 있다.[28] 파키스탄의 한 연구에서 치료되지 않은 어린이들에게서 매년 평균 5.8개의 골절이 발견되면서 뼈의 약성은 쉽게 골절을 일으킨다.[29] 골절은 일반적으로 사춘기 이후 훨씬 덜 발생하지만 폐경 후 여성과 60-80세 사이의 남성에게서 다시 증가하기 시작한다.[1]: 486
관절 초이동성은 또한 영향을 받은 유전자가 일부 유형의 에를러-단로스 증후군을 일으키는 유전자와 같기 때문에 OI의 일반적인 신호다.[5]: 1513 [note 1][30][31]
이톨로지
50세가 되면 OI를 가진 성인의 약 50%가 상당한 청력 손실을 경험하게 되는데, 이는 일반 인구와 비교했을 때 훨씬 빠른 것이다.[32] OI의 청력 손실은 오십자와 내이의 가시적인 기형과 관련이 있을 수도 있고 없을 수도 있다.[33] 청력 손실은 종종 2세, 3세, 4세 동안 시작되며 전도성, 센서리노럴 또는 두 가지 모두의 조합("혼합")[34]일 수 있다. 만약 50세까지 청력 손실이 발생하지 않는다면, 그 후 몇 년 동안 청력 손실은 발생할 가능성이 현저히 낮다.[32] 혼성 청력 손실은 모든 연령대의 OI를 가진 사람들에게 가장 흔하며 전도성 청력 손실은 노인에게 영향을 미칠 가능성이 가장 높으며, 감각 청각 손실은 어린이들에게 영향을 미칠 가능성이 가장 높다.[35]
비교적 드물기는 하지만 OI와 관련된 청력 손실은 유년기에 시작될 수 있다; 4세에서 16세 사이의 45명의 어린이들을 대상으로 한 연구에서, 11세와 15세의 두 명이 영향을 받는 것으로 밝혀졌다.[36] 다른 2008년 연구에서 OI를 가진 41명의 청력을 검사했다. 그 결과 20세 이상 연령층의 88%가 어떤 형태의 청력 손실을 가지고 있는 반면 20세 미만 연령층의 경우는 38%에 불과했다.[37]
청각 손실은 타입 I OI에서 가장 흔하며 타입 III와 IV에서는 덜 흔하다.[1]: 294–296 내이의 다른 부분들도 OI에 의해 영향을 받을 수 있다. 균형 문제를 야기시킨다. 그러나, 단지 작은 연구들만이 현기증과 OI 사이의 연관성을 발견했다.[1]: 308 OI는 청력 손실을 교정하는 치료의 결과를 악화시킬 수 있다.[35]
OI는 감각 청각 손실에 대한 OI의 연관성 외에도, 주로 중추신경계를 둘러싼 골격 구조의 기형으로 인해 중추신경계가 관여하는 여러 신경학적 이상과 연관되어 있다. 신경학적 합병증, 특히 기저귀 삽입은 기대수명에 악영향을 미칠 수 있다. OI에서 이는 C2 척추의 특징인 [38][13]: 106–107 밀도의 위쪽으로 이동하기 때문에 발생하는 경우가 가장 많다. 신경외과 수술은 환자의 생명을 위태롭게 하거나 큰 고통이나 참을 수 없는 신경학적 결함을 야기할 때 심각한 이상을 교정하기 위해 필요할 수 있다.[38][13]: 106–107
체계적
그것의 생물학적 원인이 더욱 정확하게 밝혀짐에 따라, OI의 1차적 질병 과정이 뼈에서 일어나는 반면, 가장 흔한 형태의 OI는, 1형 콜라겐 유전자 변이에 의해 야기된 OI는 사실상 모든 인체의 장기에 어떤 방식으로든 영향을 미친다는 것이 더욱 널리 인식되고 있다.[15]
제1형 콜라겐은 순환계와 호흡계 전반에 걸쳐 존재한다. 심장 자체의 심실에서부터 심장 판막, 혈관조직에 이르기까지,[1]: 329 그것은 폐의 결합조직의 필수적인 부분이다.[1]: 336 이와 같이 대동맥부족, 대동맥류, 동맥전파 등 심혈관 합병증은 OI와 동반입찰되기도 하지만 마르판증후군과 동반입찰되는 만큼 빈번하지는 않다.[1]: 333 [1]: 332
호흡기 질환은 OI에서 주요 사망 원인이다.[12][1]: 335 OI에서 호흡기 질환의 가장 분명한 원인은 흉벽의 구조상 문제로 인한 폐결핍이다.[1]: 341 그러나 폐렴과 같은 호흡기 감염도 일반 인구보다 OI가 있는 사람 중에서 더 치명적이다.[12][39] 늑골 기형이 더 심한 사람들은 OI 타입 III와 IV를 가진 22명의 이탈리아 환자들과 26명의 영향을 받지 않는 대조군을 포함한 22명의 2012년 소규모 연구에서 더 심한 폐 제한을 가진 것으로 밝혀졌다.[12]
OI, 특히 그것의 심각한 형태 타입 III는 위장 시스템에도 영향을 미친다. OI에 걸린 환자에 대한 두 가지 연구에서 재발한 복통, 만성 변비와 관련이 있는 것으로 나타났다.[40][41] 만성 변비는 특히 흔하며,[1]: 377 비대칭 골반(구개돌기)에 의해 악화되는 것으로 생각된다.[1]: 377 [41] 특히 유년기에는 OI 관련 변비가 충만감과 관련 음식 거부감을 유발해 영양실조로 이어질 수 있다.[1]: 377
분류
현대용 OI에는 두 개의 타이핑 시스템이 있다. 1979년 데이비드 실런스가 만든 첫 번째 치료제는 환자의 질병의 유전적 원인을 고려하지 않고 환자의 임상적 표현에 따라 4가지 유형, 즉 신드롬으로 분류한다.[42]: 114–115 [43] 두 번째 시스템은 실런스 모델에서 확장되지만, 새로운 번호의 유형은 발견된 대로 유전적으로 할당한다.[44][43] 따라서 OI를 가진 사람은 임상 유형과 유전 유형을 모두 가지고 있다고 설명할 수 있는데, 이는 동등하거나 동등하지 않을 수도 있다.[43]
타입 I이 가장 흔하며, 사례의 90%는 COL1A1 또는 COL1A2의 돌연변이로 인해 발생한다.[9] 증상은 종류에 따라 많이 달라지는 것은 물론, 같은 가족이라도 사람마다 다르다.[45]
2021년 현재 21종의 OI가 정의되었다.[16][17]
| 실랑스의 4종류 | ||||||
|---|---|---|---|---|---|---|
| 유형 | 설명 | 유전자 | 오밈 | 상속 모드 | 발생 | 정의됨[note 2] |
| I | 온화한 | Null COL1A1 알레일 | 166200 | 자가 우성, 34% de novo[6]. | 3만분의[46] 1 | 1979[43] |
| II | 치사기에[5]: 1511 치명적인. | COL1A1, COL1A2 | 166210 | 자가 우성, 100% de novo[6] | 40,000분의[23] 1에서 10만분의[46] 1 | |
| III | 심각하고 진행적이며 변형된 | COL1A1, COL1A2 | 259420 | 자가 우성, 85% de novo[6]. | 6만분의[46] 1 | |
| IV | 변이성 및 변형성, 그러나 보통 일반 경화성(sclerae[1]: 294–296 [47])과 함께 | COL1A1, COL1A2 | 166220 | 자가 우성, 50% de novo[6]. | 3만분의[1]: 21 1 | |
| 유전적으로 정의된 유형 | ||||
|---|---|---|---|---|
| 유형 | 유전자 | 오밈 | 상속 모드 | 정의됨[note 2] |
| V | IFITM5 | 610967 | 자가 우성[48][49] | 2000[50][note 3] |
| VI | 세르핀F1 | 613982 | 자가 열성성의[48] | 2002 |
| VII | CRTAP | 610682 | 자가 열성성의[48] | 2006 |
| VIII | LEPRE1 | 610915 | 자가 열성성의 | 2007 |
| IX | PPIB | 259440 | 자가 열성성의 | 2009 |
| X | 세르핀H1 | 613848 | 자가 열성성의 | 2010 |
| XI | FKBP10 | 610968 | 자가 열성성의 | 2010 |
| XII | SP7 | 613849 | 자가 열성성의 | 2010 |
| XIII | BMP1 | 614856 | 자가 열성성의 | 2012 |
| XIV | TMEM38B | 615066 | 자가 열성성의 | 2012 |
| XV | WNT1 | 615220 | 자가 열성성의 | 2013 |
| XVI | CREB3L1 | 616229 | 자가 열성성의 | 2013 |
| XVII | SPARC | 616507 | 자가 열성성의 | 2015 |
| XVIII | 텐트5A | 617952 | 자가 열성성의 | 2018 |
| XIX | MBTPS2 | 301014 | X-연계 열성 | 2016 |
| XX | 메스드 | 618644 | 자가 열성성의 | 2019 |
| XXI | KDELR2 | 619131 | 자가 열성성의 | 2020 |
실런스 유형
실런스의 네 가지 유형은 임상적 의미와 유전적 의미를 모두 가지고 있다; 아래 설명은 임상적이며 여러 가지 유전적 유형의 OI에 적용될 수 있다. 임상 유형뿐만 아니라 유전자를 지칭하는 데 사용되었을 때, 그것은 실제로 자기 지배적인 방식으로 유전되는 COL1A1이나 COL1A2 유전자의 돌연변이에 의해 임상 증상이 발생한다는 것을 나타낸다.[16]
유형
콜라겐은 정상 품질이지만 부족한 양으로 생산된다.[5]: 1516 일반 대중 사이에서보다 뼈 골절이 더 쉽게, 하지만 골 형성 부전증의 정상적 쉽게 더 심각한 형식이 있을 수 있지만 척추 측만증일 뿐이었지만, 비록 온화한 골 형성 부전증 유형 III및 IV에, 더 낮은 콥 각도에 비해;관절; 파란 색 sclerae, 청력 손실이 발생할 것 같다 명백할지 모른 것이므로[47]:.높이가 1과 표, 마침내, 아마도 약간의 감소이다. 이러한 증상 중 하나 이상을 누락한 사례가 존재하기 때문에 OI 타입 1은 성인기로 인식되지 않는 경우도 있다.[5]: 1513–1514
일부 추가적으로 타입 I을 타입 I-A와 I-B로 분할하여, 치신생성 불완전성(Opalesist see)의 부재(I-A) 또는 존재(I-B)로 구별되는 것으로 정의된다.[47][51]: 217 1형인 사람들은 일반적으로 정상적인 수명을 가지고 있다.[52]
유형
콜라겐은 C-terminus에 치명적인 결함이 있다.[5]: 1512 대부분의 경우 호흡기 장애로 인해 생후 1년 이내, 즉 생후 1년 이내에 사망하는 경우가 많다. 또 다른 일반적인 사인은 두개골 골절로 인한 두개골 내 출혈로 생후 또는 출생 직후에 지속된다.[5]: 1511 많은 경우, 이 신생아는 이미 여러 개의 부러진 뼈를 가지고 있다. 제2형 유아도 호흡기 질환이 심하고 뼈가 심하게 변형돼 있다. 영아의 60%는 태어난 후 24시간 이내에 사망하고, 첫 해 이후 생존은 극히 가능성이 낮으며 일반적으로 기계적 인공호흡을 필요로 한다.[53] 생후 1년을 생존하는 유아의 드문 경우에서, 심각한 발달과 운동 지연이 나타난다. 2019년에 공부한 2명의 유아는 둘 다 2세 전후로 머리 조절을 하지 않았고, 둘 다 숨을 쉬기 위해 인공호흡기가 필요했다.[54]
타입 II는 OI의 "유사성 근막" 형태로도 알려져 있으며,[55] 성인기까지의 생존에는 적합하지 않다.[53] 유사하게 심하게 기형된 뼈 때문에 심한 타입 III를 가진 유아는 처음에 타입 II로 잘못 분류되기도 한다. 일단 장기 생존이 보이면 타입 III를 가진 것으로 간주된다.[5]: 1511 [56]
유형
콜라겐 양은 충분하지만 품질이 높지 않다.[5]: 1512 유형 III및 IV의 임상 분화 항상은 사실 형식 4절에 치료를 받지 않은 성인형 3세와 치료 성인보다 더 나쁜 증후가에 당황해다;[5]:1511년[57]형상에만 형식 III에서 발견된다는 점차적으로 deforming nature[5]:1511–1512과 하나의 얼굴의``triangul에 따라 참관하는 단순하지 않다.ar" 외모.[58] III형과 IV형의 또 다른 차별화 요소는 청색 쇄골이다. III형에서 유아는 나이가 들면서 점차 하얗게 변하는 청색 쇄골을 가지고 있지만, 청색 쇄골은 10%의 사례에서 볼 수 있지만,[1]: 294–296 4형에서는 흔히 볼 수 없다.[59]
골 형성 부전증 형식 III, 자궁 속 가끔에서도 종종 평생 동안 골절의 수백명에 이르는 매우 쉽게 fractureosteopenic 뼈 사춘기까지 진행[24]초기 척추 측만증, 왜소증(최종 성인 키는 자주 작은 4발 또는 120센티미터); 느슨한 관절;그리고 가능한 호흡기 문제 낮은 갈비 뼈를 밝은 분위기였다 때문에 원인이 된다.e저폐량 사용.[5]: 1512
뼈의 문제가 심각하기 때문에 신경계 및 발작장애는 제3형에서 발병할 가능성이 높다.[5]: 1512 뇌계에 압력을 가하는 염기성 발작이 조기사망의 원인이 되거나 원인이 될 수 있다; OI의 경우 수술적 치료가 더 복잡하다.[5]: 1512 [13]: 106–107
유형
콜라겐 양은 충분하지만 품질이 높지 않다.[5]: 1512 유형 IV는 유형 III 또는 I에 맞지 않는 가변 심각도의 경우에 대한 것이다.[47] IV형식에 필요한 실런스의 특징 중 하나는 정상적인 슬래어를 가지고 있었지만,[1]: 294–296 [42]: 114 현대적인 분류는 블루 슬래어를 가진 사람이라도 그 유형의 다른 임상 요건을 충족한다면 IV형 기준을 맞출 수 있게 한다.[59]
제4형에서는 뼈의 기형이 경미하게 심하고 뼈가 쉽게 골절되며(특히 사춘기 이전), 왜소증이 흔하고 척추 붕괴와 척추측만증이 뚜렷하며 청력 손실은 흔치 않지만 가능하다.[10][47][46] Type IV OI는 대부분 타입 III와 타입 I과 대조적으로 정의되며, 둘 사이의 중간 지반 어딘가에 있는 환자에 대한 임상 분류가 된다.[5]: 1511 이와 같이 4형 OI는 같은 계열의 사람들(따라서, 같은 유전 돌연변이를 가진 사람들)의 심각도가 서로 다른,[42]: 111 흔히 "변수형" OI라고 불린다.[47]
전치골 골절률은 임상적으로 유형 IV OI를 평가하는 또 다른 방법이다. 중증 OI(유형 III)의 경우 연간 3파운드의 골절률이 1파운드가 되는 경향이 있다.[47]
I형에서와 같이 일부 유형은 IV–A형 및 IV–B형으로 추가 분할되며, 치신생성 불완전성의 부재(IV–A) 또는 존재(IV–B형)에 의해 다시 정의된다.[47][51]: 217
유전적으로 정의된 유형(유형 –)XXI
2020년 현재 15가지 유형의 OI가 유전적으로 정의된다.[16]
- 유형 – IV 유형과 동일한 임상적 특징을 가지므로 현미경으로 뼈 조직 검사에서 "메쉬 유사" 외관을 관찰하면 임상적으로 구별할 수 있다. 형식 V추가적인 골 형성 부전증의 다른 유형은"V3":불투명한 밴드(엑스선 사진에 보이는)은 성장판에 인접한에 의해;게 구분할 수 있어 비대성의 굳은 살(골질의 수리 조직이 비정상적으로 큰 질량)는 형태에서 골절 사이트 동안 치료 과정, 그리고 석회화의 뼈 사이의 세포막의 forearm,[50]는 것.그것 손목을 돌리기 [1]: 429 어려운
이 조건의 다른 특징으로는 팔꿈치를 당기는 것과 다른 유형의 OI에서와 같이 긴 뼈의 굽힘과 청력 손실이 포함될 수 있다.[60]
이러한 유형의 경우는 11p15.5 염색체의 IFITM5 유전자의 돌연변이에 의해 발생한다.[60][49] 임상 형태인 IV형 OI에서 V형을 분리하는 것은 2000년 미티유스 외 연구진에 의해 그 유전적 원인이 알려지기 전부터 처음 제안되었다.[50][61] 5형은 다른 유전적으로 정의된 OI 유형에 비해 상대적으로 일반적이다. 브라질 병원 유전학과의 OI 환자의 4%가 OI를 가지고 있는 것으로 나타났다.[62]
- 유형 – 타입 III와 동일한 임상적 특징으로 골연화증에서 볼 수 있는 것과 유사한 외모를 가진 뼈로 구별된다.[1]: 168 타입 VI는 17p13.3 염색체의 SERPINF1 유전자의 기능상실 돌연변이에 의해 발생한다.[1]: 170
- 유형 – 3p22.3 염색체의 유전자 CRTAP 돌연변이에 의해 발생하는 OI; 임상적으로 영향을 받는 개인에 따라 OI 유형 II 및 III와 유사하다. 7타입은 퀘벡의 제1국가들 사이에서 처음 발견된, 확인된 최초의 열성 OI형이었다.[63][64]
- 유형 – 1p34 염색체의 유전자 LEPRE1 돌연변이에 의해 발생하는 OI.2; 영향을 받는 개인에 따라 임상적으로 OI 유형 II 및 III와 유사하다.[65]
- 유형 – 15q22.31 염색체의 PPIB 유전자에서 균질 또는 복합 이질 변이 때문에 발생하는 OI.[66]
- 유형 – 11q13 염색체의 SERPINH1 유전자의 균질 돌연변이에 의해 발생하는 OI.[67]
- 유형 – 17q21 염색체의 FKBP10에서 돌연변이로 인한 OI 그 돌연변이는 트리머릭 프로콜라겐 분자의 분비를 감소시킨다. 이 유전자의 다른 돌연변이는 OI와 유사한 자가 열성 브루크 증후군을 일으킬 수 있다.[68]
- 유형 – 12q13.13 염색체의 SP7 프레임 변형에서 발생하는 OI. 이 돌연변이는 뼈의 기형, 골절, 치아 분화를 지연시킨다.[69]
- 유형 – 8p21.3 염색체에서 골형성 단백질 1(BMP1) 유전자의 돌연변이에 의해 발생하는 OI.[70] 이 돌연변이는 재발성 골절, 높은 골질량, 초이동성 관절 등을 유발한다.[71]
- 유형 – 9q31.2 염색체의 TMEM38B 유전자 돌연변이로 인한 OI. 이 돌연변이는 질병의 궤적이 매우 다양하지만 재발성 골절과 골포니아를 유발한다.[72]
- 유형 – 12q13.12 염색체에서 WNT1 유전자의 균질 또는 복합 이질 변이에 의해 발생하는 OI. 그것은 자동 열성적이다.[71]
- 유형 – 11p11.2 염색체의 CREB3L1 유전자의 돌연변이에 의해 발생하는 OI. 균질 돌연변이는 갈비뼈와 긴 뼈의 산전성 골절의 재발, 탈염, 두개골의 오소화 감소, 그리고 청색 쇄골의 원인이 되는데, 임상적으로 2형 또는 타입 III형이다.[73] OI 16세의 이질성 가족 구성원은 재발성 골절, 골수포니아, 청색 경화증을 가지고 있을 수 있다.[73][74]
- 유형 – 5q33 염색체 SPARC 유전자의 균질 돌연변이에 의한 OI로 단백질 오스테오넥틴에 결함이 발생하여 일반화된 일반화, 휠체어에 대한 의존성, 재발성 골절 등이 특징이다.[75]
- 유형 – 6q14.1 염색체의 FAM46A 유전자의 균질 돌연변이에 의해 발생하는 OI. 선천적으로 긴 뼈, 웜 뼈, 청색 경골, 척추 붕괴, 생애 첫 해 다발성 골절 등이 특징이다.[76]
- 유형 – Xp22.12 염색체의 MBTPS2 유전자의 혈류 돌연변이에 의해 발생하는 OI. 지금까지 OI형 XIX는 X연계 열성 유전형태를 가진 OI형 중 유일하게 알려진 타입으로 여성보다 남성에게 더 흔하게 나타나는 타입이다. OI형 XIX는 건강한 뼈 형성에 중요한 조절된 골내 단백질 분해를 방해한다.[77]
- 유형 – 15q25.1 염색체의 MESD 유전자의 균질 돌연변이에 의해 발생하는 OI. XX형식의 초기 연구는 OI형 중 첫 번째인 전지구적 발달지연을 유발할 수 있다는 것을 보여준다. OI형 XX는 골격발달에 역할이 있다고 생각되는 Wnt 신호통로를 교란시킨다.[78]
- 유형 – 7p22.1 염색체의 KDELR2 유전자의 균질 돌연변이에 의해 발생하는 OI. 임상적으로 타입 II 및 III와 유사한 질환을 유발하며, 이는 샤페론 단백질 HP47이 콜라겐 타입 I에서 분리되지 않는 것과 관련이 있다고 생각되며, 그렇게 하려면 KDELR2로 인코딩된 누락된 ER 루멘 단백질 고정 수용체 2 단백질에 바인딩해야 한다.[17]
유형발견 속도가 빠른 점을 감안할 때 아직 보고되지 않은 OI와 연관된 다른 유전자가 있을 가능성이 매우 높다.[79]: 491–492
유전학
골생성 불완전성은 유전적 질환의 집단으로, 모두 뼈의 파괴한도를 일으킨다. OI는 높은 유전적 이질성을 가지고 있다. 즉, 많은 다른 유전적 돌연변이가 관찰 가능한 증상들의 동일하거나 유사한 집합으로 이끈다.[80]
이 질환이 발병하는 주요 원인은 콜라겐 타입 I의 생성을 공동으로 담당하는 COL1A1 및/또는 COL1A2 유전자의 돌연변이의 결과다.[81] OI를 가진 사람들의 약 90%는 COL1A1이나 COL1A2 유전자의 돌연변이에 대해 이질적이다.[82] OI의 지배적인 형태의 결과인 몇 가지 생물학적 요인이 있다. 이러한 요인에는 세포 내 스트레스, 비정상적인 조직 광물화, 비정상적인 세포와 세포간의 상호작용, 비정상적인 세포 매트릭스 상호작용, 손상된 세포 매트릭스 구조, 그리고 비정상적인 비협착 단백질과 콜라겐 간의 상호작용이 포함된다.[83]
이전의 연구는 OI가 게놈의 다른 변이가 거의 없는 자가 우성 장애라는 믿음으로 이어졌다.[8] 그러나 2003년 인간 게놈 프로젝트 이후 DNA 염기서열 분석 비용이 낮아지면서 이 질환의 자가 열성형식이 확인됐다.[84] 열성적인 형태의 OI는 프로콜라겐 생성과 관련 단백질의 조립을 담당하는 콜라겐 샤프론의 결함에 크게 관련된다.[85] OI 열성형 환자에게 결함이 있는 콜라겐 샤페론의 예로는 샤페론 HSP47(Cole-Carpenter 증후군)과 FKBP65가 있다.[44] 이러한 보호막의 돌연변이는 콜라겐 1 단백질의 부적절한 접힘 패턴을 초래하여 열성적인 형태의 장애를 일으킨다.[44] 콜라겐 프롤릴 3-히드록실화 복합체(CRTAP, P3H1, CyPB 성분)에서 돌연변이로 인한 유의미한 OI 유형은 3가지다.[44] 이 성분들은 콜라겐 α1(l)Pro986의 수정을 담당한다.[44] SP7, SERPINF1, TMEM38B, BMP1과 같은 다른 유전자의 돌연변이는 불규칙하게 형성된 단백질과 효소로 이어져 다른 열성형 골생성 불완전성을 유발할 수 있다.[44]
색소 상피유발인자(PEDF)와 뼈제한 중간페론 유도 투과단백질(BRL)의 결함은 V형과 VI 골생성 불완전성의 원인이다.[86] 이 단백질들의 결함은 골육성 불완전성의 특징적인 부서지기 쉬운 뼈를 야기하는 결함이 있는 골광물로 이어진다.[86] BRIL을 인코딩하는 IFITM5 유전자의 5′ 미번역영역(5′ UTR)의 단일점 돌연변이는 OI형 V와 직접 연결된다.[60][87]
2016년 처음 발견된 희귀한 XIX형 사례에서 OI는 X연계 유전질환으로 유전되며, 궁극적으로 유전자 MBTPS2의 돌연변이에 따른 해로운 영향을 받는다.[77] 유전자 연구는 진행 중이며, 장애를 배제하기 위해 검사를 받아야 하는 유전자의 수가 계속 증가함에 따라 OI의 모든 유전적 원인이 언제 밝혀질지는 불확실하다.[79]: 491–492
37가족을 대상으로 한 연구에서, 영향을 받지 않은 두 부모에게서 태어난 여러 형제자매에서 OI가 재발할 확률은 1.3%로 조사되었다. 이는 그러한 재발들이 모두 노보일 경우 예상할 수 있는 것보다 훨씬 높은 비율이다.[88] 그 원인은 유전적 모자이즘이다. 즉, 한 부모의 세균 세포의 일부 또는 대부분은 OI의 지배적인 형태를 가지고 있지만, 체세포의 부족은 부모에게 증상이나 명백한 장애를 일으키는데 도움이 되지 않는다. 부모의 다른 세포들은 약간 다른 DNA의 두 세트 이상을 가지고 있다.[88][5]: 1513 임상적으로 OI 타입 II와 III의 경우 of5~10%가 유전적 모자이즘에 기인한다고 관찰되었다.[1]: 532
병리학
OI를 가진 사람들은 결함이 있는 결합 조직을 가지고 태어나거나, 충분한 양을 만드는 능력 없이 태어나거나, 가장 희귀한 유전자 유형에서, 샤페론 단백질, Wnt 신호 경로, BRIL 단백질, 기타 세테라 같은 뼈 형성의 다른 측면에서의 결함을 가지고 태어난다.[16] 1타입에서는 콜라겐의 구조 자체가 정상으로, 단지 그 양이 적은 것이다.[5]: 1516 II형, III형, IV형은 대개 I형 콜라겐의 결핍과 관련이 있지만 항상은 아니다.[89] 한 가지 가능한 결핍은 콜라겐 단백질의 삼중나선 구조에서 글리신을 알라닌과 같이 부피가 큰 아미노산으로 대체하는 아미노산에서 발생한다. 더 큰 아미노산 사이드 체인은 콜라겐 복합체에 불룩함을 일으키는 스테릭 효과로 이어지며, 이는 결국 분자 나노역학 및 분자 간의 상호작용 모두에 영향을 미치게 되는데, 둘 다 절충된다.[90][91] 치환 위치와 대신 사용하는 아미노산 모두에 따라 동일한 두 개의 콜라겐 유전자가 대부분의 경우를 책임지고 있음에도 불구하고 OI에서 유형 다양성을 차지하는 효과가 다르게 나타난다.[92][91] 글리신을 세린이나 시스테인으로 대체하는 경우는 치명적인 타입 II OI에서 덜 자주 볼 수 있는 반면, 발레린, 아스파르트산, 글루탐산 또는 아르기닌으로 대체하는 경우는 더 자주 볼 수 있다.[91]
더 큰 규모에서 콜라겐 섬유질과 히드록사파타이트 결정체가 뼈를 형성하는 관계가 변형돼 침식을 일으킨다.[92] 뼈 골절은 콜라겐 섬유 내 응력 상태가 돌연변이의 위치에서 변하기 때문에 발생하는데, 이 경우 국소적으로 더 큰 전단력이 건강한 콜라겐 섬유에서 일반적으로 발견되는 균일한 응력 상태가 상실되기 때문에 적당한 부하에서도 섬유질이 급속하게 파괴된다.[90] 따라서 OI는 최소 수준의 조직(유전자, 나노, 마이크로) 도미노에서 결함이 조직의 매크로 수준에 영향을 미치는 다단계 현상이다.[90]
진단
진단은 일반적으로 일반 X선과 증상을 포함한 의료 영상촬영을 기반으로 한다. 심한 OI에서 의료 영상에는 모든 사지와 척추에 이상이 있다.[93] X선은 종종 타입 I OI와 관련된 비교적 작은 골밀도 손실에 둔감하기 때문에, DEXA 스캔이 필요할 수 있다.[5]: 1514
OI 진단은 DNA나 콜라겐 단백질 분석을 통해 확인할 수 있지만 외상이 거의 없는 골절의 발생과 블루슬러 등 다른 임상적 특징의 존재만으로도 진단에 충분한 경우가 많다. 피부 생검을 통해 I형 콜라겐의 구조와 양을 판단할 수 있다. DNA 검사도 이 진단을 확인할 수 있지만 OI를 유발하는 모든 돌연변이가 아직 알려져 있거나 테스트된 것은 아니기 때문에 완전히 배제할 수는 없다.[79]: 491–492 OI 타입 II는 임신 중 초음파로 진단되는 경우가 많은데, 이미 복수의 골절과 기타 특징적인 특징이 보일 수 있다. 제어에 비해 OI 피질골은 마이크로 컴팩트 단층 촬영에서 다공성, 운하 직경 및 연결성이 증가함을 보여준다.[94] OI는 또한 양수성 같은 체외 유전자 검사 기법을 사용함으로써 출생 전에 검출될 수 있다.[95]
유전자 검사
골형성 불완전성 여부를 판단하기 위해 가장 흔히 문제가 되는 유전자인 COL1A1, COL1A2, IFITM5의 유전자 염기서열 분석을 실시할 수 있으며,[96] 아직 OI가 발견되지 않으면 OI를 유발하는 것으로 알려진 나머지 10개 이상의 유전자를 검사할 수 있다.[16] 자녀가 OI를 갖고 있다고 의심하는 부모에게도 중복·삭제 검사를 제안한다.[96] 중복과 삭제로 인한 일시적 변이가 존재하는 것은 일반적으로 질병의 심각성을 높이는 원인이다.[96]
차등진단
OI의 중요한 차등 진단은 아동학대인데, 두 가지 모두 다양한 치료 단계에서 다발성 골절을 가진 임상의에게 나타날 수 있다.[5]: 1514 특히 OI의 다른 특징적인 특징이 없을 때, 그것들을 구별하는 것은 어려울 수 있다.[1]: 391 이것은 법정에서 쟁점이 될 수 있다; 미국에서는 골인성 불완전성이 어린이 골절의 진정한 원인이라는 결론과 함께 몇몇 아동학대 사건이 해결되었고, 앨리스 벨라스케즈 외 미국인과 같은 보상금을 요구하는 소송으로 이어졌다.[1]: 391 [97]
다른 차등진단으로는 영양실조로 인한 구루병과 골연화증뿐 아니라 브루크증후군, 저인산성증, 제로데르마 골분비술, 에를러-단로스증후군 등 희귀 골격증후군이 있다.[5]: 1513 [1]: 253–256 OI가 의심되면 이아트로겐성 골다공증, 특발성 청소년 골다공증, 불용 골다공증, 운동 관련 골다공증 등 다양한 형태의 골다공증도 설명으로 고려해야 한다.[1]: 255–256
치료
골인성 불완전성에 대한 치료법은 없다.[10] 운동으로 건강한 생활습관을 유지하고 흡연을 피하는 것이 골절 예방에 도움이 될 수 있다.[98] 치료에는 부러진 뼈의 관리, 진통제, 물리치료, 교정기나 휠체어와 같은 이동 보조기구, 그리고 수술이 포함될 수 있다.[98]
골절률 감소는 우연의 일치일 수 있기 때문에 OI 환자들에게 치료의 성패를 판단하는 것은 어려울 수 있다. 이러한 비율이 치료 효능을 판단하기 위해 의학 연구에 종종 사용되는 반면, OI를 가진 15명의 사람들을 대상으로 한 노르웨이 연구는 의사가 단순히 골절률만이 아니라 전체 환자를 고려해야 한다고 생각한다고 강조했다.[99]
급성 골절 치료
골절은 골형성 불완전성을 가진 개인에서 일반 집단에서 치료되는 것과 거의 같은 방식으로 치료된다.OI 뼈는 비 OI 뼈와 같은 비율로 치유된다.[1]: 431 중간 또는 심각한 유형의 OI에서 고관절 스피카 깁스와 같은 무거운 깁스를 사용하면 일반적인 골수포니아뿐만 아니라 깁스 경계의 뼈에 골절을 일으킬 수 있기 때문에 골절을 고정시키기 위해 경량 소재를 사용하는 것이 더욱 강조된다.[1]: 431 그런 다음 경량 주물이나 부목을 몇 주 후에 탈착식 직교로 교체하고 일단 결합의 증거가 X-ray에 나타나게 된다.[1]: 431 비조합이나 부조합을 예방하기 위해서는 OI를 가진 사람들이 비조합의 위험이 더 크기 때문에 [1]: 439 골절이 사소해 보여도(소골절) 모든 골절은 고정시켜야 한다.[1]: 438
골절에 부차적인 뼈 감염은 일반 집단과 같이 적절한 항생제와 항균제를 사용하여 언제 그리고 언제 발생하는지 치료한다.[1]: 424
약물
비스포스포네이트
1998년, 초기 관찰 실험은 이전에 골다공증을 치료하기 위해 성인에게 사용되었던 비스포스포네이트인 정맥주사 파미드로네이트의 효과를 입증했다. 심한 OI에서, 이 실험은 파미드론산염으로 뼈의 통증이 감소하고, 새로운 척추골절을 예방하며, 이전에 골절되었던 척추뼈를 재형성하고, 긴 골절의 수를 줄인다는 것을 보여주었다.[100]
경구 비스포네이트가 더 편리하고 저렴하지만, 흡수도 되지 않고, 정맥 비스포네이트가 일반적으로 연구 중이지만 더 효과적이다. 일부 연구에서는 경구 알렌드론산염과 정맥 파미드론산염 등 경구 및 정맥 비스포스포네이트가 동등한 것으로 밝혀졌다.[101] 가벼운 OI를 가진 어린이들에 대한 2013년 쌍맹이 실험에서 구강 레즈드론산염은 골밀도를 증가시키고 비추골 골절을 감소시켰다. 그러나 새로운 척추 골절은 줄이지 않았다.[102][103] 2016년 코크란 리뷰는 비스포스포네이트가 골밀도를 향상시키는 것처럼 보이지만 이것이 골절의 감소나 골형성 불완전성을 가진 개인의 삶의 질 향상으로 이어질지는 불확실하다고 결론지었다.[7] 125명의 어린이들을 대상으로 한 실험에서도 비스포스포네이트와 골절률 감소 사이에 인과관계가 발견되지 않았다. 위약 조절 실험은 또한 그들이 근력 증가, 운동 조절 또는 통증 수치를 낮춘다는 것을 증명할 수 없었다.[83]
비스포스포네이트는 성인의 골밀도를 높이는 데 효과적이지 않다.[22]
영양제
OI는 유전적 질환으로 비타민이나 미네랄의 불충분한 섭취에 의해 야기되지 않는다; 보충제는 OI를 치료할 수 없다. 그렇기에 OI를 가진 사람들은 일반 인구보다 훨씬 높은 비율로 비타민D가 심각하게 결핍되는 경향이 있으며, 그 원인은 잘 알려져 있지 않다.[104][105][106] 결핍의 심각성과 그 발생 가능성은 OI의 심각성과 관련이 있다고 생각된다.[105] 최소한 혈액 내 25(OH)D3 수치가 정상으로 돌아올 때까지 비타민 D 보충제를 권고할 수 있다.[104] 비타민 D의 정상 수준 이하도 비스포스포네이트의 효능을 감소시킬 수 있기 때문에 관련된다.[104]
수술
어떤 유형의 수술이든 OI(특히 중간에서 심각한)가 있는 환자에게 시술할 경우 본질적으로 더 많은 위험이 따른다. 골격의 기형과 치의식성 불완전성은 기도 접근을 방해할 수 있다.[1]: 333 기계적 인공호흡기를 사용하고 분리하는 것도 OI 환자에 대해 수행하는 것이 더 어렵다.[1]: 333 시술 자체 또는 치료 과정 중에 결함이 있는 OI 콜라겐이 출혈을 유발할 수 있다.[1]: 333
마취의 안전성 또한 OI 환자들 사이에서 더욱 우려되는 사항으로,[1]: 333 환자가 OI 타입 III를 가지고 있을 때 마취 합병증이 5.6배 더 발생할 가능성이 높다.[107] OI에서 마취의 독특한 관심사는 수술 주기 골절 - 환자의 뼈가 강할 때 일상적으로 부서지기 쉬운 OI 뼈로 부상을 입힐 수 있는 환자 이송 및 기도 접근 기법 때문에 지속되는 골절이다.[108] 한 예로, 혈압계 커픈 골 형성 부전증 환자에 수술 동안 지속에서 상완골 골절이 1972년 보고서 때문에 혈압 모니터링 프로토콜은 골 형성 부전증 환자에 대한, 신생아 사이즈 치고 기계 환경 설정 어른들 조차에서 사용되어서,[109]:11.72을 더 이상 환자의 팔다리의 기형 프레는 완화된 것이다.ferred에 보강하려면수갑을 [20]: 14.23 채우다
로드딩
금속봉은 긴 뼈에 외과적으로 삽입되어 강도를 높일 수 있는데, 이것은 해롤드 A가 개발한 시술이다. 소필드는 그가 시카고의 슈리너스 아동병원 비서실장으로 있을 때, 가족의 지불 능력과 상관없이 아이들에게 정형외과적 관리와 수술을 제공하는 병원이다.[111] OI를 가진 아이들이 슈리너스에게 대거 찾아왔고, 소필드는 뼈를 튼튼하게 하기 위해 다양한 방법을 실험했다.[112] 1959년 에드워드 A와 함께. 밀라르 [sic], 소필드는 당시 급진적으로 보였던 3부 수술에 대해 논술한 정석적인 기사를 썼다: 뼈를 정확하게 부러뜨리고, 그 결과로 생긴 뼛조각을 일직선으로 세운 다음("실제") 금속봉을 긴 뼈의 장내 운하에 넣어 안정시키고 강화("로드 픽사트")했다.이온").[113] 그의 치료는 OI를 가진 사람들의 이동성을 증가시키는데 유용하다는 것이 증명되었고, 그것은 전 세계적으로 채택되었다. 이 치료법은 1979년까지 심각한 OI의 표준 외과적 치료가 되었고, 그 해에 David Silence는 이온을 발견했다.그가 OI 타입 III로 조사한 환자 중 2⁄3은 적어도 한 번의 로드딩 수술을 받은 적이 있다.[42]: 108
로드딩 수술은 보통 OI가 중간이거나 심각한 환자에게 매복, 보행, 보행의 길을 제공하기를 바라는 마음으로 종종 행해진다. 그 저널 골과 합동 외과의 2020년 검토(JB&을 말한다.JS)골 형성 부전증 유형 III및 IV와( 심각한 골 형성 부전증), 그들의 인생에서 41⁄10과 71⁄2년의 평균 나이에서 각각 rodding 수술의 일종을 겪어 왔다 사람들의 아직도 광범위하게 인기 있는:≈2⁄3,[25]:을 발견했다.표 1 되는 경향이 형식 III에 조금 전의 개입을 향해 가능한 설명들 중 하나다. 환아의 절반은 수술 없이는 전혀 걸을 수 없기 때문에, 그들의 팔다리가 더 구부러졌기 때문에, 더 빨리 수술을 구했다.[25]
로드드링 수술을 받은 III형 OI형은 79.5%가 양쪽 다리의 대퇴골과 경골을 장착했다.[25]: Table I 가장 일반적인 형태의 로드는 교내(IM) 로드로, 파시에-듀벌 IM 로드와 같은 일부 로드는 수정 수술의 필요성을 피하기 위해 아이가 자라면서 자라도록 고안된 것을 의미하는 텔레스코핑이다.[114] 망원경용 IM 로드가 널리 사용되고 있으며,[115] 일반적인 Fassier-Duval IM 로드는 대퇴골, 경골, 상완골 등을 로딩하는 데 사용하도록 설계되었다.[116]: 1 수술은 긴 뼈를 한 군데에서 세 군데 정도(또는 그 이상)[115]: Figure 4 로 부러뜨린 다음, 막대기를 뼈와 나란히 고정시켜 곧게 유지하는 것을 포함한다.[116]: 11
반면 IM개 넣어져 아이들에 양쪽 대퇴골과 경골과 함께 키우는 것 의사들은 덜comparatively—the JB&의 성장에 경골에 대한 선호도 러시 막대들 같은non-telescoping IM연료봉을 사용하고 위한 것이다.JS검토하는 동안 femurs의 6천 970%telescoping IM으로 치료 받았습니다, tibiae의 36.9% 있음을 발견했다.[25]:표 IV
그 JB&에 검토 처리하다.JS기동성과 골 형성 부전증의 모든 형식을 통하여, 형식 IV를 보유한 환자의 경우 rodding 수술을 받은 상호 연관시킬로rodded tibiae과non-roddedpatients—while 형식 IV환자들에 0.93tibia 골절, 자연을 가진 환자들을 경험했다 비교해 볼 때, 수술에 부러진 뼈의 발병률이 감소되지 아니하고 수 있었다. 경골은 겨우 0.81을 경험했다. 그러나 Ⅲ형 환자의 경우 로딩수술로 연평균 경골 골절 건수가 0.84건에서 0.57건으로 줄었다.[25]: Table V
척추
척추 융접은 OI 뼈의 고유한 취약성으로 인해 OI 환자에서 이 수술이 청소년기 특발성 척추측만증 환자보다 더 복잡하지만, 정상적인 골밀도를 가진 환자에게는 더욱 복잡하게 만들지만 예방적 조치로서 또는 기존 척추측만증을 교정하기 위해 수행될 수 있다.[117] 그러나 위험에도 불구하고 골인성 불완전성에 대한 외과적 개입을 전문으로 하는 네무르스-듀폰 정형외과 전문의 3명은 성인이 되어서도 척추의 곡선이 계속 악화될 수 있으므로 아이가 최고 높이 속도를 넘은 후 50° 이상의 곡선을 그리면 수술을 권고한다.[13]: 104
관련된 위험 때문에, 같은 외과의사들은 척수와 뇌간에서 작용하는 압력이 실제 신경학적 증상을 유발하는 경우에만 기초적인 인상과 기초적인 자극에 대한 수술을 해야 한다고 권고한다.[13]: 106–107 일단 기저귀 발작이 증상화되면, 오직 수술만이 신경학적 결손의 진행을 멈추거나 되돌릴 수 있다.[1]: 345
물리치료
물리치료는 일반적으로 권장되지만 OI의 가변성으로 인해 개별화된 프로토콜이 필요하다.[1]: 378 골절의 위험을 최소화하기 위해 부드럽게 해야 하지만 물리치료는 근육을 강화하고 운동성을 향상시키며 유연성을 향상시키고 체중 유지에 도움을 주기 위해 사용된다.[1]: 378 OI를 가진 사람들에게 운동은 종종 물 에어로빅, 가벼운 저항 운동, 그리고 만약 환자가 할 수 있다면 걷는 것을 포함한다.[1]: 378 그러나 가벼운 OI 환자에서도 접촉 스포츠는 물론 점핑 등 관절에 불필요한 스트레스를 줄 수 있는 활동도 위험이 있어 제약을 받는다.[1]: 378
거동이 불편한 개인들은 하루 종일 정기적으로 위치를 바꾸도록 권장된다. 하루 중 대부분 또는 종일 휠체어에 앉아 있는 사람들은 운동 형태로서 2시간마다 휠체어에서 빠져나와 뻣뻣함을 줄이고, 압박성 궤양을 예방하는 것이 좋다.[1]: 378
보조 이동 장치와 개조된 차량을 필요로 하는 보통에서 심각한 OI를 가진 개인은 휠체어로 접근 가능한 수영장이나 체육관에 접근하는 데 상당한 장벽에 직면한다. 그들은 그 지역에 어떠한 것도 가지고 있지 않을 수도 있고 거기에 도달하기 위한 수단도 가지고 있지 않을 수도 있다.[1]: 378 비만은 심한 OI를 가진 사람들 사이에서 더 잘 나타날 수 있고, 어떤 사람들은 더 많은 이동성 저하를 일으킬 수 있다.[118][1]: 371, 373
틸트 테이블 전신 진동도 OI를 가진 장기 고정(침대) 환자의 이동성을 증가시키기 위해 수행될 수 있다. 적어도 두 경우 병상에 누워 있는 어린이들이 똑바로 앉을 수 있도록 도와주었다.[119][83]
이빨
OI를 가진 사람 2명 중 1명 이상이 치아의 4대 구성 요소 중 하나인 덴틴 형성에 선천적인 이상인 덴티네제네시스 불완전성(DI)도 갖고 있다.[120] 치과 치료는 OI로 인해 다양한 기형, 골격, 치과 치료의 결과로 난제로 작용할 수 있다. OI를 가진 어린이들은 치아가 폭발하는 즉시 치아 검진을 받아야 한다; 이것은 비정상적인 틀니로 인한 치아 구조 손실을 최소화할 수 있고, 치아와 구강 건강을 보존하기 위해 정기적으로 관찰되어야 한다.[120]
OI를 가진 많은 사람들은 비스포스포네이트로 치료를 받고 있으며, 예를 들어 턱의 약물 관련 골화증(MRONJ)과 같은 치과 시술과 관련된 여러 가지 합병증이 있을 수 있다. 그러나 OI를 가진 어린이 또는 성인에서 비스포스포네이트와 관련된 MRONJ에 대한 보고는 2016년 OI를 위한 비스포스포네이트의 안전성과 효능에 대한 코크란 리뷰에서 발견되지 않았다.[7]
개발중
단클론 항체
오랫동안 OI에 대해 단핵항체가 고려되어 왔지만, 2021년 현재 이러한 치료법은 유럽 연합이나 미국에서도 OI에 대해 승인되지 않았다. 따라서, 그들이 안전한지 효과적인지는 불분명하다. 연구된 단핵항체로는 로모소주맙(대상 스크러스틴, 암겐에 의한 것), 프레스퀴무맙(TGF-β, 사노피), 블로소주맙(sclerosumab, 릴리), 셋루수맵(sclerosumab, 노바티스에 의해 시작됨) 등이 있다.[121]
이전에 BPS-804로 알려진 세트루수맵은 스크러스틴을 표적으로 하는 단핵 항체로, 특히 다른 어떤 항체보다 OI에서 더 많이 연구되어 왔다. 체내에서 스크러스틴은 LRP5 수용체와 LRP6 수용체에 결합하여 Wnt 신호 경로의 억제를 초래한다. 이것은 뼈의 형성을 감소시키고, 건강한 뼈를 가지고 있을 때 문제가 되지 않는다.[122] 그러나, 체내의 슬러스틴 농도를 감소시키면 더 많은 뼈가 형성될 수 있다고 생각되며, 그것이 자연적으로 발생하는 슬러스틴 농도를 감소시키는 단핵 항체가 왜 OI 뼈를 강하게 하는 데 도움을 줄 수 있는지에 대한 전제가 된다.[123] 세트루수맵은 제약회사 노바티스에서 처음 개발된 반면 노바티스는 2015년 울트라게닉스(Ultragenyx)와 연계해 개발을 이어가고 있는 메레오 바이오파마(Mereo Biopharma)에 특허권을 팔았다.[121][124] 2019년 메레오는 세트로수맵의 2-B단계 실험에 대한 데이터 수집을 마무리했다고 발표했는데, 연구는 2020년 11월 12일에 완료되었다.[121][125] 1차 목표인 QCT 스캔에서 시험 데이터가 골밀도 향상을 보여주지 못했는데도 DXA 스캔에서는 개선이 있었다.[126] 메레오는 2020년 9월 보도자료를 통해 2021년 3단계 임상시험을 추진하고 있으며 미국 식품의약국(FDA)으로부터 희귀소아질환(RPD) 지정을 받았다고 밝혔다.[127]
스클레로스틴을 겨냥한 단핵항체인 로모소주맙은 골다공증 치료를 위해 미국과 EU에서 승인된 의약품이다. 제약업계 애널리스트 에버코어는 로모소주맙이 희귀질환에 비해 가격이 저렴해 세트로수맵의 경제성을 없앨 수 있다며 자사의 세트로수맵이 OI에 비해 더 효과적이라는 것을 증명하기 위해 울트라제닉스의 이익률에 '비탈'할 것이라고 주장했다.[121] OI에서 로모소주맙의 효능을 평가하는 임상시험이 2020년 9월부터 시작돼 2021년 9월 현재 진행 중이다.[128]
예방

유전적 장애로서 21세기 골생성 불완전성의 예방의 주역은 우선 영향을 받은 개인이 태어나는 것을 방지하는 데 있다. 유전적 상담은 환자와 그들의 가족이 어떤 종류의 검진이 그들의 상황에 맞는지 결정하는데 도움을 줄 수 있다. 환자는 체외수정 후 이식 전 유전자 진단을 고려해 영향을 받지 않는 수정 배아를 선별할 수 있다.[1]: 247–248 OI를 유발하는 일반적인 돌연변이는 엑소메 염기서열 분석과 전체 게놈 염기서열 분석으로 잡힐 수 있다. 이미 임신이 진행 중인 경우 태아가 영향을 받았는지 확인하기 위해 양수시술을 받을 수도 있다.[1]: 247 만약 영향을 받는다면, 그들이 임신을 종료하기를 원하는지 아닌지를 고려하고 다시 시도하는 것, 즉 의료 윤리와 여성의 선택권에 대한 문제를 제기하는 것은 가족의 몫이다.[129][130]
개입 없이 골형성 불완전성을 유발하는 가장 흔한 돌연변이를 가진 환자들은 이 돌연변이가 멘델리아 유전자의 자동 지배적 패턴으로 유전되기 때문에 이 돌연변이를 물려줄 확률이 50%이다.[1]: 247 희귀한 자가 열성형 OI를 가진 사람들은 이 장애를 옮길 확률은 25%이다. 가족 구성원에 대한 유전자 검사를 사용하여 어떤 유전 패턴이 적용되는지 결정할 수 있다.[1]: 101
OI형 I형은 신생아에서 검출이 어려울 수 있으므로, 아이의 제대혈 검사를 통해 가족이 이미 더 침습적인 유전자 검사 방법을 거부했는지 여부를 확인할 수 있다.[1]: 247 더 심각한 경우에는 특히 OI가 이미 가능성이 있는 경우 초음파를 통해 진단이 가능할 수 있다.[1]: 248 OI에 대한 산전 검사에 대한 윤리적 우려는 종종 부모들이 그들의 아이가 얼마나 심각한 영향을 받을 것인가에 대해 질문할 때 발생한다. 그러한 질문들은 아직 결정적으로 대답하기 어렵다.[1]: 382
만약 영향을 받지 않은 사람이 이미 OI를 가진 아이를 가졌다면, 유전적 모자이즘으로 인해 (아직 꽤 멀었지만) 미래의 자녀들이 OI를 가질 가능성이 더 크다.[88][1]: 100, 1513
일부 생명윤리학자들과 일부 영향을 받은 개인들이 갖고 있는 OI에 대한 태아 검사의 장애권리 비판은 이를 우생학에 부정적으로 비교하며, 심지어 그들의 존재는 OI를 가진 사람들의 삶이 "살 가치가 적고" 덜하다는 믿음을 배반한다는 윤리적 이유로 낙태를 반대하지 않는다. 가치 있는"[1]: 388
예후
골생성 불완전성의 예후는 전적으로 그 유형에 달려 있다(§ 분류 참조).
기대수명
가벼운 형태의 장애인 1형에서 환자의 기대수명은 일반 인구의 기대수명에 가깝다.[1]: 461 그러나 제2형에서 환자들은 2세 이후에 사는 경우가 매우 드물며, 일반적으로 생후 첫 주에 사망한다.[5]: 1511 라이프스타일 선택이 그렇지 않았다면 발생하지 않았을 치명적 외상성 부상을 유발할 수 있거나 일반 모집단에서는 치명적이지 않았기 때문에 타입 III와 IV 환자의 기대 수명에 대한 평가는 더 복잡하다. IV OI형에서 기대수명은 정상과 가까운 것으로 생각되지만, III형에서는 일반 모집단보다 낮다.[48]
덴마크의 국립 환자 등록부의 2016년 데이터를 분석한 결과, 모든 유형의 OI에서 전체 원인 사망률이 3배 더 높았고, 여성은 약 7년, 남성은 9년 정도 감소하는 것으로 나타났다.[15] 1996년 영국 의학 저널에 발표된 한 연구는 타입 III의 사망률이 20대, 30대, 40대의 많은 환자들이 사망하고 있으며, 10세까지 생존하는 환자들은 신생아보다 기대수명이 더 긴 것으로 밝혀졌다.[131]
이동성
성인으로서 순한 (I형) OI를 가진 사람들은 적응 장비를 거의 필요로 하지 않지만, 유아기에는 일반 모집단에 비해 현저한 지연으로 모터 마일스톤에 도달한다.[1]: 477
목발, 전동 휠체어, 부목, 연장기 및/또는 가정 개조와 같은 적응형 장비로, 중간에서 심각한 OI를 가진 많은 개인이 상당한 수준의 독립성을 달성하거나 유지할 수 있다.[18][1]: 488 치료와 물리치료를 통해, 최대 이동성 수준은 I형의 공동체 걷기, III형의 가계 또는 운동 걷기, IV형의 가정 또는 공동체 걷기 등이 지원되지 않을 것으로 예상된다. 개인 간 OI의 변동성으로 인해 달성된 이동성은 다양하며 이 예상 최대치에 미치지 못할 수 있다.[1]: 476
역학
미국에서 골인성 불완전성의 발병률은 2만 명당 1명으로 추정된다.[132] 미국에서는 약 2만에서 5만 명의 사람들이 OI의 영향을 받는다.[133]
가장 흔한 종류는 I, II, III, IV이며, 나머지는 매우 드물다.[134] 1형이 가장 일반적이며, 2형보다 약 3배 더 일반적이라고 보고되었다. 타입 III와 IV의 유병률은 덜 확실하다.[23] 덴마크의 1989년 연구에서 타입 1은 71%, 타입 II는 12%로 구성됐으며, 다른 타입은 나머지 17%[15]로 구성됐다. 스웨덴의 2015년 연구에서 1형은 3형보다 거의 6배, 4형보다 거의 4배 더 흔했다.[24]
OI를 가진 대부분의 사람들은 부모로부터 그것을 받지만, 많은 경우, 그것은 한 가족의 새로운 (de novo 또는 "sporadic") 돌연변이다. OI형 생존형 환자를 대상으로 한 연구 중에서는 OI형 III형이 de novo(85%), I형(50%), I형(34%)[6]: Table 1 순으로 나타났다.
일부 모집단은 질병의 열성 형태의 평균 감염자 수보다 많은 경우 다른 경우 예상할 수 있는 것보다 높은 OI 발생률을 가질 수 있다.[1]: 20–21 [135]
역사
그 조건, 또는 그것의 종류는 여러 해 동안 다른 나라들에서 다양한 다른 이름들을 가지고 있었다; 그러나 "오스테오제네시스 불완전성"은 20세기 후반 이후 가장 널리 받아들여진 이름이었다. 가장 일반적인 대안으로는 "fragilitas ossium",[2] "Ekman-Lobstein 증후군" 그리고 "Vrolik 증후군" 그리고 구어체인 "깨지기 쉬운 골병"이 있다.[1]
가장 먼저 기록된 사례
OI는 기원전 1000년경에 미라로 미라로 만들어진 고대 이집트의 유아에게서 확인되었는데, 원래 고고학자들에 의해 원숭이의 유해가 포함된 것으로 치부되었다.[136][137]: 161 800 CE를 살았던 본리스 노르드 왕 이바르도 OI를 가졌을 것으로 추측된다.[138][139]
니콜라스 드 말브랑슈는 1688년 저서 진실 뒤 수색[에서 OI의 신체적 특징을 최초로 설명한 인물로 인정받고 있다. 이 책에서 그는 평생 "살인자가 있을 곳에서 뼈가 부러졌다"고 묘사했다. 그러나, 그가 "무형제 괴물"이라고 부르는 것을 만들어 내는 장애의 병리학에 대한 그의 자신감 넘치는 묘사는 과학적으로 공허하다. 그는 그것이 바퀴를 부러뜨려 공개 처형에 대한 어머니의 성실한 시청률 때문이라고 썼다.[27]: 683 [137]: 165–168 [140]
OI에 대한 초기 현대 과학 연구는 1788년 Olof Jakob Ekman에 의해 시작되었는데, 그는 그가 "오스테오말라시아 선천성"이라고 칭했던 상태를 박사 논문에서 설명하고, 그것이 모두 같은 가족인 1678년으로 거슬러 올라가는 경우를 3대를 거쳐 언급하였다.[141] 에크만의 병세에 대한 서술은 왜소증, 뼈의 허약성, 긴 뼈의 절 등을 언급하였다.[142]: 763 1831년 에드먼드 악스만은 OI의 특징적인 표시로 처음으로 블루 슬래어를 언급하면서 자신과 그의 두 형제에게 그것에 대한 자세한 설명을 해주었다.[27]: 683 장 로브스타인은 1833년에 처음으로 오늘날 1형이라고 알려진 이 병의 가벼운 형태를 "오스트롭사시증 특발증"이라고 묘사했다.[3]: 347
청력 손실은 영국인 의사 찰스 알렌 아데어 디튼이 간단한 논문에서 처음 언급한 OI의 증상으로 1912년에 이르러서야 긍정적으로 인식되었다.[143][137]: 168–169
해당 용어 중
선천적 결함을 가진 시체의 많은 표본을 알게 한 무세움 브롤리키아누스의 큐레이터이기도 한 네덜란드 해부학자 윌렘 브롤릭은 1849년 처음 출간된 테라톨로지(Teratology), 인간 및 포유류 엠브리게이지스(Printes of Human and Mamalian Emborgenesis)[144]에 관한 라틴어와 네덜란드어 2개 국어책에서 '오스테오스테오스테오스테오제네시스 불완전함'[27]: 683 이라는 용어를 만들었다.
현재 치명적인 OI 타입 II로[3]: 347 [1]: 5 알려진 것을 가지고 있는 유아의 유골에 대한 설명도 포함되어 있다(1998년 발제트 외 연구진이 유해를 재조사한 결과 확인).[145] 유골은 먼저 이해할 수 없는 브롤릭의 아버지에게 주어졌다. 브롤릭은 열악한 광물화 뼈, 굽은 긴 뼈, 다양한 치유 상태의 골절 등을 묘사했다.[146] Vrolik은 자신이 유아에게서 OI라고 부르는 것이 2차 구루병에 의한 것이 아니라 1차적인 골감소증을 유발하는 선천성 아비명성에 의한 것이라고 정확하게 판단했다; 그는 이것이 "내성 생성 에너지"[145]의 부족 때문이라고 이론화했다.
그 종류 중
OI의 분류도 그에 대한 과학적 이해가 향상되면서 진화했다. 현대 유전자 검사가 등장하기 전에 OI는 두 가지 광범위한 그룹으로 분류되었다: 골생성 불완전성 착향료와 독일의 의사 E가 처음 제안한 부서인 골생성 불완전성 타르다. 1906년 [2][147]루저 컨티타는 현대의 임상 유형 II, III와 IV의 일부 사례를 설명하기 위해 사용되었는데, 태어날 때 사지가 굽어있거나 자궁에서 지속되는 골절 때문에 그 상태가 명백했다.[42] 타다는 현대의 OI타입 I과 4타입의 일부 사례를 분류하는데 사용되었는데, 이 경우 뼈의 고유 파괴한도는 출생한 지 오래될 때까지 명확해지지 않았다.[2] 이러한 "후기"와 "후기" 형태가 같은 장애의 징후라는 생각은 마틴 벤노 슈미트에 의해 1897년에 처음 제안되었다.[148] 1950년대까지 이 사실은 잘 받아들여졌다.[3]: 346
한편 4종류(I, II, III, IV)의 현대식 체계는 1979년 의학유전학 저널의 데이비드 실런스, 앨리슨 센, 데이비드 댕크스의 논문에서 소개되었고,[42][149] 이후 의사, 환자, 연구자들 사이에서 표준 용어가 되었다.[43][47][150] 2006년 로이 모렐로 외 연구원에 의해 첫 번째 OI가 발견된 이후 점점 더 열성적으로 유전되는 OI 형태가 발견됨에 따라 현대의 유전자형(IV보다 큰 숫자)이 사용되기 시작했다.[46][8][63] 2010년, 국제 스켈레톤 헌법 장애 그룹(INCDS)은 실런스 형제를 분자 기준에서 "자유롭게" 하고, 실런스 형제의 새로운 임상 첫 역할을 묵인하면서 OI의 유전적 원인 수의 "놀라움" 증가를 초래했다.[150][47]
2012년 연례 유전학 리뷰를 위한 글쓰기, Drs. 피터 바이어스와 샤나 M. 피오트는 유전형질을 포함시키기 위한 유형수 확대가 어떻게 '톱시처럼 굴다'는 시스템을 만들어냈는지 한탄했다.[79]: 492 그들은 한 가지 용도를 항상 다른 용도의 희생으로 우선시하는 시도와 함께, 임상의에게 유용하고 한 사람의 OI의 유전적 원인을 정확하게 설명하는 시스템을 만드는 것은 정말로 불가능할 수 있다고 제안한다.[79]: 492
사회와 문화
많은 의학 연구가 골형성 불완전성의 원인에 대해 행해져 OI를 가진 사람들뿐만 아니라 의학적으로도 더욱 광범위하게 혜택을 받았다; 2006년에서 2016년 사이 10년 동안, 여전히 OI의 임상적 징후로 그들을 이끈 비-콜라겐 관련 열성 유전자 돌연변이의 많은 발견은 수많은 돌파구를 가져왔다. 건강한 뼈의 발달 과정에 대한 의학적 이해에 [8]있어서
다른동물
개들에게 있어서 OI는 자가 열성 질환으로, 알레르기가 두 번 있는 개들이 영향을 받게 된다는 것을 의미한다.[151] 많은 품종 단체와 수의사들은 개가 OI의 매개체인지 여부를 확인하기 위해 OI 검사를 제공한다.[151][152] OI를 위해 이질성이 있는 개들은 오직 비 캐리어들에게만 길러져야 한다. 동형 운송업자는 비 운송업자에게만 해당되지 않는 한 절대 사육해서는 안 된다.[152]
OI를 유발하는 자연적으로 발생하는 돌연변이는 골든 리트리버, 닥스훈트, 비글스에서 발견되었다. OI는 제브라피쉬와 쥐에서도 확인되었다.[153]
개, 쥐, 물고기, 그리고 인간이 유전적으로 동일하지는 않지만, 이러한 동물 모델들 중 일부는 인간에서 다양한 종류의 OI를 나타내는 것으로 공식적으로 인정되었다. 예를 들어, 동란성 oim/oim 쥐는 자발적인 골절, 작은 신체 크기, 척추후만증을 경험하여 OI 타입 III의 모델이 된다. 한편, 이질성 oim/+ 쥐는 정상으로 보이지만 야생 쥐에 비해 상당히 약한 뼈를 가지고 있어 OI 타입 I의 모델이 되고 있다.[153][154] 인간 OI에서와 같이 변이된 유전자의 위치는 결과 질병의 심각성에 영향을 미친다. G859C Col1a1 마우스는 영향을 받은 생쥐가 모두 경화기에 사망하므로 OI 타입 II의 모델이다.[153]
확인된 동물 모델에 대한 동물 실험은 OI를 위한 인간 치료로 이어질 수 있다.[153]
참고 항목
메모들
- ^ 또한 하나의 OI 돌연변이는 Ehler-Danlos 결합 증후군을 유발한다: "OIEDS1" (Cabral, et al. 2005, Rasmussen 2020)
- ^ a b 연도가 미정일 때는 OMIM이 원천이다.
- ^ 유전적 원인은 2012년까지 밝혀지지 않았다. (Cho, et al. 2012)
참조
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn Shapiro JR, Byers PH, Glorieux FH, Sponseller PD (2014). Osteogenesis imperfecta: a translational approach to brittle bone disease (2nd ed.). London: Elsevier Inc. ISBN 978-0-12-397165-4. OCLC 876364090.
- ^ a b c d Roger S, Francis MJ, Houghton GR (1983). The brittle bone syndrome: osteogenesis imperfecta. London: Butterworth-Heinemann. p. 4. ISBN 978-0-407-00211-1. OCLC 9784850.
- ^ a b c d e Davel JG, Fichardt T, Van Der Spuy D (October 1956). "Osteogenesis imperfecta". Archives of Disease in Childhood. 31 (159): 346–353. doi:10.1136/adc.31.159.346. PMC 2011939. PMID 13363481.
- ^ a b
- "osteogenesis". Lexico UK English Dictionary. Oxford University Press. n.d. Retrieved 23 August 2021. "osteogenesis imperfecta". Lexico UK English Dictionary. Oxford University Press. n.d. Retrieved 23 August 2021.
- "osteogenesis". Merriam-Webster Dictionary. Retrieved 23 August 2021. "osteogenesis imperfecta". Merriam-Webster Dictionary. Retrieved 23 August 2021.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Rowe DW (2008). "Osteogenesis imperfecta". Principles of bone biology (3rd ed.). Amsterdam: Elsevier. pp. 1511–1531. ISBN 978-0-12-373884-4. OCLC 267135745. Archived from the original on 20 September 2021. Retrieved 15 August 2021.
Dentinogenesis imperfecta (DI) is most frequent in OI types III and IV, and overall, affects about 15% of OI patients among the different phenotypes.
- ^ a b c d e f Zhytnik L, Maasalu K, Duy BH, Pashenko A, Khmyzov S, Reimann E, et al. (March 2019). "De novo and inherited pathogenic variants in collagen-related osteogenesis imperfecta". Molecular Genetics & Genomic Medicine. 7 (3): e559. doi:10.1002/mgg3.559. PMC 6418448. PMID 30675999.
- ^ a b c d Dwan K, Phillipi CA, Steiner RD, Basel D (October 2016). "Bisphosphonate therapy for osteogenesis imperfecta". The Cochrane Database of Systematic Reviews. 10: CD005088. doi:10.1002/14651858.CD005088.pub4. PMC 6611487. PMID 27760454.
- ^ a b c d e Forlino A, Marini JC (April 2016). "Osteogenesis imperfecta". Lancet. 387 (10028): 1657–1671. doi:10.1016/S0140-6736(15)00728-X. PMC 7384887. PMID 26542481.
- ^ a b c d "Osteogenesis imperfecta". Genetics Home Reference. U.S. National Library of Medicine, National Institutes of Health. 18 August 2020. Archived from the original on 29 August 2021. Retrieved 15 August 2021.
- ^ a b c d e f g h Lee B, Krakow D (July 2019). "Osteogenesis Imperfecta Overview". National Institute of Arthritis and Musculoskeletal and Skin Diseases. National Institutes of Health. Archived from the original on 9 May 2021. Retrieved 21 August 2021.
- ^ McNeeley MF, Dontchos BN, Laflamme MA, Hubka M, Sadro CT (December 2012). "Aortic dissection in osteogenesis imperfecta: case report and review of the literature". Emergency Radiology. 19 (6): 553–556. doi:10.1007/s10140-012-1044-1. PMID 22527359. S2CID 11109481.
- ^ a b c d LoMauro A, Pochintesta S, Romei M, D'Angelo MG, Pedotti A, Turconi AC, Aliverti A (27 April 2012). "Rib cage deformities alter respiratory muscle action and chest wall function in patients with severe osteogenesis imperfecta". PLOS ONE. 7 (4): e35965. Bibcode:2012PLoSO...735965L. doi:10.1371/journal.pone.0035965. PMC 3338769. PMID 22558284.
- ^ a b c d e f Wallace MJ, Kruse RW, Shah SA (February 2017). "The Spine in Patients With Osteogenesis Imperfecta". The Journal of the American Academy of Orthopaedic Surgeons. 25 (2): 100–109. doi:10.5435/JAAOS-D-15-00169. PMID 28009707.
- ^ Shapiro JR, Sponseller PD (23 August 2005). "10—Osteogenesis Imperfecta". In Kleerekoper M, Siris ES, McClung M (eds.). The Bone and Mineral Manual: A Practical Guide. Elsevier Inc. p. 45. ISBN 978-0-08-047074-0. Archived from the original on 20 September 2021. Retrieved 17 September 2021.
- ^ a b c d e f Folkestad L, Hald JD, Canudas-Romo V, Gram J, Hermann AP, Langdahl B, et al. (December 2016). "Mortality and Causes of Death in Patients With Osteogenesis Imperfecta: A Register-Based Nationwide Cohort Study". Journal of Bone and Mineral Research. 31 (12): 2159–2166. doi:10.1002/jbmr.2895. PMID 27345018. S2CID 32196304. Archived from the original on 26 August 2021. Retrieved 26 August 2021.
- ^ a b c d e f Marom R, Rabenhorst BM, Morello R (October 2020). "Osteogenesis imperfecta: an update on clinical features and therapies". European Journal of Endocrinology. 183 (4): R95–R106. doi:10.1530/EJE-20-0299. PMC 7694877. PMID 32621590. Archived from the original on 17 August 2021. Retrieved 17 August 2021.
- ^ a b c van Dijk FS, Semler O, Etich J, Köhler A, Jimenez-Estrada JA, Bravenboer N, et al. (November 2020). "Interaction between KDELR2 and HSP47 as a Key Determinant in Osteogenesis Imperfecta Caused by Bi-allelic Variants in KDELR2". American Journal of Human Genetics. 107 (5): 989–999. doi:10.1016/j.ajhg.2020.09.009. PMC 7675035. PMID 33053334. Archived from the original on 20 September 2021. Retrieved 29 August 2021.
- ^ a b Donohoe M (2020). "Therapy, Orthotics and Assistive Devices for Osteogenesis Imperfecta". In Kruse RW (ed.). Osteogenesis Imperfecta. Osteogenesis Imperfecta: A Case-Based Guide to Surgical Decision-Making and Care. Springer International Publishing. pp. 21–37. doi:10.1007/978-3-030-42527-2_3. ISBN 978-3-030-42526-5. S2CID 219518604.
- ^ "What People With Osteogenesis Imperfecta Need To Know About Osteoporosis". Osteoporosis and Related Bone Diseases National Resource Center. National Institutes of Health. November 2018. Archived from the original on 18 March 2021. Retrieved 18 September 2021.
- ^ a b Esposito P, Wallace MJ (2020), Kruse RW (ed.), "Osteogenesis Imperfecta Surgical Management of the Femur and Knee" (ePub), Osteogenesis Imperfecta: A Case-Based Guide to Surgical Decision-Making and Care, Springer International Publishing, pp. 147–182, doi:10.1007/978-3-030-42527-2_10, ISBN 978-3-030-42527-2, S2CID 219515805
- ^ Harrington J, Sochett E, Howard A (December 2014). "Update on the evaluation and treatment of osteogenesis imperfecta". Pediatric Clinics of North America. 61 (6): 1243–1257. doi:10.1016/j.pcl.2014.08.010. PMID 25439022.
- ^ a b Chevrel G, Schott AM, Fontanges E, Charrin JE, Lina-Granade G, Duboeuf F, et al. (February 2006). "Effects of oral alendronate on BMD in adult patients with osteogenesis imperfecta: a 3-year randomized placebo-controlled trial". Journal of Bone and Mineral Research. 21 (2): 300–306. doi:10.1359/JBMR.051015. PMID 16418786. S2CID 34089615.
- ^ a b c Subramanian S, Viswanathan VK (2021). Osteogenesis Imperfecta. StatPearls Publishing. StatPearls. PMID 30725642. Archived from the original on 21 October 2020. Retrieved 30 July 2019. 마지막 업데이트: 2019년 2월 3일.
- ^ a b c Lindahl K, Åström E, Rubin CJ, Grigelioniene G, Malmgren B, Ljunggren Ö, Kindmark A (August 2015). "Genetic epidemiology, prevalence, and genotype-phenotype correlations in the Swedish population with osteogenesis imperfecta". European Journal of Human Genetics. 23 (8): 1042–1050. doi:10.1038/ejhg.2015.81. PMC 4795106. PMID 25944380.
- ^ a b c d e f Rodriguez Celin M, Kruger KM, Caudill A, Nagamani SC, Harris GF, Smith PA (11 September 2020). "A Multicenter Study of Intramedullary Rodding in Osteogenesis Imperfecta". JB & JS Open Access. 5 (3): e20.00031. doi:10.2106/JBJS.OA.20.00031. PMC 7489747. PMID 32984750.
- ^ a b Kelly EB (2012). Encyclopedia of Human Genetics and Disease. ABC-CLIO. p. 613. ISBN 9780313387135. Archived from the original on 5 November 2017.
- ^ a b c d e f Dang Do AN, Marini JC (27 January 2021). "Osteogenesis imperfecta". In Carey JC, Cassidy SB, Battaglia A, Viskochil D (eds.). Cassidy and Allanson's Management of Genetic Syndromes. John Wiley & Sons. pp. 683–705. ISBN 978-1-119-43267-8. Archived from the original on 29 August 2021. Retrieved 29 August 2021.
- ^ Johnson MT, Morrison S, Heeger S, Mooney S, Byers PH, Robin NH (February 2002). "A variant of osteogenesis imperfecta type IV with resolving kyphomelia is caused by a novel COL1A2 mutation". Journal of Medical Genetics. 39 (2): 128–132. doi:10.1136/jmg.39.2.128. PMC 1735034. PMID 11836364.
- ^ Atta I, Iqbal F, Lone SW, et al. "Journal of the College of Physicians and Surgeons Pakistan" (PDF). Journal of the College of Physicians and Surgeons Pakistan. 24 (9): 653–657. Archived (PDF) from the original on 17 August 2021. Retrieved 17 August 2021.
- ^ Cabral WA, Makareeva E, Colige A, Letocha AD, Ty JM, Yeowell HN, et al. (May 2005). "Mutations near amino end of alpha1(I) collagen cause combined osteogenesis imperfecta/Ehlers-Danlos syndrome by interference with N-propeptide processing". The Journal of Biological Chemistry. 280 (19): 19259–19269. doi:10.1074/jbc.m414698200. PMID 15728585. Archived from the original on 20 September 2021. Retrieved 17 August 2021.
- ^ Rasmussen SA (2 December 2020). "Combined osteogenesis imperfecta and Ehlers–Danlos syndrome 1; OIEDS1". Online Mendelian Inheritance in Man. Johns Hopkins University. 619115. Archived from the original on 20 September 2021. Retrieved 17 August 2021.
- ^ a b Paterson CR, Monk EA, McAllion SJ (April 2001). "How common is hearing impairment in osteogenesis imperfecta?". The Journal of Laryngology and Otology. 115 (4): 280–282. doi:10.1258/0022215011907442. PMID 11276328. S2CID 12303464. Archived from the original on 20 September 2021. Retrieved 15 August 2021.
- ^ Vernick D (2 November 2005). "OI Issues: Hearing Loss". Archived from the original on 20 January 2012. Retrieved 4 November 2018.
- ^ Santos F, McCall AA, Chien W, Merchant S (December 2012). "Otopathology in Osteogenesis Imperfecta". Otology & Neurotology. 33 (9): 1562–1566. doi:10.1097/MAO.0b013e31826bf19b. PMC 3498599. PMID 22996160.
- ^ a b Pillion JP, Vernick D, Shapiro J (14 December 2011). "Hearing loss in osteogenesis imperfecta: characteristics and treatment considerations". Genetics Research International. Hindawi. 2011: 983942. doi:10.4061/2011/983942. PMC 3335494. PMID 22567374.
- ^ Kuurila K, Grénman R, Johansson R, Kaitila I (July 2000). "Hearing loss in children with osteogenesis imperfecta". European Journal of Pediatrics. 159 (7): 515–519. doi:10.1007/s004310051322. PMID 10923226. S2CID 8729406. Archived from the original on 15 August 2021. Retrieved 15 August 2021.
- ^ Pillion JP, Shapiro J (September 2008). "Audiological findings in osteogenesis imperfecta". Journal of the American Academy of Audiology. 19 (8): 595–601. doi:10.3766/jaaa.19.8.3. PMID 19323351.
- ^ a b Khandanpour N, Connolly DJ, Raghavan A, Griffiths PD, Hoggard N (1 December 2012). "Craniospinal abnormalities and neurologic complications of osteogenesis imperfecta: imaging overview". Radiographics. 32 (7): 2101–2112. doi:10.1148/rg.327125716. PMID 23150860. Archived from the original on 18 August 2021. Retrieved 18 August 2021.
- ^ Turkalj M, Miranović V, Lulić-Jurjević R, Gjergja Juraški R, Primorac D (25 September 2017). "Cardiorespiratory complications in patients with osteogenesis imperfecta". Paediatria Croatica. 61 (3): 106–111. doi:10.13112/PC.2017.15 (inactive 31 October 2021). ISSN 1330-1403. Archived from the original on 20 September 2021. Retrieved 29 August 2021.
{{cite journal}}: CS1 maint : 2021년 10월 현재 DOI 비활성화(링크) - ^ Violas P, Fassier F, Hamdy R, Duhaime M, Glorieux FH (September 2002). "Acetabular protrusion in osteogenesis imperfecta". Journal of Pediatric Orthopedics. 22 (5): 622–625. doi:10.1097/01241398-200209000-00010. PMID 12198464. S2CID 37895736.
- ^ a b Lee JH, Gamble JG, Moore RE, Rinsky LA (September 1995). "Gastrointestinal problems in patients who have type-III osteogenesis imperfecta". The Journal of Bone and Joint Surgery. American Volume. 77 (9): 1352–1356. doi:10.2106/00004623-199509000-00010. PMID 7673285.
- ^ a b c d e f Sillence DO, Senn A, Danks DM (April 1979). "Genetic heterogeneity in osteogenesis imperfecta". Journal of Medical Genetics. 16 (2): 101–116. doi:10.1136/jmg.16.2.101. PMC 1012733. PMID 458828.
- ^ a b c d e Van Dijk FS, Pals G, Van Rijn RR, Nikkels PG, Cobben JM (1 January 2010). "Classification of Osteogenesis Imperfecta revisited". European Journal of Medical Genetics. 53 (1): 1–5. doi:10.1016/j.ejmg.2009.10.007. PMID 19878741. Archived from the original on 21 August 2021. Retrieved 21 August 2021.
In 1979 Sillence proposed a classification of Osteogenesis Imperfecta (OI) in OI types I, II, III and IV. In 2004 and 2007 this classification was expanded with OI types V–VIII because of distinct clinical features and/or different causative gene mutations.
- ^ a b c d e f Marini JC, Blissett AR (August 2013). "New genes in bone development: what's new in osteogenesis imperfecta". The Journal of Clinical Endocrinology and Metabolism. 98 (8): 3095–3103. doi:10.1210/jc.2013-1505. PMC 3733862. PMID 23771926.
- ^ McKusick VA, Hamosh A (23 October 2018). "Osteogenesis imperfecta, type I; OI1". Online Mendelian Inheritance in Man. Johns Hopkins University. 166200. Archived from the original on 26 March 2021. Retrieved 17 August 2021.
- ^ a b c d e van Dijk FS, Cobben JM, Kariminejad A, Maugeri A, Nikkels PG, van Rijn RR, Pals G (December 2011). "Osteogenesis Imperfecta: A Review with Clinical Examples". Molecular Syndromology. 2 (1): 1–20. doi:10.1159/000332228. PMC 3343766. PMID 22570641.
- ^ a b c d e f g h i j Van Dijk FS, Sillence DO (June 2014). "Osteogenesis imperfecta: clinical diagnosis, nomenclature and severity assessment". American Journal of Medical Genetics. Part A. 164A (6): 1470–1481. doi:10.1002/ajmg.a.36545. PMC 4314691. PMID 24715559.
- ^ a b c d Steiner RD, Pepin MG, Byers PH, Pagon RA, Bird TD, Dolan CR, Stephens K, Adam MP (6 May 2021). "COL1A1/2 Osteogenesis Imperfecta". In Adam MP, Ardinger HH, Pagon RA, et al. (eds.). GeneReviews [Internet]. University of Washington, Seattle. PMID 20301472. Archived from the original on 18 January 2017. Retrieved 26 August 2021.
- ^ a b Shapiro JR, Lietman C, Grover M, Lu JT, Nagamani SC, Dawson BC, et al. (July 2013). "Phenotypic variability of osteogenesis imperfecta type V caused by an IFITM5 mutation". Journal of Bone and Mineral Research. 28 (7): 1523–1530. doi:10.1002/jbmr.1891. PMC 3688672. PMID 23408678.
- ^ a b c Glorieux FH, Rauch F, Plotkin H, Ward L, Travers R, Roughley P, et al. (September 2000). "Type V osteogenesis imperfecta: a new form of brittle bone disease". Journal of Bone and Mineral Research. 15 (9): 1650–1658. doi:10.1359/jbmr.2000.15.9.1650. PMID 10976985. S2CID 13748803.
- ^ a b Singer RB, Ogston SA, Paterson CR (2001). "Mortality in various types of osteogenesis imperfecta". Journal of Insurance Medicine. 33 (3): 216–220. PMID 11558400. Archived from the original on 15 August 2021. Retrieved 15 August 2021.
- ^ "Osteogenesis Imperfecta: Types, Symptoms & Management". Cleveland Clinic. 5 May 2021. Archived from the original on 17 August 2021. Retrieved 17 August 2021.
- ^ a b Basel D, Steiner RD (June 2009). "Osteogenesis imperfecta: recent findings shed new light on this once well-understood condition" (PDF). Genetics in Medicine. 11 (6): 375–385. doi:10.1097/GIM.0b013e3181a1ff7b. PMID 19533842. Archived (PDF) from the original on 20 September 2021. Retrieved 19 August 2021.
- ^ Nadar R, Saraff V, Hogler W, Desai M, Shaw N (31 July 2019). "Determinants of survival in osteogenesis imperfecta (OI) Type II". Bone Abstracts. 7: 31. doi:10.1530/boneabs.7.P31. ISSN 2052-1219. S2CID 208412310. Archived from the original on 20 September 2021. Retrieved 19 August 2021.
- ^ Zisa D, Shabbir A, Mastri M, Suzuki G, Lee T (November 2009). "Intramuscular VEGF repairs the failing heart: role of host-derived growth factors and mobilization of progenitor cells". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 297 (5): R1503–R1515. doi:10.1152/ajpregu.00227.2009. PMC 2777764. PMID 19759338.
- ^ Ben Amor IM, Glorieux FH, Rauch F (6 September 2011). "Genotype-phenotype correlations in autosomal dominant osteogenesis imperfecta". Journal of Osteoporosis. 2011: 540178. doi:10.4061/2011/540178. PMC 3170785. PMID 21912751.
For example, it can occur that a fetus is diagnosed with OI type II, the lethal form, on prenatal ultrasound, but after birth turns out to be less severely affected than initially thought and is eventually reclassified as OI type III or even type VI, if adequate management is initiated early on.
- ^ Georgescu I, Vlad C, Gavriliu TŞ, Dan S, Pârvan AA (June 2013). "Surgical treatment in Osteogenesis Imperfecta - 10 years experience". Journal of Medicine and Life. 6 (2): 205–213. PMC 3725451. PMID 23904885.
- ^ Chen H (2006). "Triangular face". Atlas of genetic diagnosis and counseling. Totowa, NJ: Humana Press. p. 771. ISBN 978-1-58829-681-8. Archived from the original on 8 June 2013.
- ^ a b Johnson MT, Morrison S, Heeger S, Mooney S, Byers PH, Robin NH (February 2002). "A variant of osteogenesis imperfecta type IV with resolving kyphomelia is caused by a novel COL1A2 mutation". Journal of Medical Genetics. 39 (2): 128–132. doi:10.1136/jmg.39.2.128. PMC 1735034. PMID 11836364.
The persistent pale blue sclera is uncommon in OI type IV, but can be seen in up to 10% of affected subjects.
- ^ a b c Cho TJ, Lee KE, Lee SK, Song SJ, Kim KJ, Jeon D, et al. (August 2012). "A single recurrent mutation in the 5'-UTR of IFITM5 causes osteogenesis imperfecta type V". American Journal of Human Genetics. 91 (2): 343–348. doi:10.1016/j.ajhg.2012.06.005. PMC 3415533. PMID 22863190.
- ^ Cao YJ, Wei Z, Zhang H, Zhang ZL (12 June 2019). "Expanding the Clinical Spectrum of Osteogenesis Imperfecta Type V: 13 Additional Patients and Review". Frontiers in Endocrinology. 10: 375. doi:10.3389/fendo.2019.00375. PMC 6581704. PMID 31244780.
- ^ Brizola E, Mattos EP, Ferrari J, Freire PO, Germer R, Llerena JC, Félix TM (October 2015). "Clinical and Molecular Characterization of Osteogenesis Imperfecta Type V". Molecular Syndromology. 6 (4): 164–172. doi:10.1159/000439506. PMC 4662268. PMID 26648832.
- ^ a b Morello R, Bertin TK, Chen Y, Hicks J, Tonachini L, Monticone M, et al. (October 2006). "CRTAP is required for prolyl 3- hydroxylation and mutations cause recessive osteogenesis imperfecta". Cell. 127 (2): 291–304. doi:10.1016/j.cell.2006.08.039. PMID 17055431. S2CID 8123837.
- ^ Barnes AM, Chang W, Morello R, Cabral WA, Weis M, Eyre DR, et al. (December 2006). "Deficiency of cartilage-associated protein in recessive lethal osteogenesis imperfecta". The New England Journal of Medicine. 355 (26): 2757–2764. doi:10.1056/NEJMoa063804. PMC 7509984. PMID 17192541.
- ^ Cabral WA, Chang W, Barnes AM, Weis M, Scott MA, Leikin S, et al. (March 2007). "Prolyl 3-hydroxylase 1 deficiency causes a recessive metabolic bone disorder resembling lethal/severe osteogenesis imperfecta". Nature Genetics. 39 (3): 359–365. doi:10.1038/ng1968. PMC 7510175. PMID 17277775.
- ^ van Dijk FS, Nesbitt IM, Zwikstra EH, Nikkels PG, Piersma SR, Fratantoni SA, et al. (October 2009). "PPIB mutations cause severe osteogenesis imperfecta". American Journal of Human Genetics. 85 (4): 521–527. doi:10.1016/j.ajhg.2009.09.001. PMC 2756556. PMID 19781681.
- ^ Christiansen HE, Schwarze U, Pyott SM, AlSwaid A, Al Balwi M, Alrasheed S, et al. (March 2010). "Homozygosity for a missense mutation in SERPINH1, which encodes the collagen chaperone protein HSP47, results in severe recessive osteogenesis imperfecta". American Journal of Human Genetics. 86 (3): 389–398. doi:10.1016/j.ajhg.2010.01.034. PMC 2833387. PMID 20188343.
- ^ Alanay Y, Avaygan H, Camacho N, Utine GE, Boduroglu K, Aktas D, et al. (April 2010). "Mutations in the gene encoding the RER protein FKBP65 cause autosomal-recessive osteogenesis imperfecta". American Journal of Human Genetics. 86 (4): 551–559. doi:10.1016/j.ajhg.2010.02.022. PMC 2850430. PMID 20362275.
- ^ Sam JE, Dharmalingam M (2017). "Osteogenesis Imperfecta". Indian Journal of Endocrinology and Metabolism. 21 (6): 903–908. doi:10.4103/ijem.IJEM_220_17. PMC 5729682. PMID 29285457.
- ^ Shapiro JR (2014). "Clinical and Genetic Classification of Osteogenesis Imperfecta and Epidemiology". Osteogenesis Imperfecta. Elsevier. pp. 15–22. doi:10.1016/b978-0-12-397165-4.00002-2. ISBN 9780123971654.
- ^ a b Sam JE, Dharmalingam M (1 November 2017). "Osteogenesis Imperfecta". Indian Journal of Endocrinology and Metabolism. 21 (6): 903–908. doi:10.4103/ijem.IJEM_220_17. PMC 5729682. PMID 29285457.
- ^ Shaheen R, Alazami AM, Alshammari MJ, Faqeih E, Alhashmi N, Mousa N, et al. (October 2012). "Study of autosomal recessive osteogenesis imperfecta in Arabia reveals a novel locus defined by TMEM38B mutation". Journal of Medical Genetics. 49 (10): 630–635. doi:10.1136/jmedgenet-2012-101142. PMID 23054245. S2CID 35542661.
- ^ a b Lindahl K, Åström E, Dragomir A, Symoens S, Coucke P, Larsson S, et al. (September 2018). "Homozygosity for CREB3L1 premature stop codon in first case of recessive osteogenesis imperfecta associated with OASIS-deficiency to survive infancy". Bone. 114: 268–277. doi:10.1016/j.bone.2018.06.019. PMID 29936144. S2CID 49406925. Archived from the original on 29 August 2021. Retrieved 29 August 2021.
- ^ Keller RB, Tran TT, Pyott SM, Pepin MG, Savarirayan R, McGillivray G, et al. (April 2018). "Monoallelic and biallelic CREB3L1 variant causes mild and severe osteogenesis imperfecta, respectively". Genetics in Medicine. 20 (4): 411–419. doi:10.1038/gim.2017.115. PMC 5816725. PMID 28817112.
- ^ Mendoza-Londono R, Fahiminiya S, Majewski J, Tétreault M, Nadaf J, Kannu P, et al. (June 2015). "Recessive osteogenesis imperfecta caused by missense mutations in SPARC". American Journal of Human Genetics. 96 (6): 979–985. doi:10.1016/j.ajhg.2015.04.021. PMC 4457955. PMID 26027498.
- ^ Doyard M, Bacrot S, Huber C, Di Rocco M, Goldenberg A, Aglan MS, et al. (April 2018). "FAM46A mutations are responsible for autosomal recessive osteogenesis imperfecta". Journal of Medical Genetics. The BMJ. 55 (4): 278–284. doi:10.1136/jmedgenet-2017-104999. PMID 29358272. S2CID 4283476. Archived from the original on 29 August 2021. Retrieved 29 August 2021.
- ^ a b Lindert U, Cabral WA, Ausavarat S, Tongkobpetch S, Ludin K, Barnes AM, et al. (July 2016). "MBTPS2 mutations cause defective regulated intramembrane proteolysis in X-linked osteogenesis imperfecta". Nature Communications. 7 (1): 11920. Bibcode:2016NatCo...711920L. doi:10.1038/ncomms11920. PMC 4935805. PMID 27380894.
- ^ Moosa S, Yamamoto GL, Garbes L, Keupp K, Beleza-Meireles A, Moreno CA, et al. (October 2019). "Autosomal-Recessive Mutations in MESD Cause Osteogenesis Imperfecta". American Journal of Human Genetics. 105 (4): 836–843. doi:10.1016/j.ajhg.2019.08.008. PMC 6817720. PMID 31564437.
- ^ a b c d e Byers PH, Pyott SM (15 December 2012). "Recessively Inherited Forms of Osteogenesis Imperfecta". Annual Review of Genetics. 46 (1): 475–497. doi:10.1146/annurev-genet-110711-155608. ISSN 0066-4197. PMID 23145505.
- ^ Ho Duy B, Zhytnik L, Maasalu K, Kändla I, Prans E, Reimann E, et al. (August 2016). "Mutation analysis of the COL1A1 and COL1A2 genes in Vietnamese patients with osteogenesis imperfecta". Human Genomics. 10 (1): 27. doi:10.1186/s40246-016-0083-1. PMC 4983065. PMID 27519266.
- ^ Palomo T, Vilaça T, Lazaretti-Castro M (December 2017). "Osteogenesis imperfecta: diagnosis and treatment". Current Opinion in Endocrinology, Diabetes and Obesity. 24 (6): 381–388. doi:10.1097/MED.0000000000000367. PMID 28863000. S2CID 4555427.
- ^ Valadares ER, Carneiro TB, Santos PM, Oliveira AC, Zabel B (18 July 2014). "What is new in genetics and osteogenesis imperfecta classification?". Jornal de Pediatria. 90 (6): 536–541. doi:10.1016/j.jped.2014.05.003. PMID 25046257.
- ^ a b c Forlino A, Cabral WA, Barnes AM, Marini JC (June 2011). "New perspectives on osteogenesis imperfecta". Nature Reviews. Endocrinology. 7 (9): 540–557. doi:10.1038/nrendo.2011.81. PMC 3443407. PMID 21670757.
- ^ Koromani F, Trajanoska K, Rivadeneira F, Oei L (4 June 2019). "Recent Advances in the Genetics of Fractures in Osteoporosis". Frontiers in Endocrinology. 10: 337. doi:10.3389/fendo.2019.00337. PMC 6559287. PMID 31231309.
- ^ Rohrbach M, Giunta C (August 2012). "Recessive osteogenesis imperfecta: clinical, radiological, and molecular findings". American Journal of Medical Genetics. Part C, Seminars in Medical Genetics. 160C (3): 175–189. doi:10.1002/ajmg.c.31334. PMID 22791419. S2CID 28592112.
- ^ a b Marini JC, Reich A, Smith SM (August 2014). "Osteogenesis imperfecta due to mutations in non-collagenous genes: lessons in the biology of bone formation". Current Opinion in Pediatrics. 26 (4): 500–507. doi:10.1097/MOP.0000000000000117. PMC 4183132. PMID 25007323.
- ^ Hanagata N (March 2016). "IFITM5 mutations and osteogenesis imperfecta". Journal of Bone and Mineral Metabolism. 34 (2): 123–131. doi:10.1007/s00774-015-0667-1. PMID 26031935. S2CID 3173191.
- ^ a b c Pyott SM, Pepin MG, Schwarze U, Yang K, Smith G, Byers PH (February 2011). "Recurrence of perinatal lethal osteogenesis imperfecta in sibships: parsing the risk between parental mosaicism for dominant mutations and autosomal recessive inheritance". Genetics in Medicine. 13 (2): 125–130. doi:10.1097/GIM.0b013e318202e0f6. PMID 21239989.
- ^ Rauch F, Glorieux FH (April 2004). "Osteogenesis imperfecta". Lancet. 363 (9418): 1377–1385. doi:10.1016/S0140-6736(04)16051-0. PMID 15110498. S2CID 24081895.
- ^ a b c Gautieri A, Uzel S, Vesentini S, Redaelli A, Buehler MJ (August 2009). "Molecular and mesoscale mechanisms of osteogenesis imperfecta disease in collagen fibrils". Biophysical Journal. 97 (3): 857–865. Bibcode:2009BpJ....97..857G. doi:10.1016/j.bpj.2009.04.059. PMC 2718154. PMID 19651044.
- ^ a b c Xiao J, Cheng H, Silva T, Baum J, Brodsky B (December 2011). "Osteogenesis imperfecta missense mutations in collagen: structural consequences of a glycine to alanine replacement at a highly charged site". Biochemistry. 50 (50): 10771–10780. doi:10.1021/bi201476a. PMC 3292618. PMID 22054507.
- ^ a b Nijhuis WH, Eastwood DM, Allgrove J, Hvid I, Weinans HH, Bank RA, Sakkers RJ (February 2019). "Current concepts in osteogenesis imperfecta: bone structure, biomechanics and medical management". Journal of Children's Orthopaedics. 13 (1): 1–11. doi:10.1302/1863-2548.13.180190. PMC 6376438. PMID 30838070.
- ^ El-Sobky TA, Shawky RM, Sakr HM, Elsayed SM, Elsayed NS, Ragheb SG, Gamal R (15 November 2017). "A systematized approach to radiographic assessment of commonly seen genetic bone diseases in children: A pictorial review". J Musculoskelet Surg Res. 1 (2): 25. doi:10.4103/jmsr.jmsr_28_17. S2CID 79825711.
- ^ Jameson JR, Albert CI, Busse B, Smith PA, Harris GF (29 March 2013). "3D micron-scale imaging of the cortical bone canal network in human osteogenesis imperfecta (OI)". In Weaver JB, Molthen RC (eds.). Medical Imaging 2013: Biomedical Applications in Molecular, Structural, and Functional Imaging. Vol. 8672. International Society for Optics and Photonics. pp. 86721L. doi:10.1117/12.2007209. S2CID 13876569. Archived from the original on 7 June 2020. Retrieved 26 August 2020.
- ^ Westgren M, Götherström C (September 2015). "Stem cell transplantation before birth - a realistic option for treatment of osteogenesis imperfecta?". Prenatal Diagnosis. 35 (9): 827–832. doi:10.1002/pd.4611. PMID 25962526. S2CID 10640427.
- ^ a b c Pepin MG, Byers PH (December 2015). "What every clinical geneticist should know about testing for osteogenesis imperfecta in suspected child abuse cases". American Journal of Medical Genetics. Part C, Seminars in Medical Genetics. 169 (4): 307–313. doi:10.1002/ajmg.c.31459. PMID 26566591. S2CID 26045033.
- ^ Castaneda R (25 October 2005). "Parents Get $1 Million in False Abuse Case". Washington Post. ISSN 0190-8286. Retrieved 4 February 2022.
- ^ a b "What Is Osteogenesis Imperfecta? Fast Facts: An Easy-to-Read Series of Publications for the Public". NIAMS. November 2014. Archived from the original on 18 October 2016. Retrieved 15 October 2016.
- ^ Swezey T, Reeve BB, Hart TS, Floor MK, Dollar CM, Gillies AP, Tosi LL (February 2019). "Incorporating the patient perspective in the study of rare bone disease: insights from the osteogenesis imperfecta community". Osteoporosis International. 30 (2): 507–511. doi:10.1007/s00198-018-4690-7. PMC 6449303. PMID 30191258.
- ^ Glorieux FH, Bishop NJ, Plotkin H, Chabot G, Lanoue G, Travers R (October 1998). "Cyclic administration of pamidronate in children with severe osteogenesis imperfecta". The New England Journal of Medicine. 339 (14): 947–952. doi:10.1056/NEJM199810013391402. PMID 9753709. S2CID 19316414.전체 텍스트 사용 가능
- ^ DiMeglio LA, Peacock M (January 2006). "Two-year clinical trial of oral alendronate versus intravenous pamidronate in children with osteogenesis imperfecta". Journal of Bone and Mineral Research. 21 (1): 132–140. doi:10.1359/JBMR.051006. PMID 16355282. S2CID 12996685.
- ^ Bishop N, Adami S, Ahmed SF, Antón J, Arundel P, Burren CP, et al. (October 2013). "Risedronate in children with osteogenesis imperfecta: a randomised, double-blind, placebo-controlled trial". Lancet. 382 (9902): 1424–1432. doi:10.1016/S0140-6736(13)61091-0. PMID 23927913. S2CID 25559791.
- ^ Ward LM, Rauch F (October 2013). "Oral bisphosphonates for paediatric osteogenesis imperfecta?". Lancet. 382 (9902): 1388–1389. doi:10.1016/S0140-6736(13)61531-7. PMID 23927912. S2CID 5872511.
- ^ a b c Meena BL, Panigrahi I, Marwaha RK (1 October 2014). "PO-0077 Vitamin D Deficiency In Children With Osteogenesis Imperfecta". Archives of Disease in Childhood. 99 (Suppl 2): A275. doi:10.1136/archdischild-2014-307384.747. ISSN 0003-9888. S2CID 72491188. Archived from the original on 18 September 2021. Retrieved 18 September 2021.
- ^ a b Edouard T, Glorieux FH, Rauch F (October 2011). "Predictors and correlates of vitamin D status in children and adolescents with osteogenesis imperfecta". The Journal of Clinical Endocrinology and Metabolism. 96 (10): 3193–3198. doi:10.1210/jc.2011-1480. PMID 21832107.
- ^ Zambrano MB, Brizola E, Pinheiro B, Vanz AP, Mello ED, Félix TM (18 May 2016). "Study of the Determinants of Vitamin D Status in Pediatric Patients With Osteogenesis Imperfecta". Journal of the American College of Nutrition. 35 (4): 339–345. doi:10.1080/07315724.2015.1057776. PMID 26709914. S2CID 45930763.
- ^ Rothschild L, Goeller JK, Voronov P, Barabanova A, Smith P (November 2018). "Anesthesia in children with osteogenesis imperfecta: Retrospective chart review of 83 patients and 205 anesthetics over 7 years". Pediatric Anesthesia. 28 (11): 1050–1058. doi:10.1111/pan.13504. PMID 30295359. S2CID 52929810. Archived from the original on 29 August 2021. Retrieved 29 August 2021.
- ^ Houck JP (2014). "Osteogenesis imperfecta". In Houck JP, Hache M, Sun LS (eds.). Handbook of Pediatric Anesthesia. New York: McGraw-Hill Education. ISBN 9780071769358. Archived from the original on 29 August 2021. Retrieved 29 August 2021.
- ^ Goeller JK, Rothschild L (2020), Kruse RW (ed.), "Anesthetic and Post-operative Pain Management" (ePub), Osteogenesis Imperfecta: A Case-Based Guide to Surgical Decision-Making and Care, Springer International Publishing, pp. 111–125, doi:10.1007/978-3-030-42527-2_8, ISBN 978-3-030-42527-2, S2CID 219515776
- ^ a b Behera P, Santoshi JA, Geevarughese NM, Meena UK, Selvanayagam R (28 February 2020). "Dislodgement of Telescopic Nail from the Epiphysis: A Case Report with an Analysis of Probable Mechanism". Cureus. 12 (2): e7130. doi:10.7759/cureus.7130. ISSN 2168-8184. PMC 7105006. PMID 32257675.
- ^ "Financial Assistance". Shriners Hospitals for Children. Archived from the original on 3 March 2021. Retrieved 21 August 2021.
Shriners Hospitals for Children is committed to providing specialized care to children with orthopaedic conditions [...] regardless of the families' ability to pay.
- ^ "A Leader in the Treatment of Osteogensis Imperfecta (OI)". Shriners International. Archived from the original on 28 September 2007. Retrieved 5 July 2007.
- ^ Sofield HA, Millar EA (1 December 1959). "Fragmentation, Realignment, and Intramedullary Rod Fixation of Deformities of the Long Bones in Children: A Ten-Year Appraisal". The Journal of Bone and Joint Surgery. 41 (8): 1371–1391. doi:10.2106/00004623-195941080-00001. ISSN 0021-9355.
- ^ "The Fassier-Duval Telescopic IM System". Pega Medical. Laval, Quebec. Archived from the original on 15 August 2021. Retrieved 15 August 2021.
- ^ a b Sterian A, Balanescu R, Barbilian A, Ulici A (2015). "Osteosynthesis in Osteogenesis Imperfecta, telescopic versus non-telescopic nailing". Journal of Medicine and Life. 8 (4): 563–565. PMC 4656972. PMID 26664490.
- ^ a b Frassier F, Duval P, Paley D (2021). "Fassier–Duval Telescopic IM System Surgical Technique" (PDF). Pega Medical. Laval, Quebec. FD-ST-EN Revision K. Archived (PDF) from the original on 15 August 2021. Retrieved 15 August 2021.
- ^ Belyea CM, Knox JB (1 January 2020). "Spinal fusion in children with osteogenesis imperfecta: A nationwide retrospective comparative cohort study over a 12-year period". Current Orthopaedic Practice. 31 (1): 72–75. doi:10.1097/BCO.0000000000000805. ISSN 1940-7041. S2CID 209229412.
- ^ Zani A, Ford-Adams M, Ratcliff M, Bevan D, Inge TH, Desai A (January 2017). "Weight loss surgery improves quality of life in pediatric patients with osteogenesis imperfecta". Surgery for Obesity and Related Diseases. Elsevier Inc. 13 (1): 41–44. doi:10.1016/j.soard.2015.11.029. PMC 5965274. PMID 26948942.
- ^ Semler O, Fricke O, Vezyroglou K, Stark C, Schoenau E (1 January 2007). "Preliminary results on the mobility after whole body vibration in immobilized children and adolescents". Journal of Musculoskeletal & Neuronal Interactions. 7 (1): 77–81. PMID 17396011. Archived from the original on 18 August 2021. Retrieved 18 August 2021.
- ^ a b Biria M, Abbas FM, Mozaffar S, Ahmadi R (July 2012). "Dentinogenesis imperfecta associated with osteogenesis imperfecta". Dental Research Journal. 9 (4): 489–494. PMC 3491340. PMID 23162594.
- ^ a b c d Plieth J (18 December 2020). "Recycling pays off for Mereo". Evaluate Vantage. Archived from the original on 18 September 2021. Retrieved 18 September 2021.
- ^ Delgado-Calle J, Sato AY, Bellido T (March 2017). "Role and mechanism of action of sclerostin in bone". Bone. 96: 29–37. doi:10.1016/j.bone.2016.10.007. PMC 5328835. PMID 27742498.
- ^ Glorieux FH, Devogelaer JP, Durigova M, Goemaere S, Hemsley S, Jakob F, et al. (July 2017). "BPS804 Anti-Sclerostin Antibody in Adults With Moderate Osteogenesis Imperfecta: Results of a Randomized Phase 2a Trial". Journal of Bone and Mineral Research. 32 (7): 1496–1504. doi:10.1002/jbmr.3143. PMID 28370407. S2CID 4432023.
- ^ "Ultragenyx and Mereo BioPharma Announce Collaboration and License Agreement for Setrusumab in Osteogenesis Imperfecta". Ultragenyx Pharmaceutical Inc. 17 December 2020. Archived from the original on 18 September 2021. Retrieved 18 September 2021.
- ^ "A Study in Adult Patients With Type I, III or IV Osteogenesis Imperfecta Treated With BPS804 (ASTEROID)". ClinicalTrials.gov. United States National Library of Medicine. 1 April 2021. NCT03118570. Retrieved 18 September 2021.
{{cite journal}}: CS1 maint : url-status (링크) - ^ Cooper M, Gregorek L (25 November 2019). "Setrusumab ready to advance into pivotal studies". Trinity Delta. Archived from the original on 18 September 2021. Retrieved 18 September 2021.
- ^ Hardy A (24 September 2020). "Mereo setrusumab gets FDA rare pediatric disease designation for osteogenesis imperfecta". BioTuesdays. Archived from the original on 18 September 2021. Retrieved 18 September 2021.
- ^ "Study to Evaluate Romosozumab in Children and Adolescents With Osteogenesis Imperfecta". ClinicalTrials.gov. United States National Library of Medicine. 23 July 2021. NCT04545554. Archived from the original on 18 September 2021. Retrieved 18 September 2021.
- ^ Green R (11 March 2012). "Brittle Bone Disease Forced Mother Into 'No Easy Choice'". Hartford Courant. Retrieved 16 September 2021.
{{cite web}}: CS1 maint : url-status (링크) - ^ Hopper T (6 February 2013). "'Incompatible with life': Mother's account of her difficult decision to request a late-term abortion sheds light on 'live-born' debate". National Post. Retrieved 16 September 2021.
{{cite news}}: CS1 maint : url-status (링크) - ^ Paterson CR, Ogston SA, Henry RM (February 1996). "Life expectancy in osteogenesis imperfecta". BMJ. 312 (7027): 351. doi:10.1136/bmj.312.7027.351. PMC 2350292. PMID 8611834.
- ^ Plotkin H (29 February 2016). "Genetics of Osteogenesis Imperfecta". Archived from the original on 30 December 2010.
- ^ "2.4: The Frequency of Bone Disease". Bone Health and Osteoporosis: A Report of the Surgeon General (PDF). Rockville, Maryland: Office of the Surgeon General of the United States, U.S. Department of Health and Human Services. 2004. p. 68. WE 225 B71259 2004.
- ^ "Osteogenesis Imperfecta Panel". University of Nebraska Medical Center. Archived from the original on 30 July 2019. Retrieved 30 July 2019.
- ^ Abali S, Arman A, Atay Z, Bereket A, Bas S, Haliloglu B, et al. (19 August 2016). "Frequency of Recessive Osteogenesis Imperfecta in a Turkish Cohort and Genetic Causes". ESPE Abstracts. Bioscientifica. 86: 131. Archived from the original on 26 August 2021. Retrieved 26 August 2021.
- ^ Lowenstein EJ (May 2009). "Osteogenesis imperfecta in a 3,000-year-old mummy". Child's Nervous System. 25 (5): 515–516. doi:10.1007/s00381-009-0817-7. PMID 19212769.
- ^ a b c Tainmont J (2007). "History of osteogenesis imperfecta or brittle bone disease: a few stops on a road 3000 years long". B-Ent. 3 (3): 157–173. PMID 17970442. Archived from the original on 29 August 2021. Retrieved 29 August 2021.
- ^ Groeneveld E (12 November 2018). "Ivar the Boneless". World History Encyclopedia. Ancient History Encyclopedia Limited. Archived from the original on 21 August 2021. Retrieved 21 August 2021.
- ^ Lewis R, Lotha G, Gaur A (8 January 2019). "Ivar the Boneless". Encyclopedia Britannica. Archived from the original on 24 June 2021. Retrieved 21 August 2021.
- ^ Malebranche N (1688). (in French) (1842 ed.). p. 119 – via Wikisource.
- ^ Edelu B, Ndu I, Asinobi I, Obu H, Adimora G (March 2014). "Osteogenesis imperfecta: a case report and review of literature". Annals of Medical and Health Sciences Research. Nigerian Medical Association. 4 (Suppl 1): S1–S5. doi:10.4103/2141-9248.131683. PMC 4083720. PMID 25031897.
- ^ Hektoen L (May 1903). "Anatomical Study of a Short-Limbed Dwarf, With Special Reference To Osteogenesis Imperfecta and Chondrodystrophia Foetalis". The American Journal of the Medical Sciences. J. B. Lippincott & Co. 125 (5): 751–769. doi:10.1097/00000441-190305000-00001. ISBN 978-0-243-38392-4. S2CID 71836609. Archived from the original on 16 August 2021. Retrieved 16 August 2021.
- ^ Adair-Dighton CA (1912). "Four generations of blue sclerotics". The Ophthalmoscope. London: George Pulman & Sons, Ltd. 10: 188–189. OCLC 1049881577 – via Internet Archive.
- ^ Vrolik W (1849). Tabulae ad illustrandam embryogenesin hominis et mammalium, tam naturalem quam abnormem — De Vrucht van den Mensch en van de Zoogdieren afgebeeld en beschreven in hare regelmatige en onregelmatige Ontwikkeling [Illustrations of human and mammalian embryogenesis, both normal and abnormal] (in Latin and Dutch). Amsterdam: G.M.P. Londonck. pp. 562–566. OCLC 489920691. Archived from the original on 29 August 2021. Retrieved 29 August 2021.
- ^ a b Baljet B (January 2002). "Aspects of the history of osteogenesis imperfecta (Vrolik's syndrome)". Annals of Anatomy = Anatomischer Anzeiger. 184 (1): 1–7. doi:10.1016/S0940-9602(02)80023-1. PMID 11876477. Archived from the original on 12 June 2018. Retrieved 29 August 2021.
- ^ Baljet B (2002). "Willem Vrolik and "his" Syndrome". In Rauschmann MA, Thomann KD, Zichner, L (eds.). Deutsches Orthopädisches Geschichts und Forschungsmuseum. Vol. 4. Heidelberg: Verlag Theodor Steinkopff. pp. 133–144. doi:10.1007/978-3-642-57510-5_15. ISBN 978-3-642-57510-5. Archived from the original on 8 June 2018. Retrieved 29 August 2021.
- ^ Looser E (1906). "Zur Kenntnis der Osteogenesis Imperfecta Congenita et Tarda (sogenannte idiopathische Osteopsatyrosis)" [On awareness of osteogenesis imperfecta congenita and tarda (so-called "idiopathic osteopsatyrosis")]. Mitteilungen aus den Grenzgebieten der Medizin und Chirurgie (Dispatches from the Frontier of Medicine and Surgery) (in German). 15: 161–207. Archived from the original on 21 August 2021. Retrieved 21 August 2021.
- ^ 누가 이름을 지었는가?
- ^ Rasmussen C, Danks A (2010). Double helix, double joy: David Danks, the father of clinical genetics in Australia. Carlton, Victoria: Melbourne University Press. p. 116. ISBN 978-0-522-85799-3. OCLC 906592657. Archived from the original on 28 August 2021. Retrieved 28 August 2021.
- ^ a b Warman ML, Cormier-Daire V, Hall C, Krakow D, Lachman R, LeMerrer M, et al. (May 2011). "Nosology and classification of genetic skeletal disorders: 2010 revision". American Journal of Medical Genetics. Part A. 155A (5): 943–968. doi:10.1002/ajmg.a.33909. PMC 3166781. PMID 21438135.
- ^ a b "Osteogenesis Imperfecta (OI) in Dachshunds". UC Davis Veterinary Genetics Laboratory. UC Davis School of Veterinary Medicine. Archived from the original on 28 August 2021. Retrieved 28 August 2021.
- ^ a b "Osteogenesis Imperfecta (OI Dachsund)". Center for Animal Genetics. Generatio GmbH. Archived from the original on 8 November 2018. Retrieved 7 November 2018.
- ^ a b c d Enderli TA, Burtch SR, Templet JN, Carriero A (September 2016). "Animal models of osteogenesis imperfecta: applications in clinical research". Orthopedic Research and Reviews. 8: 41–55. doi:10.2147/ORR.S85198. PMC 6209373. PMID 30774469.
- ^ Saban J, Zussman MA, Havey R, Patwardhan AG, Schneider GB, King D (December 1996). "Heterozygous oim mice exhibit a mild form of osteogenesis imperfecta". Bone. 19 (6): 575–579. doi:10.1016/S8756-3282(96)00305-5. PMID 8968022. Archived from the original on 30 June 2018. Retrieved 28 August 2021.
외부 링크
| 위키미디어 커먼스는 Osteogenesis 불완전성과 관련된 미디어를 가지고 있다. |
- "Osteogenesis Imperfecta Overview". NIH Osteoporosis and Related Bone Diseases — National Resource Center. National Institutes of Health, U.S. Department of Health and Human Services.