펜타센
Pentacene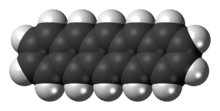 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 펜타센 | |
| 기타 이름 2,3:6,7-디벤잔트라센 벤조[b]나프타센 디벤츠[b,i]antracene NSC 90784 린 디벤잔트라센 린납토안트라센 | |
| 식별자 | |
3D 모델(JSmol) | |
| 1912418 | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.004.722 |
| EC 번호 |
|
| 733903 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C22H14 | |
| 어금질량 | 278.354 g·190−1 |
| 외관 | 다크 블루 파우더 |
| 밀도 | 1.3g cm−3 |
| 녹는점 | > 372°C에서 300°C(572°F, 573K) 하위 시간 |
| 비등점 | 0.15 torr에서 40–43 °C(104–109 °F, 313–316 K) |
자기 감수성(magnetic susibility) | -162.4 × 10−6 cm3 mol−1 |
| 구조 | |
| 삼위일체 | |
| P-1 | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
펜타센은 5개의 선형 용해 벤젠 링으로 구성된 다순환 방향족 탄화수소다. 이 고농축 화합물은 유기 반도체다. 이 화합물은 자외선(UV)이나 가시광선 흡수 시 엑시톤을 생성하는데, 이는 산화 작용에 매우 민감하게 만든다. 이 때문에 보라색 가루인 이 화합물은 공기와 빛에 노출되면 서서히 분해된다.
구조적으로 펜타센은 선형아세네 중 하나이며, 이전 것은 테트라센(융접된 벤젠 고리 4개)이고, 다음 것은 헥사센(융접된 벤젠 고리 6개)이다. 2009년 8월, IBM의 한 연구진이 원자력 현미경을 사용하여 펜타센의 단일 분자를 이미징한 실험 결과를 발표했다.[1][2] 2011년 7월, 그들은 가장 많이 점유되고 가장 적게 점유된 분자 궤도의 모양을 실험적으로 결정하기 위해 현미경 스캐닝 터널링의 수정을 이용했다.[3][4]
2012년에는 펜타센 도핑 p-terpenyl이 실온 마저용 앰프 매개체로 효과가 있는 것으로 나타났다.[5]
합성
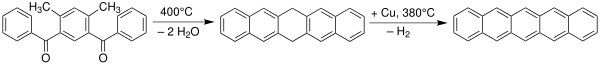
펜타센은 1912년 영국의 화학자 윌리엄 홉슨 밀스와 밀드레드 메이 고스트링에 의해 처음 합성되었다.[7][8] 펜타센 합성을 위한 고전적인 방법은 엘브스 반응에 의한 것이다.[9][10]
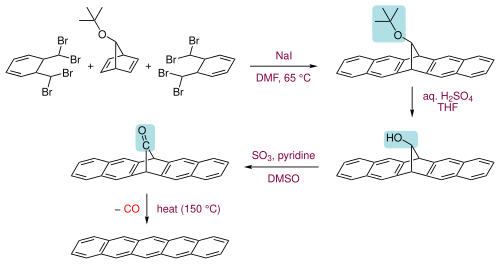
펜타센은 150 °C에서 적절한 전구체에서 작은 휘발성 성분(일산화탄소)을 압출하여 제조할 수도 있다.[11]
The precursor itself is prepared in three steps from two molecules of α,α,α',α'-tetrabromo-o-xylene with a 7-tert-butoxybicyclo[2.2.1]hepta-2,5-diene by first heating with sodium iodide in dimethylformamide to undergo a series of elimination and Diels–Alder reactions to form the ring system, then hydrolysing the tert-butoxy group to an alcohol and 케톤으로 산화시킨 [11]다음
이 제품은 클로로포름에 용해성이 있다고 보고되어 있어 스핀 코팅에 적합하다. 펜타센은 1,2,4-트리클로벤젠과 같은 뜨거운 염소 처리된 벤젠에 용해되며, 이로부터 혈소판을 형성하기 위해 재분할이 가능하다.
펜타센 유도체
모노메릭 펜타센 유도체
6,13-대체 펜타센은 아릴 또는 알킬니엘 뉴클레오필(예: 그리냐드 또는 유기석소 시약)과 반응한 후 환원 방향화를 통해 펜타세네퀴논을 통해 접근할 수 있다.[12][13][14] 또 다른 방법은 전이 금속(지르코나시클로펜타디엔스를 통한)에 의한 다이네스의 동질화에 기초한다. [15][16][17][18][19] 펜타센의 기능화는 이 색소체의 고체 포장 제어를 가능하게 했다.[20][21] 대체물의 선택(펜타센의 크기와 대체 위치 모두)은 솔리드 스테이트 패킹에 영향을 미치며, 이 화합물이 펜타센에 대해 관측된 청어본 패킹과 반대로 솔리드 스테이트에서 1차원 또는 2차원 공동 페이스 파이 스택을 채택하는지 제어하는 데 사용될 수 있다.
펜타센의 구조는 무연탄과 같은 다른 방향성 화합물의 구조와 유사하지만, 펜타센과 그 파생상품은 많은 연구 대상이다.
6-메틸렌-6,13-디히드롭텐타센과 6-메틸펜타센 사이에 팽팽한 화학 평형이 존재한다.
이 평형은 전적으로 메틸렌 화합물에 유리하다. 화합물의 용액을 200 °C로 가열해야만 적색-광선 색의 출현으로 증명되는 소량의 펜타센이 발생한다. 한 연구에[22] 따르면 이 평형의 반응 메커니즘은 분자 내 1,5 수소 이동에 기초하지 않고 분자 자유 급진적 수소 이동에 기초한다. 이와는 대조적으로, 동일한 중심 화학적 모티브를 가진 동위원소올루엔은 쉽게 향기를 낸다.
펜타센은 1,2,4-트리클로로벤젠의 원소 유황과 반응하여 헥사티아펜타센타젠 화합물에 반응한다.[23] X선 결정학에서는 모든 탄소-황산 결합 길이가 대략 (170 pm) 동일하다는 것을 보여준다. 이를 통해 완전한 전하 분리가 있는 공명 구조 B와 C가 구조 A보다 더 유의하다는 것을 알 수 있다.
결정 단계에서 분자는 방향족 쌓기 상호작용을 보이며, 여기서 인접 분자에 대한 일부 황 원자 사이의 거리는 두 반 데르 발 라디(180pm)의 합보다 낮을 수 있다.
관련 테트라티아풀발렌과 마찬가지로 이 화합물은 유기반도체 분야에서 연구되고 있다.
아세네는 평면과 경직된 분자로 나타날 수 있지만, 사실 그것들은 매우 왜곡될 수 있다. 아래에 표시된 펜타센:[24]
144°의 엔드 투 엔드 트위스트를 가지며 6개의 페닐 그룹에 의해 강직하게 안정화된다. 이 화합물은 7400°의 비정상적으로 높은 광학 회전을 가진 두 개의 에나토머로 분해될 수 있지만, 레이싱은 9시간의 화학적 반감기로 이루어진다.
펜타센의 올리고머와 폴리머
펜타센에 기반한 올리고머와 폴리머는 기기 어플리케이션 설정뿐만 아니라 합성적으로 탐구되었다.[25][26] 폴리머 발광다이오드(PED)는 플루오렌과 펜타센을 함유한 결합합성공합체(1a~b)를 사용하여 구성되었다.[27] 다른 몇 개의 결합 펜타센 폴리머(2a–b와 3)는 디브로멘타센 단량체의 소노가시라와 스즈키 커플링 반응을 바탕으로 실현되었다.[28][29] 비결합 펜타센 기반 폴리머는 비산염 염소화물과 함께 펜타센 디올 모노머를 에스테르화하여 폴리머 4a–b를 형성함으로써 합성되었다.[30][31]

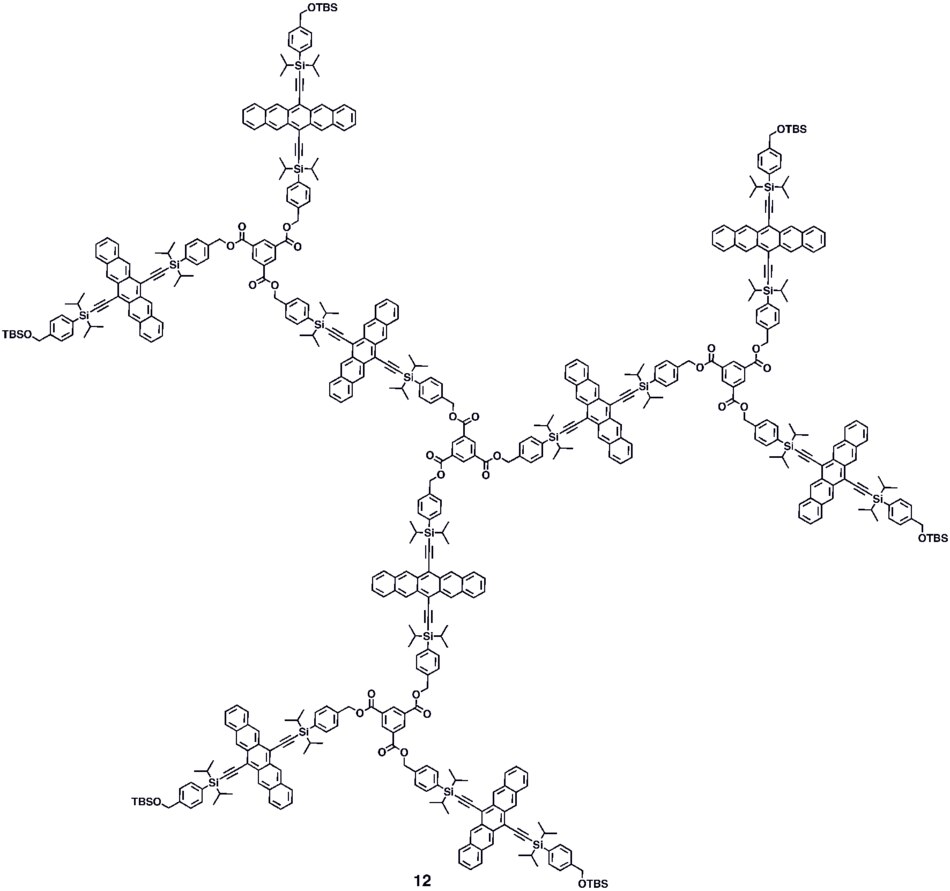
다양한 합성 전략 펜타센 5a–c의 광도전 이득 을을 선 보였다solution-processableconjugated 펜타센 다이머인(5c)를 제공하는one-pot-four-bond 형성 절차 등conjugated 올리고 모는을 형성시키기 위해 10,[32]규모의 열로 증발 영화 같은 순서에 있는 그것의 성능을 배치하고 고용되었다.없고,유사한 측정 기법을 사용하여 광촉자 이득 >16을 보인 n기능 펜타센.[33] 강력한 디하이드로펜타센 중간체의 호모-과 교차 결합 반응을 기반으로 한 모듈식 합성법(6–8)이 보고되었다.[34] 200만 M−1•cm−1 이하의 가장 강력한 흡수를 위해 어금 흡수성을 가진 분자당 최대 9개의 펜타센 모이에티를 가진 9-10의 덴드리머를 포함하여 [30][31]펜타센 기반의 비콘크리트 과점포 9-10이 합성되었다. 덴드리머 11-12는 광검출기 맥락에서 아날로그 펜타센 기반 폴리머 4a–b에 비해 장치의 성능이 향상된 것으로 나타났다.[35]
재료연구
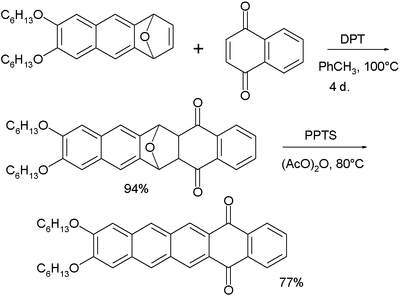
펜타센은 잠재적인 이분법 염료로 조사되어 왔다. 아래에 표시된 오타케노키논은 형광색이며 액정 E7 혼합물과 혼합하면 이분비 8에 이른다.[36][37] 더 긴 아세네는 네메틱 액정 단계에서 더 잘 정렬된다.
버크민스터풀레렌과 결합된 펜타센은 유기태양광 시제품 개발에 사용된다.[38][39] 유기태양광전지는 기존 무기전지에 비해 가격이 저렴하고 유연성이 높아 잠재적으로 새로운 시장에서 태양전지의 문을 열 수 있다.[40]
Pentacene은 유기 박막 트랜지스터와 OFET 연구를 위해 대중적으로 선택되는 것으로, 최대 5.5 cm2/(V·[41][42][43]s)의 OFET 구멍 이동성으로 인해 응용 가능성이 높은 유기 분자 중 가장 철저하게 조사된 유기 분자로 꼽힌다.
다른 유기 도체는 물론 펜타센도 공기 중 급속한 산화를 받기 때문에 상용화가 불가능하다. 펜타센을 사전 산화시킨 경우, 펜타센퀴논은 잠재적인 게이트 절연체로서 이동성이 가장 높은 운동성 유기 반도체인 40 cm/(V/s)의2 루브렌에 접근할 수 있다. 이 펜타센 산화 기술은 실리콘 전자제품에서 사용되는 실리콘 산화법과 유사하다.[42]
참고 항목
참조
- ^ "Single molecule's stunning image". BBC News. 2009-08-28. Retrieved 2009-08-28.
- ^ Gross, L.; Mohn, F; Moll, N; Liljeroth, P; Meyer, G (2009). "The Chemical Structure of a Molecule Resolved by Atomic Force Microscopy". Science. 325 (5944): 1110–1114. Bibcode:2009Sci...325.1110G. doi:10.1126/science.1176210. PMID 19713523. S2CID 9346745.
- ^ Krieger, K. (23 August 2011). "Molecules Imaged Most Intimately". Science Now. Retrieved 29 June 2017.
- ^ Gross, L.; Moll, N.; Mohn, F.; Curioni, A.; Meyer, G.; Hanke, F.; Persson, M. (2011). "High-Resolution Molecular Orbital Imaging Using a p-Wave STM Tip". Phys. Rev. Lett. 107 (8): 86101–86104. Bibcode:2011PhRvL.107h6101G. doi:10.1103/PhysRevLett.107.086101. PMID 21929180.
- ^ Brumfiel, G. (2012). "Microwave laser fulfills 60 years of promise". Nature. doi:10.1038/nature.2012.11199. S2CID 124247048.
- ^ Dinca, L. E.; De Marchi, F.; MacLeod, J. M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D. F.; Rosei, F. (2015). "Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene". Nanoscale. 7 (7): 3263–3269. Bibcode:2015Nanos...7.3263D. doi:10.1039/C4NR07057G. PMID 25619890.
- ^ Mills, William Hobson; Mills, Mildred (1912). "CCXXX.—The synthetical production of derivatives of dinaphthanthracene". J. Chem. Soc., Trans. 101: 2194–2208. doi:10.1039/CT9120102194.
- ^ Chung, Hyunjoong; Diao, Ying (2016). "Polymorphism as an emerging design strategy for high performance organic electronics". J. Mater. Chem. C. 4 (18): 3915–3933. doi:10.1039/C5TC04390E.
Since its synthesis in 1912 to the categorization of at least four different polymorphs in 2003, pentacene has developed into a benchmark organic semiconductor due to its excellent thin film transistor performance
- ^ Elbs, Karl (1886). "Beiträge zur Kenntniss aromatischer Ketone. Erste Mittheilung". J. Prakt. Chem. (in German). 33 (1): 180–188. doi:10.1002/prac.18860330119.
- ^ Breitmaier, Eberhard; Jung, Günther (2005). "12.5.3 Elbs-Reaktion". Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen (in German) (5th ed.). Stuttgart: Georg Thieme Verlag. p. 183. ISBN 9783135415055.
- ^ a b Chen, Kew-Yu; Hsieh, Hsing-Hung; Wu, Chung-Chih; Hwang, Jiunn-Jye; Chow, Tahsin J. (2007). "A new type of soluble pentacene precursor for organic thin-film transistors" (PDF). Chem. Commun. 2007 (10): 1065–1067. doi:10.1039/b616511g. PMID 17325807.
- ^ Allen, C. F. H.; Bell, Alan (1942). "Action of Grignard Reagents on Certain Pentacenequinones, 6,13-Diphenylpentacene". Journal of the American Chemical Society. 64 (6): 1253–1260. doi:10.1021/ja01258a005.
- ^ Maulding, D. R.; Roberts, Bernard G. (1969). "Electronic absorption and fluorescence of phenylethynyl-substituted acenes". The Journal of Organic Chemistry. 34 (6): 1734–1736. doi:10.1021/jo01258a045.
- ^ Li, Shi; Zhou, Lishan; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu (2010). "Synthesis of 1,2,3,4,8,9,10,11-Octasubstituted Pentacenequinone Derivatives and their Conversion into Substituted Pentacenes". Chemistry: An Asian Journal. 5 (7): 1620–6. doi:10.1002/asia.200900754. PMID 20455241.
- ^ Takahashi, Tamotsu; Kitamura, Masanori; Shen, Baojian; Nakajima, Kiyohiko (2000). "Straightforward Method for Synthesis of Highly Alkyl-Substituted Naphthacene and Pentacene Derivatives by Homologation". Journal of the American Chemical Society. 122 (51): 12876–12877. doi:10.1021/ja003130g.
- ^ Takahashi, Tamotsu; Li, Shi; Huang, Wenying; Kong, Fanzhi; Nakajima, Kiyohiko; Shen, Baojian; Ohe, Takahiro; Kanno, Ken-Ichiro (2006). "Homologation Method for Preparation of Substituted Pentacenes and Naphthacenes". The Journal of Organic Chemistry. 71 (21): 7967–77. doi:10.1021/jo060923y. PMID 17025283.
- ^ Takahashi, Tamotsu; Li, Yanzhong; Hu, Jinghan; Kong, Fanzhi; Nakajima, Kiyohiko; Zhou, Lishan; Kanno, Ken-Ichiro (2007). "Cu(I)-mediated cycloaddition reaction of zirconacyclopentadienes with fumaronitrile and application for synthesis of monocyano-substituted pentacenes". Tetrahedron Letters. 48 (38): 6726–6730. doi:10.1016/j.tetlet.2007.07.075.
- ^ Stone, Matthew T.; Anderson, Harry L. (2007). "Three-Step Synthesis of End-Substituted Pentacenes". The Journal of Organic Chemistry. 72 (25): 9776–8. doi:10.1021/jo7017284. PMID 17999529.
- ^ Li, Shi; Li, Zhiping; Nakajima, Kiyohiko; Kanno, Ken-Ichiro; Takahashi, Tamotsu (2009). "Double Homologation Method for Substituted Soluble Pentacenes and Dimerization Behaviours of Pentacenes". Chemistry: An Asian Journal. 4 (2): 294–301. doi:10.1002/asia.200800312. PMID 19072938.
- ^ Anthony, J. E.; Brooks, J. S.; Eaton, D. L.; Parkin, S. R. (2001). "Functionalized Pentacene: Improved Electronic Properties from Control of Solid-State Order". Journal of the American Chemical Society. 123 (38): 9482–9483. doi:10.1021/ja0162459. PMID 11562247.
- ^ Anthony, J. E.; Eaton, D. L.; Parkin, S. R. (2002). "A Road Map to Stable, Soluble, Easily Crystallized Pentacene Derivatives". Organic Letters. 4 (1): 15–18. doi:10.1021/ol0167356. PMID 11772079.
- ^ Norton, Joseph E.; Northrop, BH; Nuckolls, C; Houk, KN (2006). "Why 6-Methylpentacene Deconjugates but Avoids the Thermally Allowed Unimolecular Mechanism". Organic Letters. 8 (21): 4915–8. doi:10.1021/ol062012g. PMID 17020335.
- ^ Briseno, Alejandro L.; Miao, Q; Ling, MM; Reese, C; Meng, H; Bao, Z; Wudl, F (2006). "Hexathiapentacene: Structure, Molecular Packing, and Thin-Film Transistors". Journal of the American Chemical Society. 128 (49): 15576–7. doi:10.1021/ja066088j. PMID 17147352..
- ^ Lu, Jun; Ho, DM; Vogelaar, NJ; Kraml, CM; Bernhard, S; Byrne, N; Kim, LR; Pascal Jr, RA (2006). "Synthesis, Structure, and Resolution of Exceptionally Twisted Pentacenes". Journal of the American Chemical Society. 128 (51): 17043–50. doi:10.1021/ja065935f. PMID 17177456.
- ^ Lehnherr, D.; Tykwinski, R.R. (2010). "Oligomers and Polymers Based on Pentacene Building Blocks". Materials. 3 (4): 2772–2800. Bibcode:2010Mate....3.2772L. doi:10.3390/ma3042772. PMC 5445842.
- ^ Lehnherr, D.; Tykwinski, R. R. (2011). "Conjugated Oligomers and Polymers Based on Anthracene, Tetracene, Pentacene, Naphthodithiophene, and Anthradithiophene Building Blocks". Australian Journal of Chemistry. 64 (7): 919–929. doi:10.1071/CH11169.
- ^ Tokito, S.; Weinfurtner, K.-H.; Fujikawa, H.; Tsutsui, T.; Taga, Y. (2001). Kafafi, Zakya H (ed.). "Acene containing polyfluorenes for red, green and blue emission in organic light-emitting diodes". Proc. SPIE–Int. Opt. Soc. Eng. Organic Light-Emitting Materials and Devices IV. 4105: 69–74. Bibcode:2001SPIE.4105...69T. doi:10.1117/12.416877. S2CID 96976350.
- ^ Okamoto, T.; Bao, Z. (2007). "Synthesis of solution-soluble pentacene-containing conjugated copolymers". Journal of the American Chemical Society. 129 (34): 10308–10309. doi:10.1021/ja0725403. PMID 17685520.
- ^ Okamoto, T.; Okamoto, T.; Jiang, Y.; Qu, F.; Mayer, A.C.; Parmer, J.E.; McGehee, M.D.; Bao, Z. (2008). "Synthesis and characterization of pentacene– and anthradithiophene–fluorene conjugated copolymers synthesized by Suzuki reactions". Macromolecules. 41 (19): 6977–6980. Bibcode:2008MaMol..41.6977O. doi:10.1021/ma800931a.
- ^ a b Lehnherr, D.; Tykwinski, R. R. (2007). "Pentacene Oligomers and Polymers: Functionalization of Pentacene to Afford Mono-, Di-, Tri-, and Polymeric Materials". Organic Letters. 9 (22): 4583–4586. doi:10.1021/ol702094d. PMID 17918951.
- ^ a b Lehnherr, Dan; McDonald, Robert; Ferguson, Michael J.; Tykwinski, Rik R. (2008). "Synthesis of soluble oligo- and polymeric pentacene-based materials". Tetrahedron. 64 (50): 11449–11461. doi:10.1016/j.tet.2008.09.041. ISSN 0040-4020.
- ^ Lehnherr, D.; Gao, J.; Hegmann, F. A.; Tykwinski, R. R. (2008). "Synthesis and Electronic Properties of Conjugated Pentacene Dimers". Organic Letters. 10 (21): 4779–4782. doi:10.1021/ol801886h. PMID 18823120.
- ^ Gao, J.; Hegmann, F. A (2008). "Bulk photoconductive gain in pentacene thin films". Applied Physics Letters. 93 (22): 223306. Bibcode:2008ApPhL..93v3306G. doi:10.1063/1.3043431.
- ^ Lehnherr, D.; Murray, A. H.; McDonald, R.; Tykwinski, R.R. (2010). "A Modular Synthetic Approach to Conjugated Pentacene Di-, Tri-, and Tetramers". Angewandte Chemie International Edition. 49 (35): 6190–6194. doi:10.1002/anie.201000555. PMID 20645363.
- ^ Lehnherr, D.; Gao, J.; Hegmann, F. A.; Tykwinski, R. R. (2009). "Pentacene-based dendrimers: synthesis and thin film photoconductivity measurements of branched pentacene oligomers". Journal of Organic Chemistry. 74 (14): 5017–5024. doi:10.1021/jo9007089. PMID 19489566.
- ^ Chen, Zhihua; Swager, TM (2007). "Synthesis and Characterization of Fluorescent Acenequinones as Dyes for Guest−Host Liquid Crystal Displays". Organic Letters. 9 (6): 997–1000. doi:10.1021/ol062999m. PMID 17298074.
- ^ 이 화합물의 합성에 있어서, 시작 물질은 1,4-나프토키논과 DPT로 처리된다. DTP는 옥소노르보르나디엔을 중간 휴란으로 전환한다. 두 번째 단계는 PPTS에 의한 산화다.
- ^ Dissanayake, D. M. Nanditha M. (2007). "Nanoimprinted large area heterojunction pentacene-C[sub 60] photovoltaic device" (PDF). Applied Physics Letters. 90 (25): 253502. Bibcode:2007ApPhL..90y3502D. doi:10.1063/1.2749863.
- ^ 효율적인 유기농: 차세대 태양열 발전을 위해 펜타센을 사용한 연구진 sciencedaily.com 링크
- ^ "Efficiently Organic: Researchers Use Pentacene To Develop Next-generation Solar Power". ScienceDaily. Retrieved 2017-11-14.
- ^ Norbert Koch (2007). "Organic Electronic Devices and Their Functional Interfaces". ChemPhysChem. 8 (10): 1438–55. doi:10.1002/cphc.200700177. PMID 17539032.
- ^ a b Tatsuo Hasegawa & Jun Takeya (2009). "Organic field-effect transistors using single crystals". Sci. Technol. Adv. Mater. 10 (2): 024314. Bibcode:2009STAdM..10b4314H. doi:10.1088/1468-6996/10/2/024314. PMC 5090444. PMID 27877287.
- ^ Yoshiro Yamashita (2009). "Organic semiconductors for organic field-effect transistors". Sci. Technol. Adv. Mater. 10 (2): 024313. Bibcode:2009STAdM..10b4313Y. doi:10.1088/1468-6996/10/2/024313. PMC 5090443. PMID 27877286.
외부 링크
- 2006년 4월 17일에 회수된 펜타센에 대한 사실들
- 유기 트랜지스터는 나이가 들수록 좋아진다, 새로운 과학자, 2007년 12월 2일
- Pentacene Imaged, IBM은 2009년 8월 29일에 자세히 이미징된 최초의 분자인 Pentacene을 이미지화했다.