아줄렌
Azulene
| | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 아줄렌[1] | |||
| 시스템 IUPAC 이름 비시클로[5.3.0]데카펜타엔 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.005.449 | ||
| 케그 | |||
PubChem CID | |||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C10H8 | |||
| 몰 질량 | 128.19g/140−1 | ||
| 녹는점 | 99 ~ 100 °C (210 ~212 °F, 372 ~373 K) | ||
| 비등점 | 242 °C (468 °F, 515 K) | ||
자화율(δ) | - 98.5 · 10−6 cm3 / 세로 g/l[2] | ||
| 열화학 | |||
표준 엔탈피/ 연소 (δHc⦵298) | - 1,266.5 kcal/표준[3] | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
아줄렌은 나프탈렌의 유기화합물 및 이성질체이다.나프탈렌은 무색인 반면 아줄렌은 짙은 파란색이다.아줄렌 골격을 특징으로 하는 베티바줄렌(4,8-디메틸-2-이소프로필라줄렌)과 과이아줄렌(1,4-디메틸-7-이소프로필라줄렌)의 2종류의 테르페노이드가 버섯, 과이악나무유 및 일부 해양 무척추동물 중 색소의 성분으로 자연에서 발견된다.
아줄렌은 독일의 카모마일을 증류하여 얻은 푸른색 단색체로 15세기까지 거슬러 올라가는 오랜 역사를 가지고 있다.색소는 실로와 쑥에서 발견되었고 1863년 셉티머스 피에스에 의해 명명되었다.이것의 구조는 라보슬라프 루지치카에 의해 처음 보고되었고, 1937년 플라시두스 플랫너에 의해 유기 합성되었다.
구조 및 본딩
아줄렌은 보통 사이클로펜타디엔과 시클로헵타트리엔 고리의 융합에서 비롯되는 것으로 보인다.나프탈렌과 시클로데카펜타엔과 마찬가지로 10파이 전자계입니다.(i) 말초 결합의 길이가 비슷하고 (ii) Friedel-Crafts와 같은 치환을 받는다.방향족에 의한 안정성 향상은 나프탈렌의 절반으로 추정된다.
다이폴 모멘트는 1.08D로 [6]다이폴 모멘트가 0인 나프탈렌과는 대조적이다.이 극성은 아줄렌을 6μ전자 사이클로펜타디에닐 음이온과 6μ전자 트로피움 양이온의 융합으로 설명하면 설명할 수 있다. 즉, 7원환에서 5원환으로 1개의 전자가 전달되어 각 고리의 방향족 안정성을 Hükel 법칙에 의해 부여한다.반응성 연구에 따르면 7원 고리는 친전자성이고 5원 고리는 친핵성이다.
지면 상태의 쌍극자 성질은 작은 불포화 방향족 [7]화합물로는 드문 짙은 색상에 반영됩니다.아줄렌의 또 다른 주목할 만한 특징은 상층부의 형광(S2 → S0)[8]을 보여 카샤의 법칙에 위배된다는 것이다.
유기합성
아줄렌으로 가는 합성 경로는 그 [9]특이한 구조 때문에 오랫동안 관심을 받아왔다.1939년 St. Pau와 Plattner가 인단과 에틸 디아조아세테이트를 시작으로 첫 번째 방법을 보고했다.
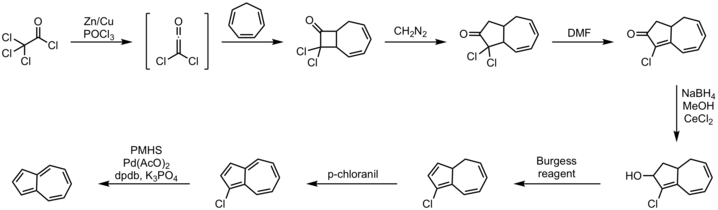
효율적인 원포트 루트는 불포화 C-신톤에5 [11]의한 사이클로펜타디엔의 고리를 수반한다.시클로헵타트리엔의 대체 접근법은 오랫동안 알려져 왔으며,[12][13] 아래에 한 가지 예가 제시되어 있다.
순서:
- 디클로로케틴에 의한 시클로헵타트리엔2+2 시클로드디션
- 디아조메탄 삽입 반응
- DMF와의 탈수소 할로겐화 반응
- 수소화붕소나트륨으로 알코올 환원
- 버지스 시약과의 제거 반응
- p-클로로닐에 의한 산화
- 폴리메틸히드로실록산, 팔라듐에 의한 탈할로겐화II) 아세트산염, 인산칼륨 및 DPDB배위자
유기 금속 착화체
유기금속화학에서 아줄렌은 저가의 금속중심에 대한 리간드 역할을 하며, 다른 방법으로는 시클로펜타디에닐 및 시클로헵타트리닐 리간드와 함께 γ-복합체를 형성하는 것으로 알려져 있다.(아줄렌2) Mo(CO)6 및 (아줄렌) 착화체Fe2(CO)5[14]
관련 화합물
1-히드록시아줄렌은 불안정한 녹색 기름으로 케토-에놀 호변이성([15]tautomerism)을 보이지 않으며 2-히드록시아줄렌은 2-메톡시아줄렌을 브롬산으로 가수분해하여 얻는다.그것은 안정적이고 케토에놀 호변이성(tautomerism)[16]을 보인다.물에 있는 2-히드록시아줄렌의 pK는a 8.71이다.그것은 페놀이나 나프톨보다 더 산성이다.물에 있는 6-히드록시아줄렌의 pK는a 7.38로 페놀이나 [16]나프톨보다 산성이 높다.
나프[a]아줄렌에서 나프탈렌 고리가 아줄렌 1,2배 농축되어 있다.그러한 시스템[17] 중 하나에서 평면성으로부터의 변형이 테트라헬리센의 변형과 유사하다는 것이 발견되었다.
과이아줄렌(1,4-디메틸-7-이소프로필라줄렌)은 거의 동일한 강청색을 가진 아줄렌의 알킬화 유도체이다.화장품 업계에서 피부 컨디셔닝제로 사용할 수 있습니다.
레퍼런스
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 207. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Sweet, L. I.; Meier, P. G. (1997). "Lethal and Sublethal Effects of Azulene and Longifolene to Microtox®, Ceriodaphnia dubia, Daphnia magna, and Pimephales promelas" (PDF). Bulletin of Environmental Contamination and Toxicology. 58 (2): 268–274. doi:10.1007/s001289900330. hdl:2027.42/42354. PMID 8975804.
- ^ Salter, Carl; Foresman, James B. (1998). "Naphthalene and Azulene I: Semimicro Bomb Calorimetry and Quantum Mechanical Calculations". Journal of Chemical Education. 75 (10): 1341. Bibcode:1998JChEd..75.1341S. doi:10.1021/ed075p1341.
- ^ Harmon, A. D.; Weisgraber, K. H.; Weiss, U. (1980). "Preformed azulene pigments of Lactarius indigo (Schw.) Fries (Russulaceae, Basidiomycetes)". Experientia. 36: 54–56. doi:10.1007/BF02003967. S2CID 21207966.
- ^ May, Gillian; Nicolas (1998). "Australasian fungi: a natural product study": 56. doi:10.26021/9162.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Anderson, Arthur G.; Steckler, Bernard M. (1959). "Azulene. VIII. A Study of the Visible Absorption Spectra and Dipole Moments of Some 1- and 1,3-Substituted Azulenes". Journal of the American Chemical Society. 81 (18): 4941–4946. doi:10.1021/ja01527a046.
- ^ Michl, Joseph; Thulstrup, E. W. (1976). "Why is azulene blue and anthracene white? A simple mo picture". Tetrahedron. 32 (2): 205. doi:10.1016/0040-4020(76)87002-0.
- ^ Tétreault, N.; Muthyala, R. S.; Liu, R. S. H.; Steer, R.P. (1999). "Control of the Photophysical Properties of Polyatomic Molecules by Substitution and Solvation: The Second Excited Singlet State of Azulene". Journal of Physical Chemistry A. 103 (15): 2524–31. Bibcode:1999JPCA..103.2524T. doi:10.1021/jp984407q.
- ^ Gordon, Maxwell (1 February 1952). "The Azulenes". Chemical Reviews. 50 (1): 127–200. doi:10.1021/cr60155a004.
- ^ St. Pfau, Alexander; Plattner, Pl. A. (1939). "Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens". Helvetica Chimica Acta. 22: 202–208. doi:10.1002/hlca.19390220126.
- ^ Hafner, Klaus; Meinhardt, Klaus-Peter (1984). "Azulene". Organic Syntheses. 62: 134. doi:10.15227/orgsyn.062.0134.
- ^ Carret, Sébastien; Blanc, Aurélien; Coquerel, Yoann; Berthod, Mikaël; Greene, Andrew E.; Deprés, Jean-Pierre (2005). "Approach to the Blues: A Highly Flexible Route to the Azulenes". Angewandte Chemie International Edition. 44 (32): 5130–5133. doi:10.1002/anie.200501276. PMID 16013070.
- ^ Lemal, David M.; Goldman, Glenn D. (1988). "Synthesis of azulene, a blue hydrocarbon". Journal of Chemical Education. 65 (10): 923. Bibcode:1988JChEd..65..923L. doi:10.1021/ed065p923.
- ^ Churchill, Melvyn R. (2007). "Transition Metal Complexes of Azulene and Related Ligands". Progress in Inorganic Chemistry. pp. 53–98. doi:10.1002/9780470166123.ch2. ISBN 9780470166123.
- ^ Asao, Toyonobu; Shunji Ito; Noboru Morita (1989). "1-Hydroxyazulene and 3-hydroxyguaiazulene: Synthesis and their properties". Tetrahedron Letters. 30 (48): 6693–6696. doi:10.1016/S0040-4039(00)70653-8.
- ^ a b Takase, Kahei; Toyonobu Asao; Yoshikazu Takagi; Tetsuo Nozoe (1968). "Syntheses and some properties of 2- and 6-hydroxyazulenes". Chemical Communications (7): 368b–370. doi:10.1039/C1968000368B.
- ^ Yamamura, Kimiaki; Kawabata, Shizuka; Kimura, Takatomo; Eda, Kazuo; Hashimoto, Masao (2005). "Novel Synthesis of Benzalacetone Analogues of Naphth[a]azulenes by Intramolecular Tropylium Ion-Mediated Furan Ring-Opening Reaction and X-ray Investigation of a Naphth[1,2-a]azulene Derivative". The Journal of Organic Chemistry. 70 (22): 8902–6. doi:10.1021/jo051409f. PMID 16238325.