키나졸린
Quinazoline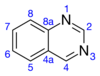 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 키나졸린[1] | |||
| 기타 이름 1,3-디아나프탈렌 벤조피리미딘 펜미아진 벤조-1,3-아미노 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.005.424 | ||
| EC 번호 |
| ||
PubChem CID | |||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C8H6N2 | |||
| 몰 질량 | 130.150g/g−1/g | ||
| 외모 | 연노란 결정 | ||
| 밀도 | 1.351 g/cm3, 솔리드 | ||
| 녹는점 | 48 °C (118 °F, 321 K) | ||
| 비등점 | 243 °C (469 °F, 516 K) | ||
| 용해성 | |||
| 산도(pKa) | 3.51[2] | ||
| 구조. | |||
| 2.2 D[3] | |||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 자극성 | ||
| GHS 라벨링: | |||
 | |||
| 경고 | |||
| H315, H319, H335 | |||
| P261, , , , , , , , , , , | |||
| 플래시 포인트 | 106 °C (223 °F, 379 K) | ||
| 안전 데이터 시트(SDS) | 외부 MSDS | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
키나졸린은 화학식이862 CHN인 유기 화합물이다.2개의 용융 6원 방향족 고리, 벤젠 고리 및 피리미딘 고리로 이루어진 이환 구조를 가진 방향족 헤테로 고리이다.물에 녹는 연노랑 결정성 고체입니다.1,3-디아나프탈렌으로도 알려진 키나졸린은 퀴놀린의 아자 유도체로부터 이름을 얻었다.부모 키나졸린 분자는 기술 문헌에서 거의 단독으로 언급되지 않지만, 치환된 유도체는 항말라리아제 및 항암제와 같은 의학적 목적으로 합성되었다.키나졸린은 평면 분자이다.벤조디아진 서브그룹의 다른 디아자나프탈렌인 신놀린, 키녹살린 및 프탈라진과 이성질체이다.200개 이상의 생물학적 활성 키나졸린과 퀴놀린 알칼로이드가 확인되었다.[4][5]
합성
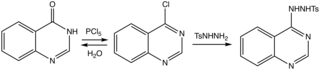
키나졸린의 합성은 1895년 August Bischler와 Lang에 의해 2-카복시 유도체(키나졸린-2-카복실산)[6]의 탈탄산화를 통해 처음 보고되었다.1903년 지그문트 가브리엘은 요오드화수소와 적린에 의해 2-아미노벤질아민으로 환원된 o-니트로벤질아민으로부터 모체 키나졸린의 합성을 보고했다.환원된 중간체는 포름산과 응축되어 디히드로키나졸린을 생성하였고, 디히드로키나졸린은 [7]키나졸린으로 산화되었다.
방법을 [8]검토했습니다.부모 헤테로환에 대한 효율적인 경로는 4-클로로 유도체를 통해 토실히드라지드로 진행되며, 토실히드라지드는 [9]염기에 의해 제거된다.
반응
수화 및 첨가 반응
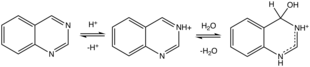
키나졸린 프로톤산염(및 메틸산염). 프로톤화는 수화작용을 유도한다.많은 약산성 기질들이 C=N3 결합에 걸쳐 첨가되는데, 여기에는 시안화수소, 아황산나트륨 및 메틸케톤이 [10]포함된다.
가수 분해
따뜻한 용액에서 키나졸린은 산성 및 알칼리 조건에서 2-아미노벤즈알데히드(또는 그 자체 응축 산물)와 포름산과 암모니아/[3]암모늄으로 가수분해된다.
친전자성 및 친핵성 치환
피리미딘 고리는 친전자성 치환에 저항하지만, 4위치가 2위치에 비해 반응성이 더 높습니다.이에 비해 벤젠 고리는 친전자성 치환에 더 민감하다.반응성의 링 위치 순서는 8 > 6 > 5 > 7이다. 키나졸린의 2-할로 유도체는 피페리딘과 같은 친핵체에 [3]의해 치환된다.
생물학적, 약리학적 중요성
게피티니브
2003년 5월 미국 식품의약국(FDA)은 키나졸린 게피티닙을 승인했다.AstraZeneca에 의해 생산된 이 약물은 표피 성장인자 수용체(EGFR)의 단백질 키나제 억제제이다.EGFR의 ATP 결합 부위에 결합하여 항아포토시스 Ras 신호 전달 캐스케이드를 비활성화하여 암세포의 [11][12][13]추가 성장을 방지한다.
라파티니브
2007년 3월, 글락소스미스클라인의 약물 라파티닙은 미국 FDA에 의해 로체의 카페시타빈과 함께 진행기 또는 전이성 유방암을 치료하도록 승인되었다.라파티닙은 종양 성장을 일으키는 유방암 줄기세포의 성장을 제거한다.EGFR 및 인간 표피 성장인자 수용체 2(HER2) 단백질 키나제 도메인에 대한 라파티닙의 결합은 신호 메커니즘 활성화를 억제한다(가역적,[14][15][16][17] 경쟁적 억제를 통해).
엘로티니브
2013년 5월, Astellas가 제조한 의약품인 erlotinib은 미국 FDA로부터 EGFR 돌연변이로 인한 종양 NSCLC 환자를 치료하도록 승인받았다.EGFR 수용체의 ATP 결합 부위에 에를로티닙이 결합하면 EGFR이 (경쟁적 저해로 인해) 포스포티로신 잔류물을 생성하는 것을 방지하고, 따라서 수용체가 세포 [18][19]성장을 촉진하기 위한 신호 캐스케이드를 생성할 수 없게 된다.
아파티닙
2013년 7월, 미국 FDA는 Boehringer Ingelheim에 의해 개발된 약물인 afatinib를 HER2 및 EGFR 키나아제들의 되돌릴 수 없는 경쟁력 있는 억제제로 승인했다.아파티니브는 비가역성 HER2 및 EGFR 억제제 역할을 하는 laptinib와 유사한 메커니즘을 나타내지만, 아파티니브는 또한 게피니티브 및 [20]에로티니브에 내성을 갖게 된 티로신 키나아제에 대한 활성을 보였다.
「 」를 참조해 주세요.
레퍼런스
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 212. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Armarego, W. L. F. (1963). "Quinazolines". Advances in Heterocyclic Chemistry Volume 1. Advances in Heterocyclic Chemistry. Vol. 1. pp. 253–309. doi:10.1016/S0065-2725(08)60527-9. ISBN 9780120206018. PMID 14087221.
- ^ a b c 부첼, K.H., ed.유기화학(Houben-Weyl) 방법: 제4판 추가 및 보충권뉴욕: Georg Thieme Verlag Stuttgart, 2001.
- ^ Shang, XF; Morris-Natschke, SL; Liu, YQ; Guo, X; Xu, XS; Goto, M; Li, JC; Yang, GZ; Lee, KH (May 2018). "Biologically active quinoline and quinazoline alkaloids part I." Medicinal Research Reviews. 38 (3): 775–828. doi:10.1002/med.21466. PMC 6421866. PMID 28902434.
- ^ Shang, Xiao-Fei; Morris-Natschke, Susan L.; Yang, Guan-Zhou; Liu, Ying-Qian; Guo, Xiao; Xu, Xiao-Shan; Goto, Masuo; Li, Jun-Cai; Zhang, Ji-Yu; Lee, Kuo-Hsiung (September 2018). "Biologically active quinoline and quinazoline alkaloids part II". Medicinal Research Reviews. 38 (5): 1614–1660. doi:10.1002/med.21492. ISSN 0198-6325. PMC 6105521. PMID 29485730.
- ^ Asif, M. Quinazoline 및 Quinazolinone 유도체의 화학적 특성, 합성 방법 및 생물학적 잠재력, 국제 의약품 화학 저널, 2014.doi:10.1155/2014/395637
- ^ 모건, G.T., Ed. 논문 요약화학 학회지런던: 1904년, Gurney & Jackson.인쇄.
- ^ Connolly, David J.; Cusack, Declan; O'Sullivan, Timothy P.; Guiry, Patrick J. (2005). "Synthesis of quinazolinones and quinazolines". Tetrahedron. 61 (43): 10153–10202. doi:10.1016/j.tet.2005.07.010.
- ^ W. L. F. Armarego (1967). "Halogenoquinazolines". In W. L. F. Armarego (ed.). Chemistry of Heterocyclic Compounds. pp. 11–38. doi:10.1002/9780470186916.ch7. ISBN 9780470186916.
- ^ W. L. F. Armarego (1967). "Quinazoline". In W. L. F. Armarego (ed.). Chemistry of Heterocyclic Compounds. Chemistry of Heterocyclic Compounds: A Series of Monographs. pp. 11–38. doi:10.1002/9780470186916.ch2. ISBN 9780470186916.
- ^ "Iressa(Gefitinib)" (PDF). US Food and Drug Administration. 2 May 2003.
- ^ Lynch, Thomas J.; Bell, Daphne W.; Sordella, Raffaella; Gurubhagavatula, Sarada; Okimoto, Ross A.; Brannigan, Brian W.; Harris, Patricia L.; Haserlat, Sara M.; Supko, Jeffrey G.; Haluska, Frank G.; Louis, David N.; Christiani, David C.; Settleman, Jeff; Haber, Daniel A (May 20, 2004). "Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non-Small-Cell Lung Cancer to Gefitinib". NEJM. 350 (21): 2129–39. doi:10.1056/nejmoa040938. PMID 15118073.
- ^ Takimoto CH, Calvo E. Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ(Eds) 암관리: 다원적 접근법. 2008년 11월.
- ^ "Lapatinib". US Food and Drug Administration. 13 March 2007.
- ^ Wood ER, Truesdale AT, McDonald OB, Yuan D, Hassell A, Dickerson SH, Ellis B, Pennisi C, et al. (2004). "A unique structure for epidermal growth factor receptor bound to GW572016 (Lapatinib): relationships among protein conformation, inhibitor off-rate, and receptor activity in tumor cells". Cancer Research. 64 (18): 6652–9. doi:10.1158/0008-5472.CAN-04-1168. PMID 15374980.
- ^ Rodriguez,A. (April 2008). New type of drug shrinks primary breast cancer tumors significantly in just six weeks; research provides leads to a new target in cancer treatment – the cancer stem cell. Archived from the original on 2008-11-26.
- ^ Nelson MH, Dolder CR (February 2006). "Lapatinib: a novel dual tyrosine kinase inhibitor with activity in solid tumors". Ann Pharmacother. 40 (2): 261–9. doi:10.1345/aph.1G387. PMID 16418322. S2CID 21622641.
- ^ "Erlotinib". US Food and Drug Administration. 14 May 2013.
- ^ Raymond E, Faivre S, Armand J (2000). "Epidermal growth factor receptor tyrosine kinase as a target for anticancer therapy". Drugs. 60 Suppl 1: 15–23, discussion 41–2. doi:10.2165/00003495-200060001-00002. PMID 11129168. S2CID 10555942.
- ^ "Afatinib". US Food and Drug Administration. 12 July 2013.