스파르타인
Sparteine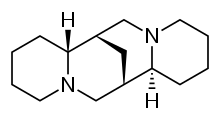 | |
| 임상 데이터 | |
|---|---|
| 기타 이름 | (6R,8S,10R,12S)-7,15-디아자테트라사이클로[7.7.1.0.0]헥타데칸2,710,15 |
| AHFS/Drugs.com | 국제 의약품명 |
| ATC 코드 | |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.001.808 |
| 화학 및 물리 데이터 | |
| 공식 | C15H26N2 |
| 몰 질량 | 234.387 g/120−1 |
| 3D 모델(JSmol) | |
| 밀도 | 1.02g/cm3 |
| 녹는점 | 30 °C (86 °F) |
| 비등점 | 325°C(617°F) |
| 물에 녹는 정도 | 3.04 mg/mL (20 °C |
| |
| |
| | |
스파르테인(Sparteine)은 나트륨 채널 차단제인 1a급 항부정맥제입니다.그것은 알칼로이드로 스카치 빗자루에서 추출할 수 있다.그것은 루피누스 돌연변이의 주요 알칼로이드이며, 2가의 양이온 칼슘과 마그네슘을 킬레이트하는 것으로 생각됩니다.항부정맥제로 FDA에서 승인하지 않았으며, Vaughan Williams 항부정맥제 분류에 포함되지 않았습니다.
또한 유기 화학, 특히 유기석 시약을 포함하는 합성에서 키랄 배위자로 사용됩니다.
생합성
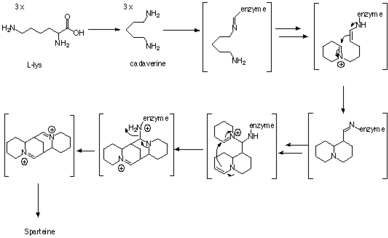
스파르테인(Sparteine)은 L-리신의 3개의5 C사슬, [1]또는 보다 구체적으로는 L-리신으로부터 유도되는 4환식 비스퀴놀리지딘 고리계를 포함한 루핀 알칼로이드이다.생합성 과정의 첫 번째 중간체는 리신 탈탄산화효소(LDC)[2]에 의해 촉매되는 리신의 탈탄산물인 카다베린이다.퀴놀리지딘 골격을 형성하기 위해 3단위의 카다베린이 사용된다.형성 메커니즘은 효소적으로 연구되고 추적기 실험에서도 연구되었지만, 정확한 합성 경로는 여전히 불분명하다.
C-N-double15 labeled cadaverine을 사용한 추적기 연구 결과, 세 단위의 카다베린이 스파르테인에 통합되고 두 개의 카다베린 단위에서 두 개의 C-N 결합이 그대로 [3]남아 있는 것으로 나타났다.관측치는 또한 H NMR 라벨링 [4]실험을 사용하여 확인되었다.
그 후 효소적 증거는 카다베린의 세 분자가 효소 결합 중간체를 통해 유리 중간체를 생성하지 않고 퀴놀리지딘 고리로 변환된다는 것을 보여주었다.원래, 카다베린의 해당 알데히드인 5-아미노펜타날로의 전환은 디아민 산화효소에 [5]의해 촉매된 것으로 생각되었다.그런 다음 알데히드는 자연스럽게 대응하는 쉬프 염기인 δ-피페리딘으로1 변환된다.두 분자의 결합은 알돌형 반응에서 δ-피페리딘의1 두 호변이성체 사이에서 일어난다.그런 다음 이민은 해당하는 알데히드/아민으로 가수분해된다.그런 다음 1차 아민은 알데히드로 산화되고 이어 이민이 형성되어 퀴놀리지딘 [5]고리를 생성한다.
17-옥소스파르틴합성효소 경유
보다 최근의 효소 증거는 아미노기 전이 효소인 17-옥소스파르테인 합성효소([6][7][8][9][10][11]OS)의 존재를 나타냈다.탈아미네이트된 카다베린은 효소로부터 방출되지 않으므로, 효소는 채널 방식으로 [9][10][11]퀴놀리지딘 골격의 형성을 촉매한다고 가정할 수 있다. 7-옥소스파르테인은 NH 수용체로서2 피루브산 4유닛을 필요로 하며, 알라닌 4분자를 생성한다.리신탈탄산화효소 및 퀴놀리지딘골격형성효소는 모두 엽록체에 [12]국재되어 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Dewick PM (2009). Medicinal Natural Products, 3rd. Ed. Wiley. p. 311.
- ^ Golebiewski WM, Spenser ID (1988). "Biosynthesis of the lupine alkaloids. II. Sparteine and lupanine". Canadian Journal of Chemistry. 66 (7): 1734–1748. doi:10.1139/v88-280.
- ^ Rana J, Robins DJ (1983). "Quinolizidine alkaloid biosynthesis: incorporation of [1-amino-15 N, 1-13 C] cadaverine into sparteine". Journal of the Chemical Society, Chemical Communications (22): 1335–6. doi:10.1039/c39830001335.
- ^ Fraser AM, Robins DJ (1984). J. Chem. Soc., Chem. Commun. 22: 1147–9.
{{cite journal}}:누락 또는 비어 있음title=(도움말) - ^ a b Aniszewski T (2007). Alkaloids - Secrets of Life, 1st Ed. Elsevier. pp. 98–101.
- ^ Wink M, Hartmann T (1984). Enzymology of Quinolizidine Alkaloid Biosynthesis; Natural Products Chemistry: Zalewski and Skolik (Eds.). pp. 511–520.
- ^ Wink M (December 1987). "Quinolizidine alkaloids: biochemistry, metabolism, and function in plants and cell suspension cultures". Planta Medica. 53 (6): 509–14. doi:10.1055/s-2006-962797. PMID 17269092.
- ^ Wink M, Hartmann T (May 1979). "Cadaverine--pyruvate transamination: the principal step of enzymatic quinolizidine alkaloid biosynthesis in Lupinus polyphyllus cell suspension cultures". FEBS Letters. 101 (2): 343–6. doi:10.1016/0014-5793(79)81040-6. PMID 446758.
- ^ a b Perrey R, Wink M (1988). "On the Role of Δ1-Piperideine and Tripiperideine in the Biosynthesis of Quinolizidine Alkaloids". Z. Naturforsch. 43 (5–6): 363–369. doi:10.1515/znc-1988-5-607. S2CID 43219650.
- ^ a b Atta-ur-Rahman (Ed.) (1995). Natural Products Chemistry. Vol. 15. Elsevier. p. 537. ISBN 978-0-444-42691-8.
- ^ a b Roberts M, Wink M, eds. (1998). Alkaloids: Biochemistry, Ecology, and Medicinal Applications. Plenum Press. pp. 112–114.
- ^ Wink M, Hartmann T (1980). "Enzymatic Synthesis of Quinolizidine Alkaloids in Lupin Chloroplasts". Z. Naturforsch. 35 (1–2): 93–97. doi:10.1515/znc-1980-1-218. S2CID 43624858.
외부 링크
 위키미디어 커먼스의 스파르타인 관련 미디어
위키미디어 커먼스의 스파르타인 관련 미디어