티오에스테르
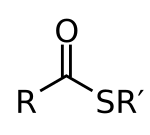
Thioester화학에서 티오에스터는 관능기 R-S-CO-R'을 가진 화합물이다.이들은 티오에스테르 내 황이 카르본산에스테르 내 산소 결합 역할을 하는 카르본산에스테르와 유사하다.그들은 카르본산과 티올 사이의 에스테르화의 산물이다.생화학에서 가장 잘 알려진 티오에스터는 예를 들어 아세틸-CoA와 같은 조효소 A의 [1]유도체이다.
합성
티오에스테르로 가는 가장 일반적인 경로는 산염화물과 티올의 [1]알칼리 금속염의 반응을 포함한다.
- RSNA + RCOCl → RCOSR + NaCl
또 다른 일반적인 경로는 티오카르본산의 알칼리 금속염에 의한 할로겐화물의 치환을 수반한다.예를 들어 티오아세트산 에스테르는 일반적으로 티오아세트산 [1]칼륨의 알킬화에 의해 제조된다.
- CHCOSK3 + RX → CHCOSR3 + KX
아세트산염의 유사한 알킬화는 거의 시행되지 않는다.알킬화는 만니히 염기와 티오카르본산을 사용하여 수행할 수 있다.
- CHOSH3 + 2RCHOH2 → CHCOSCHNR32 2+ HO2
티오에스터는 탈수제가 [2][3]있는 상태에서 티올과 카르본산을 응축하여 제조할 수 있습니다.
- RSH + R'COH2 → RSC(O)R' + HO2
대표적인 탈수제는 DCC입니다.[4]티오에스테르 합성의 지속 가능성을 개선하기 위한 노력도 보다 안전한 결합 시약 T3P와 녹색 용매 시클로펜타논을 [5]사용하여 보고되었다.산성 무수물 및 일부 락톤은 염기가 있는 상태에서 티올을 사용하여 티오에스테르를 투여한다.
티오아세트산을 [6]사용하여 미츠노부 반응으로 알코올로부터 티오에스테르를 쉽게 제조할 수 있다.
또한 티올의 [7]존재 하에서 알킨과 알케인의 카르보닐화를 통해 발생한다.
반응
티오에스테르는 티올과 카르본산으로 가수분해된다.
- RC(O)SR' + HO2 → RCOH2 + RSH
티오에스터의 카르보닐 중심은 아민 핵친화체에 대해 더 반응하여 아미드를 생성한다.
관련 반응이지만 티오에스테르를 포획하기 위해 연질 금속을 사용하여 티오에스테르로 [8]변환된다.티오에스터는 생체분자의 [9]합성에 유용한 화학선택성을 제공한다.
티오에스테르 특유의 반응은 후쿠야마 커플링으로 티오에스테르를 팔라듐 촉매에 의해 유기 할로겐화물과 결합하여 케톤을 얻는다.
생화학
티오에스터는 스테로이드 전구물질인 지방산과 메발론산염의 생성 및 분해를 포함한 많은 생합성 반응에서 일반적인 중간체이다.예를 들어 말로닐-CoA, 아세토아세틸-CoA, 프로피오닐-CoA, 시나모일-CoA 및 아실 캐리어 단백질(ACP) 티오에스테르가 있다.아세트 형성은 아세틸-CoA의 형성을 통해 진행된다.지구 육지 바이오매스의 많은 부분을 구성하는 리그닌의 생합성은 카페산의 [10]티오에스테르 유도체를 통해 진행됩니다.이들 티오에스터는 합성적으로 제조된 것과 유사하게 발생하며, 그 차이는 탈수제가 ATP라는 것이다.게다가, 티오에스터는 단백질의 분해에 태그를 붙이는 유비퀴틴에 의한 단백질 태그 부착에 중요한 역할을 한다.
티오에스테르(티오락톤) 중 황 원자의 산화는 항혈전성 프로드루그스 티클로피딘, 클로피도그렐 [11][12]및 프라수그렐의 생체활성화에 가정된다.
티오에스터와 생명의 기원
"티오에스터 세계"에 위치하는 것처럼, 티오에스터는 [13]삶의 전조일 수 있다.Christian de Duve는 다음과 같이 설명합니다.
티오에스테르가 ATP가 사용되거나 재생되는 몇 가지 주요 과정에서 필수 중간체라는 것이 밝혀졌습니다.티오에스터는 복합지질에서 발견되는 모든 에스테르 합성에 관여한다.그들은 또한 펩타이드, 지방산, 스테롤, 테르펜, 포르피린 등을 포함한 많은 다른 세포 성분들의 합성에 참여합니다.또한 티오에스터는 ATP의 조립을 초래하는 몇몇 특히 오래된 과정에서 주요 중간체로 형성된다.두 경우 모두 티오에스터는 에너지를 사용하거나 생산하는 과정에 ATP보다 더 가깝습니다.다시 말해, 티오에스터들은 처음에는 ATP가 없는 "티오에스터 세계"에서 실제로 ATP의 역할을 할 수 있었다.결국, [이들] 티오에스터는 인산염 그룹 간의 결합 형성을 지원하는 능력을 통해 ATP를 유도하는 역할을 할 수 있었다.
그러나 티오에스테르 가수 분해의 높은 자유 에너지 변화와 그에 따른 낮은 평형 상수로 인해, 이러한 화합물이 특히 열수 환기구 [14]조건에서 유의한 범위까지 축적되었을 가능성은 낮다.
티오노에스터

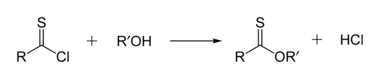
티오노에스터는 티오에스터와 이성체이다.티오노에스테르에서는 에스테르 내의 카르보닐산소를 황이 대체한다.티오노벤조산메틸은 CHC65(S)OCH이다3.이러한 화합물은 일반적으로 염화티오아실과 [15]알코올의 반응에 의해 제조됩니다.
또한 로손 시약을 에스테르와 반응시키거나 피너 소금을 황화수소로 처리하여 만들 수 있습니다.또는 염기촉매조건 [16]하에서 알코올에 의해 기존 메틸티오노에스테르를 트랜스에스테르화함으로써 다양한 티오노에스테르를 제조할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c Matthys J. Janssen은 PATAI의 기능기 화학: Carboxylic Acids and Esters, Saul Patai, Ed의 Carboxylic Acids and Esters에서 "카르본산과 에스테르"를 발표했습니다.존 와일리, 1969년 뉴욕: 페이지 705-764 doi: 10.1002/9780470771099.ch15
- ^ Fujiwara, S.; Kambe, N. (2005). "Thio-, Seleno-, and Telluro-Carboxylic Acid Esters". Topics in Current Chemistry. Vol. 251. Berlin / Heidelberg: Springer. pp. 87–140. doi:10.1007/b101007. ISBN 978-3-540-23012-0.
- ^ "Synthesis of thioesters". Organic Chemistry Portal.
- ^ Mori, Y.; Seki, M. (2007). "Synthesis of Multifunctionalized Ketones Through the Fukuyama Coupling Reaction Catalyzed by Pearlman's Catalyst: Preparation of Ethyl 6-oxotridecanoate". Organic Syntheses. 84: 285.; Collective Volume, vol. 11, p. 281
- ^ Jordan, Andrew; Sneddon, Helen F. (2019). "Development of a solvent-reagent selection guide for the formation of thioesters". Green Chemistry. 21 (8): 1900–1906. doi:10.1039/C9GC00355J. S2CID 107391323.
- ^ Volante, R. (1981). "A new, highly efficient method for the conversion of alcohols to thiolesters and thiols". Tetrahedron Letters. 22 (33): 3119–3122. doi:10.1016/S0040-4039(01)81842-6.
- ^ Bertleff, W.; Roeper, M.; Sava, X. "Carbonylation". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a05_217.pub2.
- ^ Wan Kit Chan; S. Masamune; Gary O. Spessard (1983). "Preparation Of O-esters From The Corresponding Thiol Esters: Tert-butyl Cyclohexanecarboxylate". Organic Syntheses. 61: 48. doi:10.15227/orgsyn.061.0048.
- ^ McGrath, N. A.; Raines, R. T. (2011). "Chemoselectivity in chemical biology: Acyl transfer reactions with sulfur and selenium". Acc. Chem. Res. 44 (9): 752–761. doi:10.1021/ar200081s. PMC 3242736. PMID 21639109.
- ^ Lehninger, A. L.; Nelson, D. L.; Cox, M. M. (2000). Principles of Biochemistry (3rd ed.). New York: Worth Publishing. ISBN 1-57259-153-6.
- ^ Mansuy, D.; Dansette, P. M. (2011). "Sulfenic acids as reactive intermediates in xenobiotic metabolism". Archives of Biochemistry and Biophysics. 507 (1): 174–185. doi:10.1016/j.abb.2010.09.015. PMID 20869346.
- ^ Dansette, P. M.; Rosi, J.; Debernardi, J.; Bertho, G.; Mansuy, D. (2012). "Metabolic Activation of Prasugrel: Nature of the Two Competitive Pathways Resulting in the Opening of Its Thiophene Ring". Chemical Research in Toxicology. 25 (5): 1058–1065. doi:10.1021/tx3000279. PMID 22482514.
- ^ de Duve, C. (1995). "The Beginnings of Life on Earth". American Scientist. 83 (5): 428–437. Bibcode:1995AmSci..83..428M.
- ^ Chandru, Kuhan; Gilbert, Alexis; Butch, Christopher; Aono, Masashi; Cleaves, Henderson James II (21 July 2016). "The Abiotic Chemistry of Thiolated Acetate Derivatives and the Origin of Life". Scientific Reports. 6 (29883): 29883. Bibcode:2016NatSR...629883C. doi:10.1038/srep29883. PMC 4956751. PMID 27443234.
- ^ Cremlyn, R. J. (1996). An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons. ISBN 0-471-95512-4.
- ^ Newton, Josiah J.; Britton, Robert; Friesen, Chadron M. (4 October 2018). "Base-Catalyzed Transesterification of Thionoesters". The Journal of Organic Chemistry. 83 (20): 12784–12792. doi:10.1021/acs.joc.8b02260. PMID 30235418. S2CID 52309850.