2-이미다졸린
2-Imidazoline | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 4,5-디하이드로-1H-이미다졸 | |
| 체계적 IUPAC 이름 1,3-디아자시클롭텐트-2-ene | |
| 기타 이름 2-이미다졸린 4,5-디하이드로1,3-디아졸 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.007.273 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C3H6N2 | |
| 어금질량 | 70.095 g·190−1 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
2-아이미다졸린(선호 IUPAC 이름: 4,5-디하이드로-1H-이미다졸)은 질소를 함유한 이질체 이미다졸린의 3개 이질체 중 하나이며, CHN362 공식이다. 2-이미다졸린은 상업적으로 가장 흔한 이미다졸린으로, 반지는 일부 천연물과 일부 의약품에 존재한다. 또한 유기합성, 조정화학, 균질 촉매의 맥락에서 검토되었다.[1]
합성
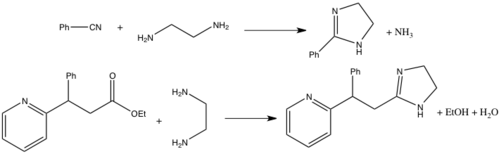
이미다졸린 합성을 위한 다양한 경로가 존재하며,[1][2] 가장 일반적인 방법은 질소나 에스테르와 1,2-다이아민(예: 에틸렌디아민)의 응축과 관련된다. 질소 기반 경로는 본질적으로 주기적인 피너 반응이다; 그것은 높은 온도와 산성 촉매제가 필요하며 알킬과 아릴 질산 둘 다에 효과적이다.
생물학적 역할
많은 이미다졸린들이 생물학적으로 활발하다.[3] 대부분의 생체 활성 유도체들은 질소 센터들 사이의 탄소에 대체물(아릴 또는 알킬 그룹)을 포함하고 있다. 일반적인 이름으로는 옥시메타졸린, 실로메타졸린, 테트라하이드로졸린, 나파졸린 등이 있다.
천연제품의 이미다졸린
이미다졸린은 다양한 천연물에서 발견되었다. 천연 분자 탑센틴 D와 스펀지 B는 여러 해양 스펀지에서 발견되었다. 이 대사물들은 항균, 항바이러스, 항염증 활동과 같은 강력한 특성 때문에 상당한 관심을 받아왔다.[4]
제약 응용 프로그램
2-imidazolines는 항혈당, 항혈증, 항고혈압, 항고혈압, 항우울제 시약으로 조사되었다.[1][5] 이미다졸린 함유 약 클로니딘은 단독으로 사용되거나 고혈압 치료를 위한 다른 약물과 함께 사용된다. 난임, 고혈압 위기, 투렛 증후군, 주의력 결핍 과잉행동 장애(ADHD) 등의 치료에도 쓰인다.[6]
- 2-이미다졸린
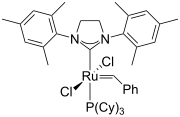
2세대 그루브스의 촉매
적용들
균질 카탈루션
2-옥사졸린의 구조적 아날로그로서 2-이미다졸린은 조정화학에서 리간드로 개발되었다. 이미다졸린 링의 질소 원자 대체물은 전자적 특성과 스테릭적 특성을 미세 조정할 수 있는 기회를 제공한다. 일부 단지는 스즈키-미야우라 커플링, 미조로키-의 촉매역할을 한다.헤크 리액션, 디엘-알데르 리액션, 비대칭 아군 대체, [3,3][1] 시그마티방성 재배열, 헨리 리액션 등
계면활성제
로루암푸아세테이트 나트륨과 같이 2-이미다졸린을 중심으로 한 계면활성제는 개인 케어 제품에 사용되며, 비이성성이 특히 중요하다(예: 유아용품, "눈물" 샴푸 등).[7]
이미다졸레스의 전도체로서의 이미다졸린스
이미다졸은 이미다졸린의 탈수로부터 준비될 수 있다.[8]
참고 항목
참조
- ^ a b c d Liu, H.; Du, D.-M. (2009). "Recent Advances in the Synthesis of 2-Imidazolines and Their Applications in Homogeneous Catalysis". Adv. Synth. Catal. 351: 489–519. doi:10.1002/adsc.200800797.
- ^ David Crouch, R. (March 2009). "Synthetic routes toward 2-substituted 2-imidazolines". Tetrahedron. 65 (12): 2387–2397. doi:10.1016/j.tet.2008.12.022.
- ^ N. MacInnes and S. Duty (2004). "Locomotor effects of imidazoline I2-site-specific ligands and monoamine oxidase inhibitors in rats with a unilateral 6-hydroxydopamine lesion of the nigrostriatal pathway". Br J Pharmacol. 143 (8): 952–959. doi:10.1038/sj.bjp.0706019. PMC 1575965. PMID 15545290.
- ^ Guinchard, X.; Valle; Denis, J. N. (2007). "Total Synthesis of Marine Sponge Bis(indole) Alkaloids of the Topsentin Class". J. Org. Chem. 72 (10): 3972–3975. doi:10.1021/jo070286r.
- ^ Dardonville, C.; Rozas, I. (2004). "Imidazoline binding sites and their ligands: An overview of the different chemical structures". Med. Res. Rev. 24: 639–661. doi:10.1002/med.20007.
- ^ "Clonidine", Pubmed Health, https://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0000623/
- ^ Tyagi, R.; Tyagi, V. K.; Pandey, S. K. (2007). "Imidazoline and its derivatives: an overview". J. Oleo Sci. 56: 211–222. doi:10.5650/jos.56.211.
- ^ Ishihara, M.; Togo, H. (2006). "An Efficient Preparation of 2-Imidazolines and Imidazoles from Aldehydes with Molecular Iodine and (Diacetoxyiodo)benzene". Synlett: 227–230. doi:10.1055/s-2005-923604.