심박출량
Cardiac output

심장 생리학에서, 심박출량(카이 트리아 오닐), 또한 심장 출력으로 간혹 이 심볼 Q{Q\displaystyle}, Q˙{\displaystyle{\dot{Q}}에 의해}표시 또는 Q˙ c{\displaystyle{\dot{Q}}_{c}하는 심장의 펌프 생산량의},[2]은 체적 유량:피의 양을 둘 다에 의하여 임신한 존재 알려져 있다. ven단위 시간당(보통 분당 측정) 심장의 삼륜.심박출량(CO)은 심장박동수(HR), 즉 분당 심장박동수(bpm)와 심장박동수(SV)의 산물이며, 따라서 다음과 같은 공식이 제공됩니다.
심박출량 값은 일반적으로 L/min으로 표시됩니다.체중이 70kg인 건강한 사람의 경우, 정지 상태의 심박출량은 평균 약 5L/min이며, 심박수가 70회라고 가정하면 뇌졸중 부피는 약 70mL가 될 것이다.
심박출량은 신체의 다양한 부분에 전달되는 혈액의 양과 관련이 있기 때문에, 심박출량은 심장이 적절한 조직 관류 유지에 대한 신체의 요구를 얼마나 효율적으로 충족시킬 수 있는지에 대한 중요한 구성요소이다.신체 조직은 대동맥과 동맥을 통해 심장의 좌심실에서 적절한 압력으로 산소화된 혈액을 체계적으로 순환시킴으로써 조직으로 산소를 지속적으로 운반해야 하는 지속적인 산소 공급을 필요로 한다.산소 공급(DO mL/min)은2 혈류(심장 출력 CO)에 혈중 산소 농도(CaO2)를 곱한 결과입니다.산술적으로 산소 공급 = 심박출량 × 동맥 산소 함량은 다음과 같이 계산되며, 공식은 다음과 같습니다.
안정 심박출량이 5L/min일 때 '정상' 산소 공급량은 약 1L/min입니다.신진대사를 통한 분당 순환 산소 소비량(VO)의2 양/비율은 활성 수준에 따라 다르지만, 정지 상태에서는 DO의2 약 25%입니다.육체적 운동은 근육 활동을 증가시키기 위해 휴식 수준보다 더 많은 산소 소비량을 필요로 한다.심부전의 경우, 실제 CO는 일상생활의 단순한 활동조차 지원하기에 충분하지 않을 수 있으며, 적당한 운동으로 인한 높은 신진대사 수요를 충족시키기에 충분히 증가할 수도 없다.
심박출량은 혈류역학에서 관심 있는 글로벌 혈류 파라미터로, 혈액의 흐름을 연구합니다.뇌졸중 볼륨과 심박수에 영향을 미치는 요인은 심박출량에도 영향을 미칩니다.오른쪽 여백의 그림은 이러한 종속성을 나타내며 이러한 요인 중 일부를 나열합니다.상세한 계층 그림은 다음 그림에 제시되어 있다.
CO를 측정하는 방법에는 비침습적 또는 비침습적으로 많은 방법이 있습니다.각 방법에는 다음과 같은 장점과 단점이 있습니다.
정의.
심장의 기능은 혈액을 순환계를 통해 산소, 영양소, 화학물질을 신체 세포로 전달하고 세포 노폐물을 제거하는 것이다.정맥 시스템에서 어떤 혈액이 다시 유입되든 간에 심장으로 돌아오는 혈액의 양은 심장에서 배출되는 혈액의 양을 효과적으로 결정합니다. 즉, 심박출량, Q. 심박출량은 일반적으로 뇌졸중 용량(SV) 및 심박수(HR)와 함께 일반적으로 정의됩니다.[citation needed]
-
(1)
피험자의 신체 크기와 무관하게 정상 범위 내에 있는 것으로 간주되는 CO 값을 표준화할 때, 허용되는 관례는 체표 면적(BSA)을 사용하여 방정식 (1)을 추가로 지수화하여 심장 지수(CI)를 생성하는 것이다.이것은 아래 식 (2)에 자세히 설명되어 있습니다.
측정.
심박출량을 측정하는 임상적 방법은 직접 심장내 카테터 삽입부터 동맥 맥박의 비침습적 측정까지 다양합니다.각 방법에는 장점과 단점이 있습니다.상대적인 비교는 널리 받아들여지는 "금본위제" 측정치가 없기 때문에 제한된다.심박출량은 호흡 단계에 의해 크게 영향을 받을 수 있습니다. 즉, 흉부 내 압력 변화는 확장기 충전에 영향을 미치므로 심박출량에 영향을 미칩니다.이는 단일 호흡 주기 [citation needed]동안 심박출량이 최대 50%까지 변동될 수 있는 기계적 인공호흡 중에 특히 중요합니다.따라서 심박출량은 단일 사이클에 걸쳐 균일한 간격으로 측정하거나 [citation needed]여러 사이클에 걸쳐 평균을 구해야 합니다.
침습적 방법은 잘 받아들여지고 있지만, 이 방법들이 정확하지도 않고 치료 안내에 효과적이지 않다는 증거가 증가하고 있다.그 결과, 비침습적 방법의 개발에 초점을 맞추고 있다.[5][6][7]
도플러 초음파
이 방법은 초음파 및 도플러 효과를 사용하여 심박출량을 측정합니다.심장을 통과하는 혈속은 돌아오는 초음파의 주파수에 도플러 변화를 일으킨다.그런 다음 이 이동을 사용하여 다음 [citation needed]방정식을 사용하여 유속과 체적, 효과적인 심장 출력을 계산할 수 있습니다.
여기서:
- CSA는 밸브 오리피스 단면적이다.
- r은 밸브 반지름이고,
- VTI는 도플러 플로우프로파일의 배선의 속도시간 적분입니다.
비침습적이고 정확하며 저렴한 도플러 초음파는 임상 초음파의 일상적인 부분으로 높은 수준의 신뢰성과 재현성을 가지고 있으며 1960년대부터 [citation needed]임상적으로 사용되어 왔다.
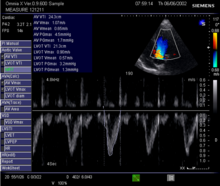
심장 초음파
심장 초음파 검사는 초음파를 사용하여 심박출량을 측정하는 비침습적 방법입니다.심박출량을 계산하기 위해 2차원(2D) 초음파와 도플러 측정이 함께 사용됩니다.대동맥환의 직경(d)의 2차원 측정으로 흐름 단면적(CSA)을 계산할 수 있으며, CSA에 대동맥 판막을 가로지르는 도플러 흐름 프로파일의 VTI를 곱하여 박동당 흐름량을 결정합니다.로크 볼륨, SV).그런 다음 결과에 심박수(HR)를 곱하여 심박출량을 구합니다.임상 의학에 사용되기는 하지만, 테스트와 재시험의 [8]다양성이 크다.광범위한 훈련과 기술이 필요한 것으로 알려져 있지만 임상적으로 적절한 정밀도를 달성하기 위해 필요한 정확한 단계는 공개되지 않았습니다. 대동맥 판막 직경의 2D 측정은 소음의 한 원천이며, 다른 것은 박자에 따른 뇌졸중 부피의 변화와 프로브 위치의 미묘한 차이입니다.반드시 더 재현할 수 있는 대안은 폐 밸브를 측정하여 우측 CO를 계산하는 것입니다.일반적으로 널리 사용되고 있지만, 이 기술은 시간이 많이 걸리고 구성요소 요소의 재현성에 의해 제한됩니다.SV와 CO의 정밀도는 임상 실무에서 사용하는 방법으로 ±20%[citation needed]이다.
경피적
초음파 심박출량 모니터(USCOM)는 연속파 도플러를 사용하여 도플러 흐름 프로파일 VTI를 측정합니다.인체측정학을 사용하여 대동맥 및 폐 판막 직경과 CSA를 계산하여 우측 및 좌측 Q 측정을 가능하게 합니다.심초음파법에 비해 USCOM은 재현성을 크게 향상시켜 흐름의 변화 검출의 감도를 높인다.도플러 플로우 프로파일의 실시간 자동 트레이스를 통해 비트 투 비트 오른쪽 및 왼쪽 Q 측정이 가능하므로 기존의 심장 초음파 촬영에 비해 조작이 간편해지고 획득 시간이 단축됩니다.USCOM은 신생아,[10] 어린이[11] 및 [12]성인에 대해 0.12L/min에서 18.7L[9]/min까지 검증되었습니다.이 방법은 생리적으로 합리적인 혈류역학 프로토콜의 개발을 위해 모든 연령의 환자에게 동일한 정확도로 적용될 수 있다.USCOM은 삽입식 흐름 [13]프로브와 동등한 정확도를 달성한 유일한 심장 출력 측정 방법입니다.이 정확도는 패혈증, 심부전, [14][15][16]고혈압을 포함한 조건에서 높은 수준의 임상 사용을 보장했습니다.
식도관측
식도관측 도플러에는 주로 진단 목적으로 사용되는 식도관측 에코그램과 심박출량 임상 모니터링에 주로 사용되는 식도관측기의 두 가지 주요 기술이 포함되어 있다.후자는 연속파 도플러를 사용하여 하강하는 흉부 대동맥의 혈속을 측정합니다.초음파 탐침은 식도 중턱까지 식도 내에 구강 또는 비강으로 삽입되며, 식도 중턱에서 식도 하행 흉부 대동맥과 나란히 놓인다.변환기가 혈류에 가깝기 때문에 신호가 깨끗합니다.최적의 신호를 보장하기 위해 프로브를 다시 포커싱해야 할 수 있습니다.이 방법은 유효성이 우수하며, 수술 중 환자 [17][18][19][20][21][22][23][24]결과 개선을 위한 증거와 함께 유체 관리에 널리 사용되며, 영국 국립 보건 및 임상 우수 연구소(NICE)[25]에서 권장하고 있습니다.식도파 모니터링은 참 Q가 아닌 혈액의 속도를 측정하므로 환자의 나이, 키 및 체중에 기초한 노모그램에[26] 의존하여 측정된 속도를 뇌졸중 부피와 심박출량으로 변환한다.이 방법은 일반적으로 환자 진정제를 필요로 하며 성인 및 [citation needed]어린이 모두에 사용할 수 있습니다.
펄스 압력법
펄스 압력(PP) 방법은 시간 경과에 따른 동맥의 압력을 측정하여 파형을 도출하고 이 정보를 사용하여 심장 성능을 계산합니다.그러나 동맥으로부터의 측정에는 예를 들어 준수 및 임피던스 등 동맥 기능의 변화와 관련된 압력 변화가 포함됩니다.혈관 직경의 생리학적 또는 치료적 변화는 Q의 변화를 반영하는 것으로 가정한다. PP 방법은 심장과 혈관의 결합 성능을 측정하므로 Q의 측정에 대한 적용이 제한된다.이는 다른 Q 측정 방법으로 간헐적으로 파형을 교정한 다음 PP 파형을 모니터링하여 부분적으로 보정할 수 있습니다.PP 파형은 비트 대 비트 단위로 보정하는 것이 이상적입니다.PP를 [citation needed]측정하는 방법에는 침습적 방법과 비침습적 방법이 있습니다.
피나프레스의 방법론
1967년 체코의 생리학자 얀 페차즈는 연속 혈압을 측정하는 부피 클램프 방법을 발명하고 특허를 취득했다.볼륨 클램프 방법의 원리는 동맥 벽의 양쪽에서 동적으로 동일한 압력을 제공하는 것입니다.동맥을 특정 볼륨으로 클램핑하여 내부 압력(동맥 내 압력)이 외부 압력(손가락 측정띠 압력)의 균형을 이룹니다.페냐즈는 이 볼륨 클램프 방법을 적용하기에 손가락이 최적의 부위라고 판단했습니다.패혈증 환자나 혈관압박기 [citation needed]환자 등 혈관수축이 없는 환자에서는 손가락 측정띠를 사용할 수 없습니다.
1978년 암스테르담 대학의 네덜란드 응용 과학 연구 기구의 연구 단위인 BMI-TNO의 과학자들은 볼륨 클램프를 임상 실습에서 작동시키는 일련의 추가 핵심 요소를 발명하고 특허를 취득했습니다.이러한 방법에는 센서 내부의 광학 시스템에서 변조된 적외선 사용, 벨크로 고정 기능이 있는 가볍고 감기가 쉬운 핑거 커프, 새로운 공압 비례 제어 밸브 원리, 핑거 동맥을 클램프할 정확한 볼륨 결정 및 추적을 위한 설정점 전략이 포함됩니다.물리학적 시스템tem. 손가락 동맥의 생리학적 보정의 약자인 이 Physocal Tracker는 정확하고 견고하며 신뢰할 [citation needed]수 있는 것으로 밝혀졌다.
Finapres 방법론은 이 정보를 사용하여 손가락 측정띠 압력 데이터에서 동맥 압력을 계산하기 위해 개발되었습니다.환자의 손가락 부위와 상완 부위 사이의 압력 수준 차이를 보정하기 위한 일반화 알고리즘이 개발되었다.이 보정은 일반적인 생리학적 원리를 적용했기 때문에, 심지어 이 보정을 위해 설계되지 않은 경우에도, 모든 상황에서 효과가 있었다.BMI-TNO가 [citation needed]2000년 시장에 선보인 피나프레스의 후속 모델인 피나프레스에 이 혁신적인 상압 파형 재구축 방식이 처음 구현됐다.
연속적인 고충실도 보정된 혈압 파형의 가용성은 두 가지 개념을 기반으로 통합 혈액역학의 비트 투 비트 계산의 관점을 열었다. 압력과 흐름은 동맥 시스템의 각 부위에서 소위 특징적인 임피던스에 의해 상호 관련된다.근위부 대동맥 부위에서 이 임피던스의 3요소 Windkesel 모델은 알려진 연령, 성별, 키 및 체중을 가진 개별 환자에서 충분한 정확도로 모델링할 수 있습니다.비침습성 말초 혈관 모니터의 비교에 따르면 정상 순환과 불변 [27]순환을 가진 환자에 대해 약간의 임상 효용이 제한된다.
침습적
침습 PP 모니터링에는 압력계 센서를 동맥(일반적으로 방사형 또는 대퇴골 동맥)에 삽입하고 PP 파형을 지속적으로 측정하는 작업이 포함됩니다.일반적으로 카테터를 디스플레이가 있는 신호 처리 장치에 연결하면 됩니다.그런 다음 PP 파형을 분석하여 심혈관 성능 측정을 제공할 수 있습니다.혈관 기능, 카테터 팁 위치 또는 압력 파형 신호의 감쇠가 변경되면 판독치의 정확도에 영향을 미칩니다.침습성 PP 측정은 보정하거나 [citation needed]보정하지 않을 수 있습니다.
보정 완료 PP – PiCCO, LiDCO
PiCCO (PULSION Medical Systems AG, 독일 뮌헨) 및 PulseCO(LiDCO Ltd, 영국 런던)는 동맥 PP 파형을 분석하여 연속 Q를 생성합니다.두 경우 모두 동맥 PP 분석에서는 혈관 바닥의 컴플라이언스 변화와 같은 측정되지 않은 변수를 설명할 수 없기 때문에 연속 Q 분석의 보정을 제공하기 위해 독립적인 기법이 필요합니다.환자 위치, 치료법 또는 [citation needed]상태가 변경된 후에는 재보정을 권장합니다.
PiCCO에서는 Stewart-Hamilton 원리를 사용하지만 중심 정맥 라인에서 중심 동맥 라인, 즉 대퇴골 또는 겨드랑이 동맥 라인까지의 온도 변화를 측정하는 경폐 열희석을 교정 기술로 사용한다.냉염수 열희석으로부터 도출된 Q 값은 동맥 PP 윤곽을 보정하는 데 사용되며, 연속적인 Q 모니터링을 제공할 수 있습니다.PiCCO 알고리즘은 혈압 파형 형태학(PP 파형의 수학적 분석)에 의존하며, Weseling과 [28]동료가 설명한 대로 연속 Q를 계산합니다.전폐 열희석은 오른쪽 심장, 폐 순환 및 왼쪽 심장에 걸쳐 열희석 곡선을 수학적으로 분석하여 심장 충전량(),GEDV 흉강 내 혈액량 및 혈관 외 폐수를 측정할 수 있습니다.경폐 열희석은 침습성이 낮은 Q 보정을 가능하게 하지만 PA 열희석보다 정확도가 떨어지고 감염 위험이 [citation needed]동반된 중앙 정맥 및 동맥 라인이 필요합니다.
LiDCO에서 독립 교정 기술은 Stewart-Hamilton 원리를 이용한 염화 리튬 희석입니다.염화리튬 희석법은 말초정맥과 말초동맥선을 사용한다.PiCCO와 마찬가지로 [29]Q에 변화가 있는 경우 잦은 교정이 권장된다. 교정 이벤트는 염화 리튬 주입을 수반하며 특정 근육 이완제가 있을 경우 오류가 발생할 수 있기 때문에 빈도가 제한된다.LiDCO에서 사용하는 PulseCO 알고리즘은 펄스 전력 유도를 기반으로 하며 파형 [citation needed]형태에 의존하지 않습니다.
동맥압 통계 분석 – FloTrac/Vigileo
FloTrac/Vigileo(Edwards Lifesciences)는 펄스 등고선 분석을 기반으로 하는 보정되지 않은 혈류역학 모니터이다.대퇴동맥 또는 요골동맥에 위치한 압력계가 있는 표준 동맥 카테터를 사용하여 심박출량(Q)을 추정합니다.장치는 고정밀 압력 변환기로 구성되어 있으며, 이 변환기는 지지 모니터(Vigileo 또는 EV1000 모니터)와 함께 사용할 경우 동맥 맥동 샘플에서 왼쪽 심장 출력(Q)을 도출합니다.이 장치는 심장의 프랭크-스타링 법칙에 기초한 알고리즘을 사용합니다. 이 법칙은 펄스 압력(PP)이 스트로크 볼륨(SV)에 비례한다는 것입니다.알고리즘은 20초 동안 샘플링된 동맥압(AP) 파형의 표준 편차와 혈관 톤 계수(Khi 또는 δ)의 곱을 계산하여 스트로크 볼륨을 생성합니다. V t ( A ) k { SV = \ { ) \ \ 또는 P ( ) ( \ BP \ k\ )는 동맥을 반영하도록 설계되어 있습니다선취특권과 혈관 저항성입니다.Khi는 컴플라이언스 또는 저항의 변화가 동맥압 파형의 모양에 영향을 미친다는 원리에 따라 동맥압 파형의 형태학적 변화를 비트 단위로 분석하여 이를 수행합니다.상기 파형의 형상을 해석함으로써 혈관 톤의 영향을 평가하고 식 (1)을 이용하여 SV.Q의 계산을 가능하게 한다.동맥 파형을 생성하는 관류 비트만 [citation needed]HR로 카운트됩니다.
이 시스템은 정확도가 가변적인 기존 동맥 카테터를 사용하여 Q를 추정합니다.이러한 동맥 모니터에는 폐동맥 카테터의 심장내 카테터 삽입이 필요하지 않습니다.동맥선이 필요하므로 침습성이 있습니다.다른 동맥 파형 시스템과 마찬가지로 설정 및 데이터 수집 시간이 짧다는 것이 이 기술의 장점입니다.단점은 우측 심장압이나 혼합 정맥 산소 [30][31]포화도에 관한 데이터를 제공할 수 없다는 것이다.볼륨 응답을 예측하는 스트로크 볼륨 변동(SVV) 측정은 모든 동맥 파형 기술에 고유합니다.고위험 수술 환자 또는 위독한 환자의 유체 최적화를 관리하는 데 사용됩니다.데이터 쌍 SV와 SVV를 통합하는 혈류역학 원리에 기초한 생리학적 최적화 프로그램이 발표되었다.[32]
동맥 모니터링 시스템은 혈관 톤의 변화를 예측할 수 없습니다. 혈관 준수의 변화를 추정합니다.심장의 흐름을 계산하기 위한 동맥의 압력 측정은 생리적으로 불합리하고 정확도가 [33]의심스러우며 입증되지 않은 유익성을 [34]가집니다.동맥압 모니터링은 환기가 안 되는 환자, 심방세동 환자, 혈관압박기 환자 및 패혈증 [29]환자 등 동적 자율 시스템을 가진 환자에서 제한됩니다.
보정되지 않은 사전 추정 인구통계 데이터 프리– PRAM
PRAM(Pressure Recording Analytical Method)은 동맥 카테터(방사선 또는 대퇴골 액세스)에서 얻은 압력파 프로파일의 분석으로부터 Q를 추정합니다.그런 다음 이 PP 파형을 사용하여 Q를 결정할 수 있습니다.파형은 1000Hz에서 샘플링되므로 검출된 압력곡선을 측정하여 실제 비트 대 비트 스트로크 볼륨을 계산할 수 있습니다.FloTrac과 달리, 외부 보정의 일정한 임피던스 값이나 사전 추정된 생체 내 또는 체외 데이터를 형성할 필요가 없다.
PRAM은 안정된 상태와[35] 다양한 혈류역학 [36]상태에서 고려된 금 표준 방법에 대해 검증되었다.소아 및 기계적으로 지원되는 [37][38]환자를 모니터링하는 데 사용할 수 있습니다.
일반적으로 모니터링되는 혈류역학 값, 유체 반응성 매개변수 및 배타적 기준은 PRAM: Cardiac Cycle Efficiency(CCE)에 의해 제공됩니다.1(최상) ~ -1(최하) 범위의 순수 수치로 표현되며 전체 심장-혈관 반응 커플링을 나타냅니다.CCE "스트레스 지수"로 표현되는 심장 성능과 소비 에너지 사이의 비율은 환자의 현재 및 미래 [39]과정을 이해하는 데 가장 중요할 수 있다.
임피던스 심전도(ICG 또는 흉부 전기 생체 임피던스(TEB)로 약칭됨)는 심장 주기에 걸쳐 흉부 영역에 걸친 전기적 임피던스의 변화를 측정합니다.임피던스가 낮으면 흉강 내 체액량 및 혈류량이 더 많다는 것을 나타냅니다.유체 체적 변화를 심박수와 동기화함으로써 임피던스의 변화를 스트로크 체적, 심박출량 및 전신 혈관 [40]저항을 계산하는 데 사용할 수 있습니다.
침습적 접근법과 비침습적 접근법이 모두 사용됩니다.[41]비침습적 접근법의 신뢰성과 타당성은 어느 정도 [42][43][44][45]인정받았지만, 이 [46]점에 대해서는 완전한 합의가 이루어지지 않았습니다.다양한 질병의 진단, 예후 및 치료에서 이 접근법의 임상적 사용은 [47]계속된다.
비침습 ICG 장비에는 BoMed의 [50][51]Bio-Z [48]Dx, Niccomo [49]및 TEBCO 제품이 포함됩니다.
초음파 희석(UD)은 체온 정상 식염수(NS)를 체외 루프에 도입하는 지표로 사용하여 초음파 센서로 방실(AV) 순환을 생성하며, 이 순환은 희석 측정 후 자체 알고리즘을 사용하여 심박출량을 계산하는 데 사용됩니다.이 [citation needed]방법을 사용하여 총 확장 말단 부피(TEDV), 중앙혈액 부피(CBV) 및 활성순환 부피(ACVI)와 같은 많은 다른 혈류역학 변수를 계산할 수 있다.
UD 방식은 [52]1995년에 처음 도입되었습니다.ECMO[53][54] 및 혈액 [55][56]투석과 같은 체외 회로 조건에서 흐름과 부피를 측정하는 데 광범위하게 사용되었으며, 150개 이상의 동료 검토 출판물을 이끌었다.UD는 이제 COstatus 장치로 [57]중환자실(ICU)에 적용되었습니다.
UD 방법은 초음파 지표 [58]희석을 기반으로 합니다.혈중 초음파 속도(1560–1585m/s)는 혈장 및 적혈구 단백질의 총합과 온도의 함수이다.체온 정상 식염수(식염수 초음속 1533m/s)를 고유한 AV 루프에 주입하면 혈액 초음파 속도가 감소하고 희석 [citation needed]곡선이 생성된다.
UD는 ICU 환자의 기존 동맥 및 중앙 정맥 라인이 있는 고유한 AV 루프를 통해 체외 순환을 설정해야 합니다.식염수 표시기가 AV 루프에 주입되면 환자의 심장 우심방으로 들어가기 전에 루프의 정맥 클램프온 센서에 의해 감지됩니다.표시기가 심장과 폐를 가로지른 후 동맥 라인의 농도 곡선이 기록되고 COstatus HCM101 Monitor에 표시됩니다.심박출량은 Stewart-Hamilton 방정식을 사용하여 농도 곡선 영역에서 계산됩니다.UD는 비침습적 시술로, AV 루프에 연결하고 환자의 회선을 두 개만 연결하면 됩니다.UD는 소아 ICU 환자에 적용하기 위해 특수화되어 있으며 침습적이고 재현 [citation needed]가능하지만 비교적 안전한 것으로 입증되었습니다.
전기 심전도법은 임피던스 심전도와 유사한 비침습적 방법으로, 두 방법 모두 흉부 전기 생체 임피던스(TEB)를 측정합니다.기본 모델은 두 가지 방법 사이에서 다르다. 전기심장측정법은 적혈구 방향의 변화에서 TEB 박동수의 급격한 증가를 기인한다.심박출량 측정에 4개의 표준 심전도 전극이 필요합니다.Electrical Cardiotronic, Inc.의 상표로 광범위한 환자에게 유망한 결과를 보여줍니다.현재 미국에서는 성인, 어린이, 아기에게 사용이 승인되어 있습니다.전기 심전도 모니터는 혈류역학적으로 안정적이고 불안정한 [59]경우 수술 후 심장 수술 환자들에게 유망한 것으로 나타났다.
속도 부호화 위상 대비 자기공명영상([60]MRI)은 포유동물에서 대형 혈관의 흐름을 측정하는 가장 정확한 기술이다.MRI 유량 측정은 비커 [61]및 타이머를 사용한 측정과 비교하여 매우 정확하며 Fick[62] 원리 및 [63]열희석보다 변동성이 적은 것으로 나타났습니다.
속도 부호화 MRI는 양성자 세차운동의 위상 변화 검출에 기초한다.이러한 변화는 알려진 구배와 함께 자기장을 통과하는 양성자의 이동 속도에 비례합니다.속도 인코딩 MRI를 사용하면 심장 주기의 각 시점마다 하나씩 두 세트의 영상이 생성됩니다.하나는 해부학적 이미지이고 다른 하나는 각 픽셀의 신호 강도가 통과 평면 속도에 정비례하는 이미지입니다.혈관, 즉 대동맥 또는 폐동맥의 평균 속도는 혈관 단면에 있는 픽셀의 평균 신호 강도를 측정한 다음 알려진 상수를 곱하여 정량화됩니다.흐름은 평균 속도에 혈관의 단면적을 곱하여 계산됩니다.이 흐름 데이터는 흐름 대 시간 그래프에서 사용할 수 있습니다.한 심장 주기의 흐름 대 시간 곡선 아래에 있는 영역이 스트로크 볼륨입니다.심장 주기의 길이가 알려져 심박수를 결정합니다. Q는 방정식 (1)을 사용하여 계산할 수 있습니다.MRI는 일반적으로 한 심장 주기의 흐름을 여러 심장 박동의 평균으로 정량화하는 데 사용됩니다.박자에 [64]따라 실시간으로 스트로크 볼륨을 정량화할 수도 있습니다.
MRI는 Q를 정확하게 측정하기 위한 중요한 연구 도구이지만, 현재 응급 상황이나 집중 치료 환경에서 혈류역학적 모니터링에 임상적으로 사용되지 않는다.2015년 현재[update] MRI에 의한 심박출량 측정은 임상 심장 MRI [65]검사에 정기적으로 사용되고 있습니다.
염료 희석법은 인도시아닌 그린이라는 염료를 심장의 우심방에 신속하게 주입하여 이루어집니다.그 염료는 혈액과 함께 대동맥으로 흐른다.대동맥에 프로브를 삽입하여 염료가 클리어될 때까지 동일한 시간 간격[0, T]에서 심장에서 나오는 염료의 농도를 측정합니다.시간 t에서 c(t)가 염료의 농도라고 하자.[0, T]의 시간 간격을 하위 간격 δt로 나누면 t - 1 t에서 t = { t까지 하위 간격 동안 측정 지점을 통과하는 염료의 양은 다음과 같다.
서 F F는 계산되는 흐름 속도입니다.염료의 총량은 다음과 같습니다.
그리고 n { n\ \ 로 했을 때 염료의 양은 다음과 같습니다.
따라서 심장 출력은 다음과 같이 제공됩니다.
여기서 A A 된 염료의 양을 알 수 있으며, 적분은 농도 [66]측정값을 사용하여 확인할 수 있습니다.
염료 희석 방법은 운동 중 심박출량을 결정하는 가장 정확한 방법 중 하나입니다.정지 상태 및 운동 중 심박출량 값의 단일 계산 오차는 5% 미만입니다.이 방법에서는 '박동 대 박동' 변화를 측정할 수 없으며 운동 중 약 10초 동안 안정되고 30초 동안 [citation needed]안정되는 심박출력이 필요합니다.
심박출량에 영향을 미치는 요인
심박출량은 주로 신체 조직의 산소 요구량에 의해 제어됩니다.다른 펌프 시스템과 달리 심장은 자체 [67]출력을 조절하지 않는 수요 펌프입니다.신체에 대사 산소 요구량이 높으면 조직을 통한 대사 조절 흐름이 증가하여 심장으로 돌아가는 혈액 흐름이 증가하여 심박출량이 높아집니다.
혈액을 운반하는 동맥 혈관 채널의 정전 용량도 심박출량을 조절합니다.인체의 혈관이 활발하게 팽창하고 수축함에 따라 혈류에 대한 저항은 각각 감소하고 증가한다.얇은 정맥은 더 팽창하기 [68]쉽기 때문에 더 많은 혈액을 운반할 수 있기 때문에 두꺼운 동맥의 약 18배의 용량을 가지고 있다.
이 공식에서 뇌졸중 볼륨과 심박수에 영향을 미치는 요인은 심박출량에도 영향을 미치는 것이 분명합니다.오른쪽 그림은 이러한 의존성을 나타내며 이러한 요인 중 몇 가지를 나열합니다.보다 상세한 계층 그림은 다음 그림에 제시되어 있습니다.
식 (1)에서는 HR과 SV가 심박출량 Q의 주요 결정 요인임을 알 수 있다.이러한 요인에 대한 자세한 설명은 오른쪽 그림에 나와 있습니다.HR에 영향을 미치는 주요 요인은 자율신경과 내분비 조절이다.전해질, 대사 생성물, 온도 등의 환경 요인은 표시되지 않습니다.심장 주기 동안 SV의 결정 요인은 심장 근육의 수축성, 단축 전 심근 확장의 예하중 정도 및 배출 [69]시 후하중이다.전해질과 같은 다른 인자는 양 또는 음의 이방성 [70]물질로 분류될 수 있다.
심장 반응
| |||||||||||||||
|
임상적 의의
건강하지만 훈련되지 않은 개인에서 Q가 증가하면, 그 증가의 대부분은 심박수 증가에 기인할 수 있다.자세 변화, 교감신경계 활동 증가, 부교감신경계 활동 감소도 심박출량을 증가시킬 수 있다.스트로크 볼륨(SV)은 70~120mL(2.5~4.2imp floz, 2.4~4.1 US floz)로 1.[71][72][73]7배 정도 차이가 날 수 있습니다.
심혈관계 질환은 종종 Q의 변화와 관련이 있으며, 특히 유행성 질환인 고혈압과 심부전과 관련이 있다.Q의 증가는 감염과 패혈증 중에 발생할 수 있는 심혈관 질환과 관련이 있을 수 있다.Q의 감소는 심근증과 심부전과 [69]관련이 있을 수 있다.때때로 확장과 관련된 심실 질환이 있는 경우 EDV가 달라질 수 있습니다.EDV의 증가는 LV 확장과 수축 장애를 상쇄할 수 있다.식 (3)에서 결과 심박출량 Q는 일정하게 유지될 수 있다.Q를 정확하게 측정할 수 있는 능력은 임상 의학에서 중요한데, 이는 Q가 이상에 대한 진단을 개선하고 적절한 [74]관리를 이끌 수 있기 때문입니다.
값의 예시
| 심실 부피 | ||
|---|---|---|
| 재다 | 우심실 | 좌심실 |
| 확장기 말기 볼륨 | 144 mL(± 23 mL)[75] | 142 mL (± 21 mL)[76] |
| 확장기 말기 부피/체표면적(mL2/m) | 78 mL/m2 (± 11 mL/m2)[75] | 78 mL/m2 (± 8.8 mL/m2)[76] |
| 수축기 말기 볼륨 | 50 mL (± 14 mL)[75] | 47 mL (± 10 mL)[76] |
| 수축기 말기 부피/체표면적(mL2/m) | 27 mL/m2 (± 7 mL/m2)[75] | 26 mL/m2 (± 5.1 mL/m2)[76] |
| 스트로크 볼륨 | 94 mL (± 15 mL)[75] | 95 mL (± 14 mL)[76] |
| 스트로크 부피 / 신체 표면적(mL/m2) | 51 mL/m2 (± 7 mL/m2)[75] | 52 mL/m2 (± 6.2 mL/m2)[76] |
| 토출률 | 66 % (± 6 [75]%) | 67 % (± 4.6 [76]%) |
| 심박수 | 60 ~ 100 bpm[77] | 60 ~ 100 bpm[77] |
| 심박출량 | 4.0~8.0 L/분[78] | 4.0~8.0 L/분[78] |
관련 측정
토출률
배출 비율(EF)은 SV와 관련된 파라미터입니다. EF는 심장 주기 또는 수축기의 수축 또는 배출 단계 동안 좌심실(LV)에서 배출되는 혈액의 비율입니다.수축기 시작 전 충전기(확장기) 동안 LV는 확장기 말기 볼륨(EDV)으로 알려진 용량까지 혈액으로 채워집니다.수축기 동안 LV는 수축기 말기 용량(ESV)으로 알려진 최소 용량에 도달할 때까지 수축하고 혈액을 배출합니다.완전히 비워지는 것은 아닙니다.다음 방정식은 EF 및 EDV가 SV를 통해 심박출량 Q에 미치는 영향을 해석하는 데 도움이 됩니다.
-
(3)
-
심장 입력
심장 입력(CI)은 심장 출력의 역작동입니다.심장 출력은 배출 비율의 체적 표현을 의미하므로 심장 입력은 체적 주입 비율(IF)을 의미합니다.
IF = 확장기 말기 볼륨(EDV)/수축기 말기 볼륨(ESV)
심장 입력은 쉽게 영상화할 수 있는 확장기 수학 모델입니다.[검증 필요]
심장 지수
정상 질량의 모든 휴면 포유류에서 CO 값은 기울기가 0.1 L/(min kg)[79][80]인 체질량의 선형 함수이다.지방은 다른 마른 신체 조직과 비교하여 질량당 산소 요구량의 약 65%를 가지고 있다.그 결과, 비만 피험자의 정상 CO 값 계산은 더 복잡하다. 성인에 대한 단일 공통 "정상" SV와 CO 값은 존재할 수 없다.모든 혈류 매개변수를 색인화해야 합니다.키와 몸무게의 함수인 DuBois & DuBois 공식에 의해 신체 표면적 BSA2 [m]로 지수화하는 것이 받아들여진다.
결과적으로 인덱스된 파라미터는 뇌졸중 지수(SI)와 심장 지수(CI)입니다.mL/beat/m2 단위로 측정되는 스트로크 지수는 다음과 같이 정의됩니다.
L/(min2 m) 단위로 측정되는 심장 지수는 다음과 같이 정의된다.
그러면 지수화된 매개변수에 대한 CO 방정식 (1)이 다음과 같이 변경됩니다.
-
(2)
이러한 지수 혈류 매개변수의 정상 범위는 SI의 경우 35~65 mL/beat/m2, [81]CI의 경우 2.5~4 L/(min2 m)이다.
복합 심박출량
결합된 심박출량은 심장의 오른쪽과 왼쪽 출력의 합계입니다.심장 양쪽에서 나오는 심박출량이 전신순환을 [82]직접 공급하는 구멍과 동맥관에 의해 부분적으로 병렬로 작용하는 태아순환에서 유용한 측정이다.
이력 방법
변덕스러운 원리
1870년 아돌프 유진 픽에 의해 처음 기술된 픽 원리는 산소 소비 속도가 혈류 속도와 적혈구에 의해 흡수되는 산소 비율의 함수라고 가정합니다.Fick 원리의 적용에는 정맥혈과 동맥혈의 산소 농도를 측정하여 시간 경과에 따른 산소 소비량을 계산하는 것이 포함됩니다.Q는 이러한 측정에서 다음과 같이 계산됩니다.
- 스피로미터(피험자 재호흡 공기 포함) 및 CO 흡수기를 사용한2 분당 V 소비량O2
- 폐동맥에서 채취한 혈액의 산소 농도(혼합 정맥혈을 나타냄)
- 말초동맥(동맥혈을 나타냄)의 캐뉴레에서 혈액의 산소함유량
이러한 값을 통해 다음 사항을 알 수 있습니다.
어디에
- C는A 동맥혈의 산소함유량이고
- C는V 정맥혈의 산소함유량이다.
이것으로 우리는 말할 수 있다.
따라서 Q(CA – CV)는 동맥 [83]산소차라고도 한다.
Fick 방법은 Q를 측정하는 가장 정확한 방법으로 간주되지만 침습적이고 검체 분석에 시간이 필요하며 정확한 산소 소비량 검체를 획득하기가 어렵습니다.폐쇄 시스템의 일부로 호흡 산소 함량을 측정하고 가정된 산소 소비 지수를 사용하여 소비 산소를 계산하는 Fick 방법이 수정되었습니다. 이 값은 Q를 계산하는 데 사용됩니다.다른 변형에서는 불활성 가스를 추적기로 사용하고, 유도 및 유효 기간 만료 가스 농도의 변화를 측정하여 Q(Innocor, Innovision A/S, 덴마크)를 계산합니다.
혈액의 동맥 및 정맥 산소 함량을 계산하는 것은 간단한 과정입니다.혈액 속의 거의 모든 산소는 적혈구의 헤모글로빈 분자와 결합되어 있다.혈액 내 헤모글로빈 함량과 헤모글로빈 포화도(혈액 산소 포화도)를 측정하는 것은 간단한 과정이며 의사가 쉽게 사용할 수 있습니다.헤모글로빈의 각 g은 1.34mL의2 O를 운반할 수 있으며, 혈액의 산소 함량은 동맥 또는 정맥을 포함하여 다음 공식을 사용하여 추정할 수 있습니다.
폐동맥 열희석(오른쪽 심장 열희석)
인디케이터 방법은 인디케이터 염료를 가열 또는 냉각된 유체로 대체하여 더욱 개발되었습니다.염료 농도가 아닌 온도 변화는 순환 부위에서 측정됩니다. 이 방법을 열희석이라고 합니다.1970년에 임상 진료에 도입된 폐동맥 카테터(PAC)는 스완-간즈 카테터라고도 하며 열희석 측정을 위해 오른쪽 심장에 직접 접근할 수 있습니다.중환자실에서의 지속적이고 침습적인 심장 모니터링은 대부분 단계적으로 중단되었다.PAC는 심장 카테터 [citation needed]검사실에서 수행된 우측 심장 연구에 여전히 유용합니다.
PAC는 풍선 끝에 있고 팽창되어 있어 카테터 풍선을 우심실을 통해 "보통"하여 폐동맥 시스템의 작은 가지를 막는데 도움이 됩니다.그런 다음 풍선이 감압됩니다.PAC 열희석법은 알려진 온도의 소량(10mL)의 냉 포도당을 폐동맥에 주입하고 알려진 [citation needed]거리만큼 떨어져 있는 동일한 카테터를 사용하여 6-10cm(2.4-3.9인치)의 온도를 측정하는 것이다.
역사적으로 중요한 Swan-Ganz 멀티 루멘 카테터를 사용하면 열희석 곡선이라고도 하는 측정된 시간-온도 곡선에서 심장 출력을 재현할 수 있습니다.서미스터 기술은 낮은 CO 레지스터는 온도 변화가 느리고 높은 CO 레지스터는 온도 변화가 빠르다는 관찰을 가능하게 했다.온도 변화의 정도는 심박출량에 정비례합니다.이 고유한 방법에서는 일반적으로 [84][85]정확성을 향상시키기 위해 세 번 또는 네 번의 반복 측정 또는 패스를 평균화합니다.최신 카테터에는 간헐적으로 열을 가하고 열희석 곡선을 측정하여 연속 Q 측정을 제공하는 가열 필라멘트가 장착되어 있습니다.이러한 계측기는 순환의 안정성에 따라 평균 2-9분 동안 측정하므로 지속적인 모니터링을 제공하지 않습니다.
PAC 사용은 부정맥, 감염, 폐동맥 파열 및 우측 심장 판막 손상으로 인해 복잡해질 수 있습니다.최근 중병, 패혈증, 급성호흡부전, 심부전 환자들에 대한 연구는 PAC의 사용이 환자의 [5][6][7]결과를 개선하지 못한다는 것을 시사한다.이러한 임상적 비효과성은 Q 값의 [13]6배 범위에 걸친 흐름 프로브와 비교하여 입증된 낮은 정확도와 민감도와 관련이 있을 수 있다.임상의들이 헤모다이내믹스를 [86]모니터링하기 위해 덜 침습적이고 더 정확한 기술로 이동함에 따라 PAC의 사용이 감소하고 있습니다.
레퍼런스
- ^ a b c d e f g h i j k l m n o p q r s Betts JG (2013). Anatomy & physiology. pp. 787–846. ISBN 978-1938168130. Archived from the original on 23 February 2022. Retrieved 11 August 2014.
- ^ Kenyon, Anna; Williams, David; Adamson, Dawn (10 June 2010). "Physiology". Basic Science in Obstetrics and Gynaecology. Elsevier. pp. 173–230. doi:10.1016/b978-0-443-10281-3.00014-2. ISBN 978-0-443-10281-3. OCLC 1023146175. Archived from the original on 30 June 2022. Retrieved 23 February 2022. Catherine E에 의해 편집자:윌리엄슨, 필립 베넷
- ^ OpenStax (6 March 2013). "Cardiac Physiology". BC Open Textbooks – Open Textbooks Adapted and Created by BC Faculty. Archived from the original on 6 November 2021. Retrieved 7 April 2020.
- ^ Dunn, J.-Oc; Mythen, M. G.; Grocott, M. P. (1 October 2016). "Physiology of Oxygen Transport". BJA Education. 16 (10): 341–48. doi:10.1093/bjaed/mkw012. ISSN 2058-5349. Archived from the original on 23 February 2022.
- ^ a b Binanay C, Califf RM, Hasselblad V, O'Connor CM, Shah MR, Sopko G, Stevenson LW, Francis GS, Leier CV, Miller LW (October 2005). "Evaluation study of congestive heart failure and pulmonary artery catheterization effectiveness: the ESCAPE trial". JAMA. 294 (13): 1625–33. doi:10.1001/jama.294.13.1625. PMID 16204662.
- ^ a b Pasche B, Knobloch TJ, Bian Y, Liu J, Phukan S, Rosman D, Kaklamani V, Baddi L, Siddiqui FS, Frankel W, Prior TW, Schuller DE, Agrawal A, Lang J, Dolan ME, Vokes EE, Lane WS, Huang CC, Caldes T, Di Cristofano A, Hampel H, Nilsson I, von Heijne G, Fodde R, Murty VV, de la Chapelle A, Weghorst CM (October 2005). "Somatic acquisition and signaling of TGFBR1*6A in cancer". JAMA. 294 (13): 1634–46. doi:10.1001/jama.294.13.1634. PMID 16204663.
- ^ a b Hall JB (October 2005). "Searching for evidence to support pulmonary artery catheter use in critically ill patients". JAMA. 294 (13): 1693–94. doi:10.1001/jama.294.13.1693. PMID 16204671.
- ^ Finegold JA, Manisty CH, Cecaro F, Sutaria N, Mayet J, Francis DP (August 2013). "Choosing between velocity-time-integral ratio and peak velocity ratio for calculation of the dimensionless index (or aortic valve area) in serial follow-up of aortic stenosis". International Journal of Cardiology. 167 (4): 1524–31. doi:10.1016/j.ijcard.2012.04.105. PMID 22575631.
- ^ Su BC, Yu HP, Yang MW, Lin CC, Kao MC, Chang CH, Lee WC (July 2008). "Reliability of a new ultrasonic cardiac output monitor in recipients of living donor liver transplantation". Liver Transplantation. 14 (7): 1029–37. doi:10.1002/lt.21461. PMID 18581505. S2CID 37185399.
- ^ Phillips R, Paradisis M, Evans N, Southwell D, Burstow D, West M (2006). "Cardiac output measurement in preterm neonates: validation of USCOM against echocardiography". Critical Care. 10 (Suppl 1): P343. doi:10.1186/cc4690. PMC 4092718.
- ^ Cattermole GN, Leung PY, Mak PS, Chan SS, Graham CA, Rainer TH (September 2010). "The normal ranges of cardiovascular parameters in children measured using the Ultrasonic Cardiac Output Monitor". Critical Care Medicine. 38 (9): 1875–81. doi:10.1097/CCM.0b013e3181e8adee. PMID 20562697. S2CID 24949904.
- ^ Jain S, Allins A, Salim A, Vafa A, Wilson MT, Margulies DR (December 2008). "Noninvasive Doppler ultrasonography for assessing cardiac function: can it replace the Swan-Ganz catheter?". American Journal of Surgery. 196 (6): 961–67, discussion 967–68. doi:10.1016/j.amjsurg.2008.07.039. PMID 19095116.
- ^ a b Phillips RA, Hood SG, Jacobson BM, West MJ, Wan L, May CN (2012). "Pulmonary Artery Catheter (PAC) Accuracy and Efficacy Compared with Flow Probe and Transcutaneous Doppler (USCOM): An Ovine Cardiac Output Validation". Critical Care Research and Practice. 2012: 1–9. doi:10.1155/2012/621496. PMC 3357512. PMID 22649718.
- ^ Horster S, Stemmler HJ, Strecker N, Brettner F, Hausmann A, Cnossen J, Parhofer KG, Nickel T, Geiger S (2012). "Cardiac Output Measurements in Septic Patients: Comparing the Accuracy of USCOM to PiCCO". Critical Care Research and Practice. 2012: 1–5. doi:10.1155/2012/270631. PMC 3235433. PMID 22191019.
- ^ Phillips R, Lichtenthal P, Sloniger J, Burstow D, West M, Copeland J (March 2009). "Noninvasive cardiac output measurement in heart failure subjects on circulatory support". Anesthesia and Analgesia. 108 (3): 881–86. doi:10.1213/ane.0b013e318193174b. PMID 19224797. S2CID 35618846.
- ^ Kager CC, Dekker GA, Stam MC (April 2009). "Measurement of cardiac output in normal pregnancy by a non-invasive two-dimensional independent Doppler device". The Australian & New Zealand Journal of Obstetrics & Gynaecology. 49 (2): 142–44. doi:10.1111/j.1479-828X.2009.00948.x. PMID 19441163. S2CID 25371483.
- ^ Mythen MG, Webb AR (April 1995). "Perioperative plasma volume expansion reduces the incidence of gut mucosal hypoperfusion during cardiac surgery". Archives of Surgery. 130 (4): 423–29. doi:10.1001/archsurg.1995.01430040085019. PMID 7535996.
- ^ Sinclair S, James S, Singer M (October 1997). "Intraoperative intravascular volume optimisation and length of hospital stay after repair of proximal femoral fracture: randomised controlled trial". BMJ. 315 (7113): 909–12. doi:10.1136/bmj.315.7113.909. PMC 2127619. PMID 9361539.
- ^ Conway DH, Mayall R, Abdul-Latif MS, Gilligan S, Tackaberry C (September 2002). "Randomised controlled trial investigating the influence of intravenous fluid titration using oesophageal Doppler monitoring during bowel surgery". Anaesthesia. 57 (9): 845–49. doi:10.1046/j.1365-2044.2002.02708.x. PMID 12190747. S2CID 43755776.
- ^ Gan TJ, Soppitt A, Maroof M, el-Moalem H, Robertson KM, Moretti E, Dwane P, Glass PS (October 2002). "Goal-directed intraoperative fluid administration reduces length of hospital stay after major surgery". Anesthesiology. 97 (4): 820–26. doi:10.1097/00000542-200210000-00012. PMID 12357146. S2CID 10471164.
- ^ Venn R, Steele A, Richardson P, Poloniecki J, Grounds M, Newman P (January 2002). "Randomized controlled trial to investigate influence of the fluid challenge on duration of hospital stay and perioperative morbidity in patients with hip fractures". British Journal of Anaesthesia. 88 (1): 65–71. doi:10.1093/bja/88.1.65. PMID 11881887.
- ^ Wakeling HG, McFall MR, Jenkins CS, Woods WG, Miles WF, Barclay GR, Fleming SC (November 2005). "Intraoperative oesophageal Doppler guided fluid management shortens postoperative hospital stay after major bowel surgery". British Journal of Anaesthesia. 95 (5): 634–42. doi:10.1093/bja/aei223. PMID 16155038.
- ^ Noblett SE, Snowden CP, Shenton BK, Horgan AF (September 2006). "Randomized clinical trial assessing the effect of Doppler-optimized fluid management on outcome after elective colorectal resection". The British Journal of Surgery. 93 (9): 1069–76. doi:10.1002/bjs.5454. PMID 16888706. S2CID 25469534.
- ^ Pillai P, McEleavy I, Gaughan M, Snowden C, Nesbitt I, Durkan G, Johnson M, Cosgrove J, Thorpe A (December 2011). "A double-blind randomized controlled clinical trial to assess the effect of Doppler optimized intraoperative fluid management on outcome following radical cystectomy". The Journal of Urology. 186 (6): 2201–06. doi:10.1016/j.juro.2011.07.093. PMID 22014804.
- ^ "CardioQ-ODM oesophageal doppler monitor Guidance NICE". Archived from the original on 23 February 2022. Retrieved 23 February 2022.
- ^ Lowe GD, Chamberlain BM, Philpot EJ, Willshire RJ (2010). "Oesophageal Doppler Monitor (ODM) guided individualised goal directed fluid management (iGDFM) in surgery – a technical review" (PDF). Deltex Medical Technical Review. Archived from the original (PDF) on 23 September 2015. Retrieved 13 October 2014.
- ^ de Wilde RB, Schreuder JJ, van den Berg PC, Jansen JR (August 2007). "An evaluation of cardiac output by five arterial pulse contour techniques during cardiac surgery". Anaesthesia. 62 (8): 760–68. doi:10.1111/j.1365-2044.2007.05135.x. PMID 17635422.
- ^ Wesseling KH, Jansen JR, Settels JJ, Schreuder JJ (May 1993). "Computation of aortic flow from pressure in humans using a nonlinear, three-element model". Journal of Applied Physiology. 74 (5): 2566–73. doi:10.1152/jappl.1993.74.5.2566. PMID 8335593.
- ^ a b Bein B, Meybohm P, Cavus E, Renner J, Tonner PH, Steinfath M, Scholz J, Doerges V (July 2007). "The reliability of pulse contour-derived cardiac output during hemorrhage and after vasopressor administration". Anesthesia and Analgesia. 105 (1): 107–13. doi:10.1213/01.ane.0000268140.02147.ed. PMID 17578965. S2CID 5549744.
- ^ Singh S, Taylor MA (August 2010). "Con: the FloTrac device should not be used to follow cardiac output in cardiac surgical patients". Journal of Cardiothoracic and Vascular Anesthesia. 24 (4): 709–11. doi:10.1053/j.jvca.2010.04.023. PMID 20673749.
- ^ Manecke GR (September 2005). "Edwards FloTrac sensor and Vigileo monitor: easy, accurate, reliable cardiac output assessment using the arterial pulse wave". Expert Review of Medical Devices. 2 (5): 523–27. doi:10.1586/17434440.2.5.523. PMID 16293062. S2CID 31049402.
- ^ McGee WT (2009). "A simple physiologic algorithm for managing hemodynamics using stroke volume and stroke volume variation: physiologic optimization program". Journal of Intensive Care Medicine. 24 (6): 352–60. doi:10.1177/0885066609344908. PMID 19736180. S2CID 12806349.
- ^ Su BC, Tsai YF, Chen CY, Yu HP, Yang MW, Lee WC, Lin CC (March 2012). "Cardiac output derived from arterial pressure waveform analysis in patients undergoing liver transplantation: validity of a third-generation device". Transplantation Proceedings. 44 (2): 424–28. doi:10.1016/j.transproceed.2011.12.036. PMID 22410034.
- ^ Takala J, Ruokonen E, Tenhunen JJ, Parviainen I, Jakob SM (June 2011). "Early non-invasive cardiac output monitoring in hemodynamically unstable intensive care patients: a multi-center randomized controlled trial". Critical Care. 15 (3): R148. doi:10.1186/cc10273. PMC 3219022. PMID 21676229.
- ^ Romano SM, Pistolesi M (August 2002). "Assessment of cardiac output from systemic arterial pressure in humans". Critical Care Medicine. 30 (8): 1834–41. doi:10.1097/00003246-200208000-00027. PMID 12163802. S2CID 12100251.
- ^ Scolletta S, Romano SM, Biagioli B, Capannini G, Giomarelli P (August 2005). "Pressure recording analytical method (PRAM) for measurement of cardiac output during various haemodynamic states". British Journal of Anaesthesia. 95 (2): 159–65. doi:10.1093/bja/aei154. PMID 15894561.
- ^ Calamandrei M, Mirabile L, Muschetta S, Gensini GF, De Simone L, Romano SM (May 2008). "Assessment of cardiac output in children: a comparison between the pressure recording analytical method and Doppler echocardiography". Pediatric Critical Care Medicine. 9 (3): 310–12. doi:10.1097/PCC.0b013e31816c7151. PMID 18446106. S2CID 25815656.
- ^ Scolletta S, Gregoric ID, Muzzi L, Radovancevic B, Frazier OH (January 2007). "Pulse wave analysis to assess systemic blood flow during mechanical biventricular support". Perfusion. 22 (1): 63–66. doi:10.1177/0267659106074784. PMID 17633137. S2CID 32129645.
- ^ Scolletta S, Romano SM, Maglioni H (2005). "Left ventricular performance by PRAM during cardiac surgery". p. S157.
{{cite web}}: (도움말이) 없거나 비어 있습니다. - ^ Bernstein, Donald P (2010). "Impedance cardiography: Pulsatile blood flow and the biophysical and electrodynamic basis for the stroke volume equations". Journal of Electrical Bioimpedance. 1: 2–17. doi:10.5617/jeb.51. Archived from the original on 17 October 2015.
- ^ Costa PD, Rodrigues PP, Reis AH, Costa-Pereira A (December 2010). "A review on remote monitoring technology applied to implantable electronic cardiovascular devices". Telemedicine Journal and e-Health. 16 (10): 1042–50. doi:10.1089/tmj.2010.0082. PMID 21070132.
- ^ Tang WH, Tong W (March 2009). "Measuring impedance in congestive heart failure: current options and clinical applications". American Heart Journal. 157 (3): 402–11. doi:10.1016/j.ahj.2008.10.016. PMC 3058607. PMID 19249408.
- ^ Ferrario CM, Flack JM, Strobeck JE, Smits G, Peters C (February 2010). "Individualizing hypertension treatment with impedance cardiography: a meta-analysis of published trials". Therapeutic Advances in Cardiovascular Disease. 4 (1): 5–16. doi:10.1177/1753944709348236. PMID 20042450.
- ^ Moshkovitz Y, Kaluski E, Milo O, Vered Z, Cotter G (May 2004). "Recent developments in cardiac output determination by bioimpedance: comparison with invasive cardiac output and potential cardiovascular applications". Current Opinion in Cardiology. 19 (3): 229–37. doi:10.1097/00001573-200405000-00008. PMID 15096956. S2CID 28996732.
- ^ Parry MJ, McFetridge-Durdle J (2006). "Ambulatory impedance cardiography: a systematic review". Nursing Research. 55 (4): 283–91. doi:10.1097/00006199-200607000-00009. PMID 16849981. S2CID 28726590.
- ^ Wang DJ, Gottlieb SS (September 2006). "Impedance cardiography: more questions than answers". Current Heart Failure Reports. 3 (3): 107–13. doi:10.1007/s11897-006-0009-7. PMID 16914102. S2CID 31094943.
- ^ Ventura HO, Taler SJ, Strobeck JE (February 2005). "Hypertension as a hemodynamic disease: the role of impedance cardiography in diagnostic, prognostic, and therapeutic decision making". American Journal of Hypertension. 18 (2 Pt 2): 26S–43S. doi:10.1016/j.amjhyper.2004.11.002. PMID 15752931.
- ^ "Archived copy". Archived from the original on 3 December 2010. Retrieved 30 November 2010.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크)[검증 필요][비프라이머리 소스 필요] - ^ "Niccomo – Non-Invasive Continuous Cardiac Output Monitor". www.medis-de.com. medis. GmbH Ilmenau. Archived from the original on 17 October 2015. Retrieved 1 June 2015.
- ^ "Archived copy". Archived from the original on 24 May 2015. Retrieved 22 May 2015.
{{cite web}}: CS1 maint : TEBCO OEM 타이틀 (링크)아카이브 카피 - ^ bomed.us/ext-teb.html EXT-TEBCO
- ^ Krivitski NM (July 1995). "Theory and validation of access flow measurement by dilution technique during hemodialysis". Kidney International. 48 (1): 244–50. doi:10.1038/ki.1995.290. PMID 7564085.
- ^ Tanke RB, van Heijst AF, Klaessens JH, Daniels O, Festen C (January 2004). "Measurement of the ductal L-R shunt during extracorporeal membrane oxygenation in the lamb". Journal of Pediatric Surgery. 39 (1): 43–47. doi:10.1016/j.jpedsurg.2003.09.017. PMID 14694369.
- ^ Casas F, Reeves A, Dudzinski D, Weber S, Lorenz M, Akiyama M, Kamohara K, Kopcak M, Ootaki Y, Zahr F, Sinkewich M, Foster R, Fukamachi K, Smith WA (2005). "Performance and reliability of the CPB/ECMO Initiative Forward Lines Casualty Management System". ASAIO Journal. 51 (6): 681–85. doi:10.1097/01.mat.0000182472.63808.b9. PMID 16340350. S2CID 1897392.
- ^ Tessitore N, Bedogna V, Poli A, Mantovani W, Lipari G, Baggio E, Mansueto G, Lupo A (November 2008). "Adding access blood flow surveillance to clinical monitoring reduces thrombosis rates and costs, and improves fistula patency in the short term: a controlled cohort study". Nephrology, Dialysis, Transplantation. 23 (11): 3578–84. doi:10.1093/ndt/gfn275. PMID 18511608.
- ^ van Loon M, van der Mark W, Beukers N, de Bruin C, Blankestijn PJ, Huisman RM, Zijlstra JJ, van der Sande FM, Tordoir JH (June 2007). "Implementation of a vascular access quality programme improves vascular access care". Nephrology, Dialysis, Transplantation. 22 (6): 1628–32. doi:10.1093/ndt/gfm076. PMID 17400567.
- ^ (COstatus 2015년 5월 12일 Transonic System Inc. 웨이백 머신에서 보관).2008년 10월 29일 뉴욕주 [non-primary source needed]이타카 웨이백머신에서 아카이브 완료)
- ^ Krivitski NM, Kislukhin VV, Thuramalla NV (July 2008). "Theory and in vitro validation of a new extracorporeal arteriovenous loop approach for hemodynamic assessment in pediatric and neonatal intensive care unit patients". Pediatric Critical Care Medicine. 9 (4): 423–28. doi:10.1097/01.PCC.0b013e31816c71bc. PMC 2574659. PMID 18496416.
- ^ Funk DJ, Moretti EW, Gan TJ (March 2009). "Minimally invasive cardiac output monitoring in the perioperative setting". Anesthesia and Analgesia. 108 (3): 887–97. doi:10.1213/ane.0b013e31818ffd99. PMID 19224798. S2CID 15891210.
- ^ Arheden H, Ståhlberg F (2006). "Blood flow measurements". In de Roos A, Higgins CB (eds.). MRI and CT of the Cardiovascular System (2nd ed.). Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 71–90. ISBN 978-0-7817-6271-7. Archived from the original on 23 February 2022. Retrieved 23 February 2022.
- ^ Arheden H, Holmqvist C, Thilen U, Hanséus K, Björkhem G, Pahlm O, Laurin S, Ståhlberg F (May 1999). "Left-to-right cardiac shunts: comparison of measurements obtained with MR velocity mapping and with radionuclide angiography". Radiology. 211 (2): 453–58. doi:10.1148/radiology.211.2.r99ma43453. PMID 10228528.
- ^ Razavi R, Hill DL, Keevil SF, Miquel ME, Muthurangu V, Hegde S, Rhode K, Barnett M, van Vaals J, Hawkes DJ, Baker E (December 2003). "Cardiac catheterisation guided by MRI in children and adults with congenital heart disease". Lancet. 362 (9399): 1877–82. doi:10.1016/S0140-6736(03)14956-2. PMID 14667742. S2CID 25380774.
- ^ Kuehne T, Yilmaz S, Schulze-Neick I, Wellnhofer E, Ewert P, Nagel E, Lange P (August 2005). "Magnetic resonance imaging guided catheterisation for assessment of pulmonary vascular resistance: in vivo validation and clinical application in patients with pulmonary hypertension". Heart. 91 (8): 1064–69. doi:10.1136/hrt.2004.038265. PMC 1769055. PMID 16020598.
- ^ Petzina R, Ugander M, Gustafsson L, Engblom H, Sjögren J, Hetzer R, Ingemansson R, Arheden H, Malmsjö M (May 2007). "Hemodynamic effects of vacuum-assisted closure therapy in cardiac surgery: assessment using magnetic resonance imaging". The Journal of Thoracic and Cardiovascular Surgery. 133 (5): 1154–62. doi:10.1016/j.jtcvs.2007.01.011. PMID 17467423.
- ^ Pennell DJ, Sechtem UP, Higgins CB, Manning WJ, Pohost GM, Rademakers FE, van Rossum AC, Shaw LJ, Yucel EK (November 2004). "Clinical indications for cardiovascular magnetic resonance (CMR): Consensus Panel report". European Heart Journal. 25 (21): 1940–65. doi:10.1016/j.ehj.2004.06.040. PMID 15522474.
- ^ Stewart J (2010). Calculus: Early Transcententals. Cengage Learning. pp. 565–66. ISBN 9780538497909.
- ^ Sircar S (2008). Principles of Medical Physiology. Thieme. p. 237. ISBN 978-1-58890-572-7. Archived from the original on 27 July 2020. Retrieved 13 March 2016.
- ^ Young DB (2010). Control of Cardiac Output. Morgan & Claypool Publishers. p. 4. ISBN 978-1-61504-021-6. Archived from the original on 27 July 2020. Retrieved 13 March 2016.
- ^ a b Vincent JL (2008). "Understanding cardiac output". Critical Care. 12 (4): 174. doi:10.1186/cc6975. PMC 2575587. PMID 18771592.
- ^ Betts JG (2013). Anatomy & physiology. pp. 787–846. ISBN 978-1938168130. Archived from the original on 23 February 2022. Retrieved 11 August 2014.
- ^ Levy MN, Berne RM (1997). Cardiovascular physiology (7th ed.). St. Louis: Mosby. ISBN 978-0-8151-0901-3.[페이지 필요]
- ^ Rowell, Loring B. (1993). Human cardiovascular control. Oxford: Oxford University Press. ISBN 978-0-19-507362-1.[페이지 필요]
- ^ Braunwald E (1997). Heart disease: a textbook of cardiovascular medicine (5th ed.). Philadelphia: Saunders. ISBN 978-0-7216-5666-3.[페이지 필요]
- ^ Dhingra VK, Fenwick JC, Walley KR, Chittock DR, Ronco JJ (September 2002). "Lack of agreement between thermodilution and fick cardiac output in critically ill patients". Chest. 122 (3): 990–97. doi:10.1378/chest.122.3.990. PMID 12226045.
- ^ a b c d e f g Maceira AM, Prasad SK, Khan M, Pennell DJ (December 2006). "Reference right ventricular systolic and diastolic function normalized to age, gender and body surface area from steady-state free precession cardiovascular magnetic resonance" (PDF). European Heart Journal. 27 (23): 2879–88. doi:10.1093/eurheartj/ehl336. PMID 17088316.
- ^ a b c d e f g Maceira A (2006). "Normalized Left Ventricular Systolic and Diastolic Function by Steady State Free Precession Cardiovascular Magnetic Resonance". Journal of Cardiovascular Magnetic Resonance. 8: 417–426. doi:10.1080/10976640600572889. (설명 필요)
- ^ a b 심박수의 정상 범위는 서맥과 빈맥 사이의 가장 좁은 한계 중 하나이다.자세한 제한은 Bradycardia 및 Tachycardia 문서를 참조하십시오.
- ^ a b "Normal Hemodynamic Parameters – Adult" (PDF). Edwards Lifesciences LLC. 2009.
- ^ WR Milnor:Williams & Wilkins, 1982년[ISBN missing][page needed] 혈류역학
- ^ BB Sramek:System Hemodynamics and Hemodynamics Management, 2002, ISBN 1-59196-046-0[page needed]
- ^ "Cardiac Output and Cardiac Index – What's the difference?". 13 December 2016. Archived from the original on 16 December 2018. Retrieved 14 December 2018.
- ^ Boron WF (2003). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. p. 1197. ISBN 978-1-4160-2328-9.[페이지 필요]
- ^ "Arteriovenous oxygen difference". Sports Medicine, Sports Science and Kinesiology. Net Industries. 2011. Archived from the original on 12 June 2011. Retrieved 30 April 2011.[어쩔 수 없는 의료원?]
- ^ Iberti TJ, Fischer EP, Leibowitz AB, Panacek EA, Silverstein JH, Albertson TE (December 1990). "A multicenter study of physicians' knowledge of the pulmonary artery catheter. Pulmonary Artery Catheter Study Group". JAMA. 264 (22): 2928–32. doi:10.1001/jama.264.22.2928. PMID 2232089.
- ^ Johnston IG, Jane R, Fraser JF, Kruger P, Hickling K (August 2004). "Survey of intensive care nurses' knowledge relating to the pulmonary artery catheter". Anaesthesia and Intensive Care. 32 (4): 564–68. doi:10.1177/0310057X0403200415. PMID 15675218.
- ^ Alhashemi JA, Cecconi M, Hofer CK (2011). "Cardiac output monitoring: an integrative perspective". Critical Care. 15 (2): 214. doi:10.1186/cc9996. PMC 3219410. PMID 21457508.


![{\displaystyle CO_{\text{[L/min]}}=SV_{\text{[L/beat]}}\times HR_{\text{[beats/min]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9758ba05f9500a4ee209f0fb42f00e150e25a75)








 t
t 하위 간격 동안 측정 지점을 통과하는 염료의 양은 다음과 같다.
하위 간격 동안 측정 지점을 통과하는 염료의 양은 다음과 같다.
 계산되는 흐름 속도입니다.염료의 총량은 다음과 같습니다.
계산되는 흐름 속도입니다.염료의 총량은 다음과 같습니다.






![{\displaystyle BSA_{\mathrm {[m^{2}]} }=W_{\mathrm {[kg]} }^{0.425}\times H_{\mathrm {[cm]} }^{0725}\times 0.007184}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00d2f209796a88f1509cc7ea78041537d6edfbaf)
![{\displaystyle SI_{\mathrm {[mL/beat/{m}^{2}]} }={\frac {SV_{\mathrm {[mL]} }}{BSA_{\mathrm {[m^{2}]} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f7cbbb7a00e3e925bef08d46843626f3bd3a39d)
![{\displaystyle CI_{\mathrm {[L/min/{m}^{2}]} }={\frac {CO_{\mathrm {[L/min]} }}{BSA_{\mathrm {[{m}^{2}]} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0d5eea41bc4141c9a58bc2585202e3ddd2fcd36)
![{\displaystyle CI_{\mathrm {[L/min/{m}^{2}]} }=(SI_{\mathrm {[mL/beat/{m}^{2}]} }\times HR_{\mathrm {[bpm]} })/1000}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82248dda9fd3023f4ebe0e5d95ef9b99d0b71612)



![{\displaystyle {\begin{aligned}{\text{Oxygen content of blood}}&=\left[{\text{haemoglobin}}\right]\left({\text{g/dL}}\right)\ \times \ 1.34\left({\text{mL}}\ {\ce {O2}}/{\text{g of haemoglobin}}\right)\\&\times \ {\text{saturation of blood}}\ \left({\text{percent}}\right)\ +\ 0.0032\ \times \ {\text{partial pressure of oxygen}}\left({\text{torr}}\right)\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eba72e33526aeb0276cf5881842334b8ad841a3d)



