순환 화합물
Cyclic compound고리화합물(또는 고리화합물)은 화합물 중 하나 이상의 원자가 연결되어 고리를 형성하는 화학 분야의 화합물을 일컫는 용어이다.고리는 크기가 3개에서 많은 원자까지 다양할 수 있으며, 모든 원자가 탄소(즉, 카보사이클), 원자가 탄소(무기 순환 화합물), 또는 탄소 원자와 비탄소 원자가 모두 존재하는(헤테로사이클 화합물) 예를 포함합니다.고리 크기, 고리 원자 간의 개별 연결 순서 및 고리 내에서의 이들 배열에 따라 탄소환 화합물 및 복소환 화합물은 방향족 또는 비방향족 화합물이 될 수 있다.후자의 경우에는 완전 포화 상태에서 고리 원자 간의 다중 결합 수가 다를 수 있다.공통 원자의 원자가와 고리를 형성하는 능력에 의해 허용되는 엄청난 다양성 때문에, 수 십억 개의 작은 크기(예를 들어, 총 원자 17개 미만)의 가능한 순환 구조의 수.
- 순환 화합물 예: 전탄소(탄화수소) 및 보다 복잡한 천연 순환 화합물
그들의 복잡성과 수에 추가하면서, 원자의 고리에 닫힘 뚜렷한 대체와(기능적인 그룹에 의해)특정 원자를 잠길 수 있도록 입체 화학 및 분자 비대칭성의 화합물 결과를 포함 일부 징후 있는 독특한에 고리(예:configurational이다.).마찬가지로, 환의 크기에 따라 특히 순환 구조의 3차원 모양과 더 큰 – 달라질 수 있고 호환하다는 형태 이성질 표시됩니다 등 5원자의 일반적으로 반지 –.실제로 이 중요한 화학 개념의 개발 역사적으로 주기적 합성 물질을 참조를 생각해냈다.모든 분자가 생화학, 구조, 그리고 생물체의 기능에 관여한 마침내, 그들은을 불러일으켰다 독특한 모양, reactivities, 속성 및 bioactivities 때문에 주기적 화합물은 대부분에 사람이 만든 분자 같은 약물, 살충제 등
구조 및 분류
고리화합물 또는 고리화합물은 그 원자의 적어도 일부가 연결되어 [1]고리를 형성하는 화합물이다.고리의 크기는 세 개에서 수십 개, 심지어 수백 개의 원자에 이르기까지 다양합니다.링 화합물의 예로는 다음과 같은 경우가 있습니다.
공통 원자는 다양한 수의 결합을 형성할 수 있으며, 많은 공통 원자는 쉽게 고리를 형성합니다.또한 고리 크기, 고리 원자 간의 개별 연결의 결합 순서 및 고리 내에서의 그 배열에 따라 환상 화합물은 방향족 또는 비방향족일 수 있으며, 비방향족 환상 화합물의 경우 완전 포화에서 다양한 수의 다중 결합을 가질 수 있다.순환 구조에서 열역학적으로 가능한 구성적 변동의 결과로, 수 [3]십억 개의 작은 크기(예: <17 개의 원자)의 수까지 가능한 순환 구조의 수.
또한 원자가 고리로 닫히면 특정 관능기 치환 원자가 제자리에 고정될 수 있으며, 그 결과 고리에 고유한 일부 징후(예: 구성 이성질체)[4]를 포함하여 입체 화학 및 키랄성이 화합물과 관련될 수 있다.또한, 링 크기에 따라, 특정 순환 구조의 3차원 형상(일반적으로 5개의 원자 이상의 고리)은 변화하고 상호 변환하여 입체구조 이성질을 [4]나타낼 수 있습니다.
Carbocycles
대부분의 순환 화합물은 유기물이며, 이 중 중요하고 개념적으로 중요한 부분은 탄소 원자만으로 이루어진 고리(즉, 탄소 [citation needed]고리)로 구성되어 있다.
무기환상화합물
무기원자도 고리화합물을 형성한다.예를 들어 황(예: 폴리황화물), 실리콘(예: 실란), 인(예: 포스판, 메타인산 및 기타 인산 유도체) 및 붕소(예: 트리불산)[citation needed]가 있습니다.벤젠의 탄소가 예를 들어 보라벤젠, 실라벤젠, 게르마나벤젠, 스타나벤젠 및 포스포린과 같은 다른 원소에 의해 "치환"되면 방향족성이 유지되므로 방향족 순환 무기 화합물도 알려져 있고 잘 [citation needed]특징지어진다.
헤테로 고리 화합물
탄소 원자와 비탄소 원자가 모두 존재하는 고리형 화합물을 복소환 [citation needed]화합물이라고 한다.또한 그 이름은 [citation needed]고리 안에 둘 이상의 원자가 있는 백산이나 보라진과 같은 무기환 화합물을 지칭할 수 있다.Hantzsch-Widman 명명법은 IUPAC에 의해 헤테로사이클 명명법에 권장되지만,[citation needed] 많은 일반적인 이름이 정기적으로 사용되고 있다.
Macrocycles
매크로사이클이라는 용어는 8개 이상의 [5][6]원자를 가진 화합물을 말한다.매크로사이클은 완전한 탄수화물, 복소환이지만 제한된 헤테로아톰(예를 들어 락톤 및 락탐)을 가질 수 있으며, 헤테로아톰이 풍부하고 유의한 대칭을 나타낼 수 있다(예를 들어 킬레이트 매크로사이클의 경우).매크로 사이클은 링 내에서 고리 모양의 비결합 상호작용을 최소화하는 구성(예: [citation needed]의자와 의자 보트가 호로 표시된 상호작용 때문에 사이클록탄에 대한 보트-보트 구성보다 더 안정적)에 거주하는 것을 선호하면서 다수의 안정적인 구성에 접근할 수 있다.중간 고리(8~11원자)가 9~13(kcal/mol)의 변형 에너지로 가장 많이 변형되며, 보다 큰 매크로 사이클의 구성에 중요한 요소의 분석은 중간 [7]고리 구성을 사용하여 모델링할 수 있습니다.홀수 원환의 구조 분석은 홀수 원환들이 안정적인 [8]형태 사이의 에너지 차이가 작은 덜 대칭적인 형태로 존재하는 경향이 있음을 시사한다.
품목 분류 표
IUPAC 명명법에는 순환 구조의 명명(핵심 구조 및 지방 순환 [citation needed]구조에 부가되는 대체 요소)을 포괄하는 광범위한 규칙이 있다.매크로사이클이라는 용어는 고리를 포함하는 화합물이 12개 이상의 [5][6]원자를 가진 고리를 가질 때 사용됩니다.다환이라는 용어는 단일 분자에 둘 이상의 고리가 나타날 때 사용됩니다.나프탈렌은 형식적으로는 다환식 화합물이지만, 더 구체적으로는 이환식 화합물로 불린다.아래 최종 갤러리에 거시 및 다환 구조의 몇 가지 예가 나와 있습니다.
고리 구조의 일부인 원자는 고리형 [9]원자라고 불린다.
Isomerism
입체화학
원자가 고리로 닫히면 특정 원자가 기능군에 의해 뚜렷한 치환으로 고정될 수 있으며, 그 결과 고리에 고유한 일부 징후(예: 구성 [4]이성질체)를 포함한 화합물의 입체 화학과 키랄리티가 된다.
Conformational 이성
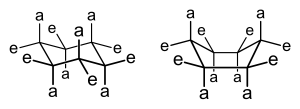
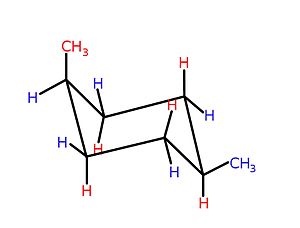
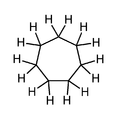
링 크기에 따라 특정 순환 구조(일반적으로 5 atom 이상의 링)의 3차원 형상이 변화하고 상호 변환되어 입체구조 이성질이 [4]나타날 수 있습니다.실제로, 이 중요한 화학 개념의 개발은 역사적으로 순환 화합물과 관련하여 일어났다.예를 들어, 시클로헥산(이중 결합이 없는 6개의 구성원 카보사이클)은 이미지와 같이 의자와 보트라는 두 가지 형태 사이의 균형을 나타낸다.
의자 구성은 선호되는 구성이다. 왜냐하면 이 구성에서는 그렇지 않으면 가능한 입체 변형률,[4] 일식 변형률 및 각도 변형률이 최소화되기 때문이다.어느 것이 가능한 의자 입체 배열의 cyclohexanes 하나 이상의 substituents의 태도는, 반지에 위치해 있어, 많은 책과 일반적으로,"부피가 큰"substituents—those 그룹들, 혹은 다른 점에서 그들의 interactions[표창 필요한]—prefer에 적도 locus의 복수형.을 차지하고 혐오스럽다 단체들은 substituents에 의존이 우세하다.tion.[4]보트에서 의자로의 평형 전환을 초래하는 분자 내 상호작용의 예는 시스-1,4-디메틸시클로헥산의 두 메틸기 사이의 상호작용이다.이 분자에서 두 개의 메틸기는 고리의 반대 위치(1,4-)에 있으며, 이들의 시스 입체화학은 이들 두 그룹을 고리의 같은 쪽을 향해 투영한다.따라서 이러한 메틸기는 높은 에너지 보트 형태로 강제될 경우 입체 접촉하고 서로 밀어내고 의자 [4]형태를 향해 평형을 구동합니다.
방향성
순환 화합물은 방향족 화합물을 나타낼 수도 있고 아닐 수도 있다. 벤젠은 방향족 순환 화합물의 한 예이며, 시클로헥산은 방향족 화합물이 아니다.유기화학에서 방향족이란 용어는 동일한 원자 세트의 다른 기하학적 또는 결합 배열과 비교하여 특이한 안정성을 보이는 고리 모양의 평면(평탄한) 분자를 설명하기 위해 사용된다.그 안정성 때문에 방향족 분자가 분해되어 다른 물질과 반응하는 것은 매우 어렵다.방향족 화합물이 아닌 유기 화합물은 지방족 화합물로 분류됩니다. 순환형일 수 있지만 방향족 고리만이 특별한 안정성(저반응성)을 가집니다.
유기 화학에서 가장 흔히 볼 수 있는 방향족 시스템 중 하나가 원형 방향족 화합물 벤젠(석유와 그 증류액에서 흔히 볼 수 있는 방향족 탄화수소)의 유도체에 기초하기 때문에, "방향족"이라는 단어는 때때로 벤젠 유도체를 비공식적으로 언급하기 위해 사용됩니다. 그리고 이것이 처음 정의되는 방법입니다.ed. 그럼에도 불구하고 많은 비벤젠 방향족 화합물이 존재한다.예를 들어, 살아있는 유기체에서 가장 흔한 방향족 고리는 RNA와 DNA의 이중 고리 염기이다. 방향족인 기능기 또는 다른 치환기를 아릴기라고 한다.
"방향족"이라는 용어가 가장 먼저 사용된 것은 1855년 아우구스트 빌헬름 호프만의 기사에서였다.Hofmann은 순수 포화 탄화수소와 달리 냄새(향기)가 있는 벤젠 화합물의 종류에 대해 이 용어를 사용했습니다.오늘날, 비록 벤젠이나 유기 화합물의 구조가 이해되기 전인 1855년에, Hofmann과 같은 화학자들이 Terpen과 같은 식물들로부터의 향기로운 분자들이 체를 가지고 있다는 것을 이해하기 시작했지만, 화학 특성으로서의 방향족과 그러한 화합물의 후각 특성 사이에는 일반적인 관계가 없습니다.오늘날 우리가 인식하는 mical 특성은 벤젠과 같은 불포화석유 탄화수소와 유사하다.
분자의 전자적 성질에 있어서 방향성은 종종 고리 내에서 단일 결합과 이중 결합이 번갈아 이루어지는 공역계를 나타낸다.이 구성은 분자의 파이 시스템의 전자가 고리 주위에 위치하지 않게 하여 분자의 안정성을 증가시킵니다.분자는 하나의 구조로 표현될 수 없고 벤젠의 두 가지 공명 구조와 같은 다른 구조의 공명 잡종입니다.이러한 분자는 한 위치에서 긴 단일 결합과 다른 위치에서 짧은 이중 결합을 가진 두 가지 표현 중 하나에서 찾을 수 없습니다(아래 이론 참조).오히려 분자는 단일 결합과 이중 결합 사이의 결합 길이를 나타낸다.일반적으로 볼 수 있는 방향족 고리 모델, 즉 벤젠이 단결합과 이중결합(시클로헥사트리엔)을 번갈아 가진 6원 탄소 고리에서 형성되었다는 생각은 August Kekulé에 의해 개발되었습니다(아래의 역사 섹션 참조).벤젠의 모델은 두 가지 공명 형태로 구성되어 있으며, 이중 결합과 단일 결합이 겹쳐서 6개의 1.5 결합을 생성합니다.벤젠은 전하 [citation needed]탈국소화를 고려하지 않고 예상했던 것보다 더 안정적인 분자입니다.
교장을 사용한다
그것이 일으키는 독특한 형태, 반응성, 특성, 그리고 생물 활동 때문에, 순환 화합물은 생물의 생화학, 구조, 그리고 기능과 관련된 모든 분자의 가장 큰 대다수이며, 인간이 자연과 제초제를 통제하려고 하는 인공 분자(예: 약물, 제초제 등)에 관여합니다.생물학적 시스템
합성 반응
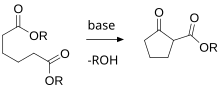
고리 형성하는 것을 위하여 중요한 일반적인 반응이다.
링의 형성만을 목적으로 하는 다양한 특화된 반응이 있으며, 이하에 설명하겠습니다.이들 외에도 역사적으로 중요한 다양한 일반 유기반응이 존재하며, 첫째, 고리화학 개념을 이해하고 둘째, 높은 수율로 고리구조를 조제하기 위한 신뢰성 있는 절차와 고리 치환기의 정의된 방향(즉, 정의된 입체화학)을 갖는 것이다.이러한 일반적인 반응은 다음과 같습니다.
고리 닫힘 반응
유기화학에서 다양한 합성조달제는 특히 카보사이클릭과 다른 고리를 닫는 데 유용하다.이것들을 고리 닫힘 반응이라고 한다.예를 들어 다음과 같습니다.
- 알킨 트리머화
- 버그만 사이클화
- Diels-Alder 및 기타 사이클로드디션 반응
- 나자로프 환화 반응
- 다양한 래디칼 사이클화
- 특정 유형의 중합 달성을 위해 사용할 수 있는 고리 결합 메타제스 반응
- 루지카 대형 링 합성
- 아지리딘의 웬커 합성
링 오픈 반응
다양한 추가 합성 과정이 탄소환 및 기타 고리를 여는 데 특히 유용하며, 일반적으로 화학을 촉진하기 위해 이중 결합 또는 기타 관능기 "핸들"을 포함합니다. 이러한 과정을 고리 개방 반응이라고 합니다.예를 들어 다음과 같습니다.
링 팽창 및 링 수축 반응
고리의 팽창 및 수축 반응은 유기 합성에 공통적이며, 순환 반응에서 자주 발생한다.고리 팽창 및 수축은 여러 가지 예로서 고리형 케톤의 바이어-빌리거 산화의 경우, 분자 내 다이엘스-알더 반응에서 보이는 고리형 카보사이클의 재배열 또는 이환 화합물의 붕괴 또는 재배열과 같은 관능기 삽입을 포함할 수 있다.
예
단순한 단일 사이클 예시
다음은 단순 및 방향족 탄수화물, 무기 순환 화합물 및 헤테로사이클의 예입니다.
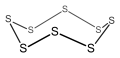
- 단순 단환식 화합물: 탄소환식, 무기환식, 복소환식(방향족 및 비방향족)의 예.
8원짜리 무기환 화합물(비방향족)인 사이클로옥타술프.
펜타졸, 5원짜리 무기 순환 화합물(방향족).
복잡하고 다환적인 예
다음은 보다 복잡한 고리 시스템과 입체 화학적 특징을 나타내는 순환 화합물의 예입니다.
- 복합환상화합물 : 대환상화합물 및 다환상화합물 예시
나프탈렌은 기술적으로 다환식, 구체적으로는 이환식 화합물이며, 원은 γ-전자(방향족)의 비국재화를 나타낸다.
Longifolene, Terpene 천연물 및 삼환식 분자(비방향족)의 예.
곱산, 복잡하고 대칭성이 높은 인공 다환 화합물(비방향족).
「 」를 참조해 주세요.
레퍼런스
- ^ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7[페이지 필요]
- ^ Halduc, I. (1961). "Classification of inorganic cyclic compounds". Journal of Structural Chemistry. 2 (3): 350–8. doi:10.1007/BF01141802. S2CID 93804259.
- ^ Reymond, Jean-Louis (2015). "The Chemical Space Project". Accounts of Chemical Research. 48 (3): 722–30. doi:10.1021/ar500432k. PMID 25687211.
- ^ a b c d e f g h William Reusch (2010). "Stereoisomers Part I" in Virtual Textbook of Organic Chemistry. Michigan State University. Archived from the original on 10 March 2015. Retrieved 7 April 2015.
- ^ a b Still, W.Clark; Galynker, Igor (1981). "Chemical consequences of conformation in macrocyclic compounds". Tetrahedron. 37 (23): 3981–96. doi:10.1016/S0040-4020(01)93273-9.
- ^ a b J. D. Dunitz (1968). J. D. Dunitz and J. A. Ibers (ed.). Perspectives in Structural Chemistry. Vol. 2. New York: Wiley. pp. 1–70.
- ^ 엘리엘, 엘, 윌렌, S.H. 및 맨더, L.S.(1994) 유기화합물 입체화학, 존 와일리와 선스, 뉴욕.[page needed]
- ^ Anet, F.A.L.; St. Jacques, M.; Henrichs, P.M.; Cheng, A.K.; Krane, J.; Wong, L. (1974). "Conformational analysis of medium-ring ketones". Tetrahedron. 30 (12): 1629–37. doi:10.1016/S0040-4020(01)90685-4.
- ^ Morris, Christopher G.; Press, Academic (1992). Academic Press Dictionary of Science and Technology. Gulf Professional Publishing. p. 120. ISBN 9780122004001. Archived from the original on 2021-04-13. Retrieved 2020-09-14.
- ^ Löwe, J; Li, H; Downing, K.H; Nogales, E (2001). "Refined structure of αβ-tubulin at 3.5 Å resolution". Journal of Molecular Biology. 313 (5): 1045–57. doi:10.1006/jmbi.2001.5077. PMID 11700061. Archived from the original on 2021-01-22. Retrieved 2020-09-14.
추가 정보
- 위르겐-힌리히 푸르홉 & 구스타프 펜즐린, 1986, "유기 합성: 개념, 방법, 출발 재료", 와인하임, BW, DEU:VCH, ISBN 0895732467 참조, [1]은 2015년 6월 19일에 접속되었다.
- 마이클 B.Smith & Jerry March, 2007년, "March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure", 6차 Ed, 뉴욕, 뉴욕, 미국: Wiley & Sons, ISBN 0470084944, 참조, 2015년 6월 19일 액세스.
- 프란시스 A.Carey & Richard J. Sundberg, 2006, "Title Advanced Organic Chemistry: Part A: Structure and Mechanisms", 4th Edn., New York, NY: Springer Science & Business Media, ISBN 03064685, 참조[3], 2015년 6월 19일 액세스.
- 마이클 B.Smith, 2011, "유기화학:산성—베이스 접근법," Boca Raton, FL, 미국:CRC Press, ISBN 1420079212, [4] 참조, 2015년 6월 19일 액세스.[이 기사에 가장 필요한 자료는 아닐 수 있지만 중요한 콘텐츠는 온라인으로 입수할 수 있습니다.]
- Jonathan Clayden, Nick Greeves & Stuart Warren, 2012, "유기화학", Oxford, Oxson, GBR: Oxford University Press, ISBN 0199270295, 참조 [5], 2015년 6월 19일 액세스.
- Laszlo Kürti & Barbara Czako, 2005, "유기 합성에서의 명명된 반응의 전략적 적용:배경 및 상세 메커니즘, 암스테르담, NH, NLD:Elsevier Academic Press, 2005 ISBN 0124297854, [6] 참조, 2015년 6월 19일 액세스.


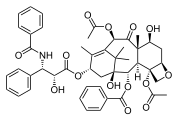










![A representative three-dimensional shape adopted by paclitaxel, as a result of its unique cyclic structure.[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Paclitaxel_JMolBiol_2001_1045.jpg/108px-Paclitaxel_JMolBiol_2001_1045.jpg)

![Benzo[a]pyrene, a pentacyclic compound both natural and man-made, and delocalized π-electrons shown as discrete bonds (aromatic).](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fa/Benzo-a-pyrene.svg/192px-Benzo-a-pyrene.svg.png)