통합효소 억제제의 발견 및 개발
Discovery and development of integrase inhibitors이 글은 갱신할 필요가 있다. (2013년 11월) |
최초의 인간면역결핍바이러스(HIV) 사례는 1980년대 초 미국에서 보고됐다. 이 병을 치료하기 위해 많은 약물이 발견되었지만 바이러스의 돌연변이와 약물에 대한 내성은 발달을 어렵게 한다. 통합효소는 레트로바이러스 DNA를 숙주세포 게놈에 통합하는 바이러스 효소다. 통합효소 억제제는 HIV 치료에 사용되는 새로운 종류의 약이다. 최초의 통합효소 억제제인 랄테그라비르는 2007년에 승인되었고 다른 약품들은 2011년에 임상시험에 들어갔다.
역사
인체는 박테리아, 바이러스 등 질병을 일으키는 존재로부터 자신을 보호하기 위해 면역체계를 사용하며, 그렇게 하지 못할 때 면역결핍 질환이 발생한다. 그러한 질병 중 하나는 후천성 면역결핍증후군이다. 이것은 인간의 면역결핍 바이러스(HIV)에 의한 감염의 결과물이다.[1] HIV-1과 HIV-2라는 두 종류의 밀접하게 연관된 HIV가 확인되었다. HIV-2가 인도와 서아프리카에서 확산되고 있는 반면, HIV-1은 더 독성이 강하며 전 세계적으로 에이즈의 원인 1위를 차지하고 있다. 비록 몇몇 환자들은 다른 결과를 가지고 있지만, 대부분의 경우 HIV에 감염된 사람들은 에이즈에 걸리고 결국 기회주의적인 감염이나 암으로 죽는다. 레트로바이러스 게놈과의 통합은 유전자 발현과 바이러스 복제에 매우 중요하다. 바이러스 게놈은 바이러스 역분해효소에 의해 감염된 세포의 DNA로 역번역되어, DNA는 바이러스 통합효소의 도움으로 숙주세포 염색체에 통합된다. RNA 대본은 통합된 바이러스 DNA에서 생성되며, 바이러스 단백질의 합성을 지시하는 mRNA와 나중에 새로운 바이러스 입자의 RNA 게놈으로 모두 사용된다. 바이러스 입자들은 각각 막 봉투에 싸여 있는 혈장 막에서 싹을 틔워 세포로부터 탈출한다.[2]
이 과정에서 HIV-1 통합효과는 필수적이며 따라서 에이즈 방지 약물 설계의 매우 유망한 표적이다. 선택적 약물 설계는 HIV-1 통합효소에는 알려진 세포 동등성이 없기 때문에 가능하다.[3] 많은 통합효소 억제제들이 발견되고 설계되었지만, 단지 몇몇 분자들만이 더 발전하여 임상시험의 2단계나 3단계까지 도달했다. 랄테그라비르(브랜드명 이센트레스)는 2007년 10월 미국 식품의약국(FDA)과 2007년 12월 EMA(현 EMA)로부터 가속 승인을 받았다.[4][5] 이미 최소 3개의 ARV 수업에 노출되어 다약 저항성을 보인 HIV-1 감염 성인을 위한 항레트로바이러스제(ARV)로 시판되었다. 일반적으로 통합효소 억제제에는 INSTI(Integrase Strand Transfer Inhibrants)와 INBI(Integrase Binding Inhibrants)의 두 가지 주요 그룹이 있다. INSTI는 PIC(사전 통합 복합체)의 결합을 억제하고, DNA와 INBI는 통합효소 및 바이러스 DNA 결합을 억제한다. 랄테그라비르는 HIV-1과 HIV-2 복제를 모두 억제하는 INSTI 통합효소 억제제다. 그것은 부작용을 덜 일으킬 뿐만 아니라 이전에 알려진 다른 통합효소 억제제보다 더 강력하다. Raltegravir, Elvitegravir, Dolutegravir, Bictegravir는 HIV-1 통합효소 억제제 중 유일하게 HIV 감염 S/GSK1349572를 치료하는데 사용된다.[4][6][7][8]
HIV-1 통합효소
HIV-1 통합효소(IN)는 역바이러스의 복제 메커니즘의 핵심 효소다.[9] 그것은 레트로바이러스 복제에 필요한 사건인 호스트 염색체에 가상으로 인코딩된 DNA의 전달을 담당한다.[10] IN은 숙주세포에 동등성이 없기 때문에 적분효소 억제제는 정상적인 세포 과정을 방해하지 않기 때문에 치료지수가 높다.[11]
구조
IN은 기계적으로나 구조적으로 모두 다핵화합물 10의 슈퍼패밀리에 속하며, 32 kDa 단백질을 구성하는 288개의 아미노산으로 구성되어 있다.[9] 레트로바이러스는 그들의 효소(단백질, 역순화효소, 통합효소)를 POL 유전자와 인코딩하여 3'end 인코딩을 한다.[11]
IN은 구조적으로 독립적인 기능 영역 3개로 구성된다(그림 1 참조).:[9]
1. N-단자영역(NTD)은 아미노산 1-50을 포괄하며 히스티딘 잔류물(His12와 His16) 2개와 시스테인 잔류물(Cys40, Cys43) 2개를 포함하고 있으며, 모두 절대 보존되어 HHCC 아연 핑거 모티브를 형성하고 있다.[9][12] 이 네 가지 잔류물 중 하나를 단일 돌연변이로 인해 IN 효소 활성도가 감소한다.[11] HHCC 아연 손가락 모티브는 IN 모노머당 아연 원자 1개를 킬레이트한다. NTD는 그것의 주요 역할로 보이는 고차 멀티머 형성을 위해 필요하다.[12][13] 다중화에는 접힌 부분을 안정시키는 아연 원자가 필요하다.[12]
2. 아미노산 51-212를 포괄하는 촉매핵심영역(CCD)은 IN의 활성부위를 포함하고 있으나 NTD와 CTD(C-단자영역)가 없는 상태에서는 통합을 촉매할 수 없다.[11] CCD에는 D64, D116 및 E152의 세 가지 음전하 아미노산이 절대적으로 보존되어 있다.[9] 이러한 아미노산은 이분 금속 이온(Mg2+ 또는 Mn2+)을 조정하는 DDE 모티브를 형성한다. 이 금속 이온은 통합의 촉매에 필수적이다.[12][13] CCD는 5개의 β-시트 및 6개의 α 헬리코스를 가진 혼합 β와 α 구조를 가지고 있으며, 플렉시블 루프로 연결된다.[12] 유연한 루프는 통합 반응의 두 가지 핵심 단계인 바이러스 DNA와 스트랜드 전이(STF) 반응의 3' 처리에 필요한 순응적 변화를 허용한다.[9] CDDE 모티브에 있는 잔류물의 대체와 이러한 단계에 CCD는 필수적이며 IN의 활동을 극적으로 억제한다.[12]
3. 아미노산 213–288을 포괄하는 C-단자 영역(CTD)은 DNA를 비특이적으로 결합하며, IN 3'의 처리 및 Strand-transfer 활동에 NTD 및 CCD와의 상호작용이 요구된다.[11][12] CTD는 세 개의 도메인 중에서 가장 보존이 덜 되어 있다.[12] IN은 멀티머 역할을 하며 3' 처리 단계에서는 디머라이징이 필요하며, 4중격 IN은 스트랜드 전달 반응을 촉진한다.
함수
HIV-1 통합은 두 가지 촉매 반응을 포함하는 다단계 프로세스를 통해 이루어진다. 즉, 3단계에서 처리된 바이러스 DNA를 세포 DNA에 통합하는 3단계 과정이다.[6] 3'에서 처리 IN은 바이러스성 DNA의 긴 단자 반복(LTR)의 양쪽 끝에 위치한 짧은 시퀀스에 결합하고 내핵분열을 촉매한다. 이것은 LTR의 각 3개 끝에서 디뉴클레오티드를 제거하는 결과를 낳는다. 그런 다음 절삭된 DNA는 통합이나 가닥 전이를 위한 기질로 사용된다.[9] 스트랜드 전이(Strand transfer)는 호스트 대상 DNA의 인산염 등뼈에서 새롭게 처리된 두 바이러스 3'DNA 종단 중 3'hydroxy 그룹의 직접 핵폭발과 관련된 전이 반응이다.[14] 이것은 감염된 세포의 게놈에 바이러스 DNA의 공동 삽입으로 이어진다. 스트랜드 전달은 바이러스성 DNA 분자의 양쪽 끝에서 동시에 발생하며, 삽입의 두 반대점 사이에 정확히 5개의 염기쌍이 상쇄된다.[9] 통합 반응은 바이러스 DNA의 5의 끝에서 손상된 디뉴클레오티드를 제거하고, 바이러스 분자와 표적 DNA 분자 사이에 발생하는 단일 가닥의 간격을 복구하며, 숙주 DNA의 끝에서 5의 끝까지의 3의 끝을 연결함으로써 완성된다.[9][14] 두 가지 금속인 Mg2+ 또는 Mn은2+ 특정 바이러스 기증자 DNA에 IN을 조립하고 특정 기능을 수행할 수 있는 복합체를 형성하기 위해 3' 처리 및 Strand 전송 단계를 필요로 한다. 인간 세포에 있는 마그네슘(Mg2+) 대 망간(Mn)의 풍부함이 100만배이기 때문에 마그네슘은 통합을 위해 더 쉽게 이용할 수 있는 이분법적 공동 인자처럼 보인다.[6]
작용기전
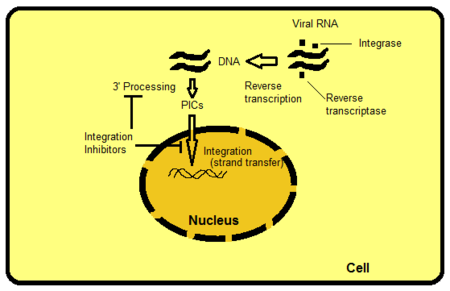
통합을 목표로 하는 방법에는 여러 가지가 있지만, Strand transfer inhibility는 가장 직관적으로 분명하고 현재까지 쉽게 추구되고 있다. 예를 들어, 다른 대상에는 IN의 활성 사이트를 벗어난 단백질 도메인이 포함된다. 도메인은 바이러스성 또는 숙주 DNA와 상호작용하며 효소에 결합하는데 중요하다. 이러한 바인딩을 방해하거나 제거함으로써 효소의 기능을 방해할 수 있다. PIC는 숙주세포 안에 있는 복합 단백질 구조로 바이러스성 단백질과 숙주 단백질로 구성되어 있다. Integrase는 PIC의 바이러스 구성 요소 중 하나이다. PIC의 바이러스성 단백질과 숙주 단백질은 효소의 내인성 활성을 조절하고, 핵으로 셔틀 PIC를 만들고, 바이러스 DNA를 숙주 게놈의 전사적 활성 영역으로 직접 통합하는 것으로 여겨진다. PIC에서 특정 단백질을 제외할 수 있다면 숙주 게놈으로 통합되는 바이러스의 능력을 차단할 것이다. 레트로바이러스 RNA가 DNA로 변환된 후 숙주세포의 게놈에 통합되는 과정은 그림 2와 같다.[8]
IN Strand 전송 억제제(INSTI)
Mg와2+ Mn은2+ 통합 단계의 중요한 공동 인자다. 이러한 공동 인자(예: 첼레이션을 통한)를 비활성화하면 IN의 기능 손상이 발생한다. 이 개념은 연구자들에게 고도로 효율적인 INI 억제제(INIs)를 설계하고 개발할 수 있는 기회를 제공한다. 실제로 현재 연구 중인 모든 소분자 HIV-1 INI는 효소의 활성 부위에서 두 개의 분자 마그네슘 이온을 조정하는 구조 모티브를 포함하고 있다.[6]
랄테그라비르와 엘비테그라비르는 통합에 대항하는 동일한 작용 메커니즘을 공유한다: Mg2+ 이온의 활성 부지에 결합하는 것이다.[8] 경쟁 억제제는 3' 엔드 처리를 억제하기 위해 통합에 결합하기 위해 바이러스 DNA와 직접 경쟁한다.[15] 이를 통해 억제제는 활성 부위가 대상 DNA로 결합되는 것을 완전히 차단한다. 이 억제를 Strand transfer inhibition이라고 한다.[8]
LEDGF/p75-집적효소 상호작용 억제
렌즈 상피 성장인자(LEDGF/p75)는 통합효소에 결합하는 숙주 단백질로 바이러스 복제에 중요하다. 행동 메커니즘은 정확히 알려져 있지 않지만 LEDGF/p75 가이드가 숙주 게놈의 전사적으로 활성 부위에 바이러스 DNA를 삽입하도록 통합된다는 증거가 제시된다. 이 단백질에 대한 억제제는 이미 개발되고 특허를 획득하고 있다. 그들은 매우 구체적이고 저항의 발달에 덜 취약할 가능성이 있다.[8]
IN 결합 억제제
또 다른 종류의 INI는 V-165와 같은 INBI(In binding inventors)일 수 있다. V-165는 통합을 억제하는 것으로 보여지지만 바이러스성 DNA 합성에 뚜렷한 영향은 없다. 작용 메커니즘을 연구했을 때 V-165가 바이러스성 DNA-IN 복합 형성을 방해한다는 것을 보여주었다. 간섭 작용으로 인해 IN 결합 억제제로 분류된다. 스티릴퀴놀린과 같은 다른 화합물들은 IN 결합을 위한 LTR 기질과 경쟁함으로써 유사한 메커니즘을 공유한다.[16]
약물 설계
바인딩
INSTI는 촉매 3중창(DDE) 모티브에 의해 조정되는 분열 금속 이온(Mg2+)을 킬링함으로써 DNA의 끝과 관련된 IN과 단단하고 구체적으로 결합된다.[9] DDE 모티브는 IN의 CCD에 위치하며 효소의 활성 부위가므로 INSTI는 활성 부위 억제제라고 불린다. INSTI는 3' 바이러스 DNA의 처리가 끝난 후 발생하는 순응에만 존재하는 사이트인 IN의 DDE 모티브에 가까운 특정 사이트에 바인딩된다. 바이러스 DNA는 억제제 결합 부위의 일부를 형성할 수 있다. 결합은 특정 통합체-바이러스 DNA 복합체의 차단을 의미하기 때문에 고농축 억제의 일종이다.[12] 이는 3' 처리 반응에 유의미한 영향을 미치지 않으면서 스트랜드 전달 반응을 선택적으로 억제한다.[9] 따라서 INSTI는 보다 구체적이고 대상 DNA 결합 사이트에 선택적으로 결합될 수 있으며 따라서 기증자와 대상 결합 사이트 모두에 결합할 수 있는 분기 억제제보다 독성이 덜할 수 있다.[12]
INBI도 IN에 바인딩되지만 동작 메커니즘을 알 수 없으므로 바인딩이 자세히 설명되지 않는다.[16]
구조활동관계(SAR)
통합효소 결합에는 두 가지 구조적 구성요소가 필요하다. 즉, 활성 부위 근처에 있는 높은 소수성 주머니 속으로 파고드는 소수성 벤질 모이티와 억제제를 단백질 표면에 고정시키는 다소 친수성 영역에서 두 Mg2+ 이온과 결합하는 첼레이트성 삼합체(chelting triad)이다(그림 3 참조).[17] 실제로 모든 잠재적 통합효소 억제제는 3'end 접합 효력 유지에 중요한 대체 벤질 성분을 가지고 있다. 벤질 그룹을 제거하면 억제 기능을 방지할 수 있다.[15] 따라서 지질 대체물은 특히 티오페닐, 후라닐 및 (티오펜-2-yl)페닐 대체물로서 스트랜드 전달 억제에 이롭다. 또한 이질적인 아민과 아미드는 3의 처리 억제 작용의 증가를 유발한다.[6]
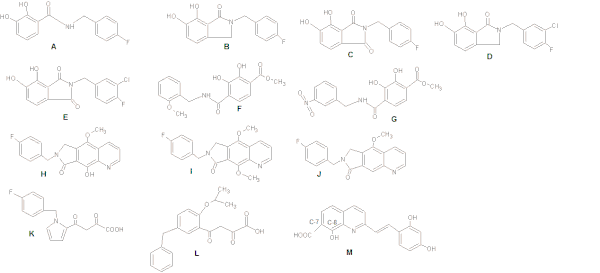
카테콜 기반의 IN 억제제를 연구했을 때, 비스 수소화 아릴 링과의 평면 관계를 유지하는 것이 효력이 증가한다는 것이 관찰되었다. 억제 활성은 메타-클로로 대체물을 포함시켜 인접 소수성 포켓과의 벤질 그룹의 상호작용을 강화함으로써 더욱 최적화될 수 있다(그림 4: Structures A-G 참조).[8]
벤질 대체 하이드록실 그룹(그림 4 H)은 금속 쉘링 능력을 향상시킨다(그림 4 H). 4) 메톡시 그룹(I)은 촉매 금속과 추가 메틸 그룹에 의한 강직성 충돌로 인해 훨씬 덜 강력하다.[15]
디케토 유도체를 연구할 때, 그림 4에 있는 구조 K의 중심 피롤 링은 다양한 대체 패턴을 가진 일련의 방향족 시스템으로 대체되었다. 그것은 벤질 및 디케토아시드(DKA) 사이트 체인의 최적 상대적 방향을 제공했다. 그림 4의 L 구조는 효력이 100배 증가하였다.[18]
Benard 외 연구진(2004)은 INI를 키놀린 서브 유닛 및 아미드, 하이드라자이드, 요소 및 히드록시프로프-1-엔-3-1 몰이티와 같은 기능화된 스페이서로 연결된 보조 방향족 링과 합성했다. 그들은 파생상품을 포함한 아미드 그룹이 가장 유망하다는 것을 발견했다.[18][19] 일련의 스타일퀴논을 합성하여 연구자들은 C-7의 카복실 그룹, 퀴놀린 서브 유닛의 C-8의 히드록실 그룹 및 보조 페닐 링(그림 4: Structure M)이 비록 고리의 변경은 허용되지만 억제에는 필요하다는 것을 알아냈다. 억제 효력에도 보조 페닐 링에 있는 두 개의 히드록실 그룹이 필요하다.[18]
약리학
HIV 통합효소 강직성에서는 중요한 구조 정보가 드물기 때문에, HIV 통합효소 강직성에 대한 정확한 약리학적 정보를 찾기가 어렵다. 왕 외 연구진(2010년)은 적분효소 및 역적분해효소(RT)에 초점을 맞춘 이중억제제 비계의 SAR과 약리학을 연구함으로써 반적분해효소 활동을 관찰할 수 있을 것으로 기대했다. HIV 통합효소 억제제의 SAR을 연구함으로써 최적의 통합효소 억제를 위해 약리학자는 특정 길이의 레지오세페셜(N-1) DCA를 필요로 한다는 것을 발견할 수 있었다. 스트랜드 전이를 선택적으로 억제하는 DCA 기능 또는 이의 이질적 생체이소스테레는 모든 주요 통합효소 억제제 화학유형에 존재하는 것처럼 보인다.[17] 위의 SAR 논의에서 자세히 설명한 것처럼 INI의 두 필수 구조적 구성요소는 벤질 소수성 무아지경과 Mg2+ 이온을 결합하는 첼팅 삼합창이다. 삼합체가 Mg2+ 이온을 결합하기 위해서는 이온화되어야 하고(그림 5 참조),[11][17] 따라서 약성 생물 이온화되어야 하며 벤질 약성 생물 이온화되어야 한다.
다만 임상개발(랄테그라비르)의 이전 성공에도 불구하고 세부적인 결합모델이 부족하여 통합효소 억제제 설계 기반구조가 어렵다는 것이 입증되었다. 살리실산과 카테콜의 약리성분이 합쳐지면서 새로운 화학비판이 탄생했다. 살리실산에 인접한 히드록실 및 카르복실 그룹은 금속 이온과 결합하여 약리 작용을 할 수 있다. 폴리히드록실화 방향족 억제제는 대부분 스트랜드 전달 반응과 3' 처리에 대해 활성화되며, 이는 두 단계를 모두 대상으로 하는 메커니즘을 시사한다. 이것은 IN의 활성 부위의 분열 금속과 결합하는 데 사용될 수 있고, 따라서 스트랜드 전이 특정 억제제에 내성이 있는 바이러스 변종에 효과적일 수 있기 때문에 화합물의 매우 중요한 부분이다.[6][17]
저항
60개 이상의 INSTI 돌연변이가 체내 및 체외 저항을 유발한다는 사실이 밝혀졌다. 이러한 돌연변이와 저항의 발달로 인해 억제제는 바이러스에 덜 효과적이다.[9] INI의 저항은 다른 ARV 약물에 해당한다. 첫 번째 IN 저항은 바이러스 민감도를 더욱 감소시키고/또는 바이러스의 적합성을 감소시키는 2차 돌연변이와 함께 INI 민감도를 감소시키는 1차 돌연변이에 의해 발생한다. 둘째, 임상 INI 활동 상실에 필요한 돌연변이의 수로 정의되는 INI 저항에는 유전적 장벽이 있다. 셋째로 INI들 사이에는 광범위하지만 불완전한 교차 저항이 있다.[13] 아미노산 잔류물 140–149를 포함하는 루프는 촉매핵심 영역에 위치하며 앞에서 언급한 바와 같이 IN 기능에 중요하다. 이 루프는 유연하며, 비록 그것의 역할이 잘 알려져 있지 않지만 그것은 중요한 것으로 생각되고 그것의 기능은 DNA 결합에 중요하다. 이 저항은 이 IN-코딩 영역의 돌연변이 내에서 나타난다.[9] 랄테그라비르와 엘비테그라비르에 대한 저항은 주로 동일한 두 개의 돌연변이 경로에 기인하지만 다른 일차 돌연변이도 각각의 약물에 관여한다.[10] 어떤 돌연변이는 다른 돌연변이에 비해 약물에 대한 저항력을 크게 높인다. 예를 들어, 가장 흔한 돌연변이 경로 중 하나는 랄테 그라비르에 대한 저항을 두 번째로 가장 흔한 경로보다 최대 100배까지 증가시킨다.[9] Integrase 억제제 S/GSK1349572에 대한 저항은 여전히 개발 중이고 저항은 완전히 특성화되지 않았다. 랄테그라비르와 엘비테그라비르의 1차 돌연변이와 함께 평가되었을 때, 그것은 교차 저항성을 보여주지 않았으며, 이것은 그것이 약물 내성 바이러스에 대해 유용할 수 있다는 것을 의미한다.[7] 랄테그라비르는 장내 흡수가 제한적이어서 더 많은 양을 처방한다고 해서 저항력을 극복할 수 없다. 신약은 이러한 약리학적 단점을 극복하고 랄테그라비르 저항성 바이러스를 타겟으로 할 만큼 높은 혈장 농도를 얻을 수 있도록 보증된다.[7]
현재 상태
HIV에 감염된 환자에 대한 치료를 개선하기 위한 새로운 방법을 찾는 일은 끊이지 않는다. 1980년대 인스티스의 ARV 약물 개발 도착 이후 수집된 경험을 새로운 강력한 ARV 등급으로 생각하면 HIV 치료의 새로운 시대를 알리는 신호탄이다. Merck Sharp & Dohme Limited에 의해 Raltegravir가 발견되었을 때 성공적인 INSTI 치료의 개발이 이루어졌다.[12] 조건부 마케팅 허가는 2007년 12월 유럽연합 전체에 걸쳐 유효한 유럽 위원회에 의해 허가되었다.[20] 2009년에 이 허가가 완전한 마케팅 허가로 전환되었고 같은 해 FDA는 승인을 가속에서 전통적 허가로 변경하고 이 약물을 1라인 ARV 치료제로 등재하였다.[12][21] 두 번째 INSTI 약물인 엘비테그라비르는 일본 담배에 의해 확인되었고 2005년에 임상시험이 시작되었다. 2011년, 이 약은 여전히 랄테그라비르와 비교되고 있는 임상 3상이었고, 경험이 많은 피험자를 치료하는 데 있어, 또한 다약 치료의 일부로서 순한 피험자를 대상으로 한 2상 개발 중에 있다.[12] S/GSK1349572는 2011년 임상 3상에 들어가던 VixV/Sinongi가 발견한 통합효소 억제제다. 이 신약은 유망하고 잘 용인되는 것 같아서 지금까지 랄테그라비르와 엘비테그라비르보다 더 좋은 결과를 보여주고 있다.[22]
랄테그라비르와 엘비테그라비르에 대한 저항성에 문제가 생긴 이후 과학자들은 2009년 머크가 개발한 MK-2048과 같은 새로운 2세대 통합효소 억제제를 개발하기 시작했다. 그것은 랄테그라비르와 엘비테그라비르에 대항하는 돌연변이를 포함하는 바이러스에 대해 여전히 강력한 것으로 남아 있는 2세대 INSTI의 프로토타입이다. MK-2048의 작용 메커니즘과 SAR은 다른 INSTI와 동일하며, 필수 약리학적 약리학적 특성이 강조된 그림 6에 나타낸 MK-2048의 구조는 다른 INSTI와 동일하다.[23][24]
위에서 논의된 약들이 개발의 길이 멀다고 약속하고 있음에도 불구하고, 이러한 약들의 효능, 안전, 작용 메커니즘에 대해 많은 것들이 여전히 알려져 있지 않다.[7]
참고 항목
참조
- ^ Johnson, Dee Unglaub Silverthorn ; with William C. Ober, illustration coordinator ; Claire W. Garrison, illustrator ; Andrew C. Silverthorn, clinical consultant ; with contributions by Bruce R. (2007). Human physiology : an integrated approach (4th ed.). San Francisco: Pearson/Benjamin Cummings. ISBN 978-0-8053-6849-9.
- ^ Murphy, Kenneth; Travers, Paul; Walport, Mark (2008). Janeway's immunobiology (7th ed.). New York: Garland Science. ISBN 978-0-8153-4123-9.
- ^ Pommier, Y; Marchand, C; Neamati, N (Sep 2000). "Retroviral integrase inhibitors year 2000: update and perspectives". Antiviral Research. 47 (3): 139–48. doi:10.1016/S0166-3542(00)00112-1. PMID 10974366.
- ^ Jump up to: a b Dąbrowska, Magdalena Monika; Wiercińska-Drapało, Alicja (1 Jan 2007). "Integrase inhibitors as a new class of ARV treatment". HIV & AIDS Review. 6 (4): 10–14. doi:10.1016/S1730-1270(10)60053-7.
- ^ "FDA approval of Isentress (raltegravir)". U.S. Food and Drug Administration (FDA). Retrieved 25 Sep 2011.
- ^ Jump up to: a b c d e f Fan, X; Zhang, FH; Al-Safi, RI; Zeng, LF; Shabaik, Y; Debnath, B; Sanchez, TW; Odde, S; Neamati, N; Long, YQ (2011-08-15). "Design of HIV-1 integrase inhibitors targeting the catalytic domain as well as its interaction with LEDGF/p75: a scaffold hopping approach using salicylate and catechol groups". Bioorganic & Medicinal Chemistry. 19 (16): 4935–52. doi:10.1016/j.bmc.2011.06.058. PMC 3163123. PMID 21778063.
- ^ Jump up to: a b c d Lenz, JC; Rockstroh, JK (Apr 2011). "S/GSK1349572, a new integrase inhibitor for the treatment of HIV: promises and challenges". Expert Opinion on Investigational Drugs. 20 (4): 537–48. doi:10.1517/13543784.2011.562189. PMID 21381981.
- ^ Jump up to: a b c d e f Pendri, A; Meanwell, NA; Peese, KM; Walker, MA (Aug 2011). "New first and second generation inhibitors of human immunodeficiency virus-1 integrase". Expert Opinion on Therapeutic Patents. 21 (8): 1173–89. doi:10.1517/13543776.2011.586631. PMID 21599420.
- ^ Jump up to: a b c d e f g h i j k l m n Mouscadet, JF; Delelis, O; Marcelin, AG; Tchertanov, L (Aug–Oct 2010). "Resistance to HIV-1 integrase inhibitors: A structural perspective". Drug Resistance Updates : Reviews and Commentaries in Antimicrobial and Anticancer Chemotherapy. 13 (4–5): 139–50. doi:10.1016/j.drup.2010.05.001. PMID 20570551.
- ^ Jump up to: a b Cocohoba, J; Dong, BJ (Oct 2008). "Raltegravir: the first HIV integrase inhibitor". Clinical Therapeutics. 30 (10): 1747–65. doi:10.1016/j.clinthera.2008.10.012. PMID 19014832.
- ^ Jump up to: a b c d e f Pommier, Yves; Johnson, Allison A.; Marchand, Christophe (24 Feb 2005). "Integrase inhibitors to treat HIV/Aids". Nature Reviews Drug Discovery. 4 (3): 236–248. doi:10.1038/nrd1660. PMID 15729361.
- ^ Jump up to: a b c d e f g h i j k l m McColl, DJ; Chen, X (Jan 2010). "Strand transfer inhibitors of HIV-1 integrase: bringing IN a new era of antiretroviral therapy". Antiviral Research. 85 (1): 101–18. doi:10.1016/j.antiviral.2009.11.004. PMID 19925830.
- ^ Jump up to: a b c Blanco, JL; Varghese, V; Rhee, SY; Gatell, JM; Shafer, RW (2011-05-01). "HIV-1 integrase inhibitor resistance and its clinical implications". The Journal of Infectious Diseases. 203 (9): 1204–14. doi:10.1093/infdis/jir025. PMC 3069732. PMID 21459813.
- ^ Jump up to: a b De Luca, Laura; De Grazia, Sara; Ferro, Stefania; Gitto, Rosaria; Christ, Frauke; Debyser, Zeger; Chimirri, Alba (Feb 2011). "HIV-1 integrase strand-transfer inhibitors: design, synthesis and molecular modeling investigation". European Journal of Medicinal Chemistry. 46 (2): 756–764. doi:10.1016/j.ejmech.2010.12.012. PMID 21227550.
- ^ Jump up to: a b c Chen, X; Tsiang, M; Yu, F; Hung, M; Jones, GS; Zeynalzadegan, A; Qi, X; Jin, H; Kim, CU; Swaminathan, S; Chen, JM (2008-07-11). "Modeling, analysis, and validation of a novel HIV integrase structure provide insights into the binding modes of potent integrase inhibitors". Journal of Molecular Biology. 380 (3): 504–19. doi:10.1016/j.jmb.2008.04.054. PMID 18565342.
- ^ Jump up to: a b Hombrouck, A.; Hantson, A.; van Remoortel, B.; Michiels, M.; Vercammen, J.; Rhodes, D.; Tetz, V.; Engelborghs, Y.; Christ, F.; Debyser, Z.; Witvrouw, M. (Jun 2007). "Selection of human immunodeficiency virus type 1 resistance against the pyranodipyrimidine V-165 points to a multimodal mechanism of action". The Journal of Antimicrobial Chemotherapy. 59 (6): 1084–95. doi:10.1093/jac/dkm101. PMID 17470918.
- ^ Jump up to: a b c d Wang, Z; Tang, J; Salomon, CE; Dreis, CD; Vince, R (2010-06-15). "Pharmacophore and structure-activity relationships of integrase inhibition within a dual inhibitor scaffold of HIV reverse transcriptase and integrase". Bioorganic & Medicinal Chemistry. 18 (12): 4202–11. doi:10.1016/j.bmc.2010.05.004. PMID 20576573.
- ^ Jump up to: a b c Dubey, S; Satyanarayana, YD; Lavania, H (Sep 2007). "Development of integrase inhibitors for treatment of AIDS: an overview". European Journal of Medicinal Chemistry. 42 (9): 1159–68. doi:10.1016/j.ejmech.2007.01.024. PMID 17367896.
- ^ Bénard, C; Zouhiri, F; Normand-Bayle, M; Danet, M; Desmaële, D; Leh, H; Mouscadet, JF; Mbemba, G; Thomas, CM; Bonnenfant, S; Le Bret, M; d'Angelo, J (2004-05-17). "Linker-modified quinoline derivatives targeting HIV-1 integrase: synthesis and biological activity". Bioorganic & Medicinal Chemistry Letters. 14 (10): 2473–6. doi:10.1016/j.bmcl.2004.03.005. PMID 15109635.
- ^ "Isentress" (PDF). European Medicines Agency. Retrieved 17 Sep 2011.
- ^ "Traditional approval of Isentress (raltegravir)". U.S. Food and Drug Administration (FDA). Retrieved 25 Sep 2011.
- ^ Barnhart, Matthew; James Shelton (April 2011). "A better state of ART improving antiretroviral regimens to increase global access to HIV treatment". Journal of AIDS and HIV Research. 3 (4): 71–78.
- ^ Bar-Magen, T; Sloan, RD; Donahue, DA; Kuhl, BD; Zabeida, A; Xu, H; Oliveira, M; Hazuda, DJ; Wainberg, MA (Sep 2010). "Identification of novel mutations responsible for resistance to MK-2048, a second-generation HIV-1 integrase inhibitor". Journal of Virology. 84 (18): 9210–6. doi:10.1128/JVI.01164-10. PMC 2937597. PMID 20610719.
- ^ Goethals, O; Vos, A; Van Ginderen, M; Geluykens, P; Smits, V; Schols, D; Hertogs, K; Clayton, R (2010-07-05). "Primary mutations selected in vitro with raltegravir confer large fold changes in susceptibility to first-generation integrase inhibitors, but minor fold changes to inhibitors with second-generation resistance profiles". Virology. 402 (2): 338–46. doi:10.1016/j.virol.2010.03.034. PMID 20421122.