면역억제이미드약
Immunomodulatory imide drug| 면역억제이미드약 | |
|---|---|
| 마약류 | |
 탈리도마이드 | |
| 클래스 식별자 | |
| 사용하다 | Erythema nodosum leprosum, 다발성 골수종, 골수이식성 증후군, 급성 골수성 백혈병 및 기타 면역학적 조건 |
| ATC 코드 | L04AX |
| 생물학적 표적 | TNF, IL-6, VEGF, NF-kB 등 |
| 임상자료 | |
| Drugs.com | 마약 클래스 |
| 위키다타에서 | |
면역억제이미드제(IMiDs)는 이미드군이 함유된[1] 면역억제제(면역반응을 조절하는 약물)의 일종이다.IMiD 등급은 탈리도마이드와 그 아날로그(레날리도마이드, 포말리도마이드, 이버도마이드)를 포함한다.[1]이러한 약물을 '세레블론 조절기'라고도 할 수 있다.세레블론(CRBN)은 이 등급의 약물이 표적이 된 단백질이다.
"IMID"라는 이름은 "IMD"의 "IMD"와 "이미드", "이미드", "이미드", "이미드" 그리고 "이미드"의 형태를 암시한다.
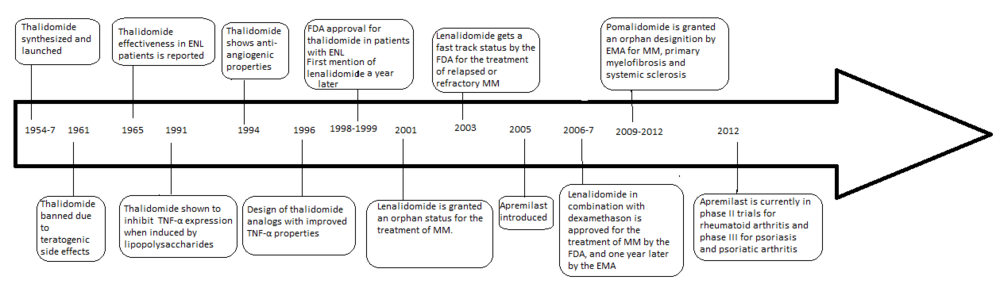
탈리도마이드의 아날로그 개발은 1961년 금지된 이후 일부 염증성 질환뿐만 아니라 암을 퇴치하는 새로운 방법을 만들어내는 항혈관신생 및 항염증 성질이 발견되면서 촉발되었다.탈리도마이드의 문제점은 기형 유발 부작용, 다른 부작용의 높은 발생률, 물에서의 용해성 불량, 장으로부터의 흡수 불량 등이다.
1998년 탈리도마이드는 엄격한 규제 하에 새로 진단된 다발성 골수종(MM)에 사용하도록 미국 식품의약국(FDA)의 승인을 받았다.[2]이로 인해 현재 셀젠이 시판·제조하고 있는 레날리도마이드, 포말리도마이드 등 부작용이 적고 효력이 높아진 아날로그가 다수 개발됐다.
역사
탈리도미드는 원래 1957년 10월 1일 독일 연방 공화국(서독)에서 케미 그뤼넨탈(현 그뤼넨탈)에 의해 콘테르간(Contergan)이라는 레이블로 발매되었다.이 약은 주로 진정제나 최면제로 처방되었지만, 임산부들의 입덧에 대한 항임증으로도 사용되었다.이 약은 기형성 성질이 관찰된 후 1961년에 금지되었다.탈리도마이드의 문제점은 기형 유발 부작용 외에도 다른 부작용의 높은 발생률과 함께 물 속 용해도가 떨어지고 장에서 흡수된다는 것이었다.[3][4]부작용으로는 피부과 합병증과 함께 대다수의 환자의 말초신경장애, 변비, 혈전증 등이 있다.[5]
탈리도미드가 심각한 선천성 결함을 유도하는 능력을 보여 시장에서 철수된 지 4년 만에 에리테마 노도섬레프로섬(ENL)을 앓는 환자들이 탈리도미드를 진정제로 사용하면서 그 항염증 특성이 발견돼 질병의 임상 증상과 증상을 모두 줄였다.탈리도마이드는 1991년(a Sampaio, Sarno, Galilly Cohn, Kaplan, JEM 173 (3) 699–703, 1991년) 종양 괴사 인자-알파(TNF-α)를 억제하는 것으로 밝혀졌으며, TNF-α는 면역계의 대식세포에 의해 생성되는 사이토카인자(cytokine)이기도 하다.따라서 이 약은 ENL (6a Sampaio, Kaplan, Miranda, Nery...)과 같은 염증성 질환에 효과적이다.JID 168(2) 408-414 2008.1994년 탈리도미드는 다발성 골수종을 포함한 암에 대한 임상시험 개시를 촉진하는 항혈관신생 활동과[6] 항투석 활동을[7] 하는 것으로 밝혀졌다.탈리도마이드의 항염증, 항혈관신생, 항염증 활성의 발견은 더 안전한 아날로그의 추가 연구와 합성에 대한 관심을 증가시켰다.[8][9]
레날리도마이드(Lenalidomide)는 시판되는 탈리도마이드의 첫 번째 아날로그다.프탈로일 링의 위치 4에 아미노 그룹이 추가되고 프탈로일 링에서 카보닐 그룹이 제거되는 등 분자 수준에서 두 가지 차이만 있는 모약보다 훨씬 강력하다.[10]레날리도마이드의 개발은 1990년대 후반에 시작되었고 레날리도마이드의 임상시험은 2000년에 시작되었다.2001년 10월 레날리도미드는 MM의 치료로 고아 지위를 부여받았으며, 2002년 중반에 2단계에 접어들었고 2003년 초에는 3단계에 접어들었다.2003년 2월 FDA는 재발 또는 내화 MM 치료로 레날리도마이드에 패스트트랙 지위를 부여했으며,[8] 2006년에는 덱사메타손과 함께 MM 치료를 승인했으며, 2007년에는 유럽의약품청(EMA)에 의해 MM 치료를 승인받았다.2008년 2단계 임상시험에서는 비호지킨 림프종을 치료하는 데 효능이 관찰되었다.[11]
포말리도마이드(3-aminothalidomide)는 이전 두 진료소보다 더 강력한 힘을 발휘하며 병원에 들어온 두 번째 탈리도마이드 아날로그였다.[12]2001년에 처음 보고된 포말리도미드는 골수종 세포 증식을 직접적으로 억제하여 종양과 혈관 구획 모두에서 MM을 억제하는 것으로 기록되었다.[13]이러한 포말리도마이드의 이중 활성은 체외와 체내 둘 다 탈리도마이드보다 더 효과적이다.[14]로립람, 펜톡시파이델린 등 강력한 TNF-α 억제제가 골수종 세포 성장이나 혈관신생을 억제하지 않았기 때문에 이 효과는 TNF-α 억제와는 관련이 없다.[9]인터페론 감마, IL-2 및 IL-10의 상향 조정은 포말리도마이드에 대해 보고되었으며, 항혈관신생 및 골수종 활동에 기여할 수 있다.
개발
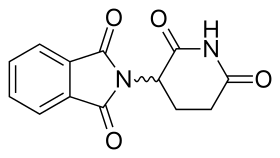
탈리도마이드 분자는 글루타민산의 합성파생물로 글루타리미드 링과 프탈로일 링(그림 5)으로 구성되어 있다.[15][16]IUPAC 명칭은 2-(2,6-dioxopiperidin-3-yl)isoindole-1,3-yl)이 있으며, 치랄도미드의[15] TNF-α에 대한 선택적 억제가 보고된 후 탈리도미드의 임상발전에 새로운 노력을 기울였다.임상적 발전은 활동을 개선하고 부작용을 감소시키는 새로운 아날로그를 발견하게 했다.[8][17]
임상적으로 탈리도미드는 항상 경주 동료로 사용되어 왔다.일반적으로 S-isomer thalidomide의 악명 높은 기형 발생의 효과가 있고 R-isomer은 기형 발생의 속성 아니지만, 진정제 effects,[8] 하지만 이 견해가 높으며 이것은 동물 모델은 이러한 다른 R-과 S-effects에서 목격된 thalidomi에 민감하지 않았다는 주장해 왔다 논의됩니다를 전달하는 결여되어 있은 연관이 있다.드기형 유발 효과이후 민감한 종인 토끼에 대한 보고에서 두 개의 이소머로부터 기형 유발 효과를 공개했다.[8][15][16][17]더욱이 탈리도마이드 에나토머는 비대칭 중심부의 산성 치랄수소 때문에 체내 상호 변환이 이루어지는 것으로 나타났기 때문에(그림 3의 전자파-12 아날로그의 경우),[16][17] 테라토제 유발 효과를 피하기 위해 정제된 단일 에나토머를 투여하는 계획은 대부분 허사가 될 가능성이 높다.[8][15][16]
레날리도마이드와 포말리도마이드 개발
관심의 아날로그 중 하나는 프탈로일 링을 이소인돌리논으로 대체함으로써 만들어졌다.EM-12라는 이름이 붙었다(그림 3).이 교체는 안정성이 증가했기 때문에 물질의 생체이용률을 증가시킬 것으로 생각되었다.이 분자는 쥐, 토끼, 원숭이에게서 탈리도마이드보다 훨씬 더 강력한 기형 유발 물질로 보고되었다.또한 이러한 아날로그는 탈리도마이드보다 혈관신생을 억제하는 강력한 억제제들이다.[13]또한 아미노탈리도미드와 아미노-EM-12는 TNF-α의 강력한 억제제였다.[16]이 두 아날로그는 후에 EM-12 아미노 아날로그인 레날리도마이드와 탈리도마이드 아미노 아날로그인 포말리도마이드라는 이름을 얻었다.[8]
의료용
의학에서 IMiDs의 주된 용도는 암과 자가면역 질환(감염 나병에 대한 반응인 질병 포함)[18]의 치료에 있다.규제 승인을 받은 대리점에 대한 표시는 다음과 같다.[19]
- 급성 골수성 백혈병의 전구 조건인 골수성 증후군
- 나병 합병증인 에리테마 노도섬
- 다발성 골수종
그들이 유망한 치료로 보이는 라벨 밖의 징후는 다음을 포함한다.[20]
- 호지킨 림프종
- 가벼운 사슬 관련(AL) 아밀로이드증
- PMF(Primary myelofibrosis)
- 급성 골수성 백혈병(AML)
- 전립선암
- 전이성 신장세포암(mRCC)
탈리도마이드
탈리도마이드는 덱사메타손과 결합해 FDA로부터 ENL 및 MM 승인을 받았다.EMA는 또한 프레드니손 및/또는 멜팔렌과 함께 MM을 치료하는 것을 승인했다.FDA의 고아 적응증에는 이식 대 숙주 질환, 균박테리아 감염, 재발 진딧물 궤양, 중증 재발 진딧물 구내염, 1차 뇌 악성종, 에이즈 관련 낭비 증후군, 크론병, 카포시 육종, 골수이식성 증후군, 조혈모세포 이식 등이 있다.[21][22]
레날리도마이드
레날리도미드는 70여 개국에서 덱사메타손과 결합해 최소 1회 이상의 사전치료를 받은 MM 환자들의 치료를 받고 있다.고아 적응증에는 큰 B세포 림프종, 만성 림프구 백혈병, 맨틀세포 림프종이 포함된다.레날리도미드는 미국, 캐나다, 스위스, 호주, 뉴질랜드, 말레이시아, 이스라엘, 중남미 여러 국가에서 추가로 세포유전학적 이상이 있거나 없는 5q 세포유전학적 이상과 연관된 저위험 또는 중간1-위험 골수분열성 신드롬으로 인해 수혈 의존성 빈혈에 대한 승인도 받고 있다.마케팅 허가 신청은 현재 많은 다른 국가에서 평가되고 있다.[23][24]이미 수많은 임상시험이 진행 중이거나, 단독으로 또는 다른 약물과 조합하여 레날리도마이드에 대한 추가적인 사용을 탐구하기 위해 실시되고 있다.이러한 징후로는 급성 골수성 백혈병, 모낭 림프종, MOLT 림프종, 월든스트롬 매크로글로불린혈증, 루푸스 에리테마토스, 호지킨 림프종, 골수이식성 증후군 등이 있다.[25][26]
포말리도마이드
포말리도미드는 2012년[27] 4월 26일 FDA 승인을 위해 제출되었으며 6월 21일 FDA 표준 심사를 받을 것이라고 발표되었다.2012년 6월 21일 EMA에 마케팅 허가 신청서가 제출되었으며, 이에 따라 이르면 2013년 초에 결정이 내려질 수 있다.EMA는 이미 포말리도미드에게 1차 골수성 근막증, MM, 전신 경화증, 다혈질 후 및 필수 혈소판혈증 후 골수성 근막염에 대한 고아 지정을 승인했다.[28]
역효과
승인된 IMiDs의 주요 독성은 말초신경장애, 혈소판감소증, 빈혈, 정맥혈전증이다.[20]2차 악성종양, 특히 IMiDs를 받는 사람들에게 급성 골수성 백혈병의 위험이 증가할 수 있다.[20]
테라토젠시티
탈리도마이드의 테라토겐성은 많은 논쟁의 대상이 되어왔고 수년에 걸쳐 수많은 가설들이 제안되어 왔다.가장 잘 알려진 두 가지는 항혈관신생 가설과 산화 스트레스 모델 가설이었으며, 탈리도마이드의 테라토겐성에 관한 이 두 가설을 뒷받침하는 상당한 실험 증거가 있다.[29]
최근, 기형생성의 새로운 메커니즘을 암시하는 새로운 발견들이 등장했다.세레블론은 신체의 수많은 부분에 있는 세포의 세포질, 핵, 말초막에 국부화된 51kDa 단백질이다.[30]그것은 알려지지 않은 기질들의 분해(유화)를 통해 발생, 발암, 세포 주기 조절을 포함한 다양한 발달 과정을 조절하면서 E3 유비퀴틴 리가제의 구성 요소로 작용한다.탈리도마이드는 세레블론에 결합되어 E3유비쿼시틴 리게아제의 활동을 억제하여 리기아제 기질 누적과 섬유블라스트 성장인자 8(FGF8) 및 FGF10의 하향 조절을 초래하는 것으로 나타났다.이것은 두 성장 요인 사이의 긍정적인 피드백 루프를 방해하여 다발성 선천적 결함과 골수종 방지 효과를 모두 유발할 수 있다.
발견은 또한 세레블론의 발현 증가가 레날리도마이드와 포말리도마이드 모두의 골수종 방지 효과의 필수 요소라는 가설을 뒷받침한다.[29]세레블론 표현은 무응답자에 비해 반응 환자에서 3배 높았고 세레블론 표현은 부분적 또는 전체적 반응과 관련이 있는 반면 낮은 표현은 안정적 또는 진행적 질병과 관련이 있었다.[30]
작용기전
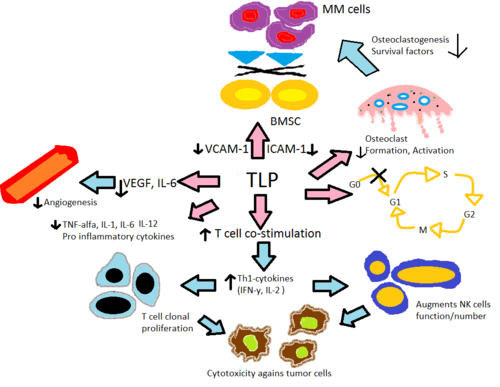
이들의 작용기전은 완전히 명확하지는 않지만 종양 괴사인자 인터루킨 6과 면역글로불린 G와 VEGF(항기생성 효과로 이어지는 것)의 생성을 억제하고 T세포와 NK세포를 공동 자극하며 인터페론 감마선과 인터루킨 2의 생성을 증가시키는 것으로 알려져 있다.[31][32][33]그들의 기형 유발 효과는 세뇌에 결합함으로써 매개되는 것처럼 보인다.[34]
탈리도마이드와 그것의 아날로그인 레날리도마이드와 포말리도마이드도 아직 정확한 작용기전이 완전히 이해되지 않았음에도 불구하고 비슷한 방식으로 작용하는 것으로 생각된다.그들은 다양한 질병에서 서로 다른 메커니즘을 통해 작용한다고 믿어진다.순효과는 아마도 서로 다른 메커니즘들이 결합되어 있기 때문일 것이다.행동의 메커니즘은 오늘날의 지식에 비추어 설명될 것이다.
탈리도마이드, 레날리도마이드, 포말리도마이드
알터치 사이토카인 생산
탈리도마이드와 그것의 면역 변조 아날로그는 염증성 사이토카인 TNF-α, IL-1, IL-6, IL-12 및 항염증 시토카인 IL-10의 생산을 변화시킨다.[30]아날로그는 모약 탈리도마이드보다 아날로그가 체외에서 최대 50.000배까지 위력적인 TNF-α의 생성을 억제하는 것으로 여겨진다.[35]이 메커니즘은 TNF-α mRNA의 강화된 열화를 통해 분비된 이 프로-염증 사이토카인의 양을 감소시킨다고 믿어지고 있다.[36]이는 탈리도마이드가 ENL 환자에게 투여되었을 때의 효과를 설명하는데, 이들은 일반적으로 혈액과 피부과 병변에서 TNF-α의 수치가 높기 때문이다.[8]대조적으로, 시험관내 검사는 T세포 활성화에서 TNF-α가 실제로 강화된다는 것을 입증했고, 여기에서 CD4+와 CD8+T 림프구가 항CD3에[8][35] 의해 자극되었고, 이후 고체종양과 염증성 피부질환을 포함하는 초기 단계 실험에서 확인되었다.[36]IL-12는 탈리도마이드와 그것의 아날로그에 의해 억제되고 강화되는 또 다른 사이토카인이다.단세포가 지용성당류에 의해 자극을 받으면 IL-12 생성이 억제되지만 T세포 자극 중에는 생성이 강화된다.[35]
레날리도마이드(Lenalidomide)는 항염증 특성에서 탈리도마이드(Thalidomide)보다 약 1000배, 포말리도마이드(Pomalidomide)는 레날리도마이드(Lenalidomide)보다 약 10배 더 강력한 체외 효력이 있는 것으로 생각된다.다만 레날리도마이드와 포말리도마이드의 경우 최대 허용 용량인 포말리도마이드의 경우 25mg보다 일일 2mg으로 포말리도마이드의 혈장 약물 농도가 10~100배 낮기 때문에 시험관내 효능의 임상적 연관성이 불분명하다는 점은 주목할 필요가 있다.[37]
T-세포 활성화
탈리도마이드와 그 아날로그는 CD28 수용체에 인산화 티로신(Tyrosine)에 의해 B7-CD28 콤플렉스를 통해 T세포의 공동 자극에 도움을 준다.[8]체외 데이터는 이러한 공동 자극이 IFN-감지기와 IL-2의 Th1 타입 사이토카인 방출 증가로 이어져 클론 T세포 증식과 자연 킬러 세포 증식과 활동을 더욱 자극한다는 것을 시사한다.이것은 자연 세포와 항체에 의존하는 세포독성을 향상시킨다.[38]레날리도마이드와 포말리도마이드 등은 탈리도마이드보다 T세포 클론 증식을 자극하는 데 약 100~1000배 더 강력하다.또한, 시험관내 데이터는 포말리도미드가 전사 인자 T-bet을 강화하여 Th2 세포를 Th1로 되돌린다는 것을 제안한다.[30]
항혈관신생
혈관신생 또는 새로운 혈관의 성장은 혈관내피성장인자(VEGF)와 그 수용체 bFGF[8], IL-6이[35] 혈관신생 시 내피세포이동에 필요한 것으로 보이는 MM 진행과 일치하는 것으로 보고되었다.탈리도마이드와 그 전후 vivo assays,[39]탈리도마이드에서 형성 활동에 pomalidomidelenalidomide에 능력이 2-3번보다thalidomide을 위한 다양한에서 높은 수준이다 언급한 요인의 변조를 통해 혈관 신생을 억제하기 위하여 또한 IL-6,의 차단을 통해서 NF-κB 활동을 방해하는 나와 있었던 것으로 추정되고 있다.한d NF-170B는 혈관신생에 관여하는 것으로 밝혀졌다.[35]다른 수많은 TNF-α 억제제가 혈관신생을 억제하지 않기 때문에 TNF-α의 억제는 탈리도마이드의 혈관신생을 억제하는 메커니즘이 아니다.[6]
투석 방지 활동
탈리도마이드의 생체내 항-투석 활성은 강력한 항혈관신생 효과와 사이토카인 발현 변화를 통한 것으로 생각된다.탈리도마이드와 그것의 아날로그로 처리했을 때, 시험관내 MM 세포의 세포사멸에 대한 측정은 카스파제-8의 활동을 상향 조절하기 위해 보여졌다.이것은 캐스파제-8과 캐스파제-9 사이의 세포외 신호에 대한 교차 논의를 유발하여 캐스파제-9 활동의 간접적인 상향 조절을 초래한다.[30][36]추가적인 항투석 활성은 IGF-1의 세포사멸에 대한 민감도를 높이고 리간드를 유도하는 TNF 관련 세포사멸에 대한 민감도를 증가시킴으로써 세포사멸 억제와[39] 생존을 통한 매개에 의해 매개된다.[36]그들은 또한 아날로그가 탈리도마이드보다 100배 더 많은 효능을 보인 백혈병 세포 라인에서[35] 용량 의존적인 G0/G1 세포 주기 구속을 유발하는 것으로 나타났다.[37]
골수환경
근막종 지원에서 혈관신생의 역할은 1994년 파스페라에 의해 처음 발견되었다.[40]그들은 증가된 골수 혈관신생이 골수종 증식과 골수종 증식과 관련이 있다는 것을 발견했고, 지원 스트롬세포는 골수종에서 혈관신생 분자의 중요한 원천이다.이것은 탈리도마이드가 다발성 골수종을 억제하는 생체내 메커니즘의 주요 성분으로 여겨진다.
게다가, 골수 내부의 염증 반응은 많은 혈액학적 질병을 촉진한다고 믿어진다.골수성층세포(BMSC)에 의한 IL-6의 분비와 점착분자 VCAM-1, ICAM-1, LFA의 분비는 TNF-α와 BMSC에 대한 MM 세포의 점착이 유도된다.MM 세포 라인의 체외 증식과 FAS 매개 세포사멸 억제는 IL-6에 의해 촉진된다.[36]탈리도마이드와 그 아날로그는 직접 IL-6의 상향조절과 TNF-α를 통해 간접적으로 감소시켜 BMSC에 따른 MM 세포의 분비를 감소시킨다. 골수성형은 MM 동안 활동성이 높아져 뼈 재흡수 및 다양한 MM 생존인자의 분비를 초래한다.그것들은 골성형 활성화에 가장 중요한 접착 분자의 수준을 낮추고, 골성형을 형성하는 세포의 형성을 감소시키며, 골성형에서 표현되는 중요한 사이스테인 프로테아제인 카테핀 K를 하향 조절한다.[39]
구조-활동 관계
탈리도마이드와 그 아날로그의 작용 메커니즘이 완전히 명확하지 않고 이러한 물질에 대한 생물수용체가 확인되지 않았기 때문에 탈리도마이드와 그 아날로그의 구조와 활동 사이의 관계에 대한 통찰은 대부분 분자 모델링과 지속적인 연구 조사로부터 도출된다.[17][41]탈리도마이드의 SAR과 그 아날로그에 대한 정보는 여전히 진행 중이므로 여기에 자세히 설명된 추세는 개별 연구 중에 관찰된다.연구는 주로 탈리도마이드의 TNF-α와 PDE4 억제와 [8][15]항혈관신생 활성을 개선하는 데 초점을 맞춰왔다.[42][43]
TNF-α 억제제(PDE4를 통하지 않음)
연구 결과 프탈로일 링에서 대체하면 TNF-α 억제 활성이 증가할 것으로 나타났다(그림 5).아미노 그룹 치환법을 탈리도마이드의 프탈로일 링(C4, C5, C6, C7)과 EM-12(이전 설명)의 다양한 위치에서 시험했다.탈리도마이드와 전자파-12 양쪽의 C4 위치에 아미노를 첨가한 결과 TNF-α의 훨씬 더 강력한 억제가 나타났다.이것은 또한 아미노 그룹이 가장 강력한 활동을 위해 이소인돌리논 링 시스템의 카보닐 그룹과 바로 반대편에 있어야 한다는 것을 밝혀냈다.[44]이러한 아날로그는 PDE4를 억제하지 않으므로 PDE4 억제에 의해 작용하지 않는다.탈리도마이드 프탈로일 링 시스템의 C4 및 C5 위치에서 더 길고 큰 그룹을 추가하는 것, 일부는 올레핀 기능을 가진 것 등이 다양한 결과와 함께 시험되었다.탈리도마이드에 비해 증가된 억제 효과는 C5 또는 C4 올레핀에 직접 산소 원자를 부착한 그룹에서 눈에 띄었다.C4나 C5에서 요오드 및 브롬을 첨가한 결과 탈리도마이드와 비교했을 때 활동량이 같거나 감소하였다.[45]이들 집단은 레날리도마이드나 포말리도마이드와는 비교되지 않았다.
PDE4 억제제
PDE4 억제를 통해 TNF-α를 억제하는 아날로그의 공통 구조는 탈리도마이드의 글루타리미드 링을 가수 분해하는 것에 기초하여 작성된다.이러한 아날로그는 탈리도마이드와 달리 산성 치랄 수소를 가지고 있지 않기 때문에 매우 안정적일 것으로 예상된다.[16]
페닐 링에서 3,4-다이얼코시페닐 모이티(그림 6)는 로립람과 같은 PDE4 억제제의 알려진 약리호르몬이다.최적 활성은 4위치(X2)에서 메톡시 그룹과 3위치 탄소(X3)에서 사이클로펜톡시(Cyclopentoxy)와 같은 더 큰 그룹으로 달성된다.그러나 탈리도마이드 PDE4 억제 아날로그는 로립람 아날로그의 SAR을 직접 따르지 않는다.탈리도마이드 아날로그의 경우 X3의 에톡시 그룹과 X2의 메톡시 그룹이 수소일 뿐 가장 높은 PDE4와 TNF-α 억제를 주었다.[15]X2-X3 포지션에서 디에이트복시보다 큰 대체물은 활동량이 감소했다.이러한 대체의 효과는 강직 효과에 의해 매개되는 것처럼 보인다.[16]
Y 위치에 대해서는 여러 그룹이 탐색되었다.메틸아미드(CONHCH3)보다 큰 대체 아미드는 PDE4 억제 활성을 감소시킨다.[16]카르복실산을 출발점으로 삼을 때 아미드 그룹은 유사한 PDE4 억제 활성을 가지지만 두 그룹 모두 PSE4 억제 활성이 약 6배 증가한 메틸 에스테르 그룹에 비해 상당히 덜 강력한 것으로 나타났다.Sulfone 그룹은 메틸에스테르 그룹과 유사한 pDE4 억제를 가지고 있었다.카르복실산보다 PDE4 억제 활성도가 32배 높은 니트릴 그룹을 부착했을 때 최상의 PDE4 억제 효과가 관찰됐다.[15]Y의 대체물이 PDE4 억제 활성을 증가시키므로 다음 순서에 따른다.
- COOH ≤ CONH2 ≤ COOCH3 ≤ SO2CH3 < CN
프탈로일 링의 대체물이 조사되었고 C4 또는 C5 위치의 니트로 그룹들은 활동을 감소시켰지만 C4 또는 C5 아미노 대체물은 그것을 극적으로 증가시켰다.[16]프탈로일 링의 4(Z) 위치에서 치환을 검사했을 때, 히드록실 및 메톡시 그룹은 아날로그를 덜 강력한 PDE4 억제제로 만드는 것처럼 보인다.아미노와 디메틸아미노와 비슷한 정도로 활동량이 증가하였지만 메틸군은 앞서 언급한 그룹보다 활동을 더 개선하였다.4-N-아세틸아미노 그룹은 메틸 그룹에 비해 PDE4 억제 활성이 약간 낮았으나, 화합물의 TNF-α 억제 활성을 더욱 증가시켰다.[15]Z의 대체물이 PDE4 억제 활성을 증가시키므로 다음 순서에 따른다.
- N(CH3)2 ≤ NH2 < NHC(O)CH3 < CH3
혈관신생 억제
혈관신생 억제 활동의 경우 온전한 글루타리미드 링이 필요한 것으로 보인다.R 위치에서 서로 다른 그룹을 시험했다.R그룹으로 질소염 성분을 함유한 물질은 양호한 활성도를 보였다.개선된 혈관신생 억제 활성은 용해성 증가 또는 양전하 질소가 활성 부위와 상호작용을 추가했기 때문일 수 있다.프탈로일 링의 테트라플루오르기는 혈관신생 억제를 증가시키는 것으로 보인다.[42]
합성
이 섹션은 대부분의 독자들이 이해하기에는 너무 기술적일 수 있다. 정보를 할 수 하십시오.(2017년 4월)(이를 및 |
아래에 설명된 것은 저명한 일차 문헌에서 보고된 탈리도마이드, 레날리도마이드, 포말리도마이드 합성 계획들이다.이러한 합성 체계는 이러한 단일 화학 실체를 합성하는 데 사용되는 유기 합성 전략을 반드시 반영하는 것은 아니라는 점에 유의하십시오.
탈리도마이드
탈리도마이드의 합성은 대개 체계 1에서 보는 바와 같이 수행되었다.이 합성은 합리적으로 단순화된 3단계 과정이다.그러나 이 프로세스의 단점은 마지막 단계에서는 다중 재시정이 필요하며 표준 장비와 호환되지 않는 고온 용해 반응이 필요하다는 것이다.
체계 2는 반응을 더 직접적으로 만들고 더 나은 수율을 생산하기 위해 고안된 새로운 합성 경로다.이 노선은 L-글루타민산이 아닌 L-글루타민을 출발 재료로 사용하며 N-카르베트호옥시프탈리미드와 반응시켜 N-프탈로일-L-글루타민(4)을 투여하고 수율이 50%~70%에 이른다.그 다음 4번 물질은 테트라하이드로푸란(THF)에 충분한 4-디메틸아미노피리딘(DMAP)이 함유된 카보닐디미다졸(CDI)과 혼합하여 저어 반응을 촉진하고 15~18시간 동안 환류하도록 가열한다.환류 중에 탈리도마이드 결정체가 혼합물에서 빠져나간다.마지막 단계에서는 탈리도마이드의 85~93%의 수율을 제공하며, 총 수율은 43~63%[46]에 이른다.
레날리도마이드와 포말리도마이드
두 아미노 아날로그는 모두 상용 Cbz-L-글루타민으로부터 2단계 반응으로 합성된 3-아미노피페리딘-2,6-디오네 염산염(Compound 3)의 응축으로부터 준비된다.Cbz-L-글루타민은 THF 환류에서 CDI로 처리되어 Cbz-aminoglutarimide를 산출한다.Cbz 보호 그룹 수소폴리시스를 제거하기 위해 에틸 아세테이트와 HCl이 혼합된 10% Pd/C의 수소 50–60 psi를 수행했다.그 다음 공식 염산염(제도 3의 혼합물 3)을 역류하는 아세트산에서 3-니트로프탈산 무수화와 반응하여 4-니트로 대체 탈리도미드 아날로그를 생산하고 니트로 그룹을 수소화하여 포말리도미드를 공급했다.[44]
레날리도미드는 니트로 대체 메틸 2-(브로메틸) 벤조산으로 처리한 화합물 3(3-아미노피페리딘-2,6-디오네)과 니트로 그룹의 수소화를 이용해 비슷한 방법으로 합성된다.[44]
약동학
탈리도마이드
| 탈리도마이드 | ||
|---|---|---|
| Tmax [약] | MM이[47] 있는 과목은 4~6시간 | 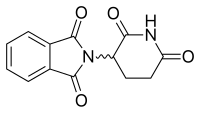 |
| 단백질 결합 | 55–65%[48] | |
| 대사물 | 수산화 대사물[48] | |
| 반감기[t1/2] | 5.5~7.6시간[48] | |
레날리도마이드
| 레날리도마이드 | ||
|---|---|---|
| Tmax [약] | 건강한[49] 과목에서 0.6–1.5시간 MM이[50] 있는 과목의 0.5~4시간 | 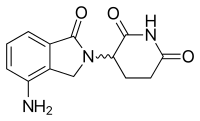 |
| 단백질 결합 | ~30%[49] | |
| 대사물 | 아직[49] 연구되지 않음 | |
| 반감기[t1/2] | 건강한 과목에서[49] 3시간 3.1–4.2시간 MM이[50] 있는 대상 | |
포말리도마이드
| 포말리도마이드 | ||
|---|---|---|
| Tmax [약] | 0.5~8시간[51] | 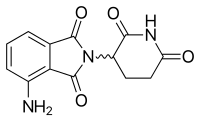 |
| 단백질 결합 | 알 수 없는 | |
| 대사물 | 알 수 없는 | |
| 반감기[t1/2] | 6.2~7.9시간[51] | |
참고 항목
참조
- ^ a b Knight, R (August 2005). "IMiDs: a novel class of immunomodulators". Seminars in Oncology. 32 (4 Suppl 5): S24–S30. doi:10.1053/j.seminoncol.2005.06.018. PMID 16085014.
- ^ Aragon-Ching AB, Li H, Gardner ER, Figg WD (2007). "Thalidomide analogues as anticancer drugs". Recent Pat Anti-Cancer Drug Discov. 2 (2): 167–174. doi:10.2174/157489207780832478. PMC 2048745. PMID 17975653.
- ^ 운명의 반전: 암과의 전쟁 - Onco'Zine - The International Oncology Network (2013년 11월 30일) 2014년 1월 3일, 오늘 보관.
- ^ Mazzoccoli, L; Cadoso, SH; Amarante, GW; de Souza, MV; Domingues, R; Machado, MA; de Almeida, MV; Teixeira, HC (July 2012). "Novel thalidomide analogues from diamines inhibit pro-inflammatory cytokine production and CD80 expression while enhancing IL-10". Biomedicine & Pharmacotherapy. 66 (5): 323–9. doi:10.1016/j.biopha.2012.05.001. PMID 22770990.
- ^ Prommer, E. E. (20 October 2009). "Review Article: Palliative Oncology: Thalidomide". American Journal of Hospice and Palliative Medicine. 27 (3): 198–204. doi:10.1177/1049909109348981. PMID 19843880. S2CID 24167431.
- ^ a b D'Amato RJ, Loughnan MS, Flynn E, Folkman J (April 1994). "Thalidomide is an inhibitor of angiogenesis". Proc. Natl. Acad. Sci. U.S.A. 91 (9): 4082–5. Bibcode:1994PNAS...91.4082D. doi:10.1073/pnas.91.9.4082. PMC 43727. PMID 7513432.
- ^ Verheul HM, Panigrahy D, Yuan J, D'Amato RJ (January 1999). "Combination oral antiangiogenic therapy with thalidomide and sulindac inhibits tumour growth in rabbits". Br. J. Cancer. 79 (1): 114–8. doi:10.1038/sj.bjc.6690020. PMC 2362163. PMID 10408702.
- ^ a b c d e f g h i j k l Bartlett, J. Blake; Dredge, Keith; Dalgleish, Angus G. (1 April 2004). "Timeline: The evolution of thalidomide and its IMiD derivatives as anticancer agents". Nature Reviews Cancer. 4 (4): 314–322. doi:10.1038/nrc1323. PMID 15057291. S2CID 7293027.
- ^ a b D'Amato RJ, Lentzsch S, Anderson KC, Rogers MS (December 2001). "Mechanism of action of thalidomide and 3-aminothalidomide in multiple myeloma". Semin. Oncol. 28 (6): 597–601. doi:10.1016/S0093-7754(01)90031-4. PMID 11740816.
- ^ Zimmerman, Todd (1 May 2009). "Immunomodulatory agents in oncology". Update on Cancer Therapeutics. 3 (4): 170–181. doi:10.1016/j.uct.2009.03.003.
- ^ Zeldis, Jerome B.; Knight, Robert; Hussein, Mohamad; Chopra, Rajesh; Muller, George (1 March 2011). "A review of the history, properties, and use of the immunomodulatory compound lenalidomide". Annals of the New York Academy of Sciences. 1222 (1): 76–82. Bibcode:2011NYASA1222...76Z. doi:10.1111/j.1749-6632.2011.05974.x. PMID 21434945. S2CID 5336195.
- ^ "Vector has moved".
- ^ a b D'Amato, RJ; Lentzsch, S; Anderson, KC; Rogers, MS (December 2001). "Mechanism of action of thalidomide and 3-aminothalidomide in multiple myeloma". Seminars in Oncology. 28 (6): 597–601. doi:10.1016/S0093-7754(01)90031-4. PMID 11740816.
- ^ Lentzsch S, Rogers MS, LeBlanc R, et al. (April 2002). "S-3-Amino-phthalimido-glutarimide inhibits angiogenesis and growth of B-cell neoplasias in mice". Cancer Res. 62 (8): 2300–5. PMID 11956087.
- ^ a b c d e f g h Man, Hon-Wah; Schafer, Peter; Wong, Lu Min; Patterson, Rebecca T.; Corral, Laura G.; Raymon, Heather; Blease, Kate; Leisten, Jim; Shirley, Michael A.; Tang, Yang; Babusis, Darius M.; Chen, Roger; Stirling, Dave; Muller, George W. (26 March 2009). "Discovery of (S)-N-{2-[1-(3-Ethoxy-4-methoxyphenyl)-2-methanesulfonylethyl]-1,3-dioxo-2,3-dihydro-1H-isoindol-4-yl}acetamide (Apremilast), a Potent and Orally Active Phosphodiesterase 4 and Tumor Necrosis Factor-α Inhibitor". Journal of Medicinal Chemistry. 52 (6): 1522–4. doi:10.1021/jm900210d. PMID 19256507.
- ^ a b c d e f g h i Muller, George W.; Corral, Laura G.; Shire, Mary G.; Wang, Hua; Moreira, Andre; Kaplan, Gilla; Stirling, David I. (1 January 1996). "Structural Modifications of Thalidomide Produce Analogs with Enhanced Tumor Necrosis Factor Inhibitory Activity". Journal of Medicinal Chemistry. 39 (17): 3238–3240. doi:10.1021/jm9603328. PMID 8765505.
- ^ a b c d Man, Hon-Wah; Corral, Laura G; Stirling, David I; Muller, George W (1 October 2003). "α-Fluoro-substituted thalidomide analogues". Bioorganic & Medicinal Chemistry Letters. 13 (20): 3415–3417. doi:10.1016/S0960-894X(03)00778-9. PMID 14505639.
- ^ Pan, B; Lentzsch, S (October 2012). "The application and biology of immunomodulatory drugs (IMiDs) in cancer". Pharmacology & Therapeutics. 136 (1): 56–68. doi:10.1016/j.pharmthera.2012.07.004. PMID 22796518.
- ^ Sedlarikova, L; Kubiczkova, L; Sevcikova, S; Hajek, R (October 2012). "Mechanism of immunomodulatory drugs in multiple myeloma". Leukemia Research. 36 (10): 1218–1224. doi:10.1016/j.leukres.2012.05.010. PMID 22727252.
- ^ a b c Vallet, S; Witzens-Harig, M; Jaeger, D; Podar, K (March 2012). "Update on immunomodulatory drugs (IMiDs) in hematologic and solid malignancies". Expert Opinion on Pharmacotherapy. 13 (4): 473–494. doi:10.1517/14656566.2012.656091. PMID 22324734. S2CID 7981368.
- ^ "Thalomid (Thalidomide) dosing, indications, interactions, adverse effects, and more". MedScape reference. Retrieved 18 September 2012.
- ^ "Thalidomide Celgene (previously Thalidomide Pharmion)". European Medicines Agency. Retrieved 18 September 2012.
- ^ "Celgene Biopharmaceutical - Investor relations - Press Releases". Archived from the original on 19 January 2013. Retrieved 18 September 2012.
- ^ "Revlimid (lenalidomide) dosing, indications, interactions, adverse effects, and more". Medscape references. Retrieved 18 September 2012.
- ^ "Search of: lenalidomide - List Results". Clinical Trials. Retrieved 18 September 2012.
- ^ "Clinical Trials Register". EU Clinical Trials Register. Retrieved 18 September 2012.
- ^ "Celgene Submits Pomalidomide For FDA Approval". The myeloma beacon.
- ^ "European Medicines Agency - Search results from your query". European Medicines Agency. Retrieved 18 September 2012.
- ^ a b Ito, Takumi; Handa, Hiroshi (1 March 2012). "Deciphering the mystery of thalidomide teratogenicity". Congenital Anomalies. 52 (1): 1–7. doi:10.1111/j.1741-4520.2011.00351.x. PMID 22348778.
- ^ a b c d e Martiniani, Roberta; Di Loreto, Valentina; Di Sano, Chiara; Lombardo, Alessandra; Liberati, Anna Marina (1 January 2012). "Biological Activity of Lenalidomide and Its Underlying Therapeutic Effects in Multiple Myeloma". Advances in Hematology. 2012: 842945. doi:10.1155/2012/842945. PMC 3417169. PMID 22919394.
- ^ Quach, H; Ritchie, D; Stewart, AK; Neeson, P; Harrison, S; Smyth, MJ; Prince, HM (January 2010). "Mechanism of action of immunomodulatory drugs (IMiDS) in multiple myeloma". Leukemia. 24 (1): 22–32. doi:10.1038/leu.2009.236. PMC 3922408. PMID 19907437.
- ^ Andhavarapu, S; Roy, V (February 2013). "Immunomodulatory drugs in multiple myeloma". Expert Review of Hematology. 6 (1): 69–82. doi:10.1586/ehm.12.62. PMID 23373782. S2CID 12782141.
- ^ Sedlarikova, L; Kubiczkova, L; Sevcikova, S; Hajek, R (October 2012). "Mechanism of immunomodulatory drugs in multiple myeloma". Leukemia Research. 36 (10): 1218–1224. doi:10.1016/j.leukres.2012.05.010. PMID 22727252.
- ^ Chang, XB; Stewart, AK (2011). "What is the functional role of the thalidomide binding protein cereblon?". International Journal of Biochemistry and Molecular Biology. 2 (3): 287–94. PMC 3193296. PMID 22003441.
- ^ a b c d e f Huang, Yen-Ta; Hsu, Chih W.; Chiu, Ted H. (1 September 2008). "Thalidomide and Its Analogs as Anticancer Agents". Tzu Chi Medical Journal. 20 (3): 188–195. doi:10.1016/S1016-3190(08)60034-8.
- ^ a b c d e Melchert, Magda; List, Alan (1 July 2007). "The thalidomide saga". The International Journal of Biochemistry & Cell Biology. 39 (7–8): 1489–1499. doi:10.1016/j.biocel.2007.01.022. PMID 17369076.
- ^ a b Quach, H; Ritchie, D; Stewart, A K; Neeson, P; Harrison, S; Smyth, M J; Prince, H M (12 November 2009). "Mechanism of action of immunomodulatory drugs (IMiDS) in multiple myeloma". Leukemia. 24 (1): 22–32. doi:10.1038/leu.2009.236. PMC 3922408. PMID 19907437.
- ^ Thomas, Sheeba K.; Richards, Tiffany A.; Weber, Donna M. (1 December 2007). "Lenalidomide in multiple myeloma". Best Practice & Research Clinical Haematology. 20 (4): 717–735. doi:10.1016/j.beha.2007.09.002. PMID 18070715.
- ^ a b c Kotla, Venumadhav; Goel, Swati; Nischal, Sangeeta; Heuck, Christoph; Vivek, Kumar; Das, Bhaskar; Verma, Amit (1 January 2009). "Mechanism of action of lenalidomide in hematological malignancies". Journal of Hematology & Oncology. 2 (1): 36. doi:10.1186/1756-8722-2-36. PMC 2736171. PMID 19674465.
- ^ Vacca A, Ribatti D, Roncali L, et al. (July 1994). "Bone marrow angiogenesis and progression in multiple myeloma". Br. J. Haematol. 87 (3): 503–8. doi:10.1111/j.1365-2141.1994.tb08304.x. PMC 3301416. PMID 7527645.
- ^ Avila, Carolina Martins; Romeiro, Nelilma Correia; Sperandio da Silva, Gilberto M.; Sant’Anna, Carlos M.R.; Barreiro, Eliezer J.; Fraga, Carlos A.M. (1 October 2006). "Development of new CoMFA and CoMSIA 3D-QSAR models for anti-inflammatory phthalimide-containing TNFα modulators". Bioorganic & Medicinal Chemistry. 14 (20): 6874–6885. doi:10.1016/j.bmc.2006.06.042. PMID 16843662.
- ^ a b Lepper, Erin R.; Ng, Sylvia S. W.; Gütschow, Michael; Weiss, Michael; Hauschildt, Sunna; Hecker, Thomas K.; Luzzio, Frederick A.; Eger, Kurt; Figg, William D. (1 April 2004). "Comparative Molecular Field Analysis and Comparative Molecular Similarity Indices Analysis of Thalidomide Analogues as Angiogenesis Inhibitors". Journal of Medicinal Chemistry. 47 (9): 2219–2227. doi:10.1021/jm0304820. PMID 15084120.
- ^ Noguchi, Tomomi; Fujimoto, Haruka; Sano, Hiroko; Miyajima, Atsushi; Miyachi, Hiroyuki; Hashimoto, Yuichi (1 December 2005). "Angiogenesis inhibitors derived from thalidomide". Bioorganic & Medicinal Chemistry Letters. 15 (24): 5509–5513. doi:10.1016/j.bmcl.2005.08.086. PMID 16183272.
- ^ a b c Muller, GW; Chen, R; Huang, SY; Corral, LG; Wong, LM; Patterson, RT; Chen, Y; Kaplan, G; Stirling, DI (Jun 7, 1999). "Amino-substituted thalidomide analogs: potent inhibitors of TNF-alpha production". Bioorganic & Medicinal Chemistry Letters. 9 (11): 1625–30. doi:10.1016/s0960-894x(99)00250-4. PMID 10386948.
- ^ Stewart, Scott G.; Spagnolo, Daniel; Polomska, Marta E.; Sin, Melvin; Karimi, Mahdad; Abraham, Lawrence J. (1 November 2007). "Synthesis and TNF expression inhibitory properties of new thalidomide analogues derived via Heck cross coupling". Bioorganic & Medicinal Chemistry Letters. 17 (21): 5819–5824. doi:10.1016/j.bmcl.2007.08.042. PMID 17851074.
- ^ Muller, George W.; Konnecke, William E.; Smith, Alison M.; Khetani, Vikram D. (1 March 1999). "A Concise Two-Step Synthesis of Thalidomide". Organic Process Research & Development. 3 (2): 139–140. doi:10.1021/op980201b.
- ^ Chung, F. (1 September 2004). "Thalidomide Pharmacokinetics and Metabolite Formation in Mice, Rabbits, and Multiple Myeloma Patients". Clinical Cancer Research. 10 (17): 5949–5956. doi:10.1158/1078-0432.CCR-04-0421. PMID 15355928.
- ^ a b c "Summary of product characteristics: Thalidomid Celgene" (PDF). European Medicines Agency. Retrieved 23 September 2012.
- ^ a b c d Armoiry, X.; Aulagner, G.; Facon, T. (1 June 2008). "Lenalidomide in the treatment of multiple myeloma: a review". Journal of Clinical Pharmacy and Therapeutics. 33 (3): 219–226. doi:10.1111/j.1365-2710.2008.00920.x. PMID 18452408.
- ^ a b Richardson, P. G. (12 July 2002). "Immunomodulatory drug CC-5013 overcomes drug resistance and is well tolerated in patients with relapsed multiple myeloma". Blood. 100 (9): 3063–3067. doi:10.1182/blood-2002-03-0996. PMID 12384400.
- ^ a b Schey, S.A. (15 August 2004). "Phase I Study of an Immunomodulatory Thalidomide Analog, CC-4047, in Relapsed or Refractory Multiple Myeloma". Journal of Clinical Oncology. 22 (16): 3269–3276. doi:10.1200/JCO.2004.10.052. PMID 15249589.