인테그레이스
Integrase| 인테그라아제아연결합도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 hiv-1 인테그라아제(e 형태), nmr, 38 구조의 n 말단 zn 결합 도메인의 용액 구조 | |||||||||
| 식별자 | |||||||||
| 기호. | Integrase_Zn | ||||||||
| 팜 | PF02022 | ||||||||
| 인터프로 | IPR003308 | ||||||||
| SCOP2 | 1wjb/SCOPe/SUPFAM | ||||||||
| |||||||||
| 핵심 도메인 통합 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
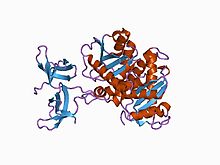 RSV 2-도메인 인테그레이스의 결정 구조. | |||||||||
| 식별자 | |||||||||
| 기호. | 움직이다 | ||||||||
| 팜 | PF00665 | ||||||||
| 빠맘 클랜 | CL0219 | ||||||||
| 인터프로 | IPR001584 | ||||||||
| SCOP2 | 2비트/SCOPe/SUPFAM | ||||||||
| |||||||||
| 인테그라아제DNA결합도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 RSV 2-도메인 인테그레이스의 결정 구조. | |||||||||
| 식별자 | |||||||||
| 기호. | IN_DBD_C | ||||||||
| 팜 | PF00552 | ||||||||
| 인터프로 | IPR001037 | ||||||||
| SCOP2 | 1ihw/SCOPe/SUPFAM | ||||||||
| |||||||||
레트로바이러스 인테그레이스(IN)는 레트로바이러스(HIV 등)에 의해 생성되는 효소로, 유전정보를 HIV가 감염시키는 [1]숙주세포와 통합한다.레트로바이러스 IN은 부위 특이적 재조합에서 논의된 바와 같이 γ 파이지 인테그레이스(phage Integrase)와 같은 생명공학에서 사용되는 파이지 인테그레이스(recombinase)와 혼동해서는 안 된다.
바이러스 DNA 말단에 결합된 IN 고분자의 고분자 복합체는 인타좀이라고 불리며 IN은 이것과 레트로바이러스 사전 통합 [2]복합체의 핵심 성분이다.
구조.
모든 레트로바이러스 IN 단백질은 유연한 [3][4]링커에 의해 연결된 세 개의 표준 도메인을 포함합니다.
● N 말단 HH-CC 아연 결합 도메인(Zn(II) 양이온의 배위에 의해 안정화된 3 나선 다발)
● 촉매 코어 도메인(RNaseH 폴드)
개별 도메인의 결정 및 NMR 구조와 HIV-1, HIV-2, SIV 및 Rous Sarcoma Virus(RSV)의 통합 효소의 2-도메인 구조가 보고되었으며, 첫 번째 구조는 1994년에 확인되었다.[5][6]생화학 데이터와 구조 데이터에 따르면 레트로바이러스 IN은 4량체(이합체)로서 기능하며, 세 가지 도메인 모두 다중화와 바이러스 DNA [7]결합에 중요하다.또한, 몇몇 숙주 세포 단백질은 통합 과정을 용이하게 하기 위해 IN과 상호작용하는 것으로 나타났다. 예를 들어, 숙주 인자, 인간 크로마틴 관련 단백질 LEDGF는 HIV IN을 단단히 결합시키고 통합을 [8]위해 HIV 사전 통합 복합체를 고도로 발현된 유전자로 유도한다.
인체에는 무해한 물질인 Human Foomy Virus(HFV)는 HIV IN과 유사한 Integrase를 가지며, 따라서 HIV IN 기능의 모델이다.바이러스 DNA 말단에 조립된 HFV Integrase의 2010년 결정 구조가 결정되었다.[6]
기능 및 메커니즘
바이러스 RNA/DNA 의존성 DNA 중합효소 [9]역전사효소에 의한 이중사슬 선형 바이러스 DNA 생성 후 통합이 일어난다.
IN의 주요 기능은 바이러스 DNA를 숙주 염색체 DNA에 삽입하는 것인데, 이는 HIV 복제에 필수적인 단계이다.통합은 바이러스 게놈의 영구 보균자가 되는 세포의 "돌아오지 않는 지점"이다.통합은 부분적으로 레트로바이러스 [10]감염의 지속에 책임이 있다.통합 후, 바이러스 유전자 발현과 입자 생성은 즉시 또는 미래의 어느 시점에서 일어날 수 있으며, 시기는 프로바이러스를 [4]호스트하는 염색체 궤적의 활성에 따라 달라진다.
레트로바이러스 IN은 두 가지 반응을 [4]촉매합니다.
● 바이러스 DNA의 한쪽 또는 양쪽 3' 말단에서 2개 또는 3개의 뉴클레오티드를 제거하여 바이러스 DNA의 양쪽 3' 말단에서 불변 CA 디뉴클레오티드를 노출시키는 3'-처리.
● 바이러스 DNA의 처리된 3' 말단이 숙주 염색체 DNA와 공유 결합되는 가닥 전달 반응.
두 반응은 동일한 활성 부위에서 촉매되며 공유가 단백질-DNA 중간체를 포함하지 않고 에스테르 전이를 수반한다(Ser/Tyr 재조합 효소 촉매 [4]반응과는 대조적으로).
HIV의 경우

HIV Integrase는 N-말단, 촉매핵심 도메인, C-말단 세 개의 도메인으로 구성된 32kDa 바이러스 단백질로, 각각 HIV Integrase의 [3]유효성에 기여하는 뚜렷한 특성과 기능을 가지고 있다.
N-말단은 보존된 히스티딘, 히스티딘, 시토신, 아연 이온을 킬레이트하는 시토신 배열을 포함하는 50개의 아미노산 잔기로 구성되어 촉매 코어 [3]도메인의 효소 활성을 더욱 강화합니다.금속 킬레이션은 인테그레이스 효과에서 필수적이기 때문에 레트로바이러스 [3]치료제 개발의 대상이다.
촉매핵심 도메인은 N-말단과 마찬가지로 보존 DDE(Asp-Asp-Glu) 모티브가 인테그레이스의 엔도핵산가수분해효소 및 폴리뉴클레오티드전달효소 기능에 기여하기 때문에 고도로 보존된 아미노산 잔기 -Asp64, Asp116, Glu152-를 포함한다.이러한 영역의 돌연변이는 인테그레이스를 비활성화시키고 게놈 [3]통합을 방해한다.
C 말단 도메인은 비특이적으로 숙주 DNA에 결합하고 통합 [3]복합체를 안정화시킨다.
통합 메커니즘
HIV의 이중 가닥 DNA 게놈 합성 후, 인테그라아제는 게놈 양 끝에 있는 긴 연속 반복에 결합합니다.인테그라아제(integrase)는 그것의 핵내 분해 활성을 이용하여 3'-[11]프로세싱으로 알려진 처리에서 게놈의 양쪽 3' 말단에서 디 또는 트리뉴클레오티드를 분해한다.분해능의 특이성은 촉매 코어 도메인의 DDE 모티브와 상호작용하는 Mn 및2+ Mg와 같은2+ 보조 인자를 사용하여 개선되며,[11] 통합효소 기능의 보조 인자로 작용한다.
새로 생성된 3'OH기는 SN2형 친핵 [6]공격을 통해 숙주 DNA의 포스포디에스터 결합을 방해한다.3' 끝은 표적 DNA와 공유로 연결되어 있다.바이러스 게놈의 5인치 오버행은 숙주 복구 효소를 사용하여 분해되며, 이러한 효소는 프로바이러스를 [6][11]형성하는 숙주 게놈에 5인치 말단을 통합하는 역할을 하는 것으로 여겨진다.
항레트로바이러스 요법
2005년 11월, 조사 대상 HIV 인테그라아제 억제제 MK-0518의 2단계 연구 데이터는 이 화합물이 강력한 항바이러스 활성을 가지고 있음을 보여주었다.2007년 10월 12일 미국 식품의약국(FDA)은 인테그라아제 억제제 랄테그라비르(MK-0518, 상표명 이센트레스)를 승인했다.두 번째 인테그라아제 억제제인 엘비테그라비르는 2012년 8월에 미국에서 승인되었습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Beck BJ, Freudenreich O, Worth JL (2010). "Patients with Human Immunodeficiency Virus Infection and Acquired Immunodeficiency Syndrome". Massachusetts General Hospital Handbook of General Hospital Psychiatry. Elsevier. pp. 353–370. doi:10.1016/b978-1-4377-1927-7.00026-1. ISBN 9781437719277.
- ^ Masuda T (2011). "Non-Enzymatic Functions of Retroviral Integrase: The Next Target for Novel Anti-HIV Drug Development". Frontiers in Microbiology. 2: 210. doi:10.3389/fmicb.2011.00210. PMC 3192317. PMID 22016749.
- ^ a b c d e f Jóźwik IK, Passos DO, Lyumkis D (September 2020). "Structural Biology of HIV Integrase Strand Transfer Inhibitors". Trends in Pharmacological Sciences. 41 (9): 611–626. doi:10.1016/j.tips.2020.06.003. PMC 7429322. PMID 32624197.
- ^ a b c d Delelis O, Carayon K, Saïb A, Deprez E, Mouscadet JF (December 2008). "Integrase and integration: biochemical activities of HIV-1 integrase". Retrovirology. 5 (1): 114. doi:10.1186/1742-4690-5-114. PMC 2615046. PMID 19091057.
- ^ Lodi PJ, Ernst JA, Kuszewski J, Hickman AB, Engelman A, Craigie R, et al. (August 1995). "Solution structure of the DNA binding domain of HIV-1 integrase". Biochemistry. 34 (31): 9826–9833. doi:10.1021/bi00031a002. PMID 7632683.
- ^ a b c d Choi E, Mallareddy JR, Lu D, Kolluru S (October 2018). "Recent advances in the discovery of small-molecule inhibitors of HIV-1 integrase". Future Science OA. 4 (9): FSO338. doi:10.4155/fsoa-2018-0060. PMC 6222271. PMID 30416746.
- ^ Hare S, Di Nunzio F, Labeja A, Wang J, Engelman A, Cherepanov P (July 2009). Luban J (ed.). "Structural basis for functional tetramerization of lentiviral integrase". PLOS Pathogens. 5 (7): e1000515. doi:10.1371/journal.ppat.1000515. PMC 2705190. PMID 19609359.
- ^ Craigie R, Bushman FD (July 2012). "HIV DNA integration". Cold Spring Harbor Perspectives in Medicine. 2 (7): a006890. doi:10.1101/cshperspect.a006890. PMC 3385939. PMID 22762018.
- ^ Burdick RC, Pathak VK (January 2021). "Efficient HIV-1 in vitro reverse transcription: optimal capsid stability is required". Signal Transduction and Targeted Therapy. 6 (1): 13. doi:10.1038/s41392-020-00458-3. PMC 7804106. PMID 33436564.
- ^ Maldarelli F (February 2016). "The role of HIV integration in viral persistence: no more whistling past the proviral graveyard". The Journal of Clinical Investigation. 126 (2): 438–447. doi:10.1172/JCI80564. PMC 4731194. PMID 26829624.
- ^ a b c Mahboubi-Rabbani M, Abbasi M, Hajimahdi Z, Zarghi A (2021). "HIV-1 Reverse Transcriptase/Integrase Dual Inhibitors: A Review of Recent Advances and Structure-activity Relationship Studies". Iranian Journal of Pharmaceutical Research. 20 (2): 333–369. doi:10.22037/ijpr.2021.115446.15370. PMC 8457747. PMID 34567166.


