나이그로스트라이탈 경로
Nigrostriatal pathway| 나이그로스트라이탈 경로 | |
|---|---|
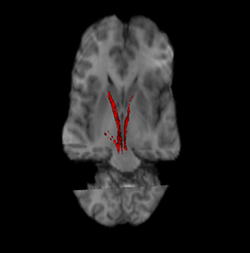 니그로스트라이탈 경로(왼쪽 및 오른쪽 빨간색). | |
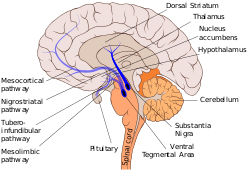 흑연사적 경로는 여기에 실재한 흑연사와 등연사를 연결하는 단색 파란색으로 표시되어 있다. | |
| 해부학적 용어 |
흑연골 경로(nigrostrial pathway)는 중뇌의 실체형 nigra 파스 콤팩트(SNC)와 전뇌의 등축(caudate nuclear, putamen)을 연결하는 뇌의 양쪽 도파민성 경로다. 뇌의 4대 도파민 경로 중 하나이며, 기저 갱년기 모터 루프라고 하는 시스템의 일부로서 움직임의 생성에 매우 중요하다. 이 경로의 도파민성 뉴런은 도파민을 액손 단자에서 시냅스(GABAergic medium spiny nerron,[1][2] MSN)로 방출하는데, 이 뉴런은 선조체 내에 위치한 가바에르그성 매체 가비뉴런(SPN)으로도 알려져 있다.
SNc에서 도파민성 뉴런의 퇴화는 파킨슨병의 주요 병리학적 특징 중 하나로 [3]도파민 기능의 현저한 감소와 저포킨증, 떨림, 경직성, 자세불균형 등 파킨슨병의 증상적 운동결손으로 이어진다.
해부학
실사 나이그라 파스 콤팩타와 등사 선조체 사이의 연결은 도파민성 액손들을 통해 매개된다.
SNC(Seremia nigra pars compacta)
실체성 니그라는 각 반구의 복측 중뇌에 위치한다. 파스 콤팩트(SNC)와 파스 레티쿨라타(SNR) 두 가지 구별되는 파트를 가지고 있다. 파스 콤팩타에는 A9 세포군의 도파민성 뉴런이 들어 있는데, 이 뉴런은 선조체에게 도파민을 공급함으로써 기초 갱년기에 정보를 전달한다. 이와는 대조적으로 파스 레티쿨라타는 대부분 GABAergic 뉴런을 포함하고 있다.
SNc는 SNr에 걸쳐 있는 얇은 세포 띠로 구성되어 있으며, 복측 테그먼트 영역(VTA)의 A10 도파민 뉴런 그룹에 횡방향으로 위치하며, 중임브릭 도파민 경로를 형성한다. SNc는 도파민 뉴런에 노화에 따라 축적되는 것으로 알려진 뉴로멜라닌이라는 검은 색소가 들어 있기 때문에 인간의 뇌 부분에서 쉽게 시각화된다.[4] SNc의 도파민성 세포체에는 인간 SNc의 도파민 세포가 약 20만~42만 개, 마우스 SNc의 도파민 세포 8천~1만2천 개가 빽빽하게 들어차 있다.[5] 이 도파민 세포체는 화학적으로 정의된 두 층 중 하나로 국부화된다.[6] 상층(또는 등층)에 있는 것은 calbindin-D28K라고 불리는 결합 단백질을 함유하고 있는데, 이 단백질이 너무 높거나 독성이 있을 때 세포 내부의 칼슘 수치를 완충할 수 있다. 하부층(또는 복부층)의 도파민 세포는 이 단백질이 부족하고 파킨슨병 같은 증상을 일으킬 수 있는 신경독신(MPTP)의 효과에 더 취약하다.[7][8] 등상층 도파민 세포는 파스 콤팩타를 가로질러 수평으로 방사되는 덴드라이트를 가지고 있는 반면, 복상층 도파민 세포는 파스 레티쿨라타 안으로 복강적으로 확장되는 덴드라이트를 가지고 있다.[6][9]
도파민성 액손
도파민 뉴런의 액손은 1차 덴드라이트에서 방출되며 내측 전뇌 묶음을 통해 등측 선조체까지 쌍방향으로 투영된다. SNc 내 도파민 세포 본체의 해부학적 국소화와 등 선조체 내 종말 영역 사이에는 대략적인 지형적 상관관계가 있다. SNc의 측면부에 있는 도파민성 세포는 주로 선조체의 측면과 카우달(포스터리어) 부분에, 내측 SNc의 도파민 세포는 내측 선조체에 투영된다.[10][9] 또한 등단층의 도파민 세포는 복측 선조체에 투영되는 반면, 복측층 뉴런은 등단층 카우데이트핵과 putamen에 투영된다.[6][9] 일반적으로 등측 선조체에는 도파민성 입력이 더 밀도가 높다.[9]
각 도파민 뉴런은 쥐의 선조체 부피의 최대 6%까지 내장을 일으킬 수 있는 극도로 큰 무염화 축사식을 가지고 있다.[11] 모든 SNc 도파민 세포가 선조체의 선조체(또는 패치)와 행렬 신경화학적 구획에 투영되지만, 등상층 뉴런의 축 영역 대부분은 행렬 구획에 있는 반면 복측층 뉴런의 축 영역은 대부분 선조체 내에 있다.[6][10][11] 흑색 스트라이커탈 도파민 액손은 다른 뇌 부위로 투영되는 액손 콜라테랄을 발생시킬 수도 있다. 예를 들어, 일부 SNc nigrostrial dopamine acxons는 액손 콜라테알을 pedunculopontine 핵, 복측 팔라듐, 아비탈라믹 핵, 글로부스 팔리두스, 편도아, 탈라무스에 보낸다.[6][9][12]
피질의 도파민성 내경사는 대부분 인접한 VTA 도파민 뉴런에서 나오지만 소수의 SNc 등부위 도파민 뉴런도 피질에 직접 투영된다.[9]
도르살 선조체
등뼈 선조체는 전뇌의 아문부위에 위치한다. 영장류와 다른 포유류에서 그것은 내부 캡슐이라고 불리는 백색 물질의 전방 사지에 의해 두 부분으로 나뉘는데,[13] 그것은 입자핵과 푸타멘이다.[14] 설치류에서, 내부 캡슐은 카우다이트와 푸타멘이 분리되지 않고 카우다이트 푸타멘(CPU)이라고 불리는 하나의 큰 실체를 형성할 정도로 개발이 미흡하다.[15][16] 등 선조체 세포의 대다수(약 95%)는 척추 투영 뉴런(SPN)으로도 알려진 GABAergic medium spiny nerron(MSN)이다. 이들 MSN의 약 절반은 도파민 D1 수용체를 포함하고 있으며 실체니아 니그라에 직접 투영되어 기저핵의 직접 경로를 형성하는 반면, 나머지 절반은 글로부스 팔리두스와 아팔라믹핵을 통해 실체니아 니그라에 간접 투영되어 기저핵의 간접 경로를 형성하는 도파민 D2 수용체를 표현한다.앵글리아.[17] 나머지 5%의 세포는 콜린거성 뉴런 또는 여러 종류의 GABAergic 뉴런들 중 하나인 내부 동맥류들이다.[18][19] 이 내부유전자의 축과 강낭콩은 선조체 내에 머무른다.
Caudate nuclear와 putamen은 대뇌피질의 모든 영역에서 흥분성 정보를 수신한다.[20] 이러한 글루타마테라믹 입력은 일반적으로 putamen이 주로 센서이모터피질로부터 정보를 얻는 반면 caudate핵은 주로 연관피질로부터 정보를 얻도록 위상적으로 배열되어 있다.[20] 또한 등지 선조체는 시상하부와 같은 다른 뇌 구조로부터 흥분 입력을 받고,[21] 해마와 편도체로부터 경미한 흥분 입력을 받는다.
등 선조체에는 더 높은 아세틸콜린세테라아제 및 칼빈딘-D28K를 포함하는 매트릭스 구획 내에 내장된 μ-오피오이드 수용체 얼룩을 보이는 스트리오솜(일명 패치라고도 함)이라는 신경화학적으로 정의된 구획이 들어 있다.[22]
등 선조체에서 GABAERGIC MSN에 시냅스하는 니그로스트라이탈 경로의 도파민성 액손 단자. 그것들은 세포 몸체와 덴드리트 축 부위에 시냅스를 형성하지만, 대부분 같은 덴드리트 가시의 머리에도 글루타마테라믹 입력을 받는 덴드리틱 가시의 목에서 시냅스를 형성한다.[1]
함수
흑연사적 경로의 주요 기능은 기본 갱년기 모터 루프를 통한 자발적 운동에 영향을 미치는 것이다. 중상 및 중상구 도파민 경로와 함께 흑색선 도파민 경로도 인지,[23] 보상, 중독을 포함한 다른 뇌 기능에 영향을 미칠 수 있다.[24] 니그로스트라이탈 도파민성 뉴런은 뉴런 발화 활동의 강장성 및 인두학적 패턴을 나타낸다. 이로 인해 등측 선조체의 액손 단자와 SNc 및 SNr의 세포체(소마) 및 덴드라이트에서 도파민이 방출되는 패턴이 달라질 수 있으며,[25][26] 흑색선 경로에 도파민을 방출하는 것뿐만 아니라 GABA도 공동 방출할 수 있다.[27][28]
흑연사적 경로는 두 가지 경로, 즉 직접적인 이동 경로와 간접적인 이동 경로를 통한 이동에 영향을 미친다.[29][30]
직접 이동 경로
직접 통로는 지명 수배 운동의 촉진에 관여한다. 도파민 D1 수용체에서 가새핵에 중간 가시가 있는 뉴런을 포함하고 있는 도파민 D1 수용체로부터 나온 투영들은 실체니아 니그라파스 레티쿨라타에서 톤 활성 GABAergic 세포와 그 후 쇄골(GPI)으로 투영된다. 선조체 / 선조체 분자 및 니그로탈라믹 경로는 억제되기 때문에, 직접 경로의 활성화는 탈하부와 운동 피질에 의해 생성되는 움직임에 대한 전반적인 순 흥분 효과를 생성한다.
간접 이동 경로
간접적인 통로는 원치 않는 움직임을 억제하는 데 관여한다. 도파민 D2 수용체에서 가새핵에 중간 가시가 있는 뉴런을 포함하고 있는 도파민 D2 수용체로부터 나온 투영들은 GPe(Globus Palidus)의 외부 부분에 있는 톤 활성 GABAergic 세포에 투영되며, 이 세포들은 흥분성 치사핵(STN)을 통해 실체 니그라 파스 레티쿨라타에 투영된다. 선조체 살상 경로와 니그로살라믹 경로는 억제되지만 니그라 경로에 대한 아탈라믹 경로는 흥분적이기 때문에, 간접 경로의 활성화는 시알무스와 운동 피질에 의한 움직임에 대한 전반적인 순 억제 효과를 생성한다.
임상적 유의성
파킨슨병
파킨슨병은 주로 저혈압, 경직성, 떨림, 자세불균형 등 운동장애가 심한 것이 특징이다.[31] 흑색선 경로에서 도파민 뉴런의 상실은 파킨슨병의 주요 병리학적 특징 중 하나이다.[32] 도파민이 생성되는 뉴런이 실체니아 니그라파스 콤팩타와 푸아멘-카우데이트 복합체에서 퇴화하면 니그로스트라이탈 경로에서 도파민 농도가 감소해 기능 저하와 특성 증상으로 이어진다.[33] 이 병의 증상은 일반적으로 도파민 기능의 80-90%가 없어질 때까지 나타나지 않는다.
레보도파 유도 이질증
레보도파 유도 이상증(LID)은 파킨슨병 치료제 L-DOPA의 장기간 사용과 관련된 합병증으로, 비자발적인 움직임과 근육의 수축이 특징이다. 이 질환은 9년 치료 후 최대 90%의 환자에게서 발생한다. 환자에게 L-DOPA를 사용하면 기저 갱년기 내 시냅스 후 뉴런의 변화뿐만 아니라 흑색선 도파민 투영의 중단으로 이어질 수 있다.[34]
정신분열증
정신분열증에서는 사전시냅스 도파민 대사가 변한다.[35][36]
기타 도파민 경로
기타 주요 도파민 경로에는 다음이 포함된다.
참고 항목
참조
- ^ a b David Smith, A.; Paul Bolam, J. (1990-07-01). "The neural network of the basal ganglia as revealed by the study of synaptic connections of identified neurones". Trends in Neurosciences. 13 (7): 259–265. doi:10.1016/0166-2236(90)90106-K. ISSN 0166-2236. PMID 1695400. S2CID 4018397.
- ^ Tritsch, NX; Ding, JB; Sabatini, BL (Oct 2012). "Dopaminergic neurons inhibit striatal output through non-canonical release of GABA". Nature. 490 (7419): 262–6. Bibcode:2012Natur.490..262T. doi:10.1038/nature11466. PMC 3944587. PMID 23034651.
- ^ 디아즈, 제이미 마약이 행동에 미치는 영향. 엥글우드 절벽: 프렌티스 홀, 1996.
- ^ Zucca, Fabio A.; Basso, Emy; Cupaioli, Francesca A.; Ferrari, Emanuele; Sulzer, David; Casella, Luigi; Zecca, Luigi (January 2014). "Neuromelanin of the human substantia nigra: an update". Neurotoxicity Research. 25 (1): 13–23. doi:10.1007/s12640-013-9435-y. ISSN 1476-3524. PMID 24155156. S2CID 8372724.
- ^ Brichta, Lars; Greengard, Paul (2014). "Molecular determinants of selective dopaminergic vulnerability in Parkinson's disease: an update". Frontiers in Neuroanatomy. 8: 152. doi:10.3389/fnana.2014.00152. ISSN 1662-5129. PMC 4266033. PMID 25565977.
- ^ a b c d e Prensa, L.; Giménez-Amaya, J. M.; Parent, A.; Bernácer, J.; Cebrián, C. (2009). "The nigrostriatal pathway: axonal collateralization and compartmental specificity". Journal of Neural Transmission. Supplementum (73): 49–58. doi:10.1007/978-3-211-92660-4_4. ISBN 978-3-211-92659-8. ISSN 0303-6995. PMID 20411767.
- ^ Nemoto, C.; Hida, T.; Arai, R. (1999-10-30). "Calretinin and calbindin-D28k in dopaminergic neurons of the rat midbrain: a triple-labeling immunohistochemical study". Brain Research. 846 (1): 129–136. doi:10.1016/s0006-8993(99)01950-2. ISSN 0006-8993. PMID 10536220. S2CID 26684957.
- ^ Dopeso-Reyes, Iria G.; Rico, Alberto J.; Roda, Elvira; Sierra, Salvador; Pignataro, Diego; Lanz, Maria; Sucunza, Diego; Chang-Azancot, Luis; Lanciego, Jose L. (2014). "Calbindin content and differential vulnerability of midbrain efferent dopaminergic neurons in macaques". Frontiers in Neuroanatomy. 8: 146. doi:10.3389/fnana.2014.00146. ISSN 1662-5129. PMC 4253956. PMID 25520629.
- ^ a b c d e f Haber, S. N. (2014-12-12). "The place of dopamine in the cortico-basal ganglia circuit". Neuroscience. 282: 248–257. doi:10.1016/j.neuroscience.2014.10.008. ISSN 1873-7544. PMC 5484174. PMID 25445194.
- ^ a b Gerfen, C. R.; Herkenham, M.; Thibault, J. (December 1987). "The neostriatal mosaic: II. Patch- and matrix-directed mesostriatal dopaminergic and non-dopaminergic systems". The Journal of Neuroscience. 7 (12): 3915–3934. doi:10.1523/JNEUROSCI.07-12-03915.1987. ISSN 0270-6474. PMC 6569093. PMID 2891799.
- ^ a b Matsuda, Wakoto; Furuta, Takahiro; Nakamura, Kouichi C.; Hioki, Hiroyuki; Fujiyama, Fumino; Arai, Ryohachi; Kaneko, Takeshi (2009-01-14). "Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum". The Journal of Neuroscience. 29 (2): 444–453. doi:10.1523/JNEUROSCI.4029-08.2009. ISSN 1529-2401. PMC 6664950. PMID 19144844.
- ^ Prensa, L.; Parent, A. (2001-09-15). "The nigrostriatal pathway in the rat: A single-axon study of the relationship between dorsal and ventral tier nigral neurons and the striosome/matrix striatal compartments". The Journal of Neuroscience. 21 (18): 7247–7260. doi:10.1523/JNEUROSCI.21-18-07247.2001. ISSN 1529-2401. PMC 6762986. PMID 11549735.
- ^ Emos, Marc Christopher; Agarwal, Sanjeev (2019), "Neuroanatomy, Internal Capsule", StatPearls, StatPearls Publishing, PMID 31194338, retrieved 2019-10-06
- ^ Mai, Jürgen K. (14 December 2015). Atlas of the human brain. Majtanik, Milan,, Paxinos, George, 1944- (4th ed.). Amsterdam. ISBN 9780128028001. OCLC 934406284.
- ^ Coizet, Veronique; Heilbronner, Sarah R.; Carcenac, Carole; Mailly, Philippe; Lehman, Julia F.; Savasta, Marc; David, Oivier; Deniau, Jean-Michel; Groenewegen, Henk J.; Haber, Suzanne N. (March 8, 2017). "Organization of the Anterior Limb of the Internal Capsule in the Rat". The Journal of Neuroscience. 37 (10): 2539–2554. doi:10.1523/JNEUROSCI.3304-16.2017. ISSN 1529-2401. PMC 5354315. PMID 28159909.
- ^ Paxinos, George, 1944- (2013-11-07). The rat brain in stereotaxic coordinates. Watson, Charles, 1943- (Seventh ed.). Amsterdam. ISBN 9780123919496. OCLC 859555862.
{{cite book}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Gerfen, Charles R.; Surmeier, D. James (2011). "Modulation of striatal projection systems by dopamine". Annual Review of Neuroscience. 34: 441–466. doi:10.1146/annurev-neuro-061010-113641. ISSN 1545-4126. PMC 3487690. PMID 21469956.
- ^ Gonzales, Kalynda K.; Smith, Yoland (September 2015). "Cholinergic interneurons in the dorsal and ventral striatum: anatomical and functional considerations in normal and diseased conditions". Annals of the New York Academy of Sciences. 1349 (1): 1–45. Bibcode:2015NYASA1349....1G. doi:10.1111/nyas.12762. ISSN 1749-6632. PMC 4564338. PMID 25876458.
- ^ Tepper, James M.; Koós, Tibor; Ibanez-Sandoval, Osvaldo; Tecuapetla, Fatuel; Faust, Thomas W.; Assous, Maxime (2018). "Heterogeneity and Diversity of Striatal GABAergic Interneurons: Update 2018". Frontiers in Neuroanatomy. 12: 91. doi:10.3389/fnana.2018.00091. ISSN 1662-5129. PMC 6235948. PMID 30467465.
- ^ a b Haber, Suzanne N. (March 2016). "Corticostriatal circuitry". Dialogues in Clinical Neuroscience. 18 (1): 7–21. doi:10.31887/DCNS.2016.18.1/shaber. ISSN 1958-5969. PMC 4826773. PMID 27069376.
- ^ Smith, Yoland; Galvan, Adriana; Ellender, Tommas J.; Doig, Natalie; Villalba, Rosa M.; Huerta-Ocampo, Icnelia; Wichmann, Thomas; Bolam, J. Paul (2014). "The thalamostriatal system in normal and diseased states". Frontiers in Systems Neuroscience. 8: 5. doi:10.3389/fnsys.2014.00005. ISSN 1662-5137. PMC 3906602. PMID 24523677.
- ^ Brimblecombe, Katherine R.; Cragg, Stephanie J. (February 15, 2017). "The Striosome and Matrix Compartments of the Striatum: A Path through the Labyrinth from Neurochemistry toward Function". ACS Chemical Neuroscience. 8 (2): 235–242. doi:10.1021/acschemneuro.6b00333. ISSN 1948-7193. PMID 27977131.
- ^ Boot, Nathalie; Baas, Matthijs; van Gaal, Simon; Cools, Roshan; De Dreu, Carsten K. W. (July 2017). "Creative cognition and dopaminergic modulation of fronto-striatal networks: Integrative review and research agenda". Neuroscience and Biobehavioral Reviews. 78: 13–23. doi:10.1016/j.neubiorev.2017.04.007. ISSN 1873-7528. PMID 28419830. S2CID 21315163.
- ^ Wise, RA (October 2009). "Roles for nigrostriatal--not just mesocorticolimbic--dopamine in reward and addiction". Trends in Neurosciences. 32 (10): 517–524. doi:10.1016/j.tins.2009.06.004. PMC 2755633. PMID 19758714.
- ^ Rice, M. E.; Patel, J. C.; Cragg, S. J. (2011-12-15). "Dopamine release in the basal ganglia". Neuroscience. 198: 112–137. doi:10.1016/j.neuroscience.2011.08.066. ISSN 1873-7544. PMC 3357127. PMID 21939738.
- ^ Rice, Margaret E.; Patel, Jyoti C. (2015-07-05). "Somatodendritic dopamine release: recent mechanistic insights". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 370 (1672): 20140185. doi:10.1098/rstb.2014.0185. ISSN 1471-2970. PMC 4455754. PMID 26009764.
- ^ Tritsch, Nicolas X.; Granger, Adam J.; Sabatini, Bernardo L. (March 2016). "Mechanisms and functions of GABA co-release". Nature Reviews. Neuroscience. 17 (3): 139–145. doi:10.1038/nrn.2015.21. ISSN 1471-0048. PMC 6980171. PMID 26865019.
- ^ Trudeau, Louis-Eric; Hnasko, Thomas S.; Wallén-Mackenzie, Asa; Morales, Marisela; Rayport, Steven; Sulzer, David (2014). "The multilingual nature of dopamine neurons". Progress in Brain Research. 211: 141–164. doi:10.1016/B978-0-444-63425-2.00006-4. ISBN 9780444634252. ISSN 1875-7855. PMC 4565795. PMID 24968779.
- ^ Kravitz, Alexxai V.; Kreitzer, Anatol C. (June 2012). "Striatal mechanisms underlying movement, reinforcement, and punishment". Physiology. 27 (3): 167–177. doi:10.1152/physiol.00004.2012. ISSN 1548-9221. PMC 3880226. PMID 22689792.
- ^ Kravitz, Alexxai V.; Freeze, Benjamin S.; Parker, Philip R. L.; Kay, Kenneth; Thwin, Myo T.; Deisseroth, Karl; Kreitzer, Anatol C. (2010-07-29). "Regulation of parkinsonian motor behaviours by optogenetic control of basal ganglia circuitry". Nature. 466 (7306): 622–626. Bibcode:2010Natur.466..622K. doi:10.1038/nature09159. ISSN 1476-4687. PMC 3552484. PMID 20613723.
- ^ Cenci, Angela M (2006). "Post- versus presynaptic plastic ity in L-DOPA-induced dyskinesia" (PDF). Journal of Neurochemistry. 99 (2): 381–92. doi:10.1111/j.1471-4159.2006.04124.x. PMID 16942598. S2CID 9649270.
- ^ Deumens, Ronald (21 June 2002). "Modeling Parkinson's Disease in Rats: An Evaluation of 6-OHDA Lesions of the Nigrostriatal Pathway". Experimental Neurology. 175 (2): 303–17. doi:10.1006/exnr.2002.7891. PMID 12061862. S2CID 2770493.
- ^ Groger, Adraine (8 January 2014). "Dopamine Reduction in the Substantia Nigra of Parkinson's Disease Patients Confirmed by In Vivo Magnetic Resonance Spectroscopic Imaging". PLOS ONE. 9 (1): e84081. Bibcode:2014PLoSO...984081G. doi:10.1371/journal.pone.0084081. PMC 3885536. PMID 24416192.
- ^ Niethammer, Martin (May 2012). "Functional Neuroimaging in Parkinson's Disease". Cold Spring Harbor Perspectives in Medicine. 2 (5): a009274. doi:10.1101/cshperspect.a009274. PMC 3331691. PMID 22553499.
- ^ Fusar-Poli, Paolo; Meyer-Lindenberg, Andreas (1 January 2013). "Striatal presynaptic dopamine in schizophrenia, part II: meta-analysis of [(18)F/(11)C]-DOPA PET studies". Schizophrenia Bulletin. 39 (1): 33–42. doi:10.1093/schbul/sbr180. ISSN 1745-1701. PMC 3523905. PMID 22282454.
- ^ Weinstein, Jodi J.; Chohan, Muhammad O.; Slifstein, Mark; Kegeles, Lawrence S.; Moore, Holly; Abi-Dargham, Anissa (1 January 2017). "Pathway-Specific Dopamine Abnormalities in Schizophrenia". Biological Psychiatry. 81 (1): 31–42. doi:10.1016/j.biopsych.2016.03.2104. ISSN 1873-2402. PMC 5177794. PMID 27206569.


