샤피로 반응
Shapiro reaction샤피로 반응 또는 톨하이드라존 분해는 오가놀륨 시약 2개의 등가물이 존재하는 상태에서 케톤이나 알데히드를 중간 히드라존을 통해 알켄으로 변환하는 유기 반응이다.[1][2][3] 그 반응은 로버트 H에 의해 발견되었다. 1967년 [4]샤피로 샤피로 반응은 니콜라우 택솔 총합성에 사용되었다.[5] 이 반응은 밤포드-스테벤스 반응과 매우 유사하며, 이것은 토실 하이드라존의 기본적인 분해도 포함한다.
반응 메커니즘
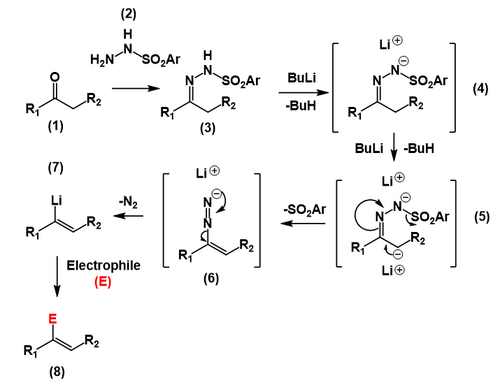
실제 샤피로 반응의 전주곡에서 케톤이나 알데히드(1)를 p-톨루엔설폰릴하이드라자이드[6](2)와 반응하여 히드라존(3)인 p-톨루엔설폰(또는 토실하이드라존)을 형성한다. n-butyllithium과 같은 강한 염기성의 두 등가물은 하이드라존으로부터 양성자를 추상화하고, 그 다음 산도가 낮은 양성자 α를 하이드라존 탄소(5)로 추상화하여 카르바니온을 형성한다. 그런 다음 카르바니온은 탄소-탄소 이중 결합을 생성하고 토실 음이온을 배출하여 디아조늄 음이온(6)을 형성한다. 이 디아조늄 음이온은 분자질소로서 손실되어 빈닐리튬 종(7)이 생기게 되는데, 그 다음 물이나 산(8)으로 단순 중화시키는 것을 포함한 다양한 전기생성 물질과 반응할 수 있다.
범위
제품 내 알켄의 위치는 오가놀리스튬 베이스에 의한 탈색 부지에 의해 제어된다. 일반적으로 동력학적으로 선호되는 덜 대체된 토실하이드라존의 부위는 선택적으로 감압되어, 덜 대체된 비닐리튬 중간이 된다. 빈닐리튬 기능군에는 많은 이차적 반응이 존재하지만, 특히 물에서 샤피로 반응이 더해져 알켄에 양성되는 결과를 초래한다.[7] 빈닐리튬 화합물의 다른 반응은 알킬 할로겐화물과 같은 알킬화 반응을 포함한다.[8]

중요한 것은, 알데히드에서 파생된 설포닐하이드라존이 C–N 이중 결합의 탄소에 오르가늄 베이스의 배타적 첨가를 거치기 때문에 샤피로 반응을 1-리시오알케네(및 그 결과로 기능화된 파생상품)를 합성하는데 사용할 수 없다.[9]
촉매 샤피로 반응
전통적인 샤피로 반응은 알케닐리튬 시약을 생성하기 위해 스토오치메트릭(때로는 과도)의 염기량을 필요로 한다. 야마모토와 동료들은 이 문제에 대처하기 위해 리튬 아미드의 촉매량을 가진 아네술폰 페닐라지르디비닐하이드라존 등가물로 케톤 페닐아지리드비닐하이드라존의 조합을 이용해 알케네에 대한 효율적인 입체 및 재생 경로를 개발했다. 필요한 페닐라지르비닐히드라존은 1-아미노-2-페닐라지르딘으로 언데칸-6-1의 응축으로부터 준비되었다. 페닐라지르비닐하이드라존 0.3 등가물을 에테르에 넣어 처리한 결과 시스:트랜스 비율이 99.4:0.6으로 아래와 같은 알켄이 나타났다. 이 비율은 mCPBA를 사용한 해당 에폭시드로 변환한 후 모세관 GLC 분석에 의해 결정되었다. 30mmol 스케일 반응의 경우 촉매 하중은 0.05 등가물로 줄일 수 있다.
높은 입체성은 페닐라지리딘에 대한 α-메틸렌 수소 동기화의 우선적 추상화에 의해 얻어지며, 또한 석회화 매개체의 내부 킬레이트화에 의해서도 설명된다.[10]
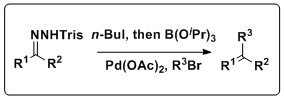
한 솥이 샤피로-스즈키 반응을 결합했다.
샤피로 반응도 스즈키 반응과 결합해 다양한 올레핀 제품을 생산할 수 있다. 키이와 동료들은 이러한 반응을 전통적인 스즈키 커플링의 후퇴인 보론산을 분리할 필요가 없는 하나의 항아리 공정으로 결합하는 방법론을 개발했다. 이 반응은 넓은 범위를 가지며, 여러 용매와 Pd 공급원뿐만 아니라 삼리실하이드라존과 아릴 할로겐화물도 견딜 수 있다.[11]
총합성에서의 샤피로 반응의 응용
샤피로 반응은 복잡한 천연물에 대한 올레핀을 생성하기 위해 사용되어 왔다. K. Mori와 동료들은 피토칼렉신스라고 불리는 천연 제품군의 피토카산 그룹의 절대적인 구성을 결정하기를 원했다. 이것은 자연적으로 발생하는 (R)-비엘란드-미쉐르 케톤(----)을 준비함으로써 달성되었다. (--------)로 가는 도중에 삼발성 케톤을 샤피로 반응 조건을 적용하여 주기성 알켄 제품을 생산했다. [12]
참고 항목
참조
- ^ Shapiro, R. H.; Lipton, M. F.; Kolonko, K. J.; Buswell, R. L.; Capuano, L. A. (1975). "Tosylhydrazones and alkyllithium reagents: More on the regiospecificity of the reaction and the trapping of three intermediates". Tetrahedron Lett. 16 (22–23): 1811–1814. doi:10.1016/S0040-4039(00)75263-4.
- ^ Shapiro, Robert H. (1976). "Alkenes from Tosylhydrazones". Organic Reactions. Org. React. Vol. 23. pp. 405–507. doi:10.1002/0471264180.or023.03. ISBN 978-0471264187.
- ^ Adlington, Robert M.; Barret, Anthony G. M. (1983). "Recent applications of the Shapiro reaction". Acc. Chem. Res. 16 (2): 55–59. doi:10.1021/ar00086a004.
- ^ Shapiro, Robert H.; Heath, Marsha J. (1967). "Tosylhydrazones. V. Reaction of Tosylhydrazones with Alkyllithium Reagents. A New Olefin Synthesis". J. Am. Chem. Soc. 89 (22): 5734–5735. doi:10.1021/ja00998a601.
- ^ Nicolaou, Kyriacos C.; Sorensen, Erik J. (1996). Classics in Total Synthesis: Targets, Strategies, Methods. Wiley. ISBN 9783527292318.
- ^ Friedman, Lester; Litle, Robert L.; Reichle, Walter R. (1960). "p-Toluenesulfonylhydrazide". Organic Syntheses. 40: 93.; Collective Volume, vol. 5, p. 1055
- ^ Shapiro, R. H.; Duncan, J. H. (1971). "2-Bornene (1,7,7-Trimethylbicyclo[2.2.1]hept-2-ene)". Organic Syntheses. 51: 66. doi:10.15227/orgsyn.051.0066.; Collective Volume, vol. 6
- ^ Chamberlin, A. Richard; Liotta, Ellen L.; Bond, F. Thomas (1983). "Generation and Reactions of Alkenyllithium Reagents: 2-Butylbornene". Organic Syntheses. 61: 141. doi:10.15227/orgsyn.061.0141.; Collective Volume, vol. 7, p. 77
- ^ Chamberlin, A. Richard; Bloom, Steven H. (1990). "Lithioalkenes from Arenesulfonylhydrazones". Org. React. 39 (1): 1–83. doi:10.1002/0471264180.or039.01.
- ^ Maruoka, Keiji; Oishi, Masataka; Yamamoto, Hisashi (1991). "The Catalytic Shapiro Reaction". J. Am. Chem. Soc. 118 (9): 2289–2290. doi:10.1021/ja951422p.
- ^ Passafaro, Marco S.; Keay, Brian A. (1996). "A one pot in situ combined Shapiro-Suzuki reaction". Tetrahedron Lett. 37 (4): 429–432. doi:10.1016/0040-4039(95)02210-4.
- ^ Yajima, Arata; Mori, Kenji (2000). "Synthesis and absolute configuration of (–)-phytocassane D, a diterpene phytoalexin isolated from the rice plant, Oryza sativa". Eur. J. Org. Chem. 2000 (24): 4079–4091. doi:10.1002/1099-0690(200012)2000:24<4079::AID-EJOC4079>3.0.CO;2-R.