티타늄(IV) 질산염
Titanium(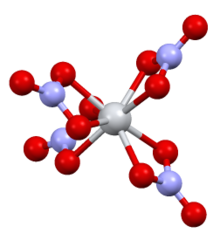 | |
| 이름 | |
|---|---|
| 기타 이름 사질산티타늄, 사질산티타늄 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.222.601 |
PubChem CID | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| Ti(NO3)4 | |
| 몰 질량 | 295.8866 g/g |
| 외모 | 백색 휘발성 고체 |
| 밀도 | 2.192[3] |
| 녹는점 | 58[4] °C (136 °F, 331 K) |
| 비등점 | 분해하다 |
| 반응[5] | |
| 구조[6] | |
| 단사정형의 | |
| P21/C | |
a = 7.80, b = 13.57, c = 10.34Ω α = 90°,β = 125·0°, β = 90° | |
격자 볼륨(V) | 896.523 8 |
수식 단위(Z) | 4 |
| 8 | |
| 편평 사면체 | |
| 관련 화합물 | |
관련 화합물 | 질산 하프늄, 질산 지르코늄, 인산티타늄, 과염소산티타늄 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
질산티타늄은 식 Ti(NO3)4의 무기화합물이다.그것은 쉽게 승화되는 무색의 반자성 고체이다.이것은 휘발성 바이너리 전이 금속 질산염의 특이한 예입니다.티타늄이나 그 산화물이 질산에 용해되면 질산티타늄이라고 불리는 잘못 정의된 종이 생성됩니다.
준비
원래의 방법과 마찬가지로3 Ti(4NO)[7][8]는 5산화수소[9] 또는 [10]질산염소를 사용하여 사염화티타늄을 질화함으로써 제조된다.
- TiCl4 + 4 NO25 → Ti(NO3)4 + 4 ClNO2
아쿠오 착체[Ti(HO2)]63+의 질산염인 수화티타늄 질산염은 질산에 [11]티타늄 화합물을 용해시켜 제조한다.
구조.
복합체는 D 대칭을 가지며2d, 4개의 이원성 질산염 배위자를 가지고 있다.N-O 거리는 1/29 å 및 1/185 ((비조정)[6]입니다.
물리 속성
적외선 스펙트럼에서는 1635cm로−1 강하게 흡수되어 N-O 진동 [12]모드에 할당됩니다.
비극성 용제인 사염화 규소와 사염화 [13][8]탄소에 용해됩니다.
반응
질산티타늄은 흡습성이 있어 불분명한 하이드레이트로 [14]변환됩니다.무수 물질은 [14]탄화수소에 대해서도 반응성이 매우 높습니다.질산티타늄은 n-도데칸,[15] p-디클로로벤젠, 아니솔, 비페닐,[15][16]
그것은 [17]이산화티타늄으로 열분해된다.
레퍼런스
- ^ Garner, C. D.; Wallwork, S. C. (1966). "The crystal structures of anhydrous nitrates and their complexes. Part III. Titanium(IV) nitrate". J. Chem. Soc. A: 1496–1500. doi:10.1039/J19660001496.
- ^ "ICSD 26639 : ICSD Structure : N4 O12 Ti". Cambridge Structural Database: Access Structures. Cambridge Crystallographic Data Centre. Retrieved 2021-05-08.
- ^ "Titanium(iv) nitrate (Ti(NO3)4)". Retrieved 27 September 2014.
- ^ 원소 화학 (제2판).N. N. 그린우드와 A.언쇼.P966.21.3.4 옥소아니온 화합물
- ^ Nathaniel Howell Furman; R. J. Mundy; G. H. Morrison (1955). The Distribution of Uranyl Nitrate from Aqueous Solutions to Diethyl Ether. the University of Michigan: U.S. Atomic Energy Commission. Technical Information Service. p. 51.
- ^ a b Garner, C. David; Ian H. Hillier; Martyn F. Guest (1975). "Ab initio self-consistent field molecular-orbital calculation of the ground state of tetranitratotitanium(IV); comments on the reactivity of anhydrous metal nitrates". Journal of the Chemical Society, Dalton Transactions (19): 1934. doi:10.1039/DT9750001934. ISSN 0300-9246.
- ^ Reihlen, Hans; Andreas Hake (1927). "Über die Konstitution des N2O4 und N2O3 und die Additionsverbindungen von Nitro- und Nitrosokörpern an Zinn- und Titantetrachlorid". Justus Liebig's Annalen der Chemie (in German). 452 (1): 47–67. doi:10.1002/jlac.19274520104. ISSN 0075-4617.
- ^ a b Schmeisser, Martin (1955). "Die Chemie der anorganischen Acylnitrate (ein Problem des Nitrylchlorids) und Acylperchlorate (ein Problem des Dichlorhexoxyds)". Angewandte Chemie (in German). 67 (17–18): 493–501. Bibcode:1955AngCh..67..493S. doi:10.1002/ange.19550671708. ISSN 0044-8249.
- ^ P. 에를리히 "Titanium Tetranitrate" (제2판) 준비 무기 화학 핸드북의 "Titanium Tetranitrate" (티타늄 테트라니트레이트)G.Braower에 의해 편집, 학술 출판, 1963, NY. Vol. 1. p. 1237.
- ^ 슈마이어, M.; 브랜들, K.질산 아실과 과염소산염.IV. ClNO3를 아실질산염의 원료로 한다.앙게반트 케미, 1957년69: 781. ISSN: 0044-8249.
- ^ Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. Academic Press. p. 1331. ISBN 9780123526519. Retrieved 28 September 2014.
- ^ Addison, C. C.; Logan, N.; Wallwork, S. C.; Garner, C. D. (1971). "Structural Aspects of Co-ordinated Nitrate Groups". Quarterly Reviews, Chemical Society. 25 (2): 289. doi:10.1039/qr9712500289.
- ^ Amos, D.W.; G.W. Flewett (1974). "Raman spectra of titanium (IV) and tin (IV) nitrates". Spectrochimica Acta Part A: Molecular Spectroscopy. 30 (2): 453–461. Bibcode:1974AcSpA..30..453A. doi:10.1016/0584-8539(74)80085-1. ISSN 0584-8539.
- ^ a b Amos, D.W.; D.A. Baines, G.W. Flewett (1973). "Nitration by titanium (IV) nitrate". Tetrahedron Letters. 14 (34): 3191–3194. doi:10.1016/S0040-4039(00)79808-X. ISSN 0040-4039.
- ^ a b Coombes, Robert G.; Leslie W. Russell (1974). "Nitration of aromatic compounds by tetranitratotitanium(IV) in carbon tetrachloride solution". Journal of the Chemical Society, Perkin Transactions 2 (7): 830. doi:10.1039/P29740000830. ISSN 0300-9580.
- ^ Schofield, Kenneth (1980). Aromatic Nitration. CUP Archive. pp. 97–98. ISBN 9780521233620. Retrieved 27 September 2014.
- ^ Allendorf, Mark Donald (1999-01-01). "Titanium Oxide CVD from Titanium (IV) Nitrate ...". Proceedings of the Symposium on Fundamental Gas-Phase and Surface Chemistry of Vapor-Phase Materials Synthesis. The Electrochemical Society. pp. 395–397. ISBN 9781566772174. Retrieved 27 September 2014.
기타 판독치
- Partington, J. R.; A. L. Whynes (1949). "660. Reactions of nitrosyl chloride. Part II". Journal of the Chemical Society (Resumed): 3135. doi:10.1039/JR9490003135. ISSN 0368-1769.
- Dauerman, L.; G.E. Salser (1973). "Mass spectra of covalent inorganic nitrates: copper(II) nitrate and titanium(IV) nitrate". Journal of Inorganic and Nuclear Chemistry. 35 (1): 304–306. doi:10.1016/0022-1902(73)80643-8. ISSN 0022-1902.
| HNO3 | 그 | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 | 로노2 | 아니요− 3 NH4NO3 | 훈오2 | FNO3 | 네 | ||||||||||
| NaNO3 | Mg(NO3)2 | 알(NO3)3 | 시 | P | S | 클로노2 | 아르 | ||||||||||
| 키보드3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 | Co(NO3)2 Co(NO3)3 | Ni(NO3)2 | CuNO3 Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | ge | ~하듯이 | 세 | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | 모 | Tc | Ru(NO3)3 | Rh(NO3)3 | PD(NO3)2 PD(NO3)4 | 아그노3 Ag(NO3)2 | CD(NO3)2 | 입력3(NO)3 | Sn(NO3)4 | Sb(NO3)3 | 테 | 이노3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | 타 | W | 레 | OS | Ir | Pt(NO3)2 Pt(NO3)4 | AU(NO3)3 | Hg2(NO3)2 Hg(NO3)2 | TLNO3 TL(NO3)3 | Pb(NO3)2 | Bi(NO3)3 BiO(NO3) | Po(NO3)4 | 앳 | Rn | |
| 프루노3 | Ra(NO3)2 | Rf | 데이터베이스 | Sg | Bh | Hs | 산 | Ds | Rg | Cn | Nh | 플 | 맥 | Lv | Ts | 오그 | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 | Pr(NO3)3 | Nd(NO3)3 | PM(NO3)3 | SM(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | 호(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | 루(NO3)3 | |||
| AC(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | AM(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | 아니요. | Lr | |||

