티타늄 테트라오다이오드
Titanium tetraiodide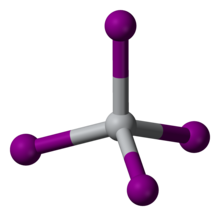 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 티타늄()IV) 요오드화합물 | |
| 기타 이름 티타늄 테트라오다이오드 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.028.868 |
| EC 번호 |
|
펍켐 CID | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| TII4 | |
| 어금질량 | 555.485 g/190 |
| 외관 | 적갈색 결정체 |
| 밀도 | 4.3 g/cm3 |
| 녹는점 | 150 °C(302 °F, 423 K |
| 비등점 | 377°C(711°F, 650K) |
| 가수 분해 | |
| 기타 용매의 용해성 | CHCl에22 녹는 CHCl3 CS2 |
| 구조 | |
| 세제곱(a = 12.21 å) | |
| 사면의 | |
| 0 D | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 격렬한 가수 분해 부식성의 |
| GHS 라벨 표시:[1] | |
 | |
| 위험 | |
| H314 | |
| P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| 관련 화합물 | |
기타 음이온 | 티타늄()IV)브로마이드 티타늄()IV) 염화물 티타늄()IV) 플루오르화 |
기타 양이온 | 실리콘 테트라오다이오드 지르코늄()IV) 요오드화합물 하프니움()IV) 요오드화합물 |
관련 화합물 | 티타늄(III) 요오드화합물 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
티타늄 테트라오다이드는 TiI라는4 공식을 가진 무기 화합물이다. 1863년 루돌프 베버가 처음 보고한 검은색 휘발성 고체다.[2] 티타늄 정화를 위한 반 아르켈-데 보어 공정의 중간이다.
물리적 성질
TiI는4 희귀한 분자 바이너리 요오드화물로 사면체 Ti(IV) 중심부의 격리된 분자로 구성되어 있다. Ti-I 거리는 261pm이다.[3] 그것의 분자4 특성을 반영하여, TiI는 하나의 대기에서 분해되지 않고 증류될 수 있다; 이 특성은 반 아르켈-데 보어 공정에서 그것의 사용의 기초가 된다. TiCl4 (m.p. -24 °C)과 TiI4 (m.p. 150 °C)의 녹는 점 차이는 CCl4 (m.p. -23 °C)과 CI4 (m.p. 168 °C)의 녹는 점의 차이와 맞먹으며, 요오드화물의 분자간 반 데르 바알스 본딩이 강함을 반영한다.
TiI의4 2개의 다형체가 존재하며, 그 중 하나는 유기 용매에 매우 용해된다. 덜 용해성 입방체 형태에서 Ti-I 거리는 261pm이다.[3]
생산
다음과 같은 세 가지 방법이 잘 알려져 있다: 1) 원소로부터, 일반적으로 425 °C에서 튜브 용해로를 사용한다.[4]
- Ti + 22 I → TiI4
이러한 반응은 Ti metal의 고순도 필름을 생산하기 위해 반전될 수 있다.[5]
2) 테트라클로라이드 티타늄과 HI의 교환반응
- TiCl4 + 4 HI → TiI4 + 4 HCl
3) 요오드화알루미늄으로부터의 산화환원
- 3TiO2 + 4 AlI3 → 3TiI4 + 2 AlO23
반응
TiCl이나4 TiBr처럼4 TiI가4 루이스 베이스와 인덕트를 형성하고, 그것 또한 줄일 수 있다. Ti metal이 있는 곳에서 감소를 실시하면 CsTiI와27 체인 CsTiI와3 같은 고분자 Ti(II) 파생상품이 각각 획득된다.[6]
TiI는4 알케인과 알케인에 대한 광범위한 반응성을 보이며, 이로 인해 유기농 유도체가 발생한다. 그것은 또한 피나콜 커플링과 다른 C-C 결합 형성 반응에도 영향을 미친다.[7]
참조
- ^ "Titanium tetraiodide". pubchem.ncbi.nlm.nih.gov. Retrieved 12 December 2021.
- ^ Weber, R. (1863). "Ueber die isomeren Modificationen der Titansäure und über einige Titanverbindungen". Annalen der Physik. 120 (10): 287–294. Bibcode:1863AnP...196..287W. doi:10.1002/andp.18631961003.
- ^ a b Tornqvist, E. G. M.; Libby, W. F. (1979). "Crystal Structure, Solubility, and Electronic Spectrum of Titanium Tetraiodide". Inorganic Chemistry. 18 (7): 1792–1796. doi:10.1021/ic50197a013.
- ^ Lowry, R. N.; Fay, R. C. (1967). Titanium(IV) Iodide. Inorganic Syntheses. Vol. 10. p. 1. doi:10.1002/9780470132418.ch1. ISBN 9780470132418.
- ^ Blumenthal, W. B.; Smith, H. (1950). "Titanium tetraiodide, Preparation and Refining". Industrial and Engineering Chemistry. 42 (2): 249. doi:10.1021/ie50482a016.
- ^ Jongen, L.; Gloger, T.; Beekhuizen, J.; Meyer, G. (2005). "Divalent Titanium: The Halides ATiX3 (A = K, Rb, Cs; X = Cl, Br, I)". Zeitschrift für anorganische und allgemeine Chemie. 631 (2–3): 582. doi:10.1002/zaac.200400464.
- ^ Shimizu, M.; Hachiya, I. (2014). "Chemoselective Reductions and Iodinations using Titanium Tetraiodide". Tetrahedron Letters. 55 (17): 2781–2788. doi:10.1016/j.tetlet.2014.03.052.


