트리메틸인산염
Trimethylphosphine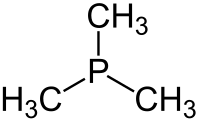 | |
 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 트리메틸인산 | |
| 체계적 IUPAC 이름 | |
| 식별자 | |
3D 모델(JSmol) | |
| 969138 | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.008.932 |
| EC 번호 |
|
| 메슈 | 트리메틸+스파인 |
펍켐 CID | |
| UN 번호 | 1993 |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C3H9P | |
| 어금질량 | 76.079 g·1998−1 |
| 외관 | 무색액 |
| 밀도 | 735mg cm−3 |
| 녹는점 | -86 °C(-123 °F; 187 K) |
| 비등점 | 38~39°C(100~102°F, 311~312K) |
| 증기압 | 49.9kPa(20°C) |
| 구조 | |
| 삼각 피라미드 | |
| 1.19 데비예 | |
| 위험 | |
| GHS 라벨 표시: | |
  | |
| 위험 | |
| H225, H315, H319, H335 | |
| P210, P261, P305+P351+P338 | |
| 플래시 포인트 | -19°C(-2°F, 254K) |
| 관련 화합물 | |
관련 화합물 | PET3 NMe3 PH3 PPh3 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
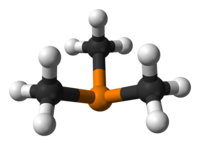
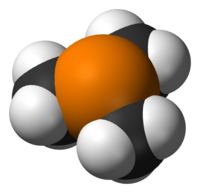
트리메틸인산(Trimethylphosine)은 P(CH3)라는 공식을 가진 유기인산 화합물로,3 일반적으로 PMe라고3 약칭한다. 이 무색의 액체는 알킬인산염의 특징인 매우 불쾌한 냄새를 가지고 있다. 그 화합물은 조정 화학에서 흔히 볼 수 있는 리간드다.
구조 및 본딩
그것은3v 대략 C 대칭이 있는 피라미드형 분자다. C-P-C 결합 각도는 약 98.6°[2]
C-P-C 결합 각도는 인이 주로 결합을 형성하기 위해 3p 궤도를 사용하며 인 원자의 sp 교배가 거의 없다는 개념과 일치한다. 후자는 인의 화학 작용의 공통점이다. 그 결과 단독쌍의 트리메틸인산염은 인산염 PH의3 경우와 마찬가지로 s-문자가 우세하다.[3]
PMe는3 염화 메틸마그네슘을 사용한 트리페닐 인산염의 처리를 통해 준비될 수 있다.[4]
- 3 CH3MgCl + P(OC6H5)3 → P(CH3)3 + 3 C6H5OMgCl
합성은 디부틸 에테르로 수행되며, 이 에테르에서 휘발성이 높은 PMe를3 증류할 수 있다.
반응

pKa 8.65로 PMe는3 강한 산과 반응하여 염 [HPMe3]X를 부여한다.[2] 이 반응은 되돌릴 수 있다. 알킬 리튬 화합물과 같은 강력한 베이스로 메틸 그룹은 PMeCHLi를22 주기 위해 디프로톤화를 겪는다.
PMe는3 산소로 인산염에 쉽게 산화된다. 메틸브로마이드와 반응하여 테트라메틸인스포늄 브로미드를 준다.[6]
조정화학
트리메틸인산(Trimethylphosphine)은 대부분의 금속과 콤플렉스를 형성하는 매우 기본적인 리간드다. 리간드로서 트리메틸인산염의 톨만콘 각도는 118°[7] 이 각도는 이 리간드가 결합되는 금속에 제공하는 강직 보호의 양을 나타내는 것이다.
Pt(Pt3)의 존재로 예시된 바와 같이, 비교적 컴팩트한 인산염으로서, 여러 개들은 하나의 전이 금속과 결합할 수 있다.4[8] 요오드화은 은으로 된 복합체, 아지(PMe3)는 가열 시 PMe를3 방출하는 공기안정형 고체다.
안전
PMe는3 독성이 있고 화혈성이다. 차아염소산나트륨이나 과산화수소로 처리하면 훨씬 안전한 인산염으로 전환된다.[9]
참조
- ^ a b "Trimethylphosphine (CHEBI:35890)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. 6 June 2006. IUPAC Names. Retrieved 25 September 2011.
- ^ a b 아네트 쉬어와 휴버트 슈미드바우어 "P-도너 리간즈"는 2006년 웨일리-VCH, 웨인하임 무기화학 백과사전에서 나왔다. doi:10.1002/0470862106.ia177
- ^ E. Fluck, 인산염의 화학, Current Chemistry Vol. 35, 64 pp, 1973.
- ^ Leutkens, Jr., M. L.; Sattelberger, A. P.; Murray, H. H.; Basil, J. D.; Fackler, Jr. J. P. (1990). "Trimethylphosphine". Inorganic Syntheses. 28: 305–310. doi:10.1002/9780470132593.ch76. ISBN 9780470132593.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Sattler, A.; Parkin, G. (2011). "Formation of a cationic alkylidene complex via formal hydride abstraction: synthesis and structural characterization of [W(PMe3)4([small eta]2-CHPMe2)H]X (X = Br, I)". Chemical Communications. 47 (48): 12828–12830. doi:10.1039/C1CC15457E. PMID 22048609.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ H. F. Klein (1978). "Trimethylphosphonium Methylide (Trimethyl Methylenephosphorane)". Inorganic Syntheses. Inorganic Syntheses. Vol. XVIII. pp. 138–140. doi:10.1002/9780470132494.ch23. ISBN 9780470132494.
- ^ G. L. Miessler와 D. A. Tarr 무기화학, 3차 Ed, Pearson/Prentice Hall 출판사, ISBN 0-13-035471-6.
- ^ T. Yoshida T. Matsuda S. Otsuka (1990). "Tetrakis(Triethylphosphine)Platinum(0)". Inorganic Syntheses. Inorganic Syntheses. Vol. 28. John Wiley & Sons. pp. 122–123. doi:10.1002/9780470132593.ch32. ISBN 9780470132593.
{{cite book}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ http://www.sigmaaldrich.com/catalog/product/aldrich/324116?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xorders-_-prodRecCold2-2