아데닐로수치네이트 리아제
Adenylosuccinate lyase| ADSL | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | ADSL, AMPS, ASE, ASL, 아데닐로수치네이트 리아제, 아데닐로수치네이트 리아제 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 608222 MGI: 103202 HomoloGene: 12 GeneCard: ADSL | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 22: 40.35 – 40.39Mb | Chr 15: 80.95 – 80.97Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 아데닐로수치네이트 리아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 4.3.2.2 | ||||||||
| CAS 번호. | 9027-81-0 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| 진 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
아데닐로수치네이트 리아제(또는 아데닐로수치나아제)는 인간에서 ADSL 유전자에 의해 인코딩되는 효소다.[6]null
아데닐로수치네이트 리아제는 푸린 뉴클레오티드 사이클의 일부로 아데닐로수치네이트를 AMP와 후마레이트(Fumarate)로 변환한다.ASL은 AMP를 만드는 푸린 생합성 경로에서 두 가지 반응을 촉진하고 ASL은 아데닐로수치네이트를 AMP와 후마레이트(Fumarate)로, SAICAR을 AICAR과 후마레이트(Fumarate)로 분해한다.null
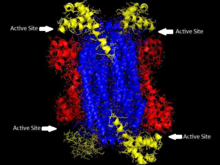
아데닐로수치틴 리아제는 효소의 β-엘리미네이션 슈퍼 패밀리의 일부로서 E1cb 반응 메커니즘을 통해 진행된다.효소는 각 모노머에 3개의 도메인과 호모테트라머당 4개의 활성 부위가 있는 호모테트라머이다.null
효소 활성을 저하시키는 아데닐로수치네이트의 포인트 돌연변이는 아데닐로수치네이트 리아제 결핍 상태를 나타내는 임상 증상을 일으킨다.null
이 단백질은 알로스테릭 조절의 모르핀 모델을 사용할 수 있다.[7]null
함수
아데닐로수치네이트 리아제(ASL)는 드노보 푸린 생합성 경로에서 두 가지 반응을 촉진하는 효소다.두 반응에서 모두 E1cb 제거 반응 메커니즘을 사용하여 기질에서 후마레이트를 분리한다.첫 번째 반응에서 ASL은 5-아미노니미다졸-(N-suchionocarboxamide) 리보타이드(SAICAR)를 5-아미노니미다졸-4-카르박스아미드 리보타이드(AICAR)로 변환하고 후마레이트를 한다.AICAR은 아데닐로수치네이트(suci닐아데노신 모노인산염 또는 SAMP라고도 함)가 되기 전에 세 가지 반응을 더 진행하며, ASL은 아데노신 모노인산염(AMP)과 후마산염으로 갈라진다.[8]ASL은 세포 복제에 필요한 청진 생성에 관여하는 것뿐만 아니라 세포 내 AMP와 후마레이트 수치를 조절하여 대사 과정을 조절하는데 도움을 주기 때문에 세포에 중요하다.[9]null

구조
수부닛
아데닐로수치네이트 리아제는 β-엘리미네이션 슈퍼 패밀리에 속하며, 그 구조는 호모테트라머이다.아데닐로수치네이트 리아제의 모노머는 세 개의 도메인을 가지고 있다.테르모토가 마리티마에서 도메인 1은 잔류물 1-93에 7 α-헬리케스를 포함하고 있으며, 그 중에는 보존성이 뛰어나고 이전에 활성 부지의 촉매산으로 생각되었던 히스68도 포함되어 있다.[5]보다 최근의 연구는 이전에 촉매 기반이라고 생각되었던 영역 2의 His171이 적어도 대장균에서 촉매 산으로 작용하고 있을 수 있다는 것을 입증했다.[9]도메인 2는 잔류물 94-341로 구성되며, 5α-헬리스크와 모노머의 유일한 β-시트(β-시트)를 함유하고 있다.도메인 3은 7 α-헬리크로 이루어져 있다.테트라머의 핵심은 네 개의 도메인 2 복사본으로 구성되어 있으며, 테트라머의 각 끝에는 각각 두 개의 도메인 1과 세 개의 복사본이 있어 테트라머 D2 다이헤드랄 대칭을 이룬다.테트라머에는 각각 3개의 도메인이 만나는 4개의 활성 사이트가 있다.[5]null
인체에서 아데닐로수치산 리아제와 바실러스 아틸로수치산 리아제는 기질 아날로그 아데노신 인산염 2'(3'), 5' 디프인산염(APBADP)에 의해 경쟁적으로 억제될 수 있다.APBADP는 아데닐로수치네이트 리아제에 의해 촉매되는 두 반응 모두에 대한 경쟁적 억제제로서, APBADP에 의한 운동학적 연구는 두 반응에 대한 기판이 동일한 활성 부지를 사용한다는 것을 보여준다.[10]아데닐로수치산을 아데노신 단인산염(AMP)과 후마산염으로 분할하는 ASL-카타린 반응에서 AMP는 반응이 완료된 후 두 제품 모두 활성 부지에 맞도록 하기 위해 후마산염이 방출되기 전에 약간 회전해야 한다.[11]null
돌연변이
아데닐로수치네이트 리아제 돌연변이는 돌연변이가 활성 부지에 있든 없든 간에 활동을 상당히 줄일 수 있다.질병 유발 ASL 돌연변이 R396C와 R396H가 활성현장의 입구에 있고 야생형 ASL보다 V가max 낮지만, 활성현장에서 떨어져 있는 돌연변이 K246E와 L311V도 V 감소의max 원인이 된다.ASL 돌연변이 R194C는 활성현장에서 떨어져 있으며, 야생형 ASL과 유사한 V를max 유지하지만 시험관내 5개 돌연변이 중 가장 순응성이 낮고 여전히 질병을 유발하는 것으로 나타났다.[12]null
메커니즘
이전에는 아데닐로수치네이트 리아제의 작용 메커니즘이 β-탄소의 수소가 촉매 베이스에 의해 추상화됨과 동시에 이탈 질소가 E2 제거를 위해 촉매산에 의해 양성되는 결합 촉매라고 생각되었다.[5]보다 최근의 데이터는 이 아이디어와 충돌하여 메커니즘이 사실상 결합되어 있는 것이 아니라 추상화가 먼저 일어나고 공명이 안정되는 중간 카르바니온 종이 있다는 것을 확인했다.두 ASL의 경우 모두 탄소 β를 이탈 질소에 대한 감응반응이 먼저 일어나고 카르바니온의 형성과 공진 안정화가 마지막으로 C-N 결합을 파괴하는 이탈 질소의 양성화가 발생한다.[9]탈색, 카르바니온 형성 및 갈라짐을 유발하는 양성자의 속도 제한 단계의 실험적인 확인은 이것이 E1cb 메커니즘임을 의미한다.가장 최근의 데이터를 보면 촉매산은 이전에 촉매기지로 생각되었던 His171이며, 다소 유별나게 위치 295에 있는 세린이 촉매기지로 작용한다는 것을 알 수 있다.아데닐로수치네이트를 AMP와 후마레이트(fumarate)로 분할한 후 활성 부위가 AMP보다 먼저 분리된다는 것을 의미한다.[13]null

질병에서의 역할
돌연변이 아데닐로수치네이트 리아제(ASL)는 아데닐로수치네이트 리아제 결핍증이라고 하는 환자에게 임상 질환을 일으킨다.이 질환은 드물며, 다양한 정도의 정신지체, 자폐증, 근육낭비, 간질 등이 나타난다.[14][15]정확한 질병의 원인은 알려지지 않았지만, 가능성은 세포 복제를 위한 충분한 퓨린 뉴클레오티드 합성, 퓨린 뉴클레오티드 사이클의 오작동, 기질들이 독성 수준으로 축적되는 것을 포함한다.여러 질병과 연관된 포인트 돌연변이가 확인되었고, 포인트 돌연변이에 대해 이질성인 사람들은 건강하지만, 동질성인 사람들은 임상 질환에 걸린다.[16]더 많은 돌연변이가 발견됨에 따라 질병을 유발하는 유전자형은 계속 증가하고 있으며, 현재 30개의 서로 다른 돌연변이가 확인되었으며, 한 개의 삭제는 아데닐로수치네이트 리아제 결핍을 유발한다.[17]null
효소결핍으로 인해 ASL(아데닐로수치네이트, SAICAR) 기판이 쌓이면 탈인산화돼 숙시비닐아데노신(S-Ado)과 숙시라미노미다졸 카르복시미드 리보사이드(SAICA 리보사이드)로 변한다.[18]일반적으로 이러한 화합물은 뇌척수액이나 소변에는 존재하지 않는데, 이는 ASL이 기질 분자의 대다수에 작용하여 그것들이 축적되고 인산염화되기 때문이다.[15]과거에는 아데닐로수치네이트 리아제 결핍에 대한 좋은 검사가 없어 희귀질환을 진단하기 어려웠으나 최근에는 소변에서 SAICA와 S-Ado를 검출하는 검사가 개발됐다.이 테스트는 비용이 저렴하며 연구자들의 작은 표본에 잘못된 긍정이나 잘못된 부정은 없었다.[19]null
중증 임상 증상 환자에서 더 높은 수준에서 발견되기 때문에 SAICA 리보사이드 성분이 더 독성이 강한 화합물일 수 있다고 생각되며, 일부 연구자들은 S-Ado가 보호막일 수도 있다고 생각한다.질병의 심각성을 결정하는 것에 대해 더 많은 연구가 필요하지만, 실험실 환경에서 인간 ASL의 불안정성은 이 연구의 장애물이 되었다.[17]null
치료적 응용
말라리아 퇴치에 대한 내성이 증가함에 따라 연구원들은 말라리아, 특히 더 치명적인 P. 팔시파룸을 유발하는 플라스모듐 기생충을 목표로 새로운 전략을 모색하고 있다.일부 연구자들은 디 노보 푸린 생합성 경로의 중단이 숙주에게는 독성이지만 플라스모듐 ASL은 인간 ASL과의 염기서열 호몰로지 수준이 낮기 때문에 인간 숙주에게 해를 끼치지 않을 만큼 특정하게 만들 수 있기 때문에 ASL을 잠재적 약물 대상으로 조사할 것을 제안했다.[20]null
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000239900 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG00002407 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d e Toth EA, Yeates TO (February 2000). "The structure of adenylosuccinate lyase, an enzyme with dual activity in the de novo purine biosynthetic pathway". Structure. 8 (2): 163–74. doi:10.1016/S0969-2126(00)00092-7. PMID 10673438.
- ^ "Entrez Gene: Adenylosuccinate lyase". Retrieved 2012-03-01.
- ^ Selwood T, Jaffe EK (Mar 2012). "Dynamic dissociating homo-oligomers and the control of protein function". Archives of Biochemistry and Biophysics. 519 (2): 131–43. doi:10.1016/j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ^ Spiegel EK, Colman RF, Patterson D (2006). "Adenylosuccinate lyase deficiency". Molecular Genetics and Metabolism. 89 (1–2): 19–31. doi:10.1016/j.ymgme.2006.04.018. PMID 16839792.
- ^ a b c d Tsai M, Koo J, Yip P, Colman RF, Segall ML, Howell PL (Jul 2007). "Substrate and product complexes of Escherichia coli adenylosuccinate lyase provide new insights into the enzymatic mechanism". Journal of Molecular Biology. 370 (3): 541–54. doi:10.1016/j.jmb.2007.04.052. PMC 4113493. PMID 17531264.
- ^ Sivendran S, Colman RF (Jul 2008). "Effect of a new non-cleavable substrate analog on wild-type and serine mutants in the signature sequence of adenylosuccinate lyase of Bacillus subtilis and Homo sapiens". Protein Science. 17 (7): 1162–74. doi:10.1110/ps.034777.108. PMC 2442012. PMID 18469177.
- ^ Kozlov G, Nguyen L, Pearsall J, Gehring K (Sep 2009). "The structure of phosphate-bound Escherichia coli adenylosuccinate lyase identifies His171 as a catalytic acid". Acta Crystallographica Section F. 65 (Pt 9): 857–61. doi:10.1107/S1744309109029674. PMC 2795585. PMID 19724117.
- ^ Ariyananda Lde Z, Lee P, Antonopoulos C, Colman RF (Jun 2009). "Biochemical and biophysical analysis of five disease-associated human adenylosuccinate lyase mutants". Biochemistry. 48 (23): 5291–302. doi:10.1021/bi802321m. PMC 2745324. PMID 19405474.
- ^ Bulusu V, Srinivasan B, Bopanna MP, Balaram H (Apr 2009). "Elucidation of the substrate specificity, kinetic and catalytic mechanism of adenylosuccinate lyase from Plasmodium falciparum". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1794 (4): 642–54. doi:10.1016/j.bbapap.2008.11.021. PMID 19111634.
- ^ Maaswinkel-Mooij PD, Laan LA, Onkenhout W, Brouwer OF, Jaeken J, Poorthuis BJ (Aug 1997). "Adenylosuccinase deficiency presenting with epilepsy in early infancy". Journal of Inherited Metabolic Disease. 20 (4): 606–7. doi:10.1023/A:1005323512982. PMID 9266401.
- ^ a b Lee P, Colman RF (Feb 2007). "Expression, purification, and characterization of stable, recombinant human adenylosuccinate lyase". Protein Expression and Purification. 51 (2): 227–34. doi:10.1016/j.pep.2006.07.023. PMID 16973378.
- ^ Stone RL, Aimi J, Barshop BA, Jaeken J, Van den Berghe G, Zalkin H, Dixon JE (Apr 1992). "A mutation in adenylosuccinate lyase associated with mental retardation and autistic features". Nature Genetics. 1 (1): 59–63. doi:10.1038/ng0492-59. PMID 1302001.
- ^ a b Palenchar JB, Crocco JM, Colman RF (Aug 2003). "The characterization of mutant Bacillus subtilis adenylosuccinate lyases corresponding to severe human adenylosuccinate lyase deficiencies". Protein Science. 12 (8): 1694–705. doi:10.1110/ps.0303903. PMC 2323956. PMID 12876319.
- ^ Jaeken J, Van den Berghe G (Nov 1984). "An infantile autistic syndrome characterised by the presence of succinylpurines in body fluids". Lancet. 2 (8411): 1058–61. doi:10.1016/s0140-6736(84)91505-8. PMID 6150139.
- ^ Maddocks J, Reed T (Jan 1989). "Urine test for adenylosuccinase deficiency in autistic children". Lancet. 1 (8630): 158–9. doi:10.1016/S0140-6736(89)91172-0. PMID 2563072.
- ^ Marshall VM, Coppel RL (Sep 1997). "Characterisation of the gene encoding adenylosuccinate lyase of Plasmodium falciparum". Molecular and Biochemical Parasitology. 88 (1–2): 237–41. doi:10.1016/S0166-6851(97)00054-6. PMID 9274883.
추가 읽기
- Marie S, Cuppens H, Heuterspreute M, Jaspers M, Tola EZ, Gu XX, Legius E, Vincent MF, Jaeken J, Cassiman JJ, Van den Berghe G (1999). "Mutation analysis in adenylosuccinate lyase deficiency: eight novel mutations in the re-evaluated full ADSL coding sequence". Human Mutation. 13 (3): 197–202. doi:10.1002/(SICI)1098-1004(1999)13:3<197::AID-HUMU3>3.0.CO;2-D. PMID 10090474.
- Kmoch S, Hartmannová H, Stibůrková B, Krijt J, Zikánová M, Sebesta I (Jun 2000). "Human adenylosuccinate lyase (ADSL), cloning and characterization of full-length cDNA and its isoform, gene structure and molecular basis for ADSL deficiency in six patients". Human Molecular Genetics. 9 (10): 1501–13. doi:10.1093/hmg/9.10.1501. PMID 10888601.
- Race V, Marie S, Vincent MF, Van den Berghe G (Sep 2000). "Clinical, biochemical and molecular genetic correlations in adenylosuccinate lyase deficiency". Human Molecular Genetics. 9 (14): 2159–65. doi:10.1093/hmg/9.14.2159. PMID 10958654.
- Tabucchi A, Carlucci F, Rosi F, Guerranti R, Marinello E (Jun 2001). "Determination, activity and biological role of adenylosuccinate lyase in blood cells". Biomedicine & Pharmacotherapy. 55 (5): 277–83. doi:10.1016/s0753-3322(01)00061-0. PMID 11428554.
- Marie S, Race V, Nassogne MC, Vincent MF, Van den Berghe G (Jul 2002). "Mutation of a nuclear respiratory factor 2 binding site in the 5' untranslated region of the ADSL gene in three patients with adenylosuccinate lyase deficiency". American Journal of Human Genetics. 71 (1): 14–21. doi:10.1086/341036. PMC 384970. PMID 12016589.
- Castro M, Pérez-Cerdá C, Merinero B, García MJ, Bernar J, Gil Nagel A, Torres J, Bermúdez M, Garavito P, Marie S, Vincent F, Van den Berghe G, Ugarte M (Aug 2002). "Screening for adenylosuccinate lyase deficiency: clinical, biochemical and molecular findings in four patients". Neuropediatrics. 33 (4): 186–9. doi:10.1055/s-2002-34493. PMID 12368987.
- Palenchar JB, Colman RF (Feb 2003). "Characterization of a mutant Bacillus subtilis adenylosuccinate lyase equivalent to a mutant enzyme found in human adenylosuccinate lyase deficiency: asparagine 276 plays an important structural role". Biochemistry. 42 (7): 1831–41. doi:10.1021/bi020640+. PMID 12590570.
- Edery P, Chabrier S, Ceballos-Picot I, Marie S, Vincent MF, Tardieu M (Jul 2003). "Intrafamilial variability in the phenotypic expression of adenylosuccinate lyase deficiency: a report on three patients". American Journal of Medical Genetics Part A. 120A (2): 185–90. doi:10.1002/ajmg.a.20176. PMID 12833398.
- Stone RL, Aimi J, Barshop BA, Jaeken J, Van den Berghe G, Zalkin H, Dixon JE (Apr 1992). "A mutation in adenylosuccinate lyase associated with mental retardation and autistic features". Nature Genetics. 1 (1): 59–63. doi:10.1038/ng0492-59. PMID 1302001.
- Sivendran S, Patterson D, Spiegel E, McGown I, Cowley D, Colman RF (Dec 2004). "Two novel mutant human adenylosuccinate lyases (ASLs) associated with autism and characterization of the equivalent mutant Bacillus subtilis ASL". The Journal of Biological Chemistry. 279 (51): 53789–97. doi:10.1074/jbc.M409974200. PMID 15471876.
외부 링크
- 미국 국립 의학 도서관에서 아데닐로수치네이트+리야제(Adenylosuchinet+liase)
- UCSC 게놈 브라우저의 인간 ADSL 게놈 위치 및 ADSL 유전자 세부 정보 페이지.
- UCSC 게놈 브라우저의 인간 ASL 게놈 위치 및 ASL 유전자 세부 정보 페이지.







