자가면역
Autoimmunity| 자가면역 | |
|---|---|
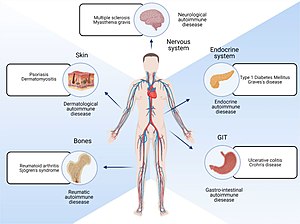 | |
| 자가면역질환에 의한 신체부위 | |
| 전문 | 면역학 |
자가면역이란 건강한 세포, 조직 및 다른 신체 정상 구성 [1][2]요소에 대한 유기체의 면역 반응 시스템이다.이러한 유형의 면역 반응에서 발생하는 모든 질병을 "자체 면역 질환"이라고 합니다.대표적인 예로는 셀리악병, 감염 후 IBS, 당뇨병 타입 1, Henloch Scholein Pupura(HSP) 육종증, 전신성 홍반성 루푸스(SLE), 셰그렌 증후군, 다발성 혈관염이 있는 호산성 육아종증, 하시모토 갑상선염, 묘비혈소판증, 혈소판성 질환 등이 있다.이것은(RA), 강직성 척추염, 다발성 근염, 피부근염, 다발성 경화증(MS)이다. 자가면역질환은 [3]스테로이드로 치료되는 경우가 매우 많다.
자가면역성은 자가단백질과 반응하는 항체 또는 T세포의 존재를 의미하며 심지어 정상적인 건강 상태에서도 모든 개인에게 존재한다.자가반응이 조직손상으로 [4]이어질 수 있다면 자가면역질환을 일으킨다.
역사
19세기 후반에는 면역체계가 신체 자신의 조직에 반응할 수 없다고 믿었다.20세기 초에 폴 에를리치는 공포 독성의 개념을 제안했다.Ehrlich는 나중에 자기 면역 조직 공격의 가능성을 인식하기 위해 그의 이론을 조정했지만, 특정한 선천적인 보호 메커니즘이 자기 면역 반응이 [citation needed]병적으로 되는 것을 막을 것이라고 믿었다.
1904년, 이 이론은 적혈구와 반응하는 발작성 냉혈색소뇨 환자의 혈청에서 물질이 발견됨으로써 도전을 받았다.그 후 수십 년 동안, 많은 조건이 자가 면역 반응과 연관될 수 있었다.그러나 에를리히의 가설의 권위적인 지위는 이러한 발견의 이해를 방해했다.면역학은 임상 [5]분야라기보다는 생화학 분야가 되었다.1950년대에 이르러서는 자가항체와 자가면역질환에 대한 현대적 이해가 [citation needed]확산되기 시작했다.
최근에는 자가면역반응이 척추동물 면역체계의 필수적인 부분이라는 것이 받아들여지고 있다.[6]자가면역성은 동종면역과 혼동해서는 안 된다.
낮은 수준의 자가면역 기능
높은 수준의 자가면역이 건강에 좋지 않은 반면, 낮은 수준의 자가면역은 실제로 이로울 수 있습니다.자가면역학의 유익한 요소의 경험을 더 나아가서, 자가면역이 항상 생존을 위한 포유류 시스템의 자기 방어 메커니즘이라는 것을 증명하려는 의도로 가설을 세울 수 있다.이 시스템은 무작위로 자신과 비자아를 구별할 수 있는 능력을 상실하지 않습니다; 세포에 대한 공격은 혈액 화학을 항상 상태로 [citation needed]유지하기 위해 필요한 대사 과정을 순환시키는 결과일 수 있습니다.
둘째, 자가면역은 외래 항원의 가용성이 반응을 제한할 때(즉, 병원균이 거의 없을 때) 감염 초기 단계에서 신속한 면역 반응을 가능하게 하는 역할을 할 수 있다.연구에서 스테파노바 외 연구진.(2002)는 CD4+T 세포-MHC 상호작용을 일시적으로 방지하기 위해 단일 유형의 MHC Class II 분자b(H-2)를 발현하는 생쥐에 항MHC Class II 항체를 주입하였다.이러한 마우스로부터 항MHC 투여 후 36시간 후에 회수된 순진한 CD4+ T 세포(비자기 항원을 접하지 못한 세포)는 ZAP70 인산화, 증식, 인터루킨 2 생성에 의해 결정된 항원 비둘기 시토크롬 c 펩타이드에 대한 반응성이 저하되었다.스테파노바 등(2002)는 자가 MHC 인식(너무 강하면 자가면역질환에 기여할 수 있음)이 외래항원이 [7]없을 때 CD4+T세포의 반응을 유지함을 입증했다.
면역학적 내성
뉴욕에 있는 노엘 로즈, 에른스트 비텝스키, 그리고 런던 유니버시티 칼리지의 로이트와 도니아크의 선구적인 연구는 적어도 항체를 생산하는 B세포(B림프구)의 관점에서 류마티스 관절염과 갑상선독증과 같은 질병이 면역 내성의 상실과 관련이 있다는 분명한 증거를 제공했는데, 이는 인디브의 능력이다."자기"를 무시하고 "비자기"에 반응하는 이중성.이 파괴는 면역체계가 자기 항원에 대해 효과적이고 특정한 면역 반응을 일으키도록 이끈다.면역학적 관용의 정확한 기원은 아직 밝혀지지 않았지만, 20세기 중반 이후 그 [citation needed]기원을 설명하기 위해 몇 가지 이론이 제시되어 왔다.
면역학자들 사이에서 세 가지 가설이 널리 주목을 받았다.
- 개인의 면역체계가 발달하는 동안 자기반응성 림프세포가 파괴되는 Burnet에 의해 제안된 클론 결실 이론.프랭크 M. 버넷과 피터 B.의 작품입니다.메다와르는 후천적인 면역학적 내성을 발견한 공로로 1960년 노벨 생리의학상을 수상했다.
- 자기반응성 T세포 또는 B세포가 정상적인 개인에서 비활성화되어 면역반응을 [8]증폭시킬 수 없는 클로날 아너지 이론.
- Jerne에 의해 제안된 바보형 네트워크 이론. 여기서 자기반응성 항체를 중화시킬 수 있는 항체의 네트워크는 [9]체내에 자연적으로 존재한다.
또한, 두 가지 다른 이론이 집중 조사 중입니다.
- 흉선에서 표현되지 않은 자가반응성 T세포가 성숙해 주변으로 이동한다는 복제 무지 이론. 접근 불가능한 조직이기 때문에 적절한 항원을 만나지 않는다.따라서 결실을 면한 자가반응성 B세포는 항원이나 특정 도우미 T세포를 [10]찾을 수 없다.
- 억제체 집단 또는 조절 T세포 이론. 조절 T림프구(일반적으로 CD4FoxP3++ 세포, 그 중에서도 CD4FoxP3 세포)는 면역체계의 자기공격적 면역반응을 예방, 하향조절 또는 제한하는 기능을 한다.
내성은 또한 위에서 언급한 체크 메커니즘이 중앙 림프 기관(흉선 및 골수) 또는 자기반응성 B세포가 파괴될 수 있는 말초 림프 기관(림프절, 비장 등)에서 작동하는지 여부에 대해 "중앙" 및 "주변" 내성으로 구분할 수 있다.이러한 이론들이 상호 배타적이지 않다는 것을 강조해야 하며, 이러한 모든 메커니즘이 척추동물 면역학적 내성에 적극적으로 기여할 수 있다는 증거가 증가하고 있다.
인간의 자발적 자가면역성에서 볼 수 있는 내성 상실의 난해한 특징은 B림프구에 의해 생성되는 자가항체 반응에 거의 전적으로 제한된다는 것이다.T세포에 의한 내성 상실은 증명하기 매우 어려우며, 비정상적인 T세포 반응에 대한 증거가 있는 경우에는 보통 자가항체에 의해 인식되는 항원에 대한 것이 아니다.따라서 류마티스 관절염에는 IgG Fc에 대한 자가항체가 존재하지만 이에 상응하는 T세포 반응은 없는 것으로 보인다.전신성 낭창에는 T세포 반응을 일으킬 수 없는 DNA에 대한 자가항체가 있으며, T세포 반응에 대한 제한된 증거는 핵단백질 항원을 포함한다.셀리악병에는 조직 트랜스글루타미나아제에 대한 자가항체가 있지만 T세포 반응은 외래 단백질인 글리아딘에 대한 것이다.이러한 불균형은 인간의 자가면역질환이 외래 항원에 대한 정상적인 T세포 반응을 다양한 [11]이상적 방법으로 이용하는 B세포 내성의 상실에 기초한 대부분의 경우(I형 당뇨병을 포함한 가능한 예외)라는 생각을 가져왔다.
면역결핍과 자가면역성
자가면역의 임상적 및 실험실적 특성을 나타내는 많은 면역결핍 증후군이 있다.이러한 환자의 감염을 제거하는 면역체계의 감소는 지속적인 면역체계 활성화를 [12]통해 자가면역을 일으키는 원인이 될 수 있다.
예를 들어 염증성 장질환, 자가면역혈소판감소증 및 자가면역 갑상선질환과 [citation needed]같은 여러 자가면역질환이 관찰되는 일반적인 가변면역결핍증(CVID)이 있다.
상염색체 열성 1차 면역결핍증인 가족성 혈구세포증이 또 다른 예이다.범세포감소증, 발진, 부은 림프절, 간과 비장의 종대가 이러한 개인에게서 흔히 나타난다.천공의 부족으로 인한 다발성 삼촌형 바이러스 감염이 원인인 것으로 생각됩니다.
만성 및/또는 재발 감염 외에도 관절염, 자가면역용혈성 빈혈, 강피증 및 제1형 당뇨병을 포함한 많은 자가면역질환이 X-연쇄성 무감마글로불린혈증(XLA)에서도 볼 수 있다.만성 육아종 질환(CGD)에서도 세균과 진균의 재발 감염과 장과 폐의 만성 염증이 나타난다.CGD는 호중구에 의한 니코틴아미드 아데닌 디뉴클레오티드 인산(NADPH) 산화효소의 생산 감소에 의해 발생한다.저형 RAG 돌연변이는 다발성 혈관염과 NK/T 세포 림프종을 가진 육아종증 환자에게서 흔히 볼 수 있는 자가면역질환인 중간선 육아종 질환 환자에게서 나타난다.WIS(Wiskott-Aldrich Syndrome) 환자도 습진, 자가면역증상, 재발성 세균감염 및 림프종을 앓고 있다.자가면역 다분비증-칸디다증-외피질디스트로피(APECED)에서도 자가면역성과 감염이 공존한다. 장기 특이적 자가면역증상(예: 부신피질부전증)과 만성 점액피부칸디다증이다.마지막으로, IgA 결핍은 때때로 자가면역 및 아토피 [citation needed]현상의 발생과 관련이 있다.
유전적 요인
어떤 사람들은 유전적으로 자가면역질환에 걸리기 쉽다.이 민감성은 여러 유전자와 다른 위험인자와 관련이 있다.유전적으로 소질이 있는 사람들이 항상 자가면역질환에 걸리는 것은 아니다.많은 자가면역질환에서 세 가지 주요 유전자가 의심된다.이들 유전자는 다음과 관련이 있다.[citation needed]
항원의 인식에 관여하는 첫 번째 두 가지는 본질적으로 가변적이고 재조합되기 쉽다.이러한 변화는 면역체계가 매우 다양한 침입자들에 반응할 수 있게 하지만, 또한 자가반응이 가능한 림프구를 발생시킬 수도 있다.
- HLA DR2는 전신성 홍반성 루푸스, 기면증[13] 및 다발성 경화증과 양의 상관관계가 있으며 DM Type 1과 음의 상관관계가 있다.
- HLA DR3는 셰그렌 증후군, 근육력증, SLE 및 DM Type 1과 강한 상관관계가 있다.
- HLA DR4는 류마티스 관절염, 제1형 당뇨병, 펨피구스의 발생과 관련이 있다.
MHC 클래스 I 분자와는 상관관계가 적다.HLA B27과 강직성 척추염 및 반응성 관절염과 같은 척추 관절염 사이의 연관성입니다.Class II MHC 프로모터 내의 다형성과 자가면역질환 사이에 상관관계가 존재할 수 있다.
MHC 복합체 외부의 유전자의 기여는 동물 질병 모델(NOD 마우스의 당뇨병에 대한 린다 위커의 광범위한 유전자 연구)과 환자(브라이언 코진의 SLE 감수성 관련 분석)에서 연구 대상으로 남아 있다.
최근 PTPN22는 제1형 당뇨병, 류마티스 관절염, 전신성 홍반성 루푸스, 하시모토 갑상선염, 그레이브스병, 애디슨병, 백반증, 전신경화성 소아특발성관절염, 건선관절염 [14][clarification needed]등 다발성 자가면역질환과 관련이 있다.
섹스.
| 여성/남성 발병률 자가면역질환의 | |
|---|---|
| 하시모토 갑상선염 | 10:1[15] |
| 그레이브스병 | 7:1[15] |
| 다발성 경화증(MS) | 2:1[15] |
| 미스테니아 중력증 | 2:1[15] |
| 전신성 홍반성 루푸스(SLE) | 9:1[15] |
| 류마티스 관절염 | 5:2[15] |
| 원발성 경화성 담관염 | 1:2 |
사람의 성별 또한 자가면역 발달에 어떤 역할을 할 수 있다는 증거가 있다. 즉, 대부분의 자가면역 질환은 성별과 관련이 있다.남성들이 여성들과 같거나 더 많이 발병할 가능성이 있는 몇 가지 자가면역질환은 강직성 척추염, 제1형 당뇨병, 다발성 혈관염이 있는 육아종증, 크론병, 일차경화성 담관염과 건선을 포함한다.
자가면역에서의 성역할에 대한 이유는 다양하다.여성들은 일반적으로 면역체계가 유발될 때 남성들보다 더 큰 염증 반응을 보이는 것으로 보이며, 이는 자가면역 위험을 증가시킨다.성 스테로이드제의 관여는 많은 자가면역질환이 예를 들어 임신 중, 생리주기 중 또는 경구피임 사용 시 호르몬 변화에 따라 변동하는 경향이 있음을 나타낸다.임신 이력은 또한 자가면역질환에 대한 지속적인 위험 증가를 남기는 것으로 보인다.임신 중 산모와 그 자녀들 사이에 약간의 직접적인 세포 교환이 자가면역을 [16]유도할 수 있다고 제안되었다.이것은 성별의 균형을 여성의 방향으로 기울게 할 것이다.
또 다른 이론은 여성의 높은 자가면역 경향은 불균형한 X염색체 [17]불활성화 때문이라고 시사한다.프린스턴 대학의 제프 스튜어트가 제안한 X 불활성화 스큐 이론은 최근 강피증과 자가면역 [18]갑상선염에서 실험적으로 확인되었다.다른 복잡한 X-연계 유전 감수성 메커니즘이 제안되어 조사 중이다.
환경 요인
전염병 및 기생충
전염병과 자가면역질환 사이에는 흥미로운 역관계가 존재한다.다발성 감염증이 유행하는 지역에서는 자가면역질환이 거의 나타나지 않는다.그 반대가 어느 정도 사실인 것 같다.위생 가설은 이러한 상관관계를 병원균의 면역조절 전략에 기인한다.그러한 관찰이 거짓되고 비효율적이라고 다양하게 불리고 있지만, 일부 연구에 따르면 기생충 감염은 자가면역질환의 [19][20][21]활동 감소와 관련이 있다.
추정 메커니즘은 기생충이 자신을 보호하기 위해 숙주의 면역 반응을 약화시키는 것이다.이것은 자가면역질환이 있는 숙주에게도 우연한 혜택을 줄 수 있다.기생충 면역 조절의 세부 사항은 아직 알려지지 않았지만 항염증제 분비나 숙주 면역 신호 전달에 대한 간섭을 포함할 수 있다.
역설적인 관찰은 특정 미생물과 자가면역질환의 강한 연관성이었다.예를 들어 Klebsiella pneumoniae와 Coxsackievirus B는 각각 강직성 척추염과 당뇨병 타입 1과 강한 상관관계가 있다.이는 B림프구의 폴리클론 활성화가 가능한 슈퍼항원을 생성하는 감염 유기체의 경향과 다양한 특이성의 항체를 대량 생산하며, 그 중 일부는 자가 반응할 수 있다(아래 참조).
화학물질 및 의약품
특정 화학 약품과 약물은 자가면역 조건 또는 자가면역 질환을 시뮬레이션하는 조건의 발생과도 연관될 수 있습니다.그 중 가장 눈에 띄는 것은 약물에 의한 홍반성 낭창이다.보통, 문제의 약을 끊으면 환자의 증상이 낫습니다.
흡연은 현재 류마티스 관절염의 발병률과 중증도 모두에 대한 주요 위험인자로 확립되어 있다.흡연의 영향이 시트룰화 펩타이드에 대한 항체의 존재와 상관관계가 있기 때문에 이는 단백질의 비정상적인 시트룰화와 관련이 있을 수 있다.
자가면역의 병인
몇 가지 메커니즘은 유전적 성향과 환경변조를 배경으로 자가면역질환의 병인에 작용하는 것으로 생각된다.이러한 각 메커니즘에 대해 자세히 설명하는 것은 이 문서의 범위를 벗어나는 것이지만, 중요한 메커니즘의 일부에 대해서는 다음과 같이 요약되어 있습니다.
- T세포 바이패스 – 정상적인 면역 체계는 T세포가 혈장 B세포로 분화 과정을 거쳐 항체를 대량으로 생산하기 전에 T세포에 의한 B세포의 활성화를 필요로 한다.T세포의 이러한 요구사항은 비특이적인 방법으로 T세포 수용체의 β 서브유닛에 직접 결합함으로써 B세포 또는 심지어 T세포의 폴리클론 활성화를 시작할 수 있는 슈퍼항원을 생산하는 유기체에 의한 감염과 같은 드문 경우에 우회될 수 있다.
- T세포 – B세포 불일치 – 비록 우리가 B세포와 T세포가 B세포를 위한 분자 표면의 형태와 T세포를 위한 단백질의 전처리된 펩타이드 조각 등 매우 다른 것들을 인식하는 것을 알더라도, 정상적인 면역 반응은 동일한 항원에 대한 B세포와 T세포의 반응을 포함하는 것으로 가정된다.하지만, 우리가 아는 한, 이것을 필요로 하는 것은 아무것도 없습니다.필요한 것은 항원 X를 인식하는 B세포가 단백질 Y(γ=X)를 엔도사이토시스 처리하여 T세포에 제시하는 것이다.Roosnek와 Lanzavecchia는 IgGFc를 인식하는 B세포가 면역 복합체의 일부로서 B세포에 의해 IgG와 공내구화된 항원에 반응하는 T세포로부터 도움을 받을 수 있다는 것을 보여주었다.결실성 질환에서는 조직 트랜스글루타민을 인식하는 B세포가 글리아딘을 인식하는 T세포에 의해 도움을 받는 것으로 보인다.
- 이상 B 세포 수용체 매개 피드백 – 인간 자가 면역 질환의 특징은 면역 반응에서 신호 역할을 알고 있는 몇몇 항원(DNA, C1q, IgGFc, Ro, Con)으로 크게 제한된다는 것이다.수용체, 땅콩응집체 수용체(PNAR).이러한 사실은 특정 항원에 대한 항체의 결합이 막 결합 배위자를 통해 모세포 B로 이상 신호를 피드백할 때 자발적 자가면역이 발생할 수 있다는 생각을 낳았다.이러한 배위자는 B 세포 수용체(항원용), IgG Fc 수용체, C3d 보체와 결합하는 CD21, Toll-like 수용체 9 및 7(DNA 및 핵단백질 결합 가능), PNAR을 포함한다.B세포의 보다 간접적인 이상 활성화는 아세틸콜린 수용체(흉선근세포)에 대한 자가항체 및 호르몬 및 호르몬 결합 단백질과 함께 예상될 수 있다.T-세포-B-세포 불일치의 개념과 함께 이 아이디어는 자기영구적인 B세포의 [22]가설을 형성한다.자발적 자기면역에서의 자기반응성 B세포는 T세포 헬프 경로와 B세포 수용체를 통한 피드백 신호 양쪽의 전복에 의해 생존하는 것으로 간주되며, 따라서 반드시 T세포 자기관용의 손실을 필요로 하지 않고 B세포 자기관용을 담당하는 음성신호를 극복한다.
- 분자 모방 – 외인성 항원은 특정 숙주 항원과 구조적 유사성을 공유할 수 있습니다. 따라서, 이 항원에 대해 생성된 항체는 이론적으로 숙주 항원과 결합하고 면역 반응을 증폭시킬 수 있습니다.분자모방의 개념은 A그룹 베타용혈성 연쇄상구균 감염에 이은 류마티스 열과 관련하여 생겨났다.류머티즘 열은 반세기 동안 분자 모방으로 인해 발생했지만 공식적으로 항원이 확인되지 않았다.게다가 질병(심장, 관절, 피부, 기저신경절)의 복잡한 조직 분포는 심장 특이 항원에 반대한다.이 질환이 면역 복합체, 보체 성분 및 내피 사이의 비정상적인 상호작용에 의한 것일 수 있다.
- 백치형 교차 반응 – 백치형은 면역글로불린 분자의 항원 결합 부분(Fab)에서 발견되는 항원 에피토프이다.Plotz와 Oldstone은 항바이러스 항체의 백치형과 문제의 바이러스에 대한 숙주 세포 수용체 사이의 교차 반응의 결과로 자가 면역성이 발생할 수 있다는 증거를 제시했다.이 경우 숙주세포 수용체는 바이러스의 내부상으로서 상정되며, 항아이디오형 항체는 숙주세포와 반응할 수 있다.
- 사이토카인 규제 장애 – 사이토카인은 최근 기능이 촉진되는 세포의 모집단에 따라 두 그룹으로 분류되었습니다.도우미 T셀 타입 1 또는 타입 2IL-4, IL-10 및 TGF-β를 포함한 사이토카인의 두 번째 범주는 염증성 면역 반응의 과장을 방지하는 역할을 하는 것으로 보인다.
- 수상 세포 아포토시스 – 수상 세포라고 불리는 면역 시스템 세포는 활성 림프구에 항원을 제공합니다.아포토시스에 결함이 있는 수지상 세포는 부적절한 전신 림프구 활성화와 그에 따른 자가 [23]내성의 저하를 초래할 수 있다.
- 에피토프 확산 또는 에피토프 드리프트 – 면역 반응이 1차 에피토프 표적에서 다른 에피토프 [24]표적으로도 바뀔 때.분자 모방과는 대조적으로, 다른 에피토프는 구조적으로 1차 에피토프와 유사할 필요는 없다.
- 에피토프 수정 또는 암호 에피토프 노출 – 자가면역 질환의 메커니즘은 조혈 시스템의 결함에서 비롯되지 않는다는 점에서 독특합니다.대신에, 수수께끼 같은 N-glycan(다당류)의 노출 질병으로부터 결과 linkages 포유류의non-hematopoietic 세포의 당단백질에 진핵 생물과 원핵 생물을 낮추고 phylogenically 원시적인 glycans의 이 노출 organs[25]고 만성적인 불임 infl을 유도하기 위해 하나 이상의 포유류의 선천적 면역 세포 수용체를 활성화하여 일반적인.입니다성숙한 상태만성 및 염증성 세포 손상이 있는 경우, 적응형 면역 시스템이 확보되고 자가항체 생산의 증가와 함께 자가내성이 상실된다.이 질환의 형태에서 림프구의 부재는 장기 손상을 가속화할 수 있으며 정맥 내 IgG 투여는 치료가 될 수 있다.자가면역 질환에 대한 이 경로는 다양한 퇴행성 질환의 기초가 될 수 있지만, 이 질환 메커니즘에 대한 진단은 현재 존재하지 않으며, 따라서 인간의 자가면역에서의 그 역할은 현재 알려져 있지 않다.
자가면역질환의 병인에 있어서 조절T세포, NKT세포, δT세포 등 특수 면역조절세포의 역할을 연구 중이다.
분류
자가면역질환은 각 질환의 주요 임상병리학적 특성에 따라 크게 전신 및 장기 특이적 또는 국소적 자가면역장애로 나눌 수 있다.
- 전신성 자가면역질환으로는 결장성 질환, 홍반성 낭창, 셰그렌 증후군, 육종증, 강피증, 류마티스 관절염, 저온글로불린혈성 혈관염, 피부근염 등이 있다.이러한 조건들은 조직특이적이지 않은 항원에 대한 자가항체와 연관되는 경향이 있다.따라서 다발성 근염은 표시상 다소 특정 조직이지만, 자가항염은 종종 어디에서나 볼 수 있는 t-RNA 합성효소이기 때문에 이 그룹에 포함될 수 있다.
- 특정 장기 또는 조직에 영향을 미치는 국소 신드롬:
전통적인 "장기 특이적"과 "비장기 특이적" 분류 체계를 사용하여, 많은 질병들이 자가면역질환 우산 아래 하나로 묶였다.그러나 많은 만성 염증성 인간 질환은 B와 T 세포 구동 면역 병리학의 명확한 연관성이 결여되어 있다.지난[clarification needed] 10년 동안 조직에 대한 "자신에 대한 염증"이 반드시 비정상적인 T세포와 B세포 [26]반응에 의존하지 않는다는 것이 확실히 입증되었다.
이것은 자가면역의 스펙트럼을 "면역학적 질병 연속체"를 따라 봐야 한다는 최근 제안으로 이어졌는데, 한 쪽 극단에서는 고전적 자가면역질환이, 다른 쪽 극단에서는 선천적 면역체계에 의해 움직이는 질병이 그것이다.이 체계에는 자가면역의 모든 스펙트럼이 포함될 수 있다.많은 흔한 인간 자가면역질환들이 이 새로운 방법을 사용하여 선천적으로 면역 매개 면역병리학을 가지고 있는 것을 볼 수 있다.이 새로운 분류 체계는 질병 메커니즘을 이해하고 치료 [26]개발에 영향을[clarification needed] 미친다.
진단.
자가면역장애의 진단은 환자의 정확한 병력과 신체검사, 정기적인 실험실 테스트의 특정 이상에 대한 높은 의심지수[clarification needed](예: 상승된 C-반응 단백질)[citation needed]에 따라 크게 좌우된다.
몇 가지 [clarification needed]전신장애에서는 특정 자가항체를 검출할 수 있는 혈청학적 분석이 이용될 [citation needed]수 있다.국소적인 장애는 생체검사 [citation needed]검체의 면역 형광에 의해 가장 잘 진단된다.
자가항체는 많은 자가면역질환을 [clarification needed]진단하는데 사용된다.자가 항체의 수치를 측정하여 질병의 [citation needed]진행 상황을 판단합니다.
치료법
자가면역질환의 치료법은 전통적으로 면역억제, 항염증 또는 [10]완화제였다.자가면역질환에서는 [27]염증을 관리하는 것이 중요하다.하시모토 갑상선염의 호르몬 대체나 제1형 당뇨병 등의 비면역학적 치료는 자가 공격 반응의 결과를 치료하기 때문에 완화 치료입니다.식사조작은 소아지방질환의 심각성을 제한한다.스테로이드 또는 NSAID 치료는 많은 질병의 염증 증상을 제한한다.IVIG는 CIDP 및 GBS에 사용됩니다.TNFα 길항제(예를 들어 에타넬셉트), B세포 고갈제 리턱시맙, 항IL-6 수용체 토실리주맙 및 늑장 억제제 아바타셉트와 같은 특정 면역조절요법이 RA 치료에 유용한 것으로 나타났다.이러한 면역요법 중 일부는 감염에 대한 민감성과 같은 부작용의 위험 증가와 관련이 있을 수 있다.
헬민트 치료는 특정 기생 장선충(helminthes)을 환자에게 접종하는 실험적인 접근법이다.현재 이용 가능한 두 가지 밀접한 관련이 있는 치료법이 있는데, 흔히 후크웜으로 알려진 Necator Americanus와 돼지 회충 [28][29][30][31][32]알로 알려진 Trichuris Suis Ova 중 하나를 접종하는 것이다.
T세포 예방접종은 자가면역 [citation needed]장애의 미래 치료법으로서도 연구되고 있다.
영양 및 자가면역성
비타민 D/선라이트
- 대부분의 인간 세포와 조직이 T와 B 세포를 포함한 비타민 D에 대한 수용체를 가지고 있기 때문에, 적절한 수준의 비타민 D는 면역 [33]체계를 조절하는데 도움을 줄 수 있습니다.비타민D는 T세포와 자연 킬러세포에 [34]작용하여 면역기능에 역할을 합니다.연구는 낮은 혈청 비타민 D와 다발성 경화증, 제1형 당뇨병, 그리고 전신성 홍반성 루푸스 ([34][35][36]일반적으로 간단히 루푸스라고 불림)를 포함한 자가 면역 질환 사이의 연관성을 증명했습니다.그러나 낭창은 광감작성이기 때문에 [34][35][36]비타민D 결핍의 원인이 될 수 있는 햇빛을 피하는 것이 좋다.비타민 D 수용체 유전자의 다형성은 자가면역질환을 가진 사람들에게서 흔히 발견되는데,[34][35] 이것은 자가면역에서의 비타민 D의 역할에 대한 하나의 잠재적 메커니즘을 제공한다.제1형 당뇨병, 루푸스,[34][35][36] 다발성 경화증에서 비타민D 보충의 효과에 대한 복합적인 증거가 있다.
오메가3 지방산
- 연구에 따르면 오메가3 지방산의 적절한 섭취는 자가면역질환의 증상에 기여하는 아라키돈산의 효과를 상쇄한다.인간과 동물 실험은 오메가3가 류마티스 관절염, 염증성 장질환, 천식, [37]건선의 많은 경우에 효과적인 치료 방법이라고 제안합니다.
- 주요 우울증은 반드시 자가면역질환은 아니지만, 그 생리적인 증상 중 일부는 본질적으로 염증과 자가면역질환이다.오메가3는 우울증의 생리적인 증상을 유발하는 간섭 감마 및 다른 사이토카인의 생성을 억제할 수 있다.이는 상반되는 영향을 미치는 오메가3 지방산과 오메가6 지방산의 불균형이 주요 [37]우울증의 원인일 수 있다.
생균제/마이크로플로라
- 발효 유제품, 특히 유산균 casei에 존재하는 다양한 종류의 박테리아와 미세 플로라는 생쥐의 종양에 대한 면역 반응을 자극하고 면역 기능을 조절하여 비비만성 당뇨병의 발병을 지연 또는 예방하는 것으로 나타났다.이것은 특히 L. casei(LCS)의 Shirota 균주에 해당된다.LcS 변종은 주로 유럽과 일본의 요구르트 및 유사한 제품에서 발견되며, [38]다른 곳에서는 거의 발견되지 않습니다.
- 유리기능은 유아와 소아에서 제1형 당뇨병의 발생에 기여하며, 따라서 임신 중 항산화물질의 높은 섭취에 의해 위험이 감소될 수 있다는 이론이 있다.그러나 1997-2002년 핀란드의 한 병원에서 실시된 연구는 항산화제 섭취와 당뇨병 [39]위험 사이에 통계적으로 유의한 상관관계가 없다는 결론을 내렸다.이 연구는 정확한 측정이나 보충제 사용이 아닌 설문지를 통한 음식 섭취 모니터링과 이를 바탕으로 추정된 항산화제 섭취를 포함했다.
「 」를 참조해 주세요.
레퍼런스
- ^ The Editors of Encyclopaedia Britannica (20 November 2018). "Autoimmunity". Health & Medicine. Encyclopædia Britannica. Archived from the original on 5 January 2021. Retrieved 5 January 2020.
{{cite web}}:last=범용명(도움말)이 있습니다. - ^ Delves, Peter J. (1998-01-01), "Autoimmunity", in Delves, Peter J. (ed.), Encyclopedia of Immunology (Second Edition), Oxford: Elsevier, pp. 292–296, ISBN 978-0-12-226765-9, retrieved 2021-01-06
- ^ Patt H, Bandgar T, Lila A, Shah N (2013). "Management issues with exogenous steroid therapy". Indian Journal of Endocrinology and Metabolism. 17 (Suppl 3): s612–s617. doi:10.4103/2230-8210.123548. PMC 4046616. PMID 24910822.
- ^ Diamond, Betty; Lipsky, Peter E. (2014), Kasper, Dennis; Fauci, Anthony; Hauser, Stephen; Longo, Dan (eds.), "Autoimmunity and Autoimmune Diseases", Harrison's Principles of Internal Medicine (19 ed.), New York, NY: McGraw-Hill Education, archived from the original on 5 January 2021, retrieved 2021-01-05
- ^ Arthur M. Silverstein:자동면역: 초기 인식 투쟁의 역사 (Ian R. Mackay, Noel R R Rose):자가면역질환(제2장), 학술전문지, 2013년
- ^ Poletaev AB, Churilov LP, Stroev YI, Agapov MM (2012). "Immunophysiology versus immunopathology: Natural autoimmunity in human health and disease". Pathophysiology. 19 (3): 221–31. doi:10.1016/j.pathophys.2012.07.003. PMID 22884694.
- ^ Stefanova I.; Dorfman J. R.; Germain R. N. (2002). "Self-recognition promotes the foreign antigen sensitivity of naive T lymphocytes". Nature. 420 (6914): 429–434. Bibcode:2002Natur.420..429S. doi:10.1038/nature01146. PMID 12459785. S2CID 993284.
- ^ Pike B, Boyd A, Nossal G (1982). "Clonal anergy: the universally anergic B lymphocyte". Proceedings of the National Academy of Sciences. 79 (6): 2013–7. Bibcode:1982PNAS...79.2013P. doi:10.1073/pnas.79.6.2013. PMC 346112. PMID 6804951.
- ^ Jerne N (1974). "Towards a network theory of the immune system". Annales d'Immunologie. 125C (1–2): 373–89. PMID 4142565.
- ^ a b "Tolerance and Autoimmunity". Archived from the original on 2011-01-01. Retrieved 2007-03-19.
- ^ Edwards JC, Cambridge G, Abrahams VM (1999). "Do self perpetuating B lymphocytes drive human autoimmune disease?". Immunology. 97 (2): 1868–1876. doi:10.1046/j.1365-2567.1999.00772.x. PMC 2326840. PMID 10447731.
- ^ Grammatikos A, Tsokos G (2012). "Immunodeficiency and autoimmunity: lessons from systemic lupus erythematosus". Trends in Molecular Medicine. 18 (2): 101–108. doi:10.1016/j.molmed.2011.10.005. PMC 3278563. PMID 22177735.
- ^ Klein J, Sato A (September 2000). "The HLA system. Second of two parts". New England Journal of Medicine. 343 (11): 782–6. doi:10.1056/NEJM200009143431106. PMID 10984567.
- ^ Gregersen, Peter K.; Olsson, Lina M. (2009-01-01). "Recent Advances in the Genetics of Autoimmune Disease". Annual Review of Immunology. 27: 363–391. doi:10.1146/annurev.immunol.021908.132653. PMC 2992886. PMID 19302045.
- ^ a b c d e f Krisha McCoy의 여성과 자가면역 장애.Lindsey Marcellin, MD, MPH 의학 리뷰 최종 갱신일 : 2009년 12월 2일
- ^ Ainsworth, Claire(2003년 11월 15일).Wayback Machine의 Archived 2008-10-22 내의 낯선 사람.새로운 사이언티스트(서브스크립션).(여기 [1] 참조)
- ^ 이론: X염색체 불활성화 불균형으로 인한 여성의 높은 자가면역성 : [2]
- ^ Uz E, Loubiere LS, Gadi VK, et al. (June 2008). "Skewed X-chromosome Inactivation in Scleroderma". Clinical Reviews in Allergy & Immunology. 34 (3): 352–5. doi:10.1007/s12016-007-8044-z. PMC 2716291. PMID 18157513.
- ^ Saunders K, Raine T, Cooke A, Lawrence C (2007). "Inhibition of Autoimmune Type 1 Diabetes by Gastrointestinal Helminth Infection". Infection and Immunity. 75 (1): 397–407. doi:10.1128/IAI.00664-06. PMC 1828378. PMID 17043101.
- ^ "Parasite Infection May Benefit Multiple Sclerosis Patients". sciencedaily.com.
- ^ Wållberg M, Harris R (2005). "Co-infection with Trypanosoma brucei brucei prevents experimental autoimmune encephalomyelitis in DBA/1 mice through induction of suppressor APCs". International Immunology. 17 (6): 721–8. doi:10.1093/intimm/dxh253. PMID 15899926.
- ^ Edwards JC, Cambridge G (2006). "B-cell targeting in rheumatoid arthritis and other autoimmune diseases". Nature Reviews Immunology. 6 (5): 394–403. doi:10.1038/nri1838. PMID 16622478. S2CID 7235553.
- ^ Kubach J, Becker C, Schmitt E, Steinbrink K, Huter E, Tuettenberg A, Jonuleit H (2005). "Dendritic cells: sentinels of immunity and tolerance". International Journal of Hematology. 81 (3): 197–203. doi:10.1532/IJH97.04165. PMID 15814330. S2CID 34998016.
- ^ DNA 백신 접종 후 티로시나아제 관련 단백질에 대한 자가항체 유도: Alan N, Wayback Machine Roopa Srinivasan에서 2008년 5월 3일 보관된 단백질 패러로그에 대한 예상치 못한 반응성.호튼과 제드 D.월척
- ^ Green R.S.; Stone E.L.; Tenno M.; Lehtonen E.; Farquhar M.G.; Marth J.D. (2007). "Mammalian N-glycan branching protects against innate immune self-recognition and inflammation in autoimmune disease pathogenesis". Immunity. 27 (2): 308–320. doi:10.1016/j.immuni.2007.06.008. PMID 17681821.
- ^ a b McGonagle, D; McDermott, MF (Aug 2006). "A proposed classification of the immunological diseases". PLOS Medicine. 3 (8): e297. doi:10.1371/journal.pmed.0030297. PMC 1564298. PMID 16942393.
- ^ Nikoopour E, Schwartz JA, Singh B (2008). "Therapeutic benefits of regulating inflammation in autoimmunity". Inflammation & Allergy - Drug Targets. 7 (3): 203–210. doi:10.2174/187152808785748155. PMID 18782028.
- ^ Zaccone P, Fehervari Z, Phillips JM, Dunne DW, Cooke A (2006). "Parasitic worms and inflammatory diseases". Parasite Immunology. 28 (10): 515–23. doi:10.1111/j.1365-3024.2006.00879.x. PMC 1618732. PMID 16965287.
- ^ Dunne DW, Cooke A (2005). "A worm's eye view of the immune system: consequences for evolution of human autoimmune disease". Nature Reviews Immunology. 5 (5): 420–6. doi:10.1038/nri1601. PMID 15864275. S2CID 24659866.
- ^ Dittrich AM, Erbacher A, Specht S, et al. (2008). "Helminth Infection with Litomosoides sigmodontis Induces Regulatory T Cells and Inhibits Allergic Sensitization, Airway Inflammation, and Hyperreactivity in a Murine Asthma Model". The Journal of Immunology. 180 (3): 1792–9. doi:10.4049/jimmunol.180.3.1792. PMID 18209076.
- ^ Wohlleben G, Trujillo C, Müller J, et al. (2004). "Helminth infection modulates the development of allergen-induced airway inflammation". International Immunology. 16 (4): 585–96. doi:10.1093/intimm/dxh062. PMID 15039389.
- ^ Quinnell RJ, Bethony J, Pritchard DI (2004). "The immunoepidemiology of human hookworm infection". Parasite Immunology. 26 (11–12): 443–54. doi:10.1111/j.0141-9838.2004.00727.x. PMID 15771680. S2CID 32598886.
- ^ Holick, Michael (December 2004). "Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease". The American Journal of Clinical Nutrition. 80 (6): 1678S–1688S. doi:10.1093/ajcn/80.6.1678S. PMID 15585788.
- ^ a b c d e Yang, Chen-Yen; Leung, Patrick S. C.; Adamopoulos, Iannis E.; Gershwin, M. Eric (2013-10-01). "The Implication of Vitamin D and Autoimmunity: a Comprehensive Review". Clinical Reviews in Allergy & Immunology. 45 (2): 217–226. doi:10.1007/s12016-013-8361-3. PMC 6047889. PMID 23359064.
- ^ a b c d Dankers, Wendy; Colin, Edgar M.; Hamburg, Van; Piet, Jan; Lubberts, Erik (2017). "Vitamin D in Autoimmunity: Molecular Mechanisms and Therapeutic Potential". Frontiers in Immunology. 7: 697. doi:10.3389/fimmu.2016.00697. PMC 5247472. PMID 28163705.
- ^ a b c Agmon-Levin, Nancy; Theodor, Emanuel; Segal, Ramit Maoz; Shoenfeld, Yehuda (2013-10-01). "Vitamin D in Systemic and Organ-Specific Autoimmune Diseases". Clinical Reviews in Allergy & Immunology. 45 (2): 256–266. doi:10.1007/s12016-012-8342-y. PMID 23238772. S2CID 13265245.
- ^ a b Simopoulos, Artemis (2002). "Omega-3 Fatty Acids in Inflammation and Autoimmune Diseases". Journal of the American College of Nutrition. 21 (6): 495–505. doi:10.1080/07315724.2002.10719248. PMID 12480795. S2CID 16733569.
- ^ Matsuzaki, Takeshi; Akimitsu Takagi; Haruo Ikemura; Tetsuya Matsuguchi; Teruo Yokokura (March 2007). "Intestinal Microflora: Probiotics and Autoimmunity". The Journal of Nutrition. 137 (3): 798S–802S. doi:10.1093/jn/137.3.798S. PMID 17311978.
- ^ Uusitalo, Liisa; Mike G Kenward; Suvi M Virtanen; Ulla Uusitalo; Jaakko Nevalainen; Sari Niinistö; Carina Kronberg-Kippilä; Marja-Leena Ovaskainen; Liisa Marjamäki; Olli Simell; Jorma Ilonen; Riitta Veijola; Mikael Knip (August 2008). "Intake of antioxidant vitamins and trace elements during pregnancy and risk of advanced beta cell autoimmunity in the child". The American Journal of Clinical Nutrition. 88 (2): 458–464. doi:10.1093/ajcn/88.2.458. PMID 18689383.
외부 링크
- 미국 자가면역 관련 질병 협회: 비영리 단체
- 면역 내성 네트워크: 연구 지향적인 자원
- 노벨상 - 1960년 노벨 생리의학상은 "획득된 면역학적 내성을 발견한" 공로로 프랭크 버넷과 피터 B 메다와르에게 수여되었다.
- 면역학 데이터베이스 및 분석 포털 – NIAID가 지원하는 전체 면역학 영역을 포함하는 참조 및 실험 데이터 데이터베이스 리소스
- 자가면역질환의 이해 - 미국 국립관절염 및 근골격계 및 피부질환연구소


