호모사피엔스 종의 단백질 코딩 유전자
BRCA1 관련 RING 도메인 단백질 1 은 인간에서 BARD1 유전자 에 의해 인코딩되는 단백질 이다.[5] [6] [7] 인간 BARD1 단백질은 777개의 아미노산 으로 RING 핑거 도메인 (리소스 46-90), 4개의 앙키린 반복측정(리소스 420-555) 및 2개의 탠덤 BRCT 도메인 (리소스 568-777)을 포함하고 있다.[8]
함수 전부는 아니더라도 대부분 BRCA1은 체내 BARD1로 이질화한다.[9] BARD1과 BRCA1 은 그들의 N-단어 RING 핑거 도메인을 통해 이질감을 형성한다. BARD1-BRCA1 상호작용은 체외 및 체외에서 관찰되며 BRCA1 안정성을 위해 필수적이다. BARD1은 N-terminal RING 모티브와 C-terminal BRCT 도메인인 BRCA1의 가장 보존된 두 영역과 동질학을 공유한다. RING 모티브는 종양 억제기 유전자와 지배적인 원생균 의 산물 등 세포 성장을 조절하는 다양한 단백질에서 발견되는 시스테인이 풍부한 염기서열이며, 유전자의 폴리콤 그룹과 같이 발달적으로 중요한 유전자를 가지고 있다. BARD1 단백질은 또한 3개의 탠덤 앤키린 반복 을 함유하고 있다.[10] [11]
BARD1/BRCA1 상호작용은 BRCA1의 종양유전 아미노산 대체에 의해 중단되며, 이러한 단백질들 사이의 안정적 복합체 형성이 BRCA1 종양 억제의 필수적인 측면이 될 수 있음을 암시한다. BARD1은 유방암이나 난소암에서 발작적인 돌연변이의 표적이 될 수 있다.[10] 구조에 영향을 미치는 BARD1 단백질의 돌연변이는 많은 유방암 , 난소암 , 자궁암 에서 나타나는데, 그 돌연변이가 BARD1의 종양 억제 기능을 무력화시킨다는 것을 암시한다.[8] 각각 BARD1의 BRCT 영역에 영향을 미치는 세 가지 오감 돌연변이 가 암에 연루된 것으로 알려져 있는데, C645R은 유방암과 난소암, V695L는 유방암과 연관되어 있으며, S761N은 유방암과 자궁암과 연관되어 있다.[8] BARD1 표현은 유전독성 스트레스에 의해 조절되며 BRCA1과 독립적으로 p53을 결합하고 안정화함으로써 세포사멸에 관여한다.[12]
BARD1은 BRCA1을 DNA 손상 부위로 신속하게 이전하는 데 필수적이다.[13] BARD1 tandem BRCA1 C-terminus(BRCT) 모티브는 키 리신 잔여물(K619)[13] DNA 트리거 폴리(ADPribose) 폴리머아제 1(PARP1)의 이중 좌초파단(DSB)으로 PAR(Poly(ADPribose) 폴리머아제 1(PAR)의 형성을 촉매하여 PAR이 BRCA1/BARD1 헤테로디머를 포함한 일련의 DNA 반응 단백질에 결합하여 DNA 손상 부위를 대상으로 한다.[14] BRCA1/BARD1 헤테로디머를 손상된 DNA 부위로 이송하면 E3 유비쿼시틴 리게아제 역할을 한다.[9] BRCA1/BARD1 헤테로디메르는 RNA 중합효소 II를 편재하여 손상된 DNA의 전사를 방지하고 유전적 안정성을 회복한다.[15]
DNA 수리 BRCA1-BARD1은 RAD51 단백질을 DNA 이중 스트랜드에 채용 하는 데 중요한 기능을 가지고 있는 것으로 보이며, 이는 이러한 균열의 동음이의 재조합 수리에 있어 중요한 초기 단계다.[16] BRCA1-BARD1은 2개의 다른 종양 억제제 단백질 BRCA2 와 PALB2 와 함께 고차량의 "호모재조합 중재자 콤플렉스"의 일부로서 기능할 가능성이 있다.[16]
상호작용 BARD1은 다음과 상호작용 하는 것으로 나타났다.
AURKB ,[17] BCL3 ,[18] BRCA1 ,[5] [7] [17] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] BRCA2 ,[17] [19] BRCC3 ,[19] BRE ,[19] CSTF1 ,[27] [28] CSTF2 ,[27] [28] EWSR1 ,[48] FANCD2 ,[25] H2AFX ,[20] [22] NPM1 ,[23] P53 ,[19] RAD51 ,[19] TACC1 [17] UBE2D1 .[19] [20] [21] [22] [23] [24] [25] [26]
암 치료의 시사점 만약 암세포의 DNA 손상 복구 능력이 무력화되었다면, 암 치료는 더 효과적일 것이다. 암세포의 BRCA1/BARD1 헤테로디메이터가 DNA 손상 부위로 이동하는 것을 억제하면 회복보다는 종양세포 사망을 유도할 수 있다. 한 가지 억제 가능성은 BARD1 BRCT 키 리신 잔류물(K619)이다. 이 리신 잔여물이 폴리(ADP-리보스)를 결합하는 기능을 억제하면 BRCA1/BARD1 헤테로디메이터가 DNA 손상 부위로 국소화되는 것을 방지하고 이후 DNA 손상 수리를 방지할 수 있다. 이것은 화학요법과 방사선 치료와 같은 암 치료법을 훨씬 더 효과적으로 만들 것이다.[49]
참조 ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000138376 - 앙상블 , 2017년 5월^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000026196 - 앙상블 , 2017년 5월^ "Human PubMed Reference:" . National Center for Biotechnology Information, U.S. National Library of Medicine .^ "Mouse PubMed Reference:" . National Center for Biotechnology Information, U.S. National Library of Medicine .^ a b Wu LC, Wang ZW, Tsan JT, Spillman MA, Phung A, Xu XL, Yang MC, Hwang LY, Bowcock AM, Baer R (Dec 1996). "Identification of a RING protein that can interact in vivo with the BRCA1 gene product". Nature Genetics . 14 (4): 430–40. doi :10.1038/ng1296-430 . PMID 8944023 . S2CID 22728511 . ^ Thai TH, Du F, Tsan JT, Jin Y, Phung A, Spillman MA, Massa HF, Muller CY, Ashfaq R, Mathis JM, Miller DS, Trask BJ, Baer R, Bowcock AM (Feb 1998). "Mutations in the BRCA1-associated RING domain (BARD1) gene in primary breast, ovarian and uterine cancers" . Human Molecular Genetics . 7 (2): 195–202. doi :10.1093/hmg/7.2.195 PMID 9425226 . ^ a b Fabbro M, Savage K, Hobson K, Deans AJ, Powell SN, McArthur GA, Khanna KK (Jul 2004). "BRCA1-BARD1 complexes are required for p53Ser-15 phosphorylation and a G1/S arrest following ionizing radiation-induced DNA damage" . The Journal of Biological Chemistry . 279 (30): 31251–8. doi :10.1074/jbc.M405372200 PMID 15159397 . ^ a b c Birrane G, Varma AK, Soni A, Ladias JA (Jul 2007). "Crystal structure of the BARD1 BRCT domains". Biochemistry . 46 (26): 7706–12. doi :10.1021/bi700323t . PMID 17550235 . ^ a b Baer R, Ludwig T (Feb 2002). "The BRCA1/BARD1 heterodimer, a tumor suppressor complex with ubiquitin E3 ligase activity". Current Opinion in Genetics & Development . 12 (1): 86–91. doi :10.1016/s0959-437x(01)00269-6 . PMID 11790560 . ^ a b "Entrez Gene: BARD1 BRCA1 associated RING domain 1" .^ Fox, David; Le Trong, Isolde; Rajagopal, Ponni; Brzovic, Peter S.; Stenkamp, Ronald E.; Klevit, Rachel E. (2008-07-25). "Crystal structure of the BARD1 ankyrin repeat domain and its functional consequences" . The Journal of Biological Chemistry . 283 (30): 21179–21186. doi :10.1074/jbc.M802333200 ISSN 0021-9258 . PMC 2475683 PMID 18480049 . ^ Irminger-Finger I, Leung WC, Li J, Dubois-Dauphin M, Harb J, Feki A, Jefford CE, Soriano JV, Jaconi M, Montesano R, Krause KH (Dec 2001). "Identification of BARD1 as mediator between proapoptotic stress and p53-dependent apoptosis" . Molecular Cell . 8 (6): 1255–66. doi :10.1016/s1097-2765(01)00406-3 PMID 11779501 . ^ a b Li M, Yu X (May 2013). "Function of BRCA1 in the DNA damage response is mediated by ADP-ribosylation" . Cancer Cell . 23 (5): 693–704. doi :10.1016/j.ccr.2013.03.025 . PMC 3759356 PMID 23680151 . ^ Baer R (May 2013). "Luring BRCA1 to the scene of the crime" . Cancer Cell . 23 (5): 565–7. doi :10.1016/j.ccr.2013.04.013 . PMC 3746756 PMID 23680142 . ^ Irminger-Finger I, Jefford CE (May 2006). "Is there more to BARD1 than BRCA1?". Nature Reviews. Cancer . 6 (5): 382–91. doi :10.1038/nrc1878 . PMID 16633366 . S2CID 13543420 . ^ a b 타르수나스 M, 성 P. DNA 수리 및 복제에서 BRCA1-BARD1의 반독점적 역할. Nat Rev Mol Cell Biol. 2020;21(5):284-118. doi:10.1038/s41580-020-0218-z ^ a b c d Ryser S, Dizin E, Jefford CE, Delaval B, Gagos S, Christodoulidou A, Krause KH, Birnbaum D, Irminger-Finger I (Feb 2009). "Distinct roles of BARD1 isoforms in mitosis: full-length BARD1 mediates Aurora B degradation, cancer-associated BARD1beta scaffolds Aurora B and BRCA2" . Cancer Research . 69 (3): 1125–34. doi :10.1158/0008-5472.CAN-08-2134 PMID 19176389 . ^ Dechend R, Hirano F, Lehmann K, Heissmeyer V, Ansieau S, Wulczyn FG, Scheidereit C, Leutz A (Jun 1999). "The Bcl-3 oncoprotein acts as a bridging factor between NF-kappaB/Rel and nuclear co-regulators" . Oncogene . 18 (22): 3316–23. doi :10.1038/sj.onc.1202717 PMID 10362352 . ^ a b c d e f g Dong Y, Hakimi MA, Chen X, Kumaraswamy E, Cooch NS, Godwin AK, Shiekhattar R (Nov 2003). "Regulation of BRCC, a holoenzyme complex containing BRCA1 and BRCA2, by a signalosome-like subunit and its role in DNA repair" . Molecular Cell . 12 (5): 1087–99. doi :10.1016/S1097-2765(03)00424-6 PMID 14636569 . ^ a b c Mallery DL, Vandenberg CJ, Hiom K (Dec 2002). "Activation of the E3 ligase function of the BRCA1/BARD1 complex by polyubiquitin chains" . The EMBO Journal . 21 (24): 6755–62. doi :10.1093/emboj/cdf691 . PMC 139111 PMID 12485996 . ^ a b Kentsis A, Gordon RE, Borden KL (Nov 2002). "Control of biochemical reactions through supramolecular RING domain self-assembly" . Proceedings of the National Academy of Sciences of the United States of America . 99 (24): 15404–9. Bibcode :2002PNAS...9915404K . doi :10.1073/pnas.202608799 PMC 137729 PMID 12438698 . ^ a b c Chen A, Kleiman FE, Manley JL, Ouchi T, Pan ZQ (Jun 2002). "Autoubiquitination of the BRCA1*BARD1 RING ubiquitin ligase" . The Journal of Biological Chemistry . 277 (24): 22085–92. doi :10.1074/jbc.M201252200 PMID 11927591 . ^ a b c Sato K, Hayami R, Wu W, Nishikawa T, Nishikawa H, Okuda Y, Ogata H, Fukuda M, Ohta T (Jul 2004). "Nucleophosmin/B23 is a candidate substrate for the BRCA1-BARD1 ubiquitin ligase" . The Journal of Biological Chemistry . 279 (30): 30919–22. doi :10.1074/jbc.C400169200 PMID 15184379 . ^ a b Wu-Baer F, Lagrazon K, Yuan W, Baer R (Sep 2003). "The BRCA1/BARD1 heterodimer assembles polyubiquitin chains through an unconventional linkage involving lysine residue K6 of ubiquitin" . The Journal of Biological Chemistry . 278 (37): 34743–6. doi :10.1074/jbc.C300249200 PMID 12890688 . ^ a b c Vandenberg CJ, Gergely F, Ong CY, Pace P, Mallery DL, Hiom K, Patel KJ (Jul 2003). "BRCA1-independent ubiquitination of FANCD2" . Molecular Cell . 12 (1): 247–54. doi :10.1016/S1097-2765(03)00281-8 PMID 12887909 . ^ a b Hashizume R, Fukuda M, Maeda I, Nishikawa H, Oyake D, Yabuki Y, Ogata H, Ohta T (May 2001). "The RING heterodimer BRCA1-BARD1 is a ubiquitin ligase inactivated by a breast cancer-derived mutation" . The Journal of Biological Chemistry . 276 (18): 14537–40. doi :10.1074/jbc.C000881200 PMID 11278247 . ^ a b c Kleiman FE, Manley JL (Mar 2001). "The BARD1-CstF-50 interaction links mRNA 3' end formation to DNA damage and tumor suppression" . Cell . 104 (5): 743–53. doi :10.1016/S0092-8674(01)00270-7 PMID 11257228 . ^ a b c Kleiman FE, Manley JL (Sep 1999). "Functional interaction of BRCA1-associated BARD1 with polyadenylation factor CstF-50". Science . 285 (5433): 1576–9. doi :10.1126/science.285.5433.1576 . PMID 10477523 . ^ Wang Q, Zhang H, Guerrette S, Chen J, Mazurek A, Wilson T, Slupianek A, Skorski T, Fishel R, Greene MI (Aug 2001). "Adenosine nucleotide modulates the physical interaction between hMSH2 and BRCA1" . Oncogene . 20 (34): 4640–9. doi :10.1038/sj.onc.1204625 PMID 11498787 . ^ Fabbro M, Rodriguez JA, Baer R, Henderson BR (Jun 2002). "BARD1 induces BRCA1 intranuclear foci formation by increasing RING-dependent BRCA1 nuclear import and inhibiting BRCA1 nuclear export" . The Journal of Biological Chemistry . 277 (24): 21315–24. doi :10.1074/jbc.M200769200 PMID 11925436 . ^ Rodriguez JA, Schüchner S, Au WW, Fabbro M, Henderson BR (Mar 2004). "Nuclear-cytoplasmic shuttling of BARD1 contributes to its proapoptotic activity and is regulated by dimerization with BRCA1" . Oncogene . 23 (10): 1809–20. doi :10.1038/sj.onc.1207302 PMID 14647430 . ^ Brzovic PS, Keeffe JR, Nishikawa H, Miyamoto K, Fox D, Fukuda M, Ohta T, Klevit R (May 2003). "Binding and recognition in the assembly of an active BRCA1/BARD1 ubiquitin-ligase complex" . Proceedings of the National Academy of Sciences of the United States of America . 100 (10): 5646–51. Bibcode :2003PNAS..100.5646B . doi :10.1073/pnas.0836054100 PMC 156255 PMID 12732733 . ^ Nishikawa H, Ooka S, Sato K, Arima K, Okamoto J, Klevit RE, Fukuda M, Ohta T (Feb 2004). "Mass spectrometric and mutational analyses reveal Lys-6-linked polyubiquitin chains catalyzed by BRCA1-BARD1 ubiquitin ligase" . The Journal of Biological Chemistry . 279 (6): 3916–24. doi :10.1074/jbc.M308540200 PMID 14638690 . ^ Chiba N, Parvin JD (Oct 2001). "Redistribution of BRCA1 among four different protein complexes following replication blockage" . The Journal of Biological Chemistry . 276 (42): 38549–54. doi :10.1074/jbc.M105227200 PMID 11504724 . ^ Morris JR, Keep NH, Solomon E (Mar 2002). "Identification of residues required for the interaction of BARD1 with BRCA1" . The Journal of Biological Chemistry . 277 (11): 9382–6. doi :10.1074/jbc.M109249200 PMID 11773071 . ^ Brzovic PS, Meza JE, King MC, Klevit RE (Nov 2001). "BRCA1 RING domain cancer-predisposing mutations. Structural consequences and effects on protein-protein interactions" . The Journal of Biological Chemistry . 276 (44): 41399–406. doi :10.1074/jbc.M106551200 PMID 11526114 . ^ Xia Y, Pao GM, Chen HW, Verma IM, Hunter T (Feb 2003). "Enhancement of BRCA1 E3 ubiquitin ligase activity through direct interaction with the BARD1 protein" . The Journal of Biological Chemistry . 278 (7): 5255–63. doi :10.1074/jbc.M204591200 PMID 12431996 . ^ Meza JE, Brzovic PS, King MC, Klevit RE (Feb 1999). "Mapping the functional domains of BRCA1. Interaction of the ring finger domains of BRCA1 and BARD1" . The Journal of Biological Chemistry . 274 (9): 5659–65. doi :10.1074/jbc.274.9.5659 PMID 10026184 . ^ Brzovic PS, Rajagopal P, Hoyt DW, King MC, Klevit RE (Oct 2001). "Structure of a BRCA1-BARD1 heterodimeric RING-RING complex". Nature Structural Biology . 8 (10): 833–7. doi :10.1038/nsb1001-833 . PMID 11573085 . S2CID 37617901 . ^ Yu X, Wu LC, Bowcock AM, Aronheim A, Baer R (Sep 1998). "The C-terminal (BRCT) domains of BRCA1 interact in vivo with CtIP, a protein implicated in the CtBP pathway of transcriptional repression" . The Journal of Biological Chemistry . 273 (39): 25388–92. doi :10.1074/jbc.273.39.25388 PMID 9738006 . ^ Jin Y, Xu XL, Yang MC, Wei F, Ayi TC, Bowcock AM, Baer R (Oct 1997). "Cell cycle-dependent colocalization of BARD1 and BRCA1 proteins in discrete nuclear domains" . Proceedings of the National Academy of Sciences of the United States of America . 94 (22): 12075–80. Bibcode :1997PNAS...9412075J . doi :10.1073/pnas.94.22.12075 PMC 23707 PMID 9342365 . ^ Scully R, Ganesan S, Vlasakova K, Chen J, Socolovsky M, Livingston DM (Dec 1999). "Genetic analysis of BRCA1 function in a defined tumor cell line" . Molecular Cell . 4 (6): 1093–9. doi :10.1016/S1097-2765(00)80238-5 PMID 10635334 . ^ Tascou S, Kang TW, Trappe R, Engel W, Burfeind P (Sep 2003). "Identification and characterization of NIF3L1 BP1, a novel cytoplasmic interaction partner of the NIF3L1 protein". Biochemical and Biophysical Research Communications . 309 (2): 440–8. doi :10.1016/j.bbrc.2003.07.008 . PMID 12951069 . ^ Benezra M, Chevallier N, Morrison DJ, MacLachlan TK, El-Deiry WS, Licht JD (Jul 2003). "BRCA1 augments transcription by the NF-kappaB transcription factor by binding to the Rel domain of the p65/RelA subunit" . The Journal of Biological Chemistry . 278 (29): 26333–41. doi :10.1074/jbc.M303076200 PMID 12700228 . ^ Cantor SB, Bell DW, Ganesan S, Kass EM, Drapkin R, Grossman S, Wahrer DC, Sgroi DC, Lane WS, Haber DA, Livingston DM (Apr 2001). "BACH1, a novel helicase-like protein, interacts directly with BRCA1 and contributes to its DNA repair function" . Cell . 105 (1): 149–60. doi :10.1016/S0092-8674(01)00304-X PMID 11301010 . ^ Wang Q, Zhang H, Kajino K, Greene MI (Oct 1998). "BRCA1 binds c-Myc and inhibits its transcriptional and transforming activity in cells" . Oncogene . 17 (15): 1939–48. doi :10.1038/sj.onc.1202403 PMID 9788437 . ^ Nishikawa H, Wu W, Koike A, Kojima R, Gomi H, Fukuda M, Ohta T (Jan 2009). "BRCA1-associated protein 1 interferes with BRCA1/BARD1 RING heterodimer activity" . Cancer Research . 69 (1): 111–9. doi :10.1158/0008-5472.CAN-08-3355 PMID 19117993 . ^ Spahn L, Petermann R, Siligan C, Schmid JA, Aryee DN, Kovar H (Aug 2002). "Interaction of the EWS NH2 terminus with BARD1 links the Ewing's sarcoma gene to a common tumor suppressor pathway". Cancer Research . 62 (16): 4583–7. PMID 12183411 . ^ Venkitaraman AR (Jan 2002). "Cancer susceptibility and the functions of BRCA1 and BRCA2" . Cell . 108 (2): 171–82. doi :10.1016/S0092-8674(02)00615-3 PMID 11832208 .
외부 링크 추가 읽기 Irminger-Finger I, Leung WC (Jun 2002). "BRCA1-dependent and independent functions of BARD1". The International Journal of Biochemistry & Cell Biology . 34 (6): 582–7. doi :10.1016/S1357-2725(01)00161-3 . PMID 11943588 . Irminger-Finger I (Jun 2003). "3rd Geneva aging workshop 2002: cancer, apoptosis and aging". Biochimica et Biophysica Acta (BBA) - Reviews on Cancer . 1653 (1): 41–5. doi :10.1016/S0304-419X(03)00019-2 . PMID 12781370 . Maruyama K, Sugano S (Jan 1994). "Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides". Gene . 138 (1–2): 171–4. doi :10.1016/0378-1119(94)90802-8 . PMID 8125298 . Bonaldo MF, Lennon G, Soares MB (Sep 1996). "Normalization and subtraction: two approaches to facilitate gene discovery" . Genome Research . 6 (9): 791–806. doi :10.1101/gr.6.9.791 PMID 8889548 . Jin Y, Xu XL, Yang MC, Wei F, Ayi TC, Bowcock AM, Baer R (Oct 1997). "Cell cycle-dependent colocalization of BARD1 and BRCA1 proteins in discrete nuclear domains" . Proceedings of the National Academy of Sciences of the United States of America . 94 (22): 12075–80. Bibcode :1997PNAS...9412075J . doi :10.1073/pnas.94.22.12075 PMC 23707 PMID 9342365 . Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (Oct 1997). "Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library". Gene . 200 (1–2): 149–56. doi :10.1016/S0378-1119(97)00411-3 . PMID 9373149 . Yu X, Wu LC, Bowcock AM, Aronheim A, Baer R (Sep 1998). "The C-terminal (BRCT) domains of BRCA1 interact in vivo with CtIP, a protein implicated in the CtBP pathway of transcriptional repression" . The Journal of Biological Chemistry . 273 (39): 25388–92. doi :10.1074/jbc.273.39.25388 PMID 9738006 . Ayi TC, Tsan JT, Hwang LY, Bowcock AM, Baer R (Oct 1998). "Conservation of function and primary structure in the BRCA1-associated RING domain (BARD1) protein" . Oncogene . 17 (16): 2143–8. doi :10.1038/sj.onc.1202123 PMID 9798686 . Meza JE, Brzovic PS, King MC, Klevit RE (Feb 1999). "Mapping the functional domains of BRCA1. Interaction of the ring finger domains of BRCA1 and BARD1" . The Journal of Biological Chemistry . 274 (9): 5659–65. doi :10.1074/jbc.274.9.5659 PMID 10026184 . Dechend R, Hirano F, Lehmann K, Heissmeyer V, Ansieau S, Wulczyn FG, Scheidereit C, Leutz A (Jun 1999). "The Bcl-3 oncoprotein acts as a bridging factor between NF-kappaB/Rel and nuclear co-regulators" . Oncogene . 18 (22): 3316–23. doi :10.1038/sj.onc.1202717 PMID 10362352 . Kleiman FE, Manley JL (Sep 1999). "Functional interaction of BRCA1-associated BARD1 with polyadenylation factor CstF-50". Science . 285 (5433): 1576–9. doi :10.1126/science.285.5433.1576 . PMID 10477523 . Scully R, Ganesan S, Vlasakova K, Chen J, Socolovsky M, Livingston DM (Dec 1999). "Genetic analysis of BRCA1 function in a defined tumor cell line" . Molecular Cell . 4 (6): 1093–9. doi :10.1016/S1097-2765(00)80238-5 PMID 10635334 . Yu X, Baer R (Jun 2000). "Nuclear localization and cell cycle-specific expression of CtIP, a protein that associates with the BRCA1 tumor suppressor" . The Journal of Biological Chemistry . 275 (24): 18541–9. doi :10.1074/jbc.M909494199 PMID 10764811 . Kleiman FE, Manley JL (Mar 2001). "The BARD1-CstF-50 interaction links mRNA 3' end formation to DNA damage and tumor suppression" . Cell . 104 (5): 743–53. doi :10.1016/S0092-8674(01)00270-7 PMID 11257228 . Hashizume R, Fukuda M, Maeda I, Nishikawa H, Oyake D, Yabuki Y, Ogata H, Ohta T (May 2001). "The RING heterodimer BRCA1-BARD1 is a ubiquitin ligase inactivated by a breast cancer-derived mutation" . The Journal of Biological Chemistry . 276 (18): 14537–40. doi :10.1074/jbc.C000881200 PMID 11278247 . Wang Q, Zhang H, Guerrette S, Chen J, Mazurek A, Wilson T, Slupianek A, Skorski T, Fishel R, Greene MI (Aug 2001). "Adenosine nucleotide modulates the physical interaction between hMSH2 and BRCA1" . Oncogene . 20 (34): 4640–9. doi :10.1038/sj.onc.1204625 PMID 11498787 . Chiba N, Parvin JD (Oct 2001). "Redistribution of BRCA1 among four different protein complexes following replication blockage" . The Journal of Biological Chemistry . 276 (42): 38549–54. doi :10.1074/jbc.M105227200 PMID 11504724 . Brzovic PS, Meza JE, King MC, Klevit RE (Nov 2001). "BRCA1 RING domain cancer-predisposing mutations. Structural consequences and effects on protein-protein interactions" . The Journal of Biological Chemistry . 276 (44): 41399–406. doi :10.1074/jbc.M106551200 PMID 11526114 .
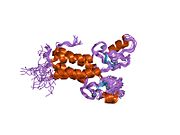
PDB 갤러리
1jm7 : BRCA1/BARD1 RING-도메인 헤테로다이머의 솔루션 구조