DNA 나노기술
DNA nanotechnologyDNA 나노기술은 기술 사용을 위한 인공 핵산 구조의 설계와 제조다.이 분야에서는 핵산이 살아있는 세포에서 유전정보의 매개체가 아니라 나노기술의 비생물공학 재료로 쓰인다.이 분야의 연구자들은 2차원 수정 격자, 나노튜브, 다면체, 임의 모양 등의 정적 구조와 분자 기계, DNA 컴퓨터 등의 기능적 장치를 만들어냈다.이 분야는 구조물을 결정하기 위한 X선 결정학 및 단백질의 핵자기공명 분광학 등에 응용하는 등 구조생물학과 생물물리학의 기초과학 문제를 해결하는 도구로 활용되기 시작하고 있다.분자규모 전자제품과 나노의학의 잠재적 응용도 조사되고 있다.
DNA 나노기술의 개념적 토대는 1980년대 초 나드리안 소먼에 의해 처음 마련되었으며, 2000년대 중반부터 이 분야가 폭넓은 관심을 끌기 시작했다.이러한 핵산의 사용은 그것의 엄격한 염기쌍성 규칙에 의해 가능하게 되는데, 이것은 보완적 염기서열을 가진 가닥의 부분만이 서로 결합하여 강하고 단단한 이중나선 구조를 형성하게 한다.이를 통해 정밀하게 제어되는 나노스케일 기능으로 복잡한 표적 구조를 형성하기 위해 선택적으로 조립되는 베이스 시퀀스의 합리적 설계를 할 수 있다.이러한 구조는 작은 구조에서 조립하는 타일 기반 구조, DNA 종이접기법을 이용한 접이식 구조, 가닥 변위법을 이용한 동적 재구성이 가능한 구조 등 여러 가지 조립 방법이 사용된다.이 분야의 명칭은 구체적으로 DNA를 언급하고 있지만, 다른 종류의 핵산에도 동일한 원리가 사용되어 왔기 때문에 대체명 핵산 나노기술이 가끔 사용되기도 했다.
기본 개념
핵산의 특성
나노기술은 종종 100나노미터 이하의 특징을 가진 물질과 장치를 연구하는 것으로 정의된다.특히 DNA 나노기술은 분자성분이 자연적으로 안정된 구조로 구성되는 상향식 분자 자가조립의 한 예로서, 이러한 구조의 특정한 형태는 설계자가 선택한 구성 요소의 물리적, 화학적 특성에 의해 유도된다.[4]DNA 나노기술에서, 성분 물질은 DNA와 같은 핵산의 가닥이다; 이 가닥들은 종종 합성되어 살아 있는 세포의 맥락 밖에서 사용된다.DNA는 두 핵산 가닥 사이의 결합이 잘 이해되는 단순한 염기쌍성 규칙에 따라 달라지기 때문에 나노 크기의 구조에 적합하며, 핵산 이중나선의 특정 나노 크기의 구조를 형성한다.이러한 품질은 핵산 설계를 통해 핵산 구조를 쉽게 조절할 수 있게 한다.단백질 설계가 매우 어려운 나노테크놀로지와 자체 특정 조립 능력이 부족한 나노입자 등 나노테크놀로지에 사용되는 다른 물질에는 이 특성이 없다.[5]
핵산 분자의 구조는 뉴클레오바제가 함유된 뉴클레오타이드의 배열로 구성된다.DNA에서 존재하는 네 가지 염기는 아데닌(A), 시토신(C), 구아닌(G), 티민(T)이다.핵산은 두 개의 시퀀스가 상호 보완적일 경우 두 개의 분자가 서로 결합하여 이중나선을 형성하는 성질을 가지고 있는데, 이는 두 개의 시퀀스가 서로 일치하는 염기쌍의 시퀀스를 형성한다는 것을 의미하며, A는 T에만, C는 G에만 결합한다.[5][6]정확히 일치하는 염기쌍의 형성은 정력적으로 유리하기 때문에, 핵산 가닥은 대부분의 경우 정확하게 쌍을 이룬 염기의 수를 최대화하는 순응에서 서로 결합할 것으로 예상된다.따라서 가닥 시스템의 염기서열은 쉽게 제어할 수 있는 방식으로 결합 패턴과 전체 구조를 결정한다.DNA 나노기술에서 가닥의 염기서열은 연구자들에 의해 합리적으로 설계되어 염기쌍의 상호작용은 가닥이 원하는 순응으로 조립되도록 한다.[3][5]DNA가 주로 사용되는 물질인 반면, RNA와 펩타이드 핵산(PNA)과 같은 다른 핵산을 포함하는 구조도 구축되었다.[7][8]
서브필드
DNA 나노기술은 때때로 구조 DNA 나노기술과 동적 DNA 나노기술이라는 두 개의 중첩된 하위 분야로 나뉜다.구조 DNA 나노기술은 SDN이라고 줄여 부르기도 하며, 정적 평형 종말 상태로 조립되는 핵산 복합체와 물질을 합성하고 특성화하는 데 초점을 맞추고 있다.반면 동적 DNA 나노기술은 화학적 자극이나 물리적 자극에 기반한 재구성 능력 등 유용한 비균형적 행동을 보이는 복합체에 초점을 맞추고 있다.핵산 나노기계장치와 같은 일부 복합체들은 구조적인 하위 영역과 동적 하위 영역의 특징을 모두 결합한다.[9][10]
구조 DNA 나노기술로 건설된 복합체들은 결합을 포함하는 위상학적으로 갈린 핵산 구조를 사용한다.(대조적으로 대부분의 생물학적 DNA는 갈지 않은 이중나선으로 존재한다.)가장 간단한 분기 구조 중 하나는 4개의 개별 DNA 가닥으로 구성된 4-팔 접합이며, 그 중 일부는 특정 패턴에서 보완된다.자연적인 홀리데이 결합과는 달리 인공적으로 움직이지 않는 4-팔 접합부의 각 팔은 염기서열이 달라 연결점이 일정한 위치에 고정되게 된다.두 교차점에서 도메인 사이에 개별 가닥이 교차하는 두 개의 평행 이중 나선 영역을 포함하는 널리 사용되는 DX 구조 모티브와 같이 동일한 복합체에서 다중 접합을 결합할 수 있다.각 교차점은 표면적으로는 4-암 접합점이지만 유연한 단일 4-암 접합점과는 대조적으로 하나의 방향으로 구속되어 있어 DX 모티브가 더 큰 DNA 복합체를 위한 구조 건물 블록으로 적합하게 만드는 강성을 제공한다.[3][5]
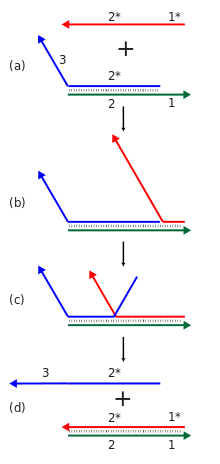
동적 DNA 나노기술은 토홀드 매개 스트랜드 변위라는 메커니즘을 사용하여 핵산 복합체가 새로운 핵산 스트랜드의 추가에 대응하여 재구성할 수 있도록 한다.이 반응에서 들어오는 가닥은 이중 가닥 단지의 단일 가닥 토홀드 영역에 묶인 다음 분지 이주 과정을 통해 원래 단지에 묶인 가닥 중 하나를 치환한다.전체적인 효과는 단지 내 한 가닥이 다른 가닥으로 교체되는 것이다.[9]또 화학반응을 수행할 수 있는 데옥시리보아제, 리보아제 등 기능성 핵산과 특정 단백질이나 작은 분자에 결합할 수 있는 압타머를 이용해 재구성 가능한 구조와 장치를 만들 수 있다.[11]
구조 DNA 나노기술
구조 DNA 나노기술은 SDN이라고 줄여 부르기도 하며, 조립체가 정적 평형 끝점을 갖는 핵산 복합체와 재료들을 합성하고 특성화하는 데 초점을 맞추고 있다.핵산 이중나선은 보다 복잡한 핵산 복합체의 구조를 시뮬레이션,[12] 예측 및 설계할 수 있는 견고하고 정의된 3차원 기하학을 가지고 있다.2차원 구조와 3차원 구조, 주기적 구조, 주기적 구조, 이산 구조 등 그러한 구조물이 많이 만들어졌다.[10]
확장 래티
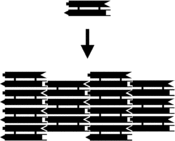
소형 핵산 복합체는 끈적끈적한 끝단을 장착할 수 있으며 개별 분자 타일의 특정 테셀레이트 패턴을 포함한 더 큰 2차원 주기 격자로 결합될 수 있다.[10]이것의 초기 예는 기본 타일로 DX 콤플렉스를 사용했는데, 각각 DX 유닛이 DNA의 본질적으로 단단한 2차원 결정체인 주기적인 2차원 평면 시트로 결합하도록 하는 시퀀스로 설계된 4개의 끈적끈적한 끝을 포함하고 있다.[16][17]홀리데이 분기점 룸버스 격자 [18]등 다른 모티브와 더블코션 방식을 활용한 다양한 DX 기반 배열도 2차원 배열로 제작됐다.[19][20]오른쪽 위의 두 이미지는 타일 기반 정기 격자의 예를 보여준다.
조립체가 특정 알고리즘을 구현하는 주기적 구조를 보여주기 위해 2차원 배열을 만들 수 있으며, 이는 하나의 형태의 DNA 컴퓨팅을 보여준다.[21]DX 타일은 끈적끈적한 엔드 시퀀스를 선택하여 왕 타일 역할을 하여 연산을 수행할 수 있다.어셈블리가 XOR 작동을 인코딩하는 DX 어레이. 이를 통해 DNA 어레이가 시어핀스키 개스킷이라고 알려진 프랙탈을 생성하는 셀룰러 자동화를 구현할 수 있다.오른쪽의 세 번째 이미지는 이러한 유형의 배열을 보여준다.[15]또 다른 시스템은 이진 카운터의 기능을 가지고 있는데, 이것은 커짐에 따라 이진수가 증가하는 표현을 보여준다.이러한 결과는 연산이 DNA 배열의 조립에 통합될 수 있음을 보여준다.[22]
DX 어레이는 직경 4~20nm의 중공 나노튜브를 형성하도록 제작되었으며, 기본적으로 스스로 구부러지는 2차원 격자를 형성한다.[23]이러한 DNA 나노튜브는 탄소 나노튜브와 크기와 모양이 다소 유사하며, 탄소 나노튜브의 전기 전도성이 부족한 반면 DNA 나노튜브는 더 쉽게 변형되어 다른 구조와 연결된다.DNA 나노튜브를 만드는 많은 방법들 중 하나는 스스로 휘어져 튜브로 닫히는 곡선의 DX 타일의 격자를 사용한다.[24]단일 가닥 타일을 사용하여 둘레를 모듈식으로 단순하게 지정할 수 있는 대안적 방법에서 관의 강성은 급발진 특성이다.[25]
DNA의 3차원 격자를 형성하는 것이 DNA 나노기술의 초기 목표였지만, 이것이 실현되기 가장 어려운 목표 중 하나라는 것이 증명되었다.긴장력과 압축력의 균형인 긴장감 개념을 모티브로 한 성공이 2009년에 마침내 보고되었다.[21][26]
이산 구조물
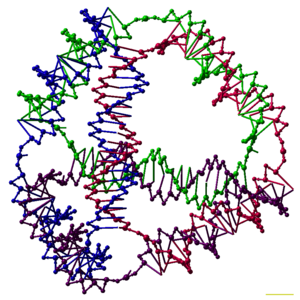
연구자들은 입방체나 팔면체처럼 각각 다면체의 연결성을 갖는 많은 3차원 DNA 콤플렉스를 합성했는데, 이는 DNA 듀플렉스들이 각 정점에 DNA 접합부가 있는 다면체의 가장자리를 추적한다는 것을 의미한다.[27]DNA 다면체의 초기 시연은 매우 작업 집약적이었으며, 강직화된 다면체를 생성하기 위해 다중 결합과 고체 위상 합성 단계가 필요했다.[28]그 후의 작업에서는 합성이 훨씬 쉬운 다면체(다면체)를 산출했다.여기에는 올바른 순응으로 접히도록 설계된 긴 단일 가닥으로 만들어진 DNA 8각형,[29] 이 글의 상단에 그려진 4개의 DNA 가닥으로부터 한 번에 생산될 수 있는 4각형이 포함된다.[1]
임의의, 비정기적인 형태의 나노 구조는 대개 DNA 종이접기 방법을 사용하여 만들어진다.이들 구조물은 "스캐플드"로서 길고 자연적인 바이러스 가닥으로 구성되어 있는데, 이것은 계산적으로 설계된 짧은 "스테이플" 가닥에 의해 원하는 모양으로 접히도록 만들어졌다.이 방법은 대부분의 다른 DNA 나노기술 방법처럼 염기서열이 비계 가닥 순서에 의해 미리 결정되기 때문에 설계가 용이하고 높은 스트랜드 순도와 정확한 스토이치측정법이 필요하지 않다는 장점이 있다.DNA 종이접기는 웃는 얼굴, 서반구의 거친 지도, 모나리자 그림 등 2차원 형상에 대해 처음 시연되었다.[27][30][31]단단한 3차원 구조는 벌집형 패턴으로 배열된 평행 DNA 나선형을 이용해 만들 수 있고,[32] 2차원 얼굴을 가진 구조물은 판지상자와 마찬가지로 속이 빈 전체 3차원 형태로 접히는 구조도 만들 수 있다.이것들은 자극에 반응하여 분자 화물을 열고 드러내거나 방출하도록 프로그램될 수 있으며, 프로그래밍 가능한 분자 우리로서 잠재적으로 유용하게 만든다.[33][34]
템플리트 조립체
핵산 구조는 핵산 이외의 분자를 통합하기 위해 만들어질 수 있는데, 단백질, 금속 나노입자, 양자점, 아민,[35] 풀레렌 등을 포함한 이질원소라고도 한다.이것은 핵산만으로 가능한 것보다 훨씬 더 큰 기능성을 가진 물질과 장치의 건설을 가능하게 한다.목표는 핵산 구조물의 자체 조립체를 사용하여 그 위에 호스팅되는 나노입자의 조립체를 형상화하여 그들의 위치와 경우에 따라 방향을 조절하는 것이다.[27][36]이 방법들 중 많은 것은 아미드 또는 티올 기능 그룹이 있는 올리고뉴클레오티드를 이단 원소를 결합하는 화학적 핸들로 사용하여 공동의 부착 체계를 사용한다.이 공동 결합 방식은 DX 기반 배열에서 금 나노입자를 배열하고,[37] 스트렙타비딘 단백질 분자를 DX 배열의 특정 패턴으로 배열하는 데 사용되어 왔다.[38]DX 배열의 Dervan polyamides를 사용한 비 공동 호스팅 체계는 DX 배열의 특정 패턴에 스트렙타비딘 단백질을 배열하는 데 사용되었다.[39]탄소 나노튜브는 조립체가 탄소 나노튜브의 전계효과 트랜지스터인 분자 전자 소자의 역할을 할 수 있는 패턴으로 DNA 배열에서 호스트되어 왔다.[40]또한 핵산 금속화 방법으로는 핵산을 원래의 핵산 구조의 일반적인 형태를 가정하는 금속으로 대체하는 방법,[41] 핵산 나노구조체를 석판화 마스크로 사용하여 그 패턴을 고체 표면으로 옮기는 계획 등이 있다.[42]
동적 DNA 나노기술
다이나믹 DNA 나노기술은 계산과 기계적인 움직임과 같은 전체적인 구조와 관련된 동적 기능을 가진 핵산 시스템 형성에 초점을 맞추고 있다.구조적인 DNA 나노기술과 동적 DNA 나노기술 사이에는 어느 정도 겹치는 부분이 있는데, 이는 구조물이 어닐링을 통해 형성되었다가 동적으로 재구성되거나 애초에 동적으로 형성되도록 만들어질 수 있기 때문이다.[27][43]
나노기계장치
DNA 콤플렉스는 어떤 자극에 따라 순응을 변화시켜 나노로보틱스의 한 형태로 만들어진다.이러한 구조는 구조 DNA 나노기술에서 만들어진 정적 구조와 동일한 방식으로 초기에 형성되지만 초기 조립 후에 동적 재구성이 가능하도록 설계된다.[9][43]그러한 장치는 B-DNA 형태와 Z-DNA 형태 사이의 전환을 이용하여 비틀림 동작을 수행함으로써 완충조건의 변화에 대응하였다.[44]버퍼 조건에 대한 이러한 의존으로 인해 모든 장치가 동시에 상태를 변경하게 되었다.후속 시스템은 제어 가닥의 존재에 따라 상태를 변경하여 여러 장치를 솔루션에서 독립적으로 작동할 수 있다.는 열린 이런 시스템의 몇가지 예들은"분자 핀셋"디자인과paranemic-crossover(PX)형태에서 double-junction(JX2)형태에 process,[46]에 회전 운동과 동적으로 및 계약 반응에를 확대할 수 있는 2차원 배열을 바꿀 수 있는 폐쇄된 state,[45]는 장치이다. cont에가닥을 [47]뒹굴다또한 역동적으로 열리거나 닫히는 구조들이 만들어졌고, 열리면 기능적인 화물을 방출하거나 드러낼 수 있는 분자 케이지의 역할을 할 가능성이 있다.[33][48][49]
DNA 워커는 선형 선로를 따라 방향 운동을 보이는 핵산 나노마치의 일종이다.많은 계획이 입증되었다.[43]한 가지 전략은 순서에 따라 수동으로 추가해야 하는 제어 가닥을 사용하여 트랙을 따라 걷는 사람의 움직임을 제어하는 것이다.[50][51]또한 다른 파장의 빛으로 조사함으로써 DNA 보행기의 개별적인 단계를 조절하는 것도 가능하다.[52]또 다른 접근법은 제한 효소나 디옥시리보아제를 사용하여 가닥을 잘라서 보행자가 앞으로 나아가게 하는 것으로, 이는 자율적으로 달리는 장점이 있다.[53][54]이후 시스템은 선형 선로가 아닌 2차원 표면을 걸을 수 있었고, 분자 화물을 선택적으로 집어서 이동할 수 있는 능력을 보여주었다.[55]2018년에는 부착된 T7 RNA 중합효소에 의해 롤링원 전사를 사용하는 포탄화된 DNA가 생성된 RNA Strand에 의해 유도된 DNA 경로를 따라 걷는 것으로 나타났다.[56]또한, 보행자가 트랙을 따라 전진할 때 DNA-템플 합성을 수행하는 선형 보행기가 입증되어 보행자가 지시하는 자율적인 다단계 화학 합성이 가능해졌다.[57]합성 DNA 워커의 기능은 디네인과 키네신의 단백질과 비슷하다.[58]
스트랜드 변위 계단식 계단식
Strand 변위 반응의 계단식 변위 반응은 계산적 또는 구조적인 목적으로 사용될 수 있다.개별 스트랜드 변위 반응은 일부 이니시에이터 스트랜드의 존재에 대응하여 새로운 시퀀스를 밝히는 것을 포함한다.그러한 많은 반응은 한 반응의 새로 드러난 출력 시퀀스가 다른 곳에서 또 다른 스트랜드 변위 반응을 일으킬 수 있는 계단식으로 연결될 수 있다.이를 통해 복잡한 계산 및 정보 처리 능력을 보여줌으로써 많은 구성요소를 가진 화학 반응 네트워크를 구축할 수 있다.이러한 계단식 폭포는 새로운 염기쌍의 형성과 분해반응으로 얻는 엔트로피 이득을 통해 에너지적으로 유리하게 만들어진다.스트랜드 변위 계단식 계단참은 표준 핵산 조립체의 열적 아닐링 스텝 요구 조건과 대조적으로 조립체 또는 계산 프로세스의 등온 작동을 허용하며, 열적 아닐링 스텝에 대한 요구 조건과는 대조적으로, 원하는 구조의 적절한 형성을 보장한다.또한 이니시에이터 종의 촉매 기능을 지원할 수 있으며, 여기서 이니시에이터와 동등한 1개 미만이 반응을 완료로 유도할 수 있다.[9][59]
Strand 변위 콤플렉스는 분자 논리 관문을 복잡한 계산이 가능하도록 만드는 데 사용될 수 있다.[60]전류를 입력과 출력으로 사용하는 기존의 전자 컴퓨터와 달리 분자 컴퓨터는 특정 화학종의 농도를 신호로 사용한다.핵산 가닥 변위 회로의 경우 신호는 변위 복합체의 다른 가닥에 결합 및 결합 해제 이벤트에 의해 방출되거나 소비되는 핵산 가닥의 존재다.이 접근방식은 AND, OR, NOT 게이트와 같은 논리 게이트를 만드는 데 사용되어 왔다.[61]좀 더 최근에는, 130개의 DNA 가닥을 포함하는 관문 시스템을 사용하여 정수의 제곱근을 계산할 수 있는 4비트 회로가 시연되었다.[62]
또 다른 스트랜드 변위 계단식 계단식 사용은 역동적으로 조립된 구조물을 만드는 것이다.이들은 반응제용 헤어핀 구조를 사용하기 때문에 입력 가닥이 결합할 때 새로 드러난 순서는 분해하기보다는 같은 분자에 놓여 있다.이것은 새로 연 헤어핀이 성장하는 콤플렉스에 추가될 수 있게 해준다.이 접근방식은 3-팔과 4-팔 접합부와 덴드리머와 같은 간단한 구조를 만드는 데 사용되어 왔다.[59]
적용들
DNA 나노기술은 나노 크기의 특징을 정밀하게 제어하여 설계되고 복잡한 구조를 형성하는 몇 안 되는 방법 중 하나를 제공한다.이 분야는 구조생물학과 생물물리학의 기초과학 문제를 해결하기 위한 응용이 시작되고 있다.그 분야에 대해, 그리고 아직 개발 중에 있는, 그러한 응용은 결정학에 있어서, 고립되어 결정화되기 어려운 분자들을 3차원 핵산 격자 안에 배열하여 그 구조를 결정할 수 있도록 할 수 있다.또 다른 적용은 단백질 NMR 분광학에서 잔류 이극 결합 실험에서 액체 결정을 대체하기 위해 DNA 종이접기 로드를 사용하는 것이다; DNA 종이접기를 사용하는 것은 액체 결정과 달리, 용액에서 막 단백질을 고정하는 데 필요한 세제에 내성이 있기 때문에 유리하다.DNA 워커는 나노 입자를 이동시키고 직접 화학 합성을 위해 나노 크기의 조립 라인으로 사용되어 왔다.또한, DNA 종이접기 구조는 효소 기능과 단백질 접힘의 생물물리학적 연구에 도움을 주었다.[10][63]
DNA 나노기술은 잠재적인 실제 응용 분야로 이동하고 있다.다른 분자를 배열하는 핵산 배열의 능력은 분자 척도 전자공학에서 그것의 잠재적인 응용을 나타낸다.핵산 구조물의 조립은 분자 전선과 같은 분자 전자 소자의 조립을 템플릿으로 만들기 위해 사용될 수 있으며, 분자 빵판에 유사한 장치의 배치와 전체적인 구조를 나노미터 단위로 제어하는 방법을 제공할 수 있다.[10][27]DNA 나노기술은 그 재료 특성에 연산이 결합되기 때문에 프로그램 가능한 물질의 개념과 비교되어 왔다.[64]
아루스 대학교의 iNO와 CDNA 센터의 과학자 그룹이 수행한 연구에서, 연구원들은 작은 멀티스위치형 3D DNA 박스 오리가미를 만들 수 있었다.제안된 나노입자는 원자력 현미경(AFM), 전송전자현미경(TEM), Förster 공명 에너지 전달(FRET)이 특징이었다.생성된 상자는 고유한 은둔 메커니즘을 가지고 있는 것으로 보여져, 고유한 DNA 또는 RNA 키 집합에 반응하여 반복적으로 열고 닫을 수 있었다.저자들은 "DNA 장치는 단일 분자의 기능 제어, 약물 전달 제어, 분자 컴퓨팅과 같은 광범위한 응용 분야에 잠재적으로 사용될 수 있다"[65]고 제안했다.
나노의학의 DNA 나노기술은 생체적합한 형태로 연산을 수행할 수 있는 능력을 활용하여 표적 약물 전달과 진단 응용을 위한 "스마트 약물"을 만들 수 있다.조사되고 있는 그러한 시스템 중 하나는 세포사멸을 유도하는 단백질이 들어 있는 속이 빈 DNA 박스를 사용하며, 이는 암세포에 가까이 있을 때만 열린다.[63][66]이러한 복잡한 구조물이 세포질에서 효율적으로 접히거나 조립할 수 있는지는 알 수 없지만, 대부분 조립을 위해 전사된 RNA를 사용하는 공학적 살아있는 박테리아 세포에서 이러한 인공 구조를 표현하는 데 관심이 더해져 왔다.만약 성공한다면, 이것은 핵산 나노구조의 방향 진화를 가능하게 할 수 있을 것이다.[27]옥스퍼드 대학의 과학자들은 네 가닥의 짧은 합성 DNA가 세포에 들어가 적어도 48시간 동안 생존할 수 있는 우리에 자체 조립되었다고 보고했다.이틀 뒤 세포 효소의 공격에도 불구하고 배양된 인간의 신장 세포에는 형광물질로 표시된 DNA 사면체가 그대로 남아 있는 것으로 밝혀졌다.이 실험은 DNA '케이지'를 이용하여 살아있는 세포 내부의 약물 전달 가능성을 보여주었다.[67][68]마우스 모델에서 RNA 간섭(RNA Interference, RNAi)을 전달하기 위해 DNA 사면체가 사용되었다고 MIT 연구팀이 보고했다. 치료를 위한 간섭 RNA의 전달은 폴리머나 지질 등을 사용하여 어느 정도 성공을 거두었지만, 혈류에서 짧은 저장 수명과 더불어 안전과 부정확한 타겟팅의 한계가 있다.연구팀이 만든 DNA 나노구조는 4면체를 형성하기 위해 6개의 DNA 가닥으로 구성되며, 6개의 가장자리 각각에 1개의 RNA 가닥이 부착되어 있다.사면체는 DNA 나노입자를 일부 종양에서 발견되는 풍부한 엽산 수용체로 이끄는 세 개의 엽산 분자인 단백질을 대상으로 하는 기능을 추가로 갖추고 있다.그 결과 RNAi가 표적으로 삼은 유전자 발현인 루시퍼아제가 절반 이상 떨어진 것으로 나타났다.이 연구는 DNA 나노기술을 새로운 RNA 간섭 기술을 이용한 치료의 효과적인 도구로 사용하는 가능성을 보여준다.[69][70]DNA 사면체 또한 다약 저항 현상을 극복하기 위한 노력으로 사용되었다.독소루비신(DOX)은 사면체와 결합해 P-글리코프로틴 약물유출펌프가 들어 있는 MCF-7 유방암 세포에 실렸다.실험 결과는 DOX가 퍼지지 않고 있고 암세포의 세포사멸이 달성되었다는 것을 보여주었다.DOX가 없는 사면체는 생체적합성을 시험하기 위해 세포에 실렸고, 구조는 세포독성 그 자체도 보이지 않았다.[71]DNA 사면체는 진단 목적으로 세포 내 단백질의 아세포 발현과 분포를 프로파일링하는 바코드로도 사용되었다.사면체 나노 구조는 라벨링 효율과 안정성이 높아져 신호가 개선된 것으로 나타났다.[72]
나노의학의 DNA 나노기술 적용도 DNA 나노구조를 설계해 자연적으로 발생하는 막 단백질의 구조와 기능을 모방하는 데 초점을 맞추고 있다.랭커 등은 2012년 소수성 콜레스테롤 수정을 통해 지질막에 자가 삽입하고 이온 전류를 막을 가로질러 유도할 수 있는 모공 모양의 DNA 종이접기 구조를 도입했다.[73]이 합성 DNA 이온 채널의 첫 번째 시연은 단일 DNA 듀플렉스부터 작은 타일 기반 구조,[74][75][76][77][78][79] 대형 DNA 종이접기 트랜섬브레인 포린에 이르기까지 다양한 모공 유도 설계가 뒤따랐다.[80]자연적으로 발생하는 단백질 이온 채널과 유사하게, 합성 DNA로 만들어진 이 앙상블은 전도성의 여러 가지 순서에 걸쳐 있다.멤브레인 삽입 단일 DNA 듀플렉스 연구는 이온이 지질 빌레이어를 통과하도록 하는 설계에 중심 채널 루멘이 없기 때문에 DNA-립체 인터페이스에서도 전류가 흐를 수 밖에 없다는 것을 보여주었다.이는 DNA에 막이 삽입된 부분을 향하도록 지질 그룹들이 방향을 바꾸면서 DNA가 유도하는 지질 모공에는 원통형이 아닌 토로이드 모양이 있음을 나타낸다.[74]그 후 케임브리지 대학교와 일리노이 대학교 어바나 샴페인의 연구원들은 그러한 DNA 유도 토로이드 모공이 지질 빌리더 전단지 사이의 급속한 지질 플립플롭을 촉진할 수 있다는 것을 증명했다.이들은 이런 효과를 활용해 자연적으로 발생하는 스크램블라제라는 단백질보다 더 빨리 크기의 생물학적 막 주문에 지질을 날리는 합성 DNA 구축 효소를 설계했다.[81]이 개발은 개인화된 약물과 치료법을 위한 합성 DNA 나노 구조의 가능성을 강조한다.
디자인
DNA 나노구조는 개별 핵산 가닥이 원하는 구조로 조립되도록 합리적으로 설계해야 한다.이 과정은 대개 원하는 목표 구조물이나 기능의 규격으로 시작한다.그런 다음 대상 복합체의 전반적인 이차 구조를 결정하여 구조 내 핵산 가닥의 배열과 그 가닥의 어느 부분을 서로 묶어야 하는지를 명시한다.마지막 단계는 1차 구조 설계로, 각 핵산 가닥의 실제 염기서열 명세서다.[23][82]
구조설계
핵산 나노구조 설계의 첫 번째 단계는 주어진 구조가 핵산 가닥의 특정한 배열로 어떻게 표현되어야 하는지를 결정하는 것이다.이 설계 단계는 2차 구조 또는 개별 가닥을 원하는 형태로 함께 고정하는 베이스 쌍의 위치를 결정한다.[23]다음과 같은 몇 가지 접근방식이 입증되었다.
- 타일 기반 구조.이 접근방식은 각 단위에 포함된 가닥들 사이에 강한 결합을 가진 작은 단위로 목표 구조를 세분화하고 단위들 간의 상호작용이 약하다.주기적인 격자를 만드는 데 종종 사용되지만, 알고리즘 자체 조립을 구현하는 데도 사용될 수 있어 DNA 컴퓨팅의 플랫폼이 되고 있다.이는 1990년대 중반부터 2000년대 중반까지 DNA 종이접기 방법론이 개발될 때까지 사용된 지배적인 설계 전략이었다.[23][83]
- 접히는 구조물.타일 기반 접근방식의 대안인 접기 접근방식은 나노 구조를 긴 가닥으로 만들 수 있는데, 나노 구조는 자신과의 상호작용 때문에 접히는 설계 순서를 가질 수도 있고, 더 짧은 "스태플" 가닥을 사용하여 원하는 모양으로 접을 수도 있다.이 후자의 방법을 DNA 종이접기라고 하는데, 이는 나노 크기의 2차원 및 3차원 형상을 형성할 수 있다(위의 이산 구조 참조).[27][30]
- 동적 어셈블리.이 접근방식은 최종 제품 외에 반응 메커니즘의 모든 중간 단계를 명시하면서 DNA 자체 조립의 운동학을 직접 제어한다.이는 헤어핀 구조를 채택한 시작 재료를 사용하여 수행되며, 이 재료들은 특정한 순서로 계단식 반응으로 최종 순응으로 조립된다(아래 스트랜드 변위 계단식 참조).이 접근방식은 일정한 온도에서 반대 방향으로 진행할 수 있는 장점이 있다.이는 조립을 촉발하고 원하는 구조의 적절한 형성을 선호하기 위해 온도 변화가 필요한 열역학적 접근방식과는 대조적이다.[27][59]
시퀀스 설계
대상 단지의 이차 구조를 설계하기 위해 위의 접근법 중 하나를 사용한 후에는 원하는 구조로 형성될 실제 핵물질의 순서를 고안해야 한다.핵산 설계는 특정 핵산 염기서열을 각 구조물의 구성 가닥에 할당하여 그것들이 원하는 순응에 연결되도록 하는 과정이다.대부분의 방법은 대상 구조가 가장 낮은 에너지를 가지도록 시퀀스를 설계하는 목표를 가지고 있으며, 따라서 열역학적으로 가장 유리한 반면 잘못 조립된 구조는 더 높은 에너지를 가지므로 바람직하지 않다.이것은 시퀀스 대칭 최소화 같은 단순하고 빠른 경험적 접근법을 통해서 또는 보다 정확하지만 느리고 계산적으로 집약적인 완전 근접한 열역학 모델을 사용하여 이루어진다.기하학적 모델은 나노 구조물의 3차 구조를 검사하고 콤플렉스가 과도하게 변형되지 않도록 하기 위해 사용된다.[82][84]
핵산 설계는 단백질 설계와 유사한 목표를 가지고 있다.둘 다에서, 모노머의 순서는 원하는 목표 구조를 선호하고 다른 구조를 선호하지 않도록 설계된다.핵산 설계는 간단한 염기쌍성 규칙은 구조물의 에너지적인 호감도를 예측하기에 충분하고 구조물의 전체적인 3차원 접힘에 대한 자세한 정보가 필요하지 않기 때문에 단백질 설계보다 연산적으로 훨씬 쉽다는 장점이 있다.이를 통해 실험적으로 강력한 설계를 산출하는 단순한 경험적 경험적 접근법을 사용할 수 있다.핵산 구조는 복잡한 구조로 접히는 단백질의 능력 증가와 20개의 단백질 유발 아미노산에 비해 4개의 뉴클레오티드의 화학적 다양성이 제한되어 기능상 단백질보다 덜 다용성이 있다.[84]
자재와 방법
표적 구조를 구성하는 DNA 가닥의 순서는 분자 모델링과 열역학 모델링 소프트웨어를 사용하여 계산적으로 설계된다.[82][84]그 후 핵산 자체는 표준 올리고뉴클레오티드 합성법을 사용하여 합성되며, 보통 올리고뉴클레오티드 합성기에서 자동화되며, 일련의 맞춤형 시퀀스들이 상업적으로 이용 가능하다.[85]Strand는 필요시 변성겔전기영양증(denaturing gel electrophoresis)에 의해 정제될 수 있으며,[86] 자외선 흡광도 분광법을 이용하여 여러 핵산 정량법을 통해 정밀한 농도를 결정할 수 있다.[87]
완전하게 형성된 표적 구조는 핵산 복합체에 대한 크기와 모양 정보를 제공하는 네이티브 젤 전기영동법을 사용하여 검증할 수 있다.전기영동성 이동성 이동성 측정은 구조물이 원하는 모든 가닥을 포함하는지 여부를 평가할 수 있다.[88]형광 라벨링과 FRET(Forrster Community Energy Transfer)는 복합체의 구조를 특성화하기 위해 사용되기도 한다.[89]
핵산 구조는 확장된 2차원 구조물에 잘 적합하지만, 현미경 끝과 취약한 핵산 구조와의 상호작용 때문에 이산 3차원 구조에는 유용하지 않다; 전송 전자 현미경 및 극저온 전자 현미경 검사는 종종 있다.이 경우에 사용된다.확장된 3차원 격자는 X선 결정학에 의해 분석된다.[90][91]
역사

DNA 나노기술의 개념적 토대는 1980년대 초 나드리안 소먼에 의해 처음 만들어졌다.[92]수만의 원래 동기는 다른 큰 분자의 방향을 정하기 위한 3차원 DNA 격자를 만드는 것이었는데, 이것은 순결정을 얻는 어려운 과정을 제거함으로써 그들의 결정학적 연구를 단순화시킬 수 있을 것이다.이 아이디어는 1980년 말 M. C. 에셔의 목판화 깊이와 일련의 DNA 6-팔 접합 사이의 유사성을 깨달은 후 그에게 떠올랐다고 한다.[3][93]당시 DNA복제포크와 이동식 홀리데이 분기점 등 몇 가지 자연 분기 DNA 구조가 알려져 있었지만, 조립된 분자의 대칭성을 제거하기 위해 가닥 시퀀스를 적절히 설계함으로써 움직일 수 있는 핵산 결합이 만들어질 수 있고, 이러한 움직이지 않는 결합이 프린트로도 가능하다는 것이 서먼의 통찰이었다.ciple을 견고한 결정 격자로 결합하다.이 계획을 제안하는 최초의 이론 논문은 1982년에 발표되었고, 움직이지 않는 DNA 접합에 대한 최초의 실험적인 실증 실험은 이듬해 발표되었다.[5][27]
1991년, Thoman의 실험실은 그가 1995년 파인만 나노기술 상을 받은 최초의 합성 3차원 핵산 나노구조인 DNA로 만들어진 큐브 합성에 관한 보고서를 발표했다.이것은 DNA가 잘린 옥타헤드론이 뒤따랐다.이러한 구조물들, 즉 융통성 있는 접합부를 정점으로 하는 다각형 모양들이 확장된 3차원 격자를 형성할 만큼 충분히 견고하지 않다는 것이 곧 분명해졌다.수만은 보다 단단한 DX(Double-Crossover) 구조 모티브를 개발하였고, 1998년 에릭 윈프리와 협력하여 DX 타일의 2차원 격자 창조를 발표했다.[3][92][94]이러한 타일을 기반으로 한 구조물은 DNA 컴퓨팅을 구현할 수 있는 능력을 제공한다는 장점이 있었는데, 윈프리(Winfree)와 폴 로테문드(Paul Rotemund)는 2004년 논문에서 시에르핀스키 개스킷 구조의 알고리즘 자가 조립에 대해 입증했으며, 2006년 파인만상을 나노기술 부문에서 공유했다.Winfree의 핵심 통찰은 DX 타일을 왕 타일로 사용할 수 있다는 것으로, 이들의 조립이 연산을 수행할 수 있다는 것을 의미한다.[92]3차원 격자 합성은 그가 그것을 성취하기 위해 나선 지 거의 30년이 지난 2009년에 마침내 서맨에 의해 출판되었다.[63]
2000년대 내내 설계된 DNA 구조에 대한 새로운 능력이 계속해서 발견되었다.입력에 대응하여 그 구조를 바꾸는 모티브인 최초의 DNA 나노마치는 1999년 Syman에 의해 입증되었다.토오홀드 매개 스트랜드 변위를 사용한 최초의 핵산 소자였던 개선된 시스템이 이듬해 베르나르 유르케에 의해 입증되었다.그 다음 진전은 이것을 기계적인 움직임으로 번역하는 것이었고, 2004년과 2005년에는 수난, 나일즈 피어스, 앤드류 터버필드, 청드 마오 등의 그룹에 의해 여러 개의 DNA 워커 시스템이 실증되었다.[43]1987년 브루체 로빈슨과 투먼이 처음 제안한 나노입자와 단백질과 같은 다른 분자의 조립을 템플릿으로 만들기 위해 DNA 배열을 사용하는 아이디어는 2002년 투먼, 키엘 외 다른 [96]많은 그룹에 의해 입증되었다.[95]
2006년, 로테문트는 처음으로 임의모양의 접힌 DNA 구조를 쉽고 강력하게 형성하기 위한 DNA 종이접기법을 시연했다.로테문트는 이 방법이 많은 짧은 가닥을 사용한 스마얀의 DX 격자와 대부분 아주 긴 가닥으로 구성된 윌리엄 시크의 DNA 옥타헤드론 사이에 개념적으로 중간이라고 생각해 왔다.로테문트의 DNA 종이접기는 접히는 긴 가닥을 포함하고 있는데, 이 가닥은 몇 가닥의 짧은 가닥에 의해 도움을 받는다.이 방법은 이전에 가능했던 것보다 훨씬 더 큰 구조물을 형성할 수 있었고, 설계와 합성이 기술적으로 덜 요구되었다.[94]DNA 종이접기는 2006년 3월 15일 자연의 표지 이야기였다.[30]로테문트의 2차원 DNA 종이접기 구조를 실증한 연구는 2009년 더글러스 외 연구진이 고체 3차원 DNA 종이접기를 실증한 데 이어,[32] 요르겐 젬스와 얀 연구소는 2차원 면으로 만들어진 속이 빈 3차원 구조를 실증했다.[63]
DNA 나노기술은 핵산을 구조물을 쌓고 연산을 하기 위한 재료로 비생물학적으로 사용하는 특이한 점, 그리고 그 분야의 능력을 확장시켰지만 실제 적용과는 거리가 먼 원리 실험의 입증의 우세함 때문에 처음에는 회의론에 부딪혔다.1991년 수만의 DNA 큐브 합성에 관한 논문은 한 비평가는 그것의 독창성을 칭찬했고 다른 비평가는 그것의 생물학적 관련성이 없다고 비판한 후 사이언스지에 의해 거절당했다.[97]2010년대 초까지 이 분야는 기초과학연구 신청이 실현되기 시작하고, 의학과 다른 분야의 실용적 응용이 실현 가능하다고 여겨지기 시작할 정도로 능력을 높인 것으로 평가되었다.[63][98]이 분야는 2001년 극소수의 활동 연구소에서 2010년 최소 60개 연구소로 성장했고, 이는 인재 풀을 늘렸으며, 따라서 그 10년 동안 이 분야의 과학 발전 수를 증가시켰다.[21]
참고 항목
참조
- ^ a b DNA 다면체:Goodman RP, Schaap IA, Tardin CF, Erben CM, Berry RM, Schmidt CF, Turberfield AJ (December 2005). "Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication". Science. 310 (5754): 1661–1665. Bibcode:2005Sci...310.1661G. doi:10.1126/science.1120367. PMID 16339440. S2CID 13678773.
- ^ a b c 개요:
- ^ a b c d e 개요:
- ^ 배경:
- ^ a b c d e 개요:
- ^ 배경:
- ^ RNA 나노기술:
- ^ RNA 나노기술:
- ^ a b c d 동적 DNA 나노 기술:
- ^ a b c d e 구조 DNA 나노기술:
- ^ 동적 DNA 나노 기술:
- ^ DNA 구조 시뮬레이션:
- ^ 기타 배열:
- ^ Yan H, Park SH, Finkelstein G, Reif JH, LaBean TH (September 2003). "DNA-templated self-assembly of protein arrays and highly conductive nanowires". Science. 301 (5641): 1882–1884. Bibcode:2003Sci...301.1882Y. doi:10.1126/science.1089389. PMID 14512621. S2CID 137635908.
- ^ a b 알고리즘 자가 조립:
- ^ DX 어레이:
- ^ DX 어레이:
- ^ 기타 배열:
- ^ 기타 배열:
- ^ 기타 배열:
- ^ a b c 기록:
- ^ 알고리즘 자가 조립:
- ^ a b c d 설계:
- ^ DNA 나노튜브:
- ^ DNA 나노튜브:
- ^ 3차원 배열:
- ^ a b c d e f g h i 개요:
- ^ DNA 다면체:
- ^ DNA 다면체:
- ^ a b c DNA 종이접기:
- ^ Tikhomirov G, Petersen P, Qian L (December 2017). "Fractal assembly of micrometre-scale DNA origami arrays with arbitrary patterns". Nature. 552 (7683): 67–71. Bibcode:2017Natur.552...67T. doi:10.1038/nature24655. PMID 29219965. S2CID 4455780.
- ^ a b DNA 종이접기:
- ^ a b DNA 상자:
- ^ DNA 상자:
- ^ Zaborova, O. V.; Voinova, A. D.; Shmykov, B. D.; Sergeyev, V. G. "Solid Lipid Nanoparticles for the Nucleic Acid Encapsulation". Reviews and Advances in Chemistry. 11 (3–4): 178–188. doi:10.1134/S2079978021030055. ISSN 2634-8276.
- ^ 개요:
- ^ 나노 아키텍처:
- ^ 나노 아키텍처:
- ^ 나노 아키텍처:
- ^ 나노 아키텍처:
- ^ 나노 아키텍처:
- ^ 나노 아키텍처:
- ^ a b c d DNA 기계:
- ^ DNA 기계:
- ^ DNA 기계:
- ^ DNA 기계:
- ^ DNA 기계:
- ^ DNA 기계:
- ^ 응용 프로그램:
- ^ DNA 워커:
- ^ DNA 워커:
- ^ DNA 워커:
- ^ DNA 워커:
- ^ DNA 워커:
- ^ 기능성 DNA 워커:
- ^ 기능성 DNA 워커:
- ^ 기능성 DNA 워커:
- ^ Pan J, Li F, Cha TG, Chen H, Choi JH (August 2015). "Recent progress on DNA based walkers". Current Opinion in Biotechnology. 34: 56–64. doi:10.1016/j.copbio.2014.11.017. PMID 25498478.
- ^ a b c 키네틱 조립체:
- ^ DNA 기반 퍼지 및 부울 논리 게이트:
- ^ 스트랜드 변위 계단식:
- ^ 스트랜드 변위 계단식:
- ^ a b c d e 기록/응용 프로그램:
- ^ 응용 프로그램:
- ^ Zadegan RM, Jepsen MD, Thomsen KE, Okholm AH, Schaffert DH, Andersen ES, et al. (November 2012). "Construction of a 4 zeptoliters switchable 3D DNA box origami". ACS Nano. 6 (11): 10050–10053. doi:10.1021/nn303767b. PMID 23030709.
- ^ 응용 프로그램:
- ^ Lovy, Howard (5 July 2011). "DNA cages can unleash meds inside cells". fiercedrugdelivery.com. Retrieved 22 September 2013.
- ^ Walsh AS, Yin H, Erben CM, Wood MJ, Turberfield AJ (July 2011). "DNA cage delivery to mammalian cells". ACS Nano. 5 (7): 5427–5432. doi:10.1021/nn2005574. PMID 21696187.
- ^ Trafton, Anne (4 June 2012). "Researchers achieve RNA interference, in a lighter package". MIT News. Retrieved 22 September 2013.
- ^ Lee H, Lytton-Jean AK, Chen Y, Love KT, Park AI, Karagiannis ED, et al. (June 2012). "Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery". Nature Nanotechnology. 7 (6): 389–393. Bibcode:2012NatNa...7..389L. doi:10.1038/NNANO.2012.73. PMC 3898745. PMID 22659608.
- ^ Kim KR, Kim DR, Lee T, Yhee JY, Kim BS, Kwon IC, Ahn DR (March 2013). "Drug delivery by a self-assembled DNA tetrahedron for overcoming drug resistance in breast cancer cells". Chemical Communications. 49 (20): 2010–2012. doi:10.1039/c3cc38693g. PMID 23380739.
- ^ Sundah NR, Ho NR, Lim GS, Natalia A, Ding X, Liu Y, et al. (September 2019). "Barcoded DNA nanostructures for the multiplexed profiling of subcellular protein distribution". Nature Biomedical Engineering. 3 (9): 684–694. doi:10.1038/s41551-019-0417-0. PMID 31285580. S2CID 195825879.
- ^ DNA 이온 채널:
- ^ a b DNA 이온 채널:
- ^ DNA 이온 채널:
- ^ DNA 이온 채널:
- ^ DNA 이온 채널:
- ^ DNA 이온 채널:
- ^ DNA 이온 채널:
- ^ DNA 이온 채널:
- ^ DNA 스크램블라제:
- ^ a b c 설계:
- ^ 개요:
- ^ a b c 설계:
- ^ 방법:
- ^ 방법:
- ^ 방법:
- ^ 방법:
- ^ 방법:
- ^ 방법:
- ^ 방법:
- ^ a b c 기록:
- ^ 기록:문제에 대한 설명과 제안된 해결책은 을 참조하십시오.
- ^ a b DNA 종이접기:
- ^ 나노 아키텍처:
- ^ 나노 아키텍처:
- ^ Service RF (June 2011). "DNA nanotechnology. DNA nanotechnology grows up". Science. 332 (6034): 1140–1, 1143. Bibcode:2011Sci...332.1140S. doi:10.1126/science.332.6034.1140. PMID 21636754.
- ^ 기록:
추가 읽기
일반:
- Seeman NC (June 2004). "Nanotechnology and the double helix". Scientific American. 290 (6): 64–75. Bibcode:2004SciAm.290f..64S. doi:10.1038/scientificamerican0604-64. PMID 15195395.—현장의 창시자가 평민을 위해 쓴 글
- Seeman NC (June 2010). "Structural DNA nanotechnology: growing along with Nano Letters". Nano Letters. 10 (6): 1971–1978. Bibcode:2010NanoL..10.1971S. doi:10.1021/nl101262u. PMC 2901229. PMID 20486672.—2001-2010년도의 결과 검토
- Seeman NC (2010). "Nanomaterials based on DNA". Annual Review of Biochemistry. 79: 65–87. doi:10.1146/annurev-biochem-060308-102244. PMC 3454582. PMID 20222824.—현장의 이전 결과와 새로운 결과를 모두 포함한 보다 포괄적인 검토
- 서비스 RF(2011년 6월)."DNA나노 기술이다.DNA나노 기술 up" 자란다.과학332(6034):1140–1, 1143년.Bibcode:2011Sci...332.1140S. doi:10.1126/science.332.6034.1140. PMID 21636754. 및 서비스 RF(2011년 6월)."DNA나노 기술이다.다음 단계:DNA야?로봇?"라고.과학332(6034):1142년. doi:10.1126/science.332.6034.1142. PMID 21636755..—A 뉴스 기사는 필드의 역사와 새로운 애플리케이션 개발에 집중하고 있다.
- Zadegan RM, Norton ML (June 2012). "Structural DNA nanotechnology: from design to applications". International Journal of Molecular Sciences. 13 (6): 7149–7162. doi:10.3390/ijms13067149. PMC 3397516. PMID 22837684.—현장에서의 매우 최근적이고 포괄적인 검토
특정 하위 필드:
- Bath J, Turberfield AJ (May 2007). "DNA nanomachines". Nature Nanotechnology. 2 (5): 275–284. Bibcode:2007NatNa...2..275B. doi:10.1038/nnano.2007.104. PMID 18654284.—핵산 나노기계 장치의 검토
- Feldkamp U, Niemeyer CM (March 2006). "Rational design of DNA nanoarchitectures". Angewandte Chemie. 45 (12): 1856–1876. doi:10.1002/anie.200502358. PMID 16470892.—이차 구조 설계 관점에서 검토
- Lin C, Liu Y, Rinker S, Yan H (August 2006). "DNA tile based self-assembly: building complex nanoarchitectures". ChemPhysChem. 7 (8): 1641–1647. doi:10.1002/cphc.200600260. PMID 16832805.—타일 기반 어셈블리에 초점을 맞춘 미니 뷰
- Zhang DY, Seelig G (February 2011). "Dynamic DNA nanotechnology using strand-displacement reactions". Nature Chemistry. 3 (2): 103–113. Bibcode:2011NatCh...3..103Z. doi:10.1038/nchem.957. PMID 21258382.—Strand 변위 메커니즘을 이용한 DNA 시스템의 검토
외부 링크
| 위키미디어 커먼즈에는 DNA 나노기술과 관련된 미디어가 있다. |
- 바이오나노테크놀로지란 무엇인가?—DNA 나노 기술에 대한 비디오 소개