오페나우어 산화
Oppenauer oxidation| 오페나우어 산화 | |
|---|---|
| 이름을 따서 명명됨 | 루퍼트 빅토르 오페나우어 |
| 반응형 | 유기 리독스 반응 |
| 식별자 | |
| 유기화학포털 | 오페나우어 포식자 |
| RSC 온톨로지 ID | RXNO:0000047 |
루퍼트 빅토르 오페나우어[1]의 이름을 딴 오페나우어 산화는 2차 알코올을 케톤으로 선택적으로 산화시키는 부드러운 방법이다.
그 반응은 반대편인 미어웨인-폰도르프-베를리 감소다.[2] 알코올은 아세톤 과다에 이소프로산화알루미늄으로 산화된다. 이것은 평형을 제품 쪽으로 이동시킨다.
산화작용은 2차 알코올의 경우 선택성이 높으며 아민이나 황화물과 같은 다른 민감한 기능군을 산화시키지 않는다.[3] 오페나우어 조건에서 1차 알코올은 산화가 가능하지만 알데히드 제품의 알돌 응축이 경쟁적으로 발생하기 때문에 1차 알코올은 이 방법에 의해 산화가 거의 이루어지지 않는다. 오페나우어 산화는 여전히 산성 미분 기판의 산화에 사용된다. 이 방법은 비교적 순하고 독성이 없는 시약(예: 아세톤/벤젠 혼합물에서 반응이 실행됨)을 사용했기 때문에 크롬산염(예: 피리디늄 클로로크롬산염)이나 황산화 디메틸(스웨른 산화) 또는 데스-마틴 산화에 기초한 산화방법에 의해 대체되었다. 오페나우어 산화는 스테로이드, 호르몬, 알칼로이드, 테르펜 등의 합성과 같은 다양한 산업 과정에서 흔히 사용된다.
메커니즘
이 메커니즘의 첫 번째 단계에서는 알콜(1)이 알루미늄에 좌표하여 콤플렉스를 형성한다(3). 그 다음 두 번째 단계에서는 알카산화이온(4)에 의해 감압되어 알카산화 중간(5)을 생성한다. 세 번째 단계에서는 산화제 아세톤(7)과 기질 알코올이 모두 알루미늄에 결합된다. 아세톤은 알카산화물로부터의 수화 전달을 위해 그것을 활성화시키는 알루미늄에 조정된다. 알루미늄 촉매 하이드라이드 전환은 알코올의 α-탄소로부터 아세톤의 카보닐 탄소로 6-엠베드 전환 상태(8)에 걸쳐 진행된다. 원하는 케톤(9)은 하이드라이드 전달 후 형성된다.[4]
이점
오페나우어 산화제의 장점은 비교적 저렴하고 독성이 없는 시약을 사용한다는 것이다. 기판은 일반적으로 아세톤/벤젠 혼합물로 가열되기 때문에 반응 조건은 온화하고 부드럽다. 피리디늄 클로로크롬산염(PCC)과 데스-마틴 피르디난 등 다른 산화방법에 독보적으로 작용하는 오페나우어 산화의 또 다른 장점은 2차 알코올이 1차 알코올보다 훨씬 빨리 산화되기 때문에 화학적 발현이 가능하다는 것이다. 게다가, 존스 산화와 같은 또 다른 산화 방법과는 반대로 카르복실산에 대한 알데히드의 과도한 산화는 없다.[4]
수정
웨트슈타인-오페나우어 반응
1945년 Wettstein에 의해 발견된 Wettstein-Openauer 반응에서 Δ 5–3β-hydroxy 스테로이드는 수소 수용체로서 벤조퀴논을 가지고 Δ 4,6-3-케토스테로이드로 산화된다. 이 반응은 Δ 4,6-3-케토스테로이드의 한 단계 준비를 할 수 있다는 점에서 유용하다.[5]
우드워드
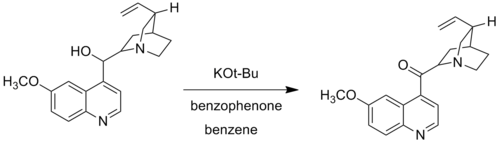
우드워드 수정에서 우드워드는 테르트-부토산화칼륨을 알카산화 알루미늄으로 대체했다. 오페나우어 산화의 우드워드 수정, 오페나우어-라고도 한다.목재 방향 산화, 특정 알코올 그룹이 표준 오페나우어 반응 조건 하에서 산화되지 않을 때 사용된다. 예를 들어 우드워드는 전통적인 알루미늄 촉매 시스템이 루이스 기반 질소의 알루미늄 중심 조정으로 형성된 복합체로 인해 퀴닌을 산화시키지 못했기 때문에 테르트-부토화칼륨과 벤조페논을 키니논으로 산화시키는 데 사용했다.[6]
기타수정
일부 변형된 알루미늄 알카산화 촉매도 보고되었다. 예를 들어, 마루오카와 동료들은 매우 활동적인 알루미늄 촉매를 보고받았는데, 이 촉매는 우수한 수율(94%)[7]에서 샤벨과 카르보네(테르페노이드라는 화학물질 계열의 일원) 사이의 산화에 활용되었다.
또 다른 변형에서[8] 촉매는 트리메틸알루미늄이며 알데히드 3-니트로벤츠알데히드는 예를 들어 이소보네올과 캄포르 산화에 산화제로 사용된다.
합성 응용 프로그램
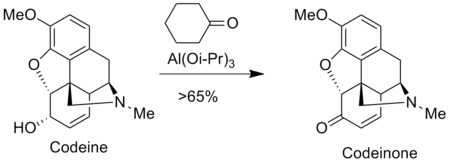
오페나우어 산화는 모르핀, 코딘 등 제약업계에서 진통제를 조제하는 데 쓰인다. 예를 들어, 코드노인은 코데인의 오페나우어 산화에 의해 준비된다.[9]
오페나우어 산화는 호르몬을 합성하는데도 사용된다. 프로게스테론은 임페놀론의 오페나우어 산화에 의해 준비된다.[10]
오페나우어 산화물의 약간의 변화는 스테로이드 유도체를 합성하는데도 사용된다. 예를 들어 루테늄 촉매를 사용하는 오페나우어 산화의 효율적인 촉매 버전은 해당 4-en-3-1 파생 모델에 대한 5-불포화 3β-히드록시 스테로이드의 산화를 위해 개발되었다.[11]
오페나우어 산화는 1,4 디올과 1,5 디올의 락톤 합성에도 사용된다.[12]
사이드 리액션
오페나우어 산화의 일반적인 부작용은 알데히드 제품의 염기 분석 알돌 응축으로, 알데히드 제품은 α-하이드록시 알데히드 또는 α-불포화 알데히드 중 하나를 형성한다.[13]
또 다른 부작용으로는 α-수소가 없는 알데히드 제품의 티셴코 반응도 있지만 이는 무수 용제를 사용함으로써 예방할 수 있다.[4] 또 다른 일반적인 측면 반응은 동맹 알코올 기판의 산화 과정에서 이중 결합의 이동이다.[14]
참고 항목
- 알코올 산화
- 클로로크롬산 피리디늄
- 존스 산화
- 피츠너-모파트 산화
- 패리크-도어링 산화
- 올브라이트-골드만 산화
- 스웨른 산화
- 코리-김 산화
- 데스-마틴 피르디난 산화
- 레이 산화(TPAP 산화)
- TEMO 산화
참조
- ^ Oppenauer, R. V. (1937). "Eine Methode der Dehydrierung von Sekundären Alkoholen zu Ketonen. I. Zur Herstellung von Sterinketonen und Sexualhormonen" [Dehydration of secondary alcohols to ketones. I. Preparation of sterol ketones and sex hormones]. Recl. Trav. Chim. Pays-Bas (in German). 56 (2): 137–144. doi:10.1002/recl.19370560206.
- ^ Wilds, A. L. (1944). "Reduction with Aluminum Alkoxides (The Meerwein-Ponndorf-Verley Reduction)". Org. React. 2 (5): 178–223. doi:10.1002/0471264180.or002.05.
- ^ Otvos, L.; Gruber, L.; Meisel-Agoston, J. (1965). "The Meerwein-Ponndorf-Verley-Oppenauer. Investigation of the reaction mechanism with radiocarbon. Racemization of secondary alcohols". Acta Chim. Acad. Sci. Hung. 43: 149–153.
- ^ a b c Corey, E.J; Nicolaou, K.C. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Elsevier. ISBN 978-7-03-019190-8.
- ^ Mandell, L. (1955). "The Mechanism of the Wettstein-Oppenauer Oxidation". J. Am. Chem. Soc. 78 (13): 3199–3201. doi:10.1021/ja01594a061.
- ^ Woodward, R. B.; Wendler, N. L.; Brutschy, F. J. (1945). "Quininone1". J. Am. Chem. Soc. 67 (9): 1425. doi:10.1021/ja01225a001.
- ^ Ooi, T; Otsuka, H; Miura, T; Ichikawa, H; Maruoka, K (2002). "Practical Oppenauer (OPP) oxidation of alcohols with a modified aluminum catalyst". Organic Letters. 4 (16): 2669–72. doi:10.1021/ol020094c. PMID 12153205.
- ^ Graves, C. R.; Zeng, B. S.; Nguyen, S. T. (2006). "Efficient and Selective Al-Catalyzed Alcohol Oxidation via Oppenauer Chemistry". Journal of the American Chemical Society. 128 (39): 12596–7. doi:10.1021/ja063842s. PMID 17002323.
- ^ Stéphane Caron; Robert W. Dugger; Sally Gut Ruggeri; John A. Ragan & David H. Brown Ripin (2006). "Large-Scale Oxidations in the Pharmaceutical Industry". Chem. Rev. 106 (7): 2943–89. doi:10.1021/cr040679f. PMID 16836305.
- ^ Dewick, P (2001). Medicinal Natural Products: A Biosynthetic Approach (2nd ed.). Wiley & Sons. p. 243. ISBN 0471496405.
- ^ Almeida, Maria L.S.; Kočovský, Paval; Bäckvall, Jan-E. (1996). "Ruthenium-Catalyzed Oppenauer-Type Oxidation of 3β-Hydroxy Steroids. A Highly Efficient Entry into the Steroidal Hormones with 4-En-3-one Functionality". J. Org. Chem. 61 (19): 6587–6590. doi:10.1021/jo960361q. PMID 11667525.
- ^ Eignerova, L.; Kasal, A. (1976). "Intramolecular hydride shift in Oppenauer oxidation of some dihydroxy steroids". ChemPlusChem. 41 (4): 1056–1065. doi:10.1135/cccc19761056.
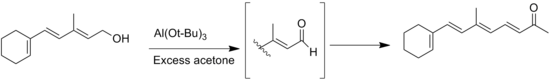
- ^ Milas, N. A.; Grossi, F. X.; Penner, S. E.; Kahn, S. (1948). "The Synthesis of 1-[cyclohexen-1'-yl]-3-Methyl-1,3,5-Octatrien-7-One (C15Ketone)1". Journal of the American Chemical Society. 70 (3): 1292. doi:10.1021/ja01183a522.
- ^ Reich, R.; Keana, J. F. W. (1972). "Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor". Synthetic Communications. 2 (5): 323. doi:10.1080/00397917208061988.
- ^ Reich, Richard; Keana, John F. W. (1972). "Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor". Synth. Commun. 2 (5): 323–325. doi:10.1080/00397917208061988.








![Oppenauer oxidation of a steroid derivative.[15]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Wiki-oppenaure-mxa2.tif/lossy-page1-350px-Wiki-oppenaure-mxa2.tif.jpg)


