광활성 국재 현미경법
Photoactivated localization microscopy광활성화 현미경(PALM 또는 FPALM)[1][2] 및 확률광 재구성 현미경(STORM)[3]은 회절 한계를 넘는 분해능의 화상을 얻을 수 있는 와이드필드(레이저 주사 공초점 현미경 등의 점 주사 기술과는 반대) 형광 현미경법이다.이 방법들은 2006년 광학 초해상도 현미경법의 일반적인 출현을 계기로 제안되었으며, Nature Methods [4]저널에 의해 2008년 Methods for the Year로 선정되었습니다.표적 생물물리학 이미징 방법으로서의 PARM의 개발은 새로운 종의 발견과 광활성 GFP와 같이 제어 가능한 광색소를 나타내는 형광 단백질의 돌연변이 공학에 의해 주로 촉진되었다.그러나, 동일한 기본 원리를 공유하는 STORM의 부수적 개발은 원래 쌍을 이룬 시아닌 염료를 사용했다.한 쌍의 분자(활성제라고 함)는 흡수가 최대치에 가까워지면 다른 분자(리포터라고 함)를 형광 상태로 다시 활성화시키는 역할을 한다.
점점 더 많은 수의 염료가 PARM, STORM 및 유기 형광체 및 형광 단백질 관련 기술에 사용되고 있습니다.일부는 라이브 셀 이미징과 호환되며, 다른 일부는 더 빠른 획득 또는 더 밀도 높은 라벨링을 허용합니다.특정 형광체의 선택은 궁극적으로 응용 분야와 그 기초적인 광물리학적 [5]특성에 따라 달라진다.
두 기법 모두 특히 다색 이미징과 3차원 확장이 가능하며,[7] 두 가지 상반된 목표가 샘플에서 형광을 수집하는 간섭계 접근방식을 사용하여 얻은 3차원에서 10nm의 최상의 전류 축 분해능을 가진 상당한 기술적 발전을 [6]거쳤다.
원칙
기존의 형광현미경법은 면역조직화학에서와 같이 항체와 결합하거나 관심 유전자에 유전적으로 융합된 형광단백질을 사용하여 형광분자를 선택적으로 염색함으로써 이루어진다.일반적으로 형광체가 더 집중될수록 형광 이미지의 대비가 향상됩니다.
방출된 광자의 수가 충분히 많고 배경도 충분히 낮으면 현미경(또는 맨눈[8] 아래) 아래에서 단일 형광체를 시각화할 수 있습니다.현미경으로 관찰된 점 소스의 2차원 이미지는 영상 시스템의 에어리 디스크(점 확산 기능의 일부)에 해당하는 확장된 지점입니다.두 개의 개별적인 실체로 간격이 긴 두 개의 형광체를 식별하는 능력은 빛의 회절에 의해 제한된다.이는 ABBE의 기준에 의해 정량화되며, 2개의 점 소스를 해결할 수 있는 최소 d(\ d는 다음과 같이 주어진다.
여기서 \는 형광 방출의 파장이고 NA는 현미경의 숫자 개구부입니다.실제 여자 파장이 가장 짧은 경우의 이론 분해능 한계는 가로 치수가 약 150nm이고 축 치수가 400nm에 가깝다(숫자 개구 1.40, 여자 파장이 400nm인 물체를 사용하는 경우).
그러나 인접한 두 형광분자로부터의 방출을 구별할 수 있게 되면, 즉 두 형광분자로부터의 광자를 식별할 수 있으므로 회절 한계를 극복할 [9]수 있다.특정 분자로부터 광자 세트가 수집되면, 현미경의 이미지 평면에서 회절 제한 지점을 형성합니다.이 지점의 중심은 관측된 방출 프로파일을 알려진 기하학적 함수(일반적으로 2차원 가우스 함수)에 적합시켜 찾을 수 있다.점 이미터의 중심을 위치시킬 때 발생하는 오차는 방출된 광자 수의 역제곱근으로서 첫 번째 근사치까지 확대되며 충분한 양의 광자가 수집되면 원래 점 확산 함수보다 훨씬 작은 위치 오차를 얻기 쉽습니다.
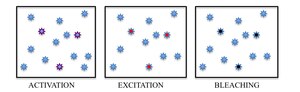
PARM, STORM 및 그 발달의 기초는 많은 형광 분자가 존재하는 밀도 높은 환경에서 개별 형광 분자의 식별과 국재화의 두 단계이다.
분자 식별에 대한 많은 접근법이 존재하지만, 선택된 형광체의 광유도 광색성은 형광 방출을 시간 내에 분리함으로써 인접한 분자를 구별하는 가장 유망한 접근법으로 발전했다.특정 파장의 빛으로 확률적으로 희박한 형광체의 서브셋을 켜면 각각의 분자를 들뜨게 하고 스펙트럼에 따라 촬상할 수 있다.결국 회절 제한 이미지로 분해되는 샘플 내 활성 형광체의 축적을 방지하기 위해 PARM에서는 자발적인 광 표백 현상이 이용되는 반면, STORM에서는 형광 온 상태와 다크 오프 상태 사이의 가역 전환이 이용된다.
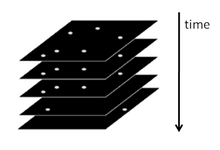
요약하자면, PARM과 STORM은 형광 현미경 아래에서 각각 몇 개의 활성 절연 형광체를 포함하는 다수의 이미지를 수집하는 데 기초하고 있습니다.이미징 시퀀스를 사용하면 각 형광체를 비방사성(또는 방사성) 상태에서 밝은 상태로 확률적으로 활성화하고 다시 비방사성 또는 표백 상태로 되돌리는 데 필요한 많은 방출 사이클이 가능합니다.각 주기 동안 활성 분자의 밀도는 개별 형광체의 분자 이미지가 일반적으로 겹치지 않을 정도로 낮게 유지됩니다.
개별 형광체의 국재화
이 배열의 각 화상에서 불소포자의 위치는 일반적으로 회절 한계보다 큰 정밀도로 계산되며, 그 결과 얻은 국재 분자의 중심 위치 정보를 이용하여 초분해능 PARM 또는 STORM 화상을 구축한다.
현지화 정밀도 \는 다음 공식에 따라 계산할 수 있습니다.
여기서 N은 수집된 광자의 수, a는 이미징 검출기의 픽셀 크기, 2 b는 평균 배경 신호, })는 포인트 확산 [10]함수의 표준 편차입니다.여러 형광체를 동시에 확장 영역에 걸쳐 위치시켜야 하는 요건은 CCD, EMCCD 또는 CMOS 카메라를 검출기로 사용하여 이러한 방법이 광시야인 이유를 결정한다.
국재 정밀도를 최대화하기 위한 향상된 신호 대 잡음비의 요건은 이 개념의 빈번한 조합을 전체 내부 반사 형광 현미경(TIRF) 및 라이트 시트 형광 현미경과 같은 광학 섹션링이 가능한 와이드 필드 형광 현미경과 결정한다.
초해상도 이미지
최종 이미지의 해상도는 회절 대신 각 로컬라이제이션의 정밀도와 로컬라이제이션의 수에 의해 제한됩니다.따라서 초해상도 이미지는 모든 국소 분자의 좌표를 점묘하게 표현한 것입니다.초해상도 이미지는 일반적으로 수집된 광자 수에 비례하는 진폭과 국재 정밀도에 따라 표준 편차를 갖는 2차원 가우스로서 이미지 평면의 각 분자를 표현하여 표현합니다.

적용들
다색 PARM / STORM
PARM/STORM 초해상도 영상에 사용되는 형광체의 독특한 광물리학적 특성은 다색 이미징의 제약과 기회를 모두 제기합니다.지금까지 세 가지 전략이 나타났다. 발광 빔플리터를 [12]이용한 스펙트럼 분리형 형광체 들뜸, STOM[13][14] 모드에서의 다중 활성제/리포터 사용 및 스펙트럼 근접형 형광체의 [15]래티오메트릭 이미징이다.
팜과 스톰의 3D
PARM과 STORM은 원래 2D(x,y) 이미징 방식으로 개발되었지만 빠르게 3D(x,y,z)로 발전했습니다.샘플에서 단일 형광체의 축 위치를 결정하기 위해 현재 다음과 같은 접근법이 사용되고 있습니다. 2D(x,y) 영상에서 z-의존적 특징을 도입하기 위한 점 확산 기능의 수정(가장 일반적인 접근법은 PSF에 난시를 도입하는 것), 축 위치가 다음과 같이 결정되는 멀티판 검출비교 같은 PSF의 두 이미지는에 관련된, 이미터 두 반대하는 목적과 다중 탐지기를 사용하는 것의 축 방향 위치의 간섭 측정의. 결단력, 시간적 초점을 맞추[7]사용은 excitation/activation하고, 밝은 시트 excitation/activation의 사용 몇 백 나노 미터까지 제한하는 두꺼운 것 defocused. (yer는 샘플 내의 z 평면을 따라 임의로 배치됩니다.
라이브 셀 이미징
활성화, 여기 및 비활성화/표백의 여러 주기에 대한 요구사항은 일반적으로 PARM/STORM 이미지를 형성하기 위해 오랜 시간이 걸리고, 따라서 고정된 샘플에 대해 작동해야 한다는 것을 의미합니다.라이브 셀을 대상으로 PARM/STORM을 실행하는 많은 연구가 2007년에 발표되었습니다.이러한 기술을 사용하여 라이브 초해상도 이미징을 실행할 수 있는지 여부는 궁극적으로 단일 이미터에서 매우 짧은 시간 내에 충분한 광자를 수집해야 하는 기술적 제한에 달려 있습니다.이는 프로브의 광물리학적 한계와 채택한 검출기의 민감도에 따라 달라진다.PARM을 [17]통해 초점 접착 조직에서의 수정과 같은 비교적 느린(수~수십 초) 과정을 연구한 반면, STORM은 Clathrin 코팅된 피트의 막 확산이나 미토콘드리아 핵분열/융합 과정과 같은 더 빠른 과정을 이미징할 수 있게 했다.살아있는 세포 PARM의 유망한 적용은 고밀도 단일 입자 추적(sptPALm)을 수행하기 위해 광활성화를 사용하는 것으로, 단일 입자 추적의 전통적인 한계를 극복하고 매우 낮은 농도의 불소 포자를 표시하는 시스템과 함께 작동합니다.
나노포토닉 상호작용
반면 전통적인 팜과 STORM한 측정 샘플의 형광 사건이 국산화의 확실성을 결정하는 강도가 가진 물리적인 구조, 결정하는데 사용된다, 이 강도 또한nanophotonic 구조로fluorophore 상호 작용 매핑 하는 데 사용될 수 있다.이 금 nanorods,[19][20]뿐만 아니라 반도체의 구조와 같은 실리콘 나노 와이어 같은 금속(plasmonic)구조에 대해 수행되고 있다.[21]이들 접근법도 fluorophores 관심(그plasmonic 입자 연구 여기서 언급한로), 또는 무작위로의 샘플은 기질 샘플은 주변에 흡착의 표면에 functionalized에, 모든 위치가 구조에 비해 상대적으로 fluorophore-nanostructure는 상호 작용으로 가득 차 2D매핑을 허용하는 사용될 수 있다.[21]
이러한 연구는 현지화의 지점 확산 함수 탈의로 인해 표준 불확실성 외에, 빛 나노 입자에 의해 늘어놓self-interference은imaged 점 퍼지의 왜곡이나 변이에 functions,[20][21] 그러한 측정의 분석을 복잡하게 이어질 수 있다는 것을 발견했다.이러한 한계에, 그러나, 빛의 각도 분포는 측정 시스템에 허용된 제어 metasurface 마스크를 통합하여 예를 들어 가능할 수 있다.[22]
PARM과 STORM의 차이점
팜과 로켓 및 유도탄 전력 공통된 기본적인 원칙이고 수많은 발전은 그 두 방법은 더욱 연관성을 만드는 경향이 있었다.그럼에도, 그들은 여러가지 기술적 세부 사항과 기본 포인트가 다르다.기술 측면에, 팜은 생물 표본 fluorophores exogenouslyphotoactivatable 형광 단백질과 유전적인 융합 구문의 형태로 표현을 사용하여에서 수행한다.로켓 및 유도탄 전력 대신 항체 유기 fluorophores가 적힌 꼬리표가 달려를 샘플의 내생적인 분자의 immunolabeling을 사용한다.두 경우 모두 fluorophores active-ON고inactive-OFF 주 사이에 빛에 의해 움직인다.팜에는, 하지만, 광활성화와 퇴색 시간을 제한한 간격으로, 그리고 fluorophore의 연속적인 방출 사이의 어떤 형광 단절 없이 바람직한은 fluorophore의 삶을 가둡니다.로켓 및 유도탄 전력에서 유기농 fluorophores(일반적으로 형광 단백질보다 밝)의 확률 photoblinking는 원래 이웃 염료를 분리해 개발되고 있다이러한 점에 더 건전한 그 눈을 깜박이는 것, 두 이웃 fluorophores 구별하기 확률이 더 높아진다.
이와 관련하여, 활성화된 불소 [11][23][24]포자를 계수하여 샘플에 존재하는 불소 포자(따라서 관심 단백질)의 수를 정량화할 수 있는 PARM의 가능성을 연구한 연구들이 있다.실험에 사용된 형광 라벨의 형광 역학을 처리하는 데 사용되는 접근방식은 초해상도 이미지의 최종 외관을 결정할 것이며, 표본의 국재 현상과 단백질 사이의 명확한 대응 가능성을 결정할 것이다.
멀티미디어
광활성화, 들뜸 및 표백 중인 고정화 형광단백질
저친화성 광변환성 액틴을 [25]이용한 수상돌기의 초해상도 동적 영상촬영.
초해상도 광학 현미경을 이용한 쥐 해마 신경세포의 서브척추액틴 역학 연구
레퍼런스
- ^ E. Betzig; G. H. Patterson; R. Sougrat; O. W. Lindwasser; S. Olenych; J. S. Bonifacino; M. W. Davidson; J. Lippincott-Schwartz; H. F. Hess (2006). "Imaging Intracellular Fluorescent Proteins at Nanometer Resolution". Science. 313 (5793): 1642–1645. Bibcode:2006Sci...313.1642B. doi:10.1126/science.1127344. PMID 16902090.
- ^ S. T. Hess; T. P. Giriajan; M. D. Mason (2006). "Ultra-high resolution imaging by Fluorescence Photoactivation Localization Microscopy". Biophysical Journal. 91 (11): 4258–4272. Bibcode:2006BpJ....91.4258H. doi:10.1529/biophysj.106.091116. PMC 1635685. PMID 16980368.
- ^ M. J. Rust; M. Bates; X. Zhuang (2006). "Sub diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM)". Nature Methods. 3 (20): 793–796. doi:10.1038/nmeth929. PMC 2700296. PMID 16896339.
- ^ "Method of the Year 2008". Nature Methods. 6 (1): 1–109. 2009. doi:10.1038/nmeth.f.244.
- ^ Ha, Taekjip & Tinnefeld, Philip (2012). "Photophysics of Fluorescent Probes for Single-Molecule Biophysics and Super-Resolution Imaging". Annual Review of Physical Chemistry. 63 (1): 595–617. Bibcode:2012ARPC...63..595H. doi:10.1146/annurev-physchem-032210-103340. PMC 3736144. PMID 22404588.
- ^ Bo Huang and Hazen Babcock and Xiaowei Zhuang (2010). "Breaking the Diffraction Barrier: Super-Resolution Imaging of Cells". Cell. 143 (7): 1047–58. doi:10.1016/j.cell.2010.12.002. PMC 3272504. PMID 21168201.
- ^ a b Shtengel, Gleb and Galbraith, James A. and Galbraith, Catherine G. and Lippincott-Schwartz, Jennifer and Gillette, Jennifer M. and Manley, Suliana and Sougrat, Rachid and Waterman, Clare M. and Kanchanawong, Pakorn and Davidson, Michael W. and Fetter, Richard D. and Hess, Harald F. (2009). "Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure". Proceedings of the National Academy of Sciences. 106 (9): 3125–3130. Bibcode:2009PNAS..106.3125S. doi:10.1073/pnas.0813131106. PMC 2637278. PMID 19202073.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ W. E. Moerner; D. P. Fromm (2003). "Methods of single-molecule fluorescence spectroscopy and individual fluorescence probes". Review of Scientific Instruments. 74 (8): 3597–3619. Bibcode:2003RScI...74.3597M. doi:10.1063/1.1589587. S2CID 11615310.
- ^ E. Betzig (1995). "Proposed Method for molecular optical imaging". Optics Letters. 20 (3): 237–239. Bibcode:1995OptL...20..237B. doi:10.1364/OL.20.000237. PMID 19859146.
- ^ K. I. Mortensen; L S. Churchman; J. A. Spudich; H. Flyvbjerg (2010). "Optimized localization analysis for single-molecule tracking and super-resolution microscopy". Nature Methods. 7 (5): 377–381. doi:10.1038/nmeth.1447. PMC 3127582. PMID 20364147.
- ^ a b Greenfield D, McEvoy AL, Shroff H, Crooks GE, Wingreen NS, et al. (2009). "Self-Organization of the Escherichia coli Chemotaxis Network Imaged with Super-Resolution Light Microscopy". PLOS Biology. 7 (6): e1000137. doi:10.1371/journal.pbio.1000137. PMC 2691949. PMID 19547746.
- ^ Shroff H, Galbraith CG, Galbraith JA, White H, Gillette J, Olenych S, Davidson MW, Betzig E (2007). "Dual-color superresolution imaging of genetically expressed probes within individual adhesion complexes". Proceedings of the National Academy of Sciences. 104 (51): 20308–20313. Bibcode:2007PNAS..10420308S. doi:10.1073/pnas.0710517105. PMC 2154427. PMID 18077327.
- ^ M Bates; B Huang; GT Dempsey; X Zhuang (2007). "Multicolor Super Resolution Imaging with Photo-Switchable fluorescent probes". Science. 317 (5845): 1749–1753. Bibcode:2007Sci...317.1749B. doi:10.1126/science.1146598. PMC 2633025. PMID 17702910.
- ^ Bock, H.; et al. (2007). "Two-color far-field fluorescence nanoscopy based on photoswitchable emitters". Applied Physics B. 88 (2): 161–165. Bibcode:2007ApPhB..88..161B. doi:10.1007/s00340-007-2729-0. S2CID 122146697.
- ^ Testa I, Wurm CA, Medda R, Rothermel E, von Middendorf C, Folling J, Jakobs S, Schonle A, Hell SW, Eggeling C (2010). "Multicolor fluorescence nanoscopy in fixed and living cells by exciting conventional fluorophores with a single wavelength". Biophysical Journal. 99 (8): 2686–2694. Bibcode:2010BpJ....99.2686T. doi:10.1016/j.bpj.2010.08.012. PMC 2956215. PMID 20959110.
- ^ Hess, Samuel T. and Gould, Travis J. and Gudheti, Manasa V. and Maas, Sarah A. and Mills, Kevin D. and Zimmerberg, Joshua (2007). "Dynamic clustered distribution of hemagglutinin resolved at 40 nm in living cell membranes discriminates between raft theories". Proceedings of the National Academy of Sciences. 104 (44): 17370–17375. Bibcode:2007PNAS..10417370H. doi:10.1073/pnas.0708066104. PMC 2077263. PMID 17959773.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Shroff, H., C. G. Galbraith, J. A. Galbraith, and E. Betzig (2008). "Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics". Nature Methods. 5 (44): 417–423. doi:10.1038/nmeth.1202. PMC 5225950. PMID 18408726.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ S Manley; J M Gillette; G H Patterson; H Shroff; H F Hess; E Betzig; J Lippincott-Schwartz (2008). "High-density mapping of single-molecule trajectories with photoactivated localization microscopy". Nature Methods. 5 (2): 155–157. doi:10.1038/nmeth.1176. PMID 18193054. S2CID 1101468.
- ^ Zhou, Xiaochun; Andoy, Nesha May; Liu, Guokun; Choudhary, Eric; Han, Kyu-Sung; Shen, Hao; Chen, Peng (2012). "Quantitative super-resolution imaging uncovers reactivity patterns on single nanocatalysts". Nature Nanotechnology. 7 (4): 237–241. Bibcode:2012NatNa...7..237Z. doi:10.1038/nnano.2012.18. ISSN 1748-3387. PMID 22343380. S2CID 4654704.
- ^ a b Lin, Hongzhen; Centeno, Silvia P.; Su, Liang; Kenens, Bart; Rocha, Susana; Sliwa, Michel; Hofkens, Johan; Uji-i, Hiroshi (2012). "Mapping of Surface-Enhanced Fluorescence on Metal Nanoparticles using Super-Resolution Photoactivation Localization Microscopy". ChemPhysChem. 13 (4): 973–981. doi:10.1002/cphc.201100743. ISSN 1439-4235. PMID 22183928.
- ^ a b c Johlin, Eric; Solari, Jacopo; Mann, Sander A.; Wang, Jia; Shimizu, Thomas S.; Garnett, Erik C. (2016). "Super-resolution imaging of light–matter interactions near single semiconductor nanowires". Nature Communications. 7: 13950. Bibcode:2016NatCo...713950J. doi:10.1038/ncomms13950. ISSN 2041-1723. PMC 5187462. PMID 27996010.
- ^ Backlund, Mikael P.; Arbabi, Amir; Petrov, Petar N.; Arbabi, Ehsan; Saurabh, Saumya; Faraon, Andrei; Moerner, W. E. (2016). "Removing orientation-induced localization biases in single-molecule microscopy using a broadband metasurface mask" (PDF). Nature Photonics. 10 (7): 459–462. Bibcode:2016NaPho..10..459B. doi:10.1038/nphoton.2016.93. ISSN 1749-4885. PMC 5001689. PMID 27574529.
- ^ P Annibale; S Vanni; M Scarselli; U Rothlisberger; A Radenovic (2011). "Quantitative Photo Activated Localization Microscopy: Unraveling the Effects of Photoblinking". PLOS ONE. 6 (7): p.e22678, 07. Bibcode:2011PLoSO...622678A. doi:10.1371/journal.pone.0022678. PMC 3144238. PMID 21818365.
- ^ Lee, Sang-Hyuk and Shin, Jae Yen and Lee, Antony and Bustamante, Carlos (2012). "Counting single photoactivatable fluorescent molecules by photoactivated localization microscopy (PALM)". Proceedings of the National Academy of Sciences. 109 (43): 17436–17441. Bibcode:2012PNAS..10917436L. doi:10.1073/pnas.1215175109. PMC 3491528. PMID 23045631.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Izeddin I, Specht CG, Lelek M, Darzacq X, Triller A, et al. (2011). "Super-Resolution Dynamic Imaging of Dendritic Spines Using a Low-Affinity Photoconvertible Actin Probe". PLOS ONE. 6 (1): e15611. Bibcode:2011PLoSO...615611I. doi:10.1371/journal.pone.0015611. PMC 3022016. PMID 21264214.
- ^ Tatavarty V, Kim E, Rodionov V, Yu J (2009). "Investigating Sub-Spine Actin Dynamics in Rat Hippocampal Neurons with Super-Resolution Optical Imaging". PLOS ONE. 4 (11): e7724. doi:10.1371/journal.pone.0007724. PMC 2771285. PMID 19898630.
외부 링크
- 초해상도 현미경 및 디지털 이미징의 Zeiss 교육 페이지 내 초해상도 현미경 검사
- Nikon의 현미경 교육 자원 내 초해상도 기본 개념
- Eric Betzig와 Harald Hess가 PARM 현미경 검사 개발
- Xiaowei Zhang 강연:초해상도 현미경 검사
- 라이트 현미경:현재 진행 중인 현대적 혁명(입문 리뷰)
 다음과 같이 주어진다.
다음과 같이 주어진다.
 형광 방출의
형광 방출의 

 다음 공식에 따라 계산할 수 있습니다.
다음 공식에 따라 계산할 수 있습니다.
 평균 배경 신호,
평균 배경 신호, 




