셀렌화나트륨
Sodium selenide | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 셀렌화나트륨 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.013.830 |
| EC 번호 |
|
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| 나지완2Se | |
| 몰 질량 | 124.951 g/120−1 |
| 밀도 | 2.62gcm−3[1] |
| 녹는점 | 875°C[1] 이상 |
| 물과 반응하다 | |
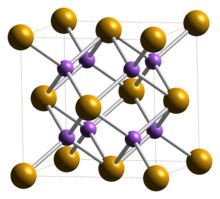
| 구조[2] | |
| 큐빅(불소), cF12 | |
| FM3m, 225호 | |
a = 0.6825 nm | |
수식 단위(Z) | 4 |
| 위험 요소 | |
| GHS 라벨링: | |
   | |
| 위험. | |
| H301, H331, H373, H410 | |
| P260, , , , , , , , , , , , | |
| 관련 화합물 | |
기타 음이온 | 산화 나트륨 황화나트륨 텔루화나트륨 폴로니드 나트륨 |
기타 캐티온 | 셀렌화수소 셀렌화 리튬 셀렌화칼륨 셀렌화 루비듐 셀렌화 세슘 |
관련 화합물 | 셀레나이트나트륨 셀렌산나트륨 셀렌화알루미늄 셀렌화 안티몬 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
셀레늄화나트륨은 나트륨과 셀레늄의 무기화합물로 화학식은2 NaSe이다.
준비
이 무색 고체는 -40°C에서 [3]셀레늄과 액체 암모니아 속의 나트륨 용액을 반응시켜 제조됩니다.또는 셀렌화나트륨은 셀렌화수소가스와 금속나트륨을 100℃에서 반응시켜 제조할 수 있다.
반응
다른 알칼리 금속 칼코게나이드와 마찬가지로 이 물질은 물에 매우 민감하며 쉽게 가수분해되어 비셀렌화 나트륨(NaSeH)과 수산화물의 혼합물을 제공합니다.이 가수분해는 Se 이온의2− 극단적인 염기성 때문에 일어난다.
- NaSe2 + HO2 → NaHSe + NaOH
마찬가지로 셀레나이드나트륨은 쉽게 폴리셀레나이드로 산화되는데, 이 변환은 오프 화이트 시료에 의해 신호된다.
셀레나이드 나트륨은 산과 반응하여 유독성 셀레나이드 가스를 생성한다.
- NaSe2 + 2 HCl → HSe2 + 2 NaCl
이 화합물은 친전자성분과 반응하여 셀레늄 화합물을 생성한다.할로겐화 알킬을 사용하면 다양한 유기세렌 화합물을 얻을 수 있습니다.
- NaSe2 + 2 RBR → RSe2 + 2 NaBr
유기소틴과 유기실리콘 할로겐화물은 유사하게 반응하여 다음과 같은 유도체를 생성합니다.
- NaSe2 + 2 MeXCl3 → (MeX3)2Se + 2 NaCl (X † Si, Ge, Sn)
레퍼런스
- ^ a b Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. p. 4.87. ISBN 9781498754293.
- ^ Bonneau, Philippe R.; Jarvis, Robert F.; Kaner, Richard B. (1992). "Solid-state metathesis as a quick route to transition-metal mixed dichalcogenides". Inorganic Chemistry. 31 (11): 2127–2132. doi:10.1021/ic00037a027.
- ^ Brauer, G. ed. (1963) 준비 무기 화학 핸드북, 제2판, 뉴욕 학술 출판사, 제1권, 421쪽.


