구문인
Syntaxin| 구문인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
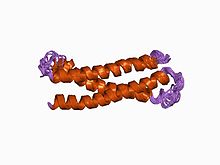 1A에서 구문의 N단자 영역으로 진화적으로 보존된 구조.[1] | |||||||||
| 식별자 | |||||||||
| 기호 | 구문인 | ||||||||
| Pfam | PF00804 | ||||||||
| 인터프로 | IPR006011 | ||||||||
| 스마트 | SM00503 | ||||||||
| SCOP2 | 1br0 / SCOPe / SUPFAM | ||||||||
| OPM 슈퍼 패밀리 | 197 | ||||||||
| OPM단백질 | 2xhe | ||||||||
| 멤브라노메 | 349 | ||||||||
| |||||||||
구문인은 세포소독에 관여하는 막 통합 Q-SNare 단백질의 계열이다.[2]
도메인
구문인은 단일 C-단말 트랜섬브레인 도메인, DLOG 도메인(H3로 알려져 있음), N-단말 규제 도메인(Havc)을 가지고 있다.구문 17은 두 개의 투과된 도메인을 가질 수 있다.
- ROGG(H3) 도메인은 핵심 ROGG 콤플렉스를 형성하는 시냅토브레빈과 SNAP-25 모두에 바인딩된다.이 안정적인 DRIG 코어 복합체가 형성되면 배실막과 플라즈마막 사이의 융합을 시작하는 데 필요한 자유 에너지가 생성되는 것으로 생각된다.[3]
- N-terminal Havc 도메인은 3 α-헬리크로 형성되며, 자체 H3 나선형으로 축소될 경우 순응에서 비활성 "폐쇄" 구문을 형성한다.보다 최근의 데이터를 통해 nSec1이 다른 구문 순응에도 바인딩될 수 있음을 알 수 있지만, 이러한 폐쇄적인 구문 순응은 Munc-18 (nSec1)의 바인딩에 의해 안정화되는 것으로 생각된다."개방형" 구문 순응은 DRIG 핵심 복합체로 형성될 수 있는 역량이 있는 순응이다.
함수

시험관내 구문 per se는 v-SNare를 포함하는 시냅스 vesicles의 자발적 칼슘 독립적 융합을 추진하기에 충분하다.[5]
좀 더 최근에 그리고 다소 논란의 여지가 있는 암페리미터 데이터는 구문신1A의 투과영역이 외세포 분열의 융합공극의 일부를 형성할 수 있다는 것을 암시한다.[6]
바인딩
구문인은 칼슘에 의존하는 방식으로 시냅토타그민을 결합하고 C-단자 H3 도메인을 통해 전압에 의존하는 칼슘 및 칼륨 채널과 상호작용한다.채널 내 직접 구문 상호작용은 사전 시냅스 축 부톤을 탈극화하는 동안 핵융합 기계와 Ca2+ 진입 관문 사이의 근접성을 위한 적절한 분자 메커니즘이다.
Sec1/Munc18 단백질군은 구문인과 결합하여 구문인 기계를 규제하는 것으로 알려져 있다.Munc18-1은 N-terminus 바인딩과 "폐쇄된" 순응이라는 두 개의 구별되는 사이트를 통해 구문인 1A에 바인딩되며, 이는 중앙 Havc 도메인과 DLOG 핵심 도메인을 모두 통합한다.구문신1의 N-terminus에 대한 Munc18-1 바인딩은 구문신-1과 다른 HOGP와의 상호작용을 용이하게 하는 것으로 생각되며, 구문신-1의 "폐쇄" 순응에 대한 바인딩은 억제라고 생각된다.
최근 발표된 데이터는 트랜섬브레인 영역이 없는 대체 스플라이스 구문 1(STX1B)이 핵에서 국부화한다는 것을 보여준다.[7]
유전자
단백질에서 구문 인코딩을 하는 인간의 유전자는 다음과 같다.
- STX1A, STX1B, STX2, STX3, STX4, STX5, STX6, STX7, STX8,
- STX10, STX11, STX12, STX16, STX17, STX18, STX19
참고 항목
- 구문 결합 단백질인 Tomosyn
참조
- ^ Fernandez I, Ubach J, Dulubova I, Zhang X, Südhof TC, Rizo J (Sep 1998). "Three-dimensional structure of an evolutionarily conserved N-terminal domain of syntaxin 1A". Cell. 94 (6): 841–9. doi:10.1016/S0092-8674(00)81742-0. PMID 9753330.
- ^ Bennett MK, García-Arrarás JE, Elferink LA, Peterson K, Fleming AM, Hazuka CD, Scheller RH (Sep 1993). "The syntaxin family of vesicular transport receptors". Cell. 74 (5): 863–73. doi:10.1016/0092-8674(93)90466-4. PMID 7690687.
- ^ Lam AD, Tryoen-Toth P, Tsai B, Vitale N, Stuenkel EL (2008). "SNARE-catalyzed fusion events are regulated by Syntaxin1A-lipid interactions". Molecular Biology of the Cell. 19 (2): 485–97. doi:10.1091/mbc.E07-02-0148. PMC 2230580. PMID 18003982.
- ^ Georgiev DD, Glazebrook JF (2007). "Subneuronal processing of information by solitary waves and stochastic processes". In Lyshevski SE (ed.). Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. pp. 17–1–17-41. ISBN 978-0-8493-8528-5.
- ^ Woodbury DJ, Rognlien K (2000). "The t-SNARE syntaxin is sufficient for spontaneous fusion of synaptic vesicles to planar membranes". Cell Biology International. 24 (11): 809–18. doi:10.1006/cbir.2000.0631. PMID 11067766.
- ^ Han X, Wang CT, Bai J, Chapman ER, Jackson MB (Apr 2004). "Transmembrane segments of syntaxin line the fusion pore of Ca2+-triggered exocytosis". Science. 304 (5668): 289–92. doi:10.1126/science.1095801. PMID 15016962.
- ^ Pereira S, Massacrier A, Roll P, Vérine A, Etienne-Grimaldi MC, Poitelon Y, Robaglia-Schlupp A, Jamali S, Roeckel-Trevisiol N, Royer B, Pontarotti P, Lévêque C, Seagar M, Lévy N, Cau P, Szepetowski P (Nov 2008). "Nuclear localization of a novel human syntaxin 1B isoform". Gene. 423 (2): 160–71. doi:10.1016/j.gene.2008.07.010. PMID 18691641.
외부 링크
- 미국 국립 의학도서관의 구문론

