염색
Staining염색은 일반적으로 현미경 수준에서 검체의 대조도를 높이기 위해 사용되는 기법입니다.염색과 염료는 조직학(생물조직의 현미경 연구)과 현미경 수준의 질병 연구와 진단에 초점을 맞춘 조직병리학, 혈액학, 세포병리학 의학 분야에서 자주 사용된다.염색은 생물학적 조직(예: 근육 섬유 또는 결합 조직), 세포 집단(다른 혈구 분류), 또는 개별 세포 내의 세포 조직을 정의하는 데 사용될 수 있다.
생화학에서 그것은 특정 화합물의 존재를 인정하거나 정량화하기 위해 기질에 등급 특이적 염료(DNA, 단백질, 지질, 탄수화물)를 추가하는 것을 포함한다.염색과 형광 태깅도 비슷한 용도로 사용될 수 있습니다.생물학적 염색은 또한 유동 세포 측정에서 세포를 표시하고 겔 전기영동에 단백질 또는 핵산을 표시하기 위해 사용됩니다.광현미경은 일반적으로 밝은 영역 또는 에피 형광 조명을 사용하여 높은 배율로 얼룩진 샘플을 보는 데 사용됩니다.
염색은 생물학적 물질에 국한되지 않고, 반결정성 고분자의 층상 구조나 블록 공중합체의 영역 구조 등 다른 물질의 구조를 연구하는데도 사용될 수 있다.
체내 대 체외
생체 내 염색은 살아있는 조직을 염색하는 과정이다.특정 세포 또는 구조가 대비되는 색을 띠게 함으로써 세포 또는 조직 내의 형태(형태학) 또는 위치를 쉽게 보고 연구할 수 있다.일반적인 목적은 그렇지 않으면 분명하지 않을 수 있는 세포학적 세부사항을 밝히는 것이다; 그러나 염색은 또한 세포나 조직 내에서 특정 화학 물질이나 특정 화학 반응이 일어나는 위치를 밝힐 수 있다.
시험관내 염색은 생물학적 맥락에서 제거된 세포나 구조에 착색하는 것을 포함한다.특정 얼룩은 종종 하나의 얼룩보다 더 많은 디테일과 특징을 드러내기 위해 결합됩니다.과학자와 의사는 고정 및 검체 준비를 위한 특정 프로토콜과 결합하여 이러한 표준 기술을 일관되고 반복 가능한 진단 도구로 사용할 수 있습니다.카운터스테인은 세포나 구조를 더 잘 보이게 하는 염색체이지만, 주요 염색체와 함께 완전히 보이지 않습니다.
- 크리스털 바이올렛은 그램 양성 유기체와 그램 음성 유기체를 모두 오염시킨다.알코올로 처리하면 그램 음성 유기체에서만 수정 보라색을 제거할 수 있습니다.사프라닌은 알코올로 탈색된 그램 음성의 유기체를 착색하는데 사용된다.
체외에서 많은 세포들이 "고정될 때까지" 계속 살아가고 신진대사를 한다.일부 염색 방법은 이 속성을 기반으로 합니다.살아있는 세포에 의해 제외되지만 이미 죽은 세포에 의해 흡수된 이러한 얼룩은 중요한 얼룩이라고 불립니다(예: 진핵 세포의 경우 트리판 블루 또는 프로피듐 요오드화물입니다.살아있는 세포에 들어가 염색하는 것을 중력 위 염색이라고 합니다(예: 망상 적혈구 염색에 대한 새로운 메틸렌 블루와 밝은 크레실 블루).하지만, 이러한 얼룩들은 결국 다른 것들보다 더 유기체에 독성이 있다.부분적으로 살아있는 세포 내부의 독성 상호작용 때문에, 중력의 상층 기미가 살아있는 세포에 들어갈 때, 그것들은 이미 고정된 세포의 염색과는 다른 특징적인 염색 패턴을 만들어 낼 수 있다(예: "망상 적혈구" 모양 대 확산성 "다색소증").원하는 효과를 얻기 위해 얼룩은 1:5000 ~ 1:500000 범위의 매우 희박한 용액에 사용됩니다(Howey, 2000).살아있는 셀과 고정된 셀 모두에서 많은 얼룩이 사용될 수 있습니다.
준비
관련된 준비 단계는 계획된 분석 유형에 따라 달라집니다. 다음 절차의 일부 또는 전부가 필요할 수 있습니다.
습식 마운트 습식 마운트는 살아있는 유기체를 보는 데 사용되며 물과 특정 얼룩을 사용하여 만들 수 있습니다.이 액체는 생물을 첨가하기 전에 슬라이드에 첨가되며,[1] 물속과 얼룩에 있는 시료 위에 덮개를 씌워 시야 내에 보관할 수 있도록 합니다.
고정(그 자체가 여러 단계로 구성될 수 있음)은 관련된 세포나 조직의 형태를 최대한 보존하는 것을 목표로 한다.때로는 열고정을 사용하여 검체를 죽이고, 부착하고, 얼룩을 흡수하도록 변경하기도 합니다.대부분의 화학적 고정제(고정을 일으키는 화학 물질)는 단백질과 샘플 내의 다른 물질 사이에 화학적 결합을 생성하여 그 강성을 높입니다.일반적인 정착제에는 포름알데히드, 에탄올, 메탄올 및/또는 피크산이 포함된다.조직 조각은 파라핀 왁스에 묻혀 기계적 강도와 안정성을 높이고 얇게 [2]자르기 쉽게 할 수 있다.
매단트:이들은 염료를 만들어 염색할 수 있는 힘이 있는 화학 약품이며, 그렇지 않으면 염색할 수 없습니다.
매독제는 두 가지 범주로 분류된다.
a) Basic Mordant : Alum, ferrous sulfate, cetylpyridinium chloride 등 산성염료와 반응한다.
b) 산성 매염제 : 피크산, 탄닌산 등의 염기성 염료와 반응한다.
[2]직접 염색 : 매염제 없이 실시합니다.
간접염색: 매염제의 도움으로 생기는 염색.
| 시어 | 간접 염색 기법 이름 | 도포한 매독제명 |
|---|---|---|
| 1.) | 그램의 염색 | 그램 요오드 |
| 2.) | 세포벽 염색 a) 호출음 방식 b)Dyar의 방법 | 10 % 탄닌산 0.34% C.P.c |
| 3.) | 편모 염색 a) 리프슨의 방법 b) Loeffler의 방법 | 리프슨 얼룩의 탄닌산 뢰플러 매염제(20% 탄산) |
| 4.) | 스피로헤테 염색 a.) Fontana의 방법 b) Becker의 방법 | 폰타나의 매염제 (5% 탄산) 폰타나의 매염제 (5% 탄산) |
투과성은 (보통) 약한 계면활성제로 세포를 처리하는 것을 포함한다.이 처리는 세포막을 녹여 세포 내부에 더 큰 염료 분자를 넣을 수 있게 한다.
장착에는 일반적으로 관찰 및 분석을 위해 샘플을 유리 현미경 슬라이드에 부착하는 작업이 포함됩니다.경우에 따라 세포는 슬라이드에서 직접 자랄 수 있습니다.느슨한 세포 샘플의 경우(혈액 도말 또는 자궁 도말과 같이) 샘플을 슬라이드에 직접 적용할 수 있습니다.더 큰 조직의 경우 마이크로톰을 사용하여 얇은 단면(슬라이스)을 만든 다음 이러한 슬라이스를 장착하고 검사할 수 있습니다.
표준화
현미경 검사에 일반적으로 사용되는 염료는 대부분 BSC 인증 얼룩으로 구입할 수 있습니다.즉, 제조업체 배치의 샘플이 독립 기관인 BSC(Biological Chain Commission)에 의해 테스트되었으며 염색 기술에 있어 특정 순도, 염료 함량 및 성능 기준을 충족하거나 초과하여 보다 정확하게 수행된 실험과 보다 신뢰할 수 있는 결과를 보장하는 것으로 확인되었습니다.이러한 기준은 위원회의 Biotechnic & Histocemistry [3]저널에 게재되어 있습니다.많은 염료들은 한 공급 업체에서 다른 공급 업체로 조성이 일관되지 않습니다.BSC 인증 얼룩을 사용하면 예상치 못한 결과를 [4]얻을 수 있습니다.
일부 노점상들은 생물 염색 위원회가 아닌 자체적으로 "인증"된 얼룩을 판매한다.이러한 제품은 진단 및 기타 [5]용도에 적합하거나 적합하지 않을 수 있습니다.
아니요.

양성염색법이 실패하더라도 일반적으로 성공하는 세균의 간단한 염색법은 음성염색법을 사용하는 것이다.슬라이드에 샘플을 도포한 다음 니그로신(검은색 합성 염료) 또는 India 잉크(탄소 입자의 수성 부유액)를 도포하면 됩니다.건조 후, 미생물은 [6]밝은 필드 현미경 검사에서 주변의 어두운 환경과 잘 대비되는 가벼운 포함물로 볼 수 있다.미생물의 세포벽은 전형적으로 음전하를 띠어 음전하를 띤 얼룩을 물리치기 때문에 음염색은 유기체 대신 배경을 염색할 수 있다.네거티브 염색에 사용되는 염료는 [1]산성이다.참고: 음성 염색은 미생물을 파괴하지 않을 수 있는 가벼운 기술이기 때문에 병원균 연구에 적합하지 않습니다.
긍정적
네거티브 염색과 달리, 포지티브 염색은 밝은 배경에 시료를 색칠하기 위해 염기성 염료를 사용합니다.발색단은 음염색 및 양염색에 모두 사용되는 반면, 이 기술에 사용되는 발색단은 음염색체가 아닌 양전하 이온이다.많은 미생물의 음전하 세포벽은 양전하 색소를 끌어당겨 검체가 얼룩을 흡수하게 하여 사용하는 얼룩의 색을 만든다.미생물학에서는 음염색보다 양염색이 더 일반적으로 사용된다.다양한 유형의 양성 얼룩이 [1]아래에 나열되어 있습니다.
심플과 차분
심플 염색은 슬라이드에 한 번에 한 가지 타입의 얼룩만 사용하는 기술입니다.하나의 얼룩만 사용하므로 시료(양극 얼룩용) 또는 배경(음극 얼룩용)은 한 가지 색상이 됩니다.따라서 단순한 얼룩은 일반적으로 슬라이드당 하나의 유기체만 볼 때 사용됩니다.차등 염색은 슬라이드당 여러 개의 얼룩을 사용합니다.사용하는 얼룩을 기준으로 성질이 다른 유기체는 여러 개의 시료를 분류할 수 있도록 다른 색상으로 나타날 것이다.차등염색은 또한 내포자염색에서 [1]볼 수 있는 하나의 유기체 내의 다른 소기관들을 염색하는 데 사용될 수 있다.
종류들
| 시니어 | 염색법 | 준비 | 어플 | 결과 |
|---|---|---|---|---|
| 1. | 심플(단색) | 단일 염료로 얼룩을 도포합니다. 예: 메틸렌블루, 사프라닌 등 | 미생물 강조 및 세포 설명에 사용 모양과 배치 | 유기체는 착색된 색상으로 얼룩져 있다. |
| 2. | 네거티브(구제) | 니그로신과 혼합하여 펴 바르는 도말 박막으로 | 세포형태학을 연구하다 | 유기체는 얼룩지고, 배경은 검은색이다. |
| 3 | 그램 | 1차 오염:크리스털 바이올렛을 필름에 도포한 후 요오드(요오드), 알코올(탈색제), 사프라닌으로 얼룩진 카운터 | 그램 양성 또는 그램 음성 중 하나의 그룹으로 박테리아를 특징짓습니다. | 그램 양성(Gram positive)은 보라색으로 나타난다. 그램의 음성은 분홍색으로 나타난다. |
| 4 | 내산성(질-닐센 기술) | 핫 Z.N.C.F. 탈색(산알코올)으로 얼룩진 필름 및 메틸렌 블루로 얼룩진 카운터 | 탈색되지 않은 비탈색산속균과 착색된 비탈색산속균을 분리한다. | 내산성 세균:빨간. 비산성: 블루 |
| 5 | 내포자(도르의 방법) | 1차 착색 말라카이트 녹색열로 포자를 투과할 수 있습니다.생식세포는 사프라닌으로 대항합니다. | 박테리아 6개 속 내포자 존재 감지 | 내포자: 녹색 식물 세포: 빨간색 |
| 6 | 캡슐 A: Hiss 방법(긍정적 기법) B: 마네발스의 기술(부정적) | 황산구리 처리 후 히스 얼룩으로 얼룩진 도말 콩고의 붉은 색과 함께 박테리아 현탁액이 번져 마네반 얼룩이 묻었습니다. | 캡슐은 캡슐화된 박테리아 세포를 둘러싼 명확한 구역으로 관찰될 수 있으며 캡슐의 존재를 증명하는 데 사용됩니다. | 캡슐:옅은 보라색 / 옅은 보라색 세균:보라색 캡슐, 박테리아 세포 어두운 배경에서 눈에 띄는 |
| 7 | 세포벽(Dyar의 방법) | C.P.C.로 처리한 도말. 이 도말은 분해되어 양전하 세틸피리듐과 음전하 염화물 이온을 형성합니다.음전하를 띤 이온은 음전하를 띤 세포벽에 흡착됩니다. | 세균 세포벽 오염 | 세포벽: 붉은 세포질:파랑색 |
| 8 | 편모(리프슨법) | 매염제는 염색 전에 편모를 두꺼워지게 하는 작용을 하며, 라이프슨 염색 시 현미경으로 시인성을 높여줍니다. | 편모 유무를 나타냅니다. | 편모: 적색 식물 세포: 청색 |
| 9 | 핵물질(펄겐 기술) | 스미어는 가수분해 처리되어 DNA에서 푸린체를 방출하고 푸린체는 푸라노스에서 알데히드로의 전환을 일으킨다.알데히드기는 쉬프의 시약과 반응하여 추가 화합물을 형성할 수 있다. | 세포 내 DNA의 존재를 증명하기 위해서.그러나 DNA의 검출을 위해 RNA는 DNA에 영향을 주지 않고 산 가수분해로 선택적으로 파괴되어야 한다. | 핵물질 - 분홍빛이 도는 보라색 세포질-무색 |
| 10 | 메타크로마틱 과립(알베르츠법 | 먼저 지방을 제거하기 위해 클로로포름으로 도포하고, 톨루이딘 블루와 말라카이트 그린 등의 양이온성 염료를 함유한 알베르트 염색제를 도포합니다.톨루이딘 블루는 과립을, 말라카이트 그린은 세포질을 우선 오염시킨다. | 과립은 전형적인 단색 특성을 나타내며, 과립을 입증하는 데 사용됩니다. | 과립:푸르스름한 검은색, 세포질:초록의 |
| 11 | 세포내 지질(버든법) | 지질은 수단 블랙과 같은 지용성 염료로 얼룩져 있다.수단 블랙-B 염료를 도포하면 지질로 이동하여 유지되는 반면 세포질은 사프라닌에 의해 역염색된다. | 세포벽, 세포막 또는 지방구(세포질 내 PHB)에서 지질 유무를 감지 | 지질과립:진청색 세포질:연분홍 |
| 12 | 다당류(Hotch Kuss법) | 다당류는 과요오드산염으로 산화되어 시프의 시약과 반응하여 붉은색을 띠는 폴리알데히드를 형성하고, 세포질은 말라카이트 그린으로 착색되는 역작용을 한다. | 세포 내 다당류 과립의 축적을 검출한다. | 다당류:빨간. 세포질:초록의 |
기술
그램
그램 염색은 그램 상태를 세포벽의 조성에 따라 광범위하게 분류하기 위해 사용된다.그램 염색은 크리스털 바이올렛을 세포벽을 염색하기 위해, 요오드는 매염제로, 후크신 또는 사프라닌은 모든 박테리아에 대항하기 위해 사용합니다.그램 상태는 박테리아 검체를 두 그룹으로 나누는 데 도움이 되며, 일반적으로 그 기본 계통 발생을 나타냅니다.이러한 특성은 다른 기술과 결합되어 임상 미생물학 실험실에서 유용한 도구로 사용되며, 적절한 항생제의 [8]조기 선택에 중요한 역할을 할 수 있습니다.
대부분의 그램 염색제에서 그램 음성의 유기체는 그들의 대항제 때문에 붉거나 분홍색으로 보인다.높은 지질 함량이 존재하기 때문에 알코올 처리 후 세포벽의 다공성이 증가하여 CVI 복합체(크리스털 바이올렛 – 요오드)가 통과할 수 있습니다.따라서 1차 오염은 유지되지 않습니다.또한 대부분의 그램 양성균과 달리 그램 음성균은 몇 층의 펩티도글리칸과 주로 리포다당류로 이루어진 2차 세포막만을 가지고 있다.
내포자
내포자 염색은 박테리아를 죽이기 매우 어렵게 만드는 내포자의 유무를 확인하는 데 사용됩니다.박테리아 포자는 수성 염료 시약에 투과되지 않기 때문에 염색하기 어려운 것으로 입증되었습니다.내포자염색은 클로스트리듐 디피실 등의 내포자형성 세균병원체 식별에 특히 유용하다.보다 효율적인 방법이 개발되기 전에, 이 염색은 열 고정 및 반염색을 포함한 Wirtz 방법을 사용하여 수행되었습니다.말라카이트 그린과 카르볼 푸치신의 희석 비율을 사용하여, 오스미산에 박테리아를 고정하는 것은 염료의 혼합을 보장하는 좋은 방법이었다.그러나 새롭게 수정된 염색법으로 인해 이러한 얼룩을 만드는 데 걸리는 시간이 크게 단축되었습니다.이 개정안에는 5% 희석된 말라카이트 그린 공식과 짝을 이룬 카볼 후크신이 수성 사프라닌으로 대체되었다.이 새롭고 개선된 얼룩 구성은 열 고정, 헹굼 및 추후 검사를 위해 블롯 드라이를 사용하여 이전과 동일한 방식으로 수행되었습니다.검사 결과, 내포자를 형성하는 모든 세균은 녹색으로 염색되고 다른 세포들은 모두 붉은색으로 나타납니다.[9]
지엘 닐슨
지엘-닐센 염색은 그램 염색과 같은 표준 실험실 염색 절차로 염색되지 않는 결핵균의 종을 염색하는 데 사용되는 내산성 염색이다.
이 얼룩은 박테리아를 오염시키는 붉은 색상의 카르보푸친과 메틸렌 블루와 같은 카운터 얼룩을 모두 사용하여 수행됩니다.
헤마톡실린 및 에오신(H&E)
헤마톡실린과 에오신 염색은 얇은 조직 [10]단면을 검사하기 위해 조직학에서 자주 사용됩니다.헤마톡실린은 세포핵을 파란색으로 염색하고, 에오신은 세포질, 결합조직 및 기타 세포외 물질을 분홍색 또는 [10]빨간색으로 염색합니다.에오신은 적혈구에 강하게 흡수되어 밝은 붉은색을 띤다.교묘하게 제조된 H&E 제제는 적혈구가 거의 오렌지색이며 콜라겐과 세포질(특히 근육)은 다른 색조의 분홍색을 획득한다.
파파니콜라우
파피콜라우 염색, 즉 PAP 염색은 품질을 훼손하지 않고 염색 시간과 비용을 줄이기 위해 미세한 바늘 흡인 세포학(FNAC)을 대체하기 위해 개발되었습니다.이 얼룩은 다양한 장기의 다양한 조직 유형에서 세포 샘플을 검사하는 데 자주 사용되는 방법입니다.PAP 염색은 FNAC의 "적절한 대안"이 되기 위해 몇 가지 수정을 견뎌 왔습니다.이러한 변화는 공기 건조 로마노프스키 도말의 불투명한 외관에 반해 핵의 구조를 보존하는 과학자들에 의한 습식 고정 도말의 감상으로부터 비롯되었다.이것은 초고속 파파니콜라우 염색으로 알려진 습식 고정 염색과 공기 건조 염색의 혼합 염색으로 이어졌다.이 변형은 세포 투명성을 높이기 위해 세포를 재수화하기 위해 비염수를 사용하는 것을 포함하며 핵의 색을 향상시키기 위해 알코올 포르말린을 사용하는 것과 짝을 이룬다.파파니콜라우 염색은 형태학적 품질의 증가, 염색 시간 감소 및 비용 감소로 인해 현재 모든 장기 유형에서 세포학적 염색 대신 사용됩니다.Pap 도말 [11]검체를 염색하는 데 자주 사용됩니다.헤마톡실린, 오렌지 G, 에오신 Y, 연두색 SF 황색, 비스마르크 브라운 [10][11]Y의 조합을 사용합니다.[12]
PAS
[13]주기산 쉬프는 탄수화물(글리코겐, 당단백질, 프로테오글리칸)을 표시하는 데 사용되는 조직학적 특수 염색체입니다.PAS는 글리코겐 축적물이 만들어지는 간 조직에 일반적으로 사용되며, 글리코겐 축적물은 다양한 유형의 글리코겐 저장 질환을 구별하기 위해 행해진다.PAS는 신장의 방광과 신장뿐만 아니라 내분비계의 난소와 췌장의 종양에서 발견되는 글리코겐 과립을 검출할 수 있기 때문에 중요하다.기저막은 또한 PAS 얼룩에 나타날 수 있으며 신장 질환을 진단할 때 중요합니다.균사균의 세포벽 내 탄수화물과 효모 형태의 곰팡이 때문에, 주기산 쉬프 염색은 인체 조직 샘플 안에서 이러한 종들의 위치를 찾는데 도움을 줄 수 있습니다.
마손
마손의 트리크롬은 (이름에서 알 수 있듯이) 3색 염색 프로토콜입니다.이 레시피는 다양한 특정 용도에 대한 마손의 독창적인 기술에서 발전해 왔지만, 모두 주변 결합 조직과 세포를 구별하는 데 적합하다.대부분의 조리법은 붉은 케라틴과 근육 섬유, 콜라겐과 뼈의 청색 또는 녹색 염색, 세포질의 옅은 붉은색 또는 분홍색 염색, 그리고 검은 세포핵을 생성한다.
로마노프스키
로마노프스키 얼룩은 폴리크롬 염색 효과로 간주되며, 에오신 플러스(화학적으로 환원된 에오신)와 탈메틸화 메틸렌 블루(산화 생성물인 푸른색 및 푸른색)의 조합을 기반으로 합니다.이 얼룩은 모든 세포 구조에 대해 다양한 색을 발하고("로마노스키-젬사 효과") 호중구 다형과 세포핵을 염색하는 데 사용되었습니다.일반적인 변종으로는 라이트 염색, 제너 염색, 메이 그룬왈드 염색, 레이시만 염색, 젬사 염색 등이 있다.
모두 혈액이나 골수 샘플을 검사하는 데 사용됩니다.다양한 유형의 백혈구(백혈구)를 쉽게 구별할 수 있기 때문에 혈액 세포 검사에는 H&E보다 선호된다.모두 [14]말라리아와 같은 혈액 매개 기생충을 검출하기 위한 혈액 검사에도 적합합니다.
실버
은염색이란 은을 조직학적 단면을 염색하는 데 사용하는 것이다.이러한 종류의 염색은 단백질(예: III형 콜라겐)과 DNA의 입증에 중요하다.그것은 세포 내부와 외부의 두 가지 물질을 모두 보여줄 때 사용된다.은염색은 온도구배겔 전기영동에도 사용된다.
아르젠타핀 세포는 포르말린 고정 후 은 용액을 금속 은으로 환원시킨다.이 방법은 이탈리아 카밀로 골지(Camillo Golgi)가 질산은과 중크롬산칼륨의 반응을 이용하여 일부 세포에서 크롬산은을 침전시키는 방식으로 발견했다(골지 방법 참조).강직성 세포는 환원제가 함유된 얼룩에 노출된 후 은용액을 금속은으로 환원시킨다.이것의 예로는 하이드로퀴논이나 포르말린이 있다.
수단
수단염색제는 수단염료를 사용하여 친수단의 물질을 염색하는데, 종종 지질도 포함한다.수단 III, 수단 IV, 오일 레드 O, 사산화 오스뮴, 그리고 수단 블랙 B가 자주 사용된다.수단염색제는 지방질 진단 시 분변지방 수치를 측정하기 위해 종종 사용된다.
비르츠콩클린
Wirtz-Conklin 염색제는 말라카이트 그린 염료를 1차 염색제로, 사프라닌을 대염색제로 하여 진정한 내포자를 염색하기 위한 특수 기술입니다.한번 착색되면 탈색되지 않습니다.염색 과정에서 열을 추가하는 것은 큰 기여 [15]요인입니다.열은 포자의 막을 열어 염료가 들어갈 수 있도록 도와줍니다.이 얼룩의 주된 목적은 세균 포자의 발아를 보여주는 것이다.발아 과정이 진행되면 말라카이트 그린으로 인해 포자가 녹색으로 변하고 사프라닌으로 인해 주변 세포가 붉게 변한다.이 얼룩은 또한 세균 세포 내 포자의 방향을 결정하는데 도움을 줄 수 있습니다. 포자가 말단(끝), 하위 말단(세포 내), 또는 중앙(세포의 완전히 중앙) 중 어느 쪽이든 상관없습니다.
콜라겐하이브리징펩타이드
CHP(Cologen Hybridizing Peptide) 염색은 효소, 기계적, 화학적 또는 열적 수단을 통해 손상 또는 열화 여부에 관계없이 모든 유형(Type I, II, IV 등)의 변성된 콜라겐을 쉽고 직접적으로 염색할 수 있습니다.조직 내에서 사용 가능한 단일 가닥을 사용하여 콜라겐 삼중나선으로 리폴드하여 작동합니다.CHP는 간단한 형광 현미경으로 시각화할 수 있다.
일반적인 생물학적 오염
세포나 조직의 다른 부분에서 서로 다른 얼룩이 반응하거나 농축되며, 이러한 특성은 특정 부위나 영역을 드러내기 위해 사용됩니다.가장 일반적인 생물학적 얼룩 중 일부는 아래에 나열되어 있습니다.달리 표시하지 않는 한, 이 모든 염료는 고정된 세포와 조직과 함께 사용될 수 있다. 활력소 염료(생물에 사용하기에 적합)가 기재되어 있다.
아크리딘 오렌지
아크리딘 오렌지(AO)는 세포주기 결정에 유용한 핵산 선택형 형광 양이온 색소이다.이것은 세포 투과성이며, 중간 또는 정전기 흡인력에 의해 DNA 및 RNA와 상호작용합니다.DNA와 결합할 때, 그것은 플루오레세인과 스펙트럼상 매우 유사합니다.플루오레세인처럼 조직의 고체 샘플 표면에서 종래의 착색 세포를 역광하는 비특이적 염색체로서도 유용하다(형 형광 역광 염색체[16]).
비스마르크 브라운
비스마르크 갈색(또한 비스마르크 갈색 Y 또는 맨체스터 갈색)[17]은 산성 뮤신에 노란색을 부여합니다.가슴세포까지 강렬한 갈색으로 변합니다.이 얼룩의 디폴트 중 하나는 주변의 다른 구조물이 흐려지고 콘트라스트의 품질이 낮아지는 것입니다.유용하게 쓰려면 다른 얼룩과 짝을 이루어야 합니다.Bismark Brown과 함께 사용되는 일부 보완적 색상은 Hematoxylin과 Toluidine blue로 조직학 샘플 내에서 더 나은 대조를 제공합니다.
카르민
카르민은 글리코겐을 염색하는 데 사용되는 강렬한 붉은 색소이고, 카르민 알룸은 핵염색소이다.카민 얼룩은 매염제(일반적으로 알루미늄)를 사용해야 합니다.
쿠마시 블루
쿠마시 블루(또한 밝은 파란색)는 단백질을 강한 파란색으로 특이적으로 염색합니다.그것은 종종 젤 전기영동에 사용된다.
크레실 바이올렛
크레실 바이올렛은 신경 세포질의 산성 성분들을 보라색, 특히 니슬 체질로 염색합니다.뇌 연구에 자주 쓰입니다.
크리스털 바이올렛
크리스털 바이올렛은 적절한 매염제와 조합하면 세포벽을 보라색으로 물들인다.크리스탈 바이올렛은 그램 염색에 사용되는 얼룩입니다.
DAPI
DAPI는 자외선에 의해 들뜨고 DNA에 결합하면 강한 청색 형광을 보이는 형광성 핵염색체이며, DAPI는 A=T의 풍부한 반복 염색체와 결합한다.DAPI는 일반 투과 현미경 검사에서도 보이지 않습니다.살아있는 세포나 고정된 세포에서 사용될 수 있다.DAPI로 오염된 세포는 특히 [18]세포계수에 적합합니다.
어신
에오신은 세포질 물질, 세포막 및 일부 세포외 구조에 분홍색 또는 붉은색을 부여하여 헤마톡실린의 대용으로 가장 많이 사용됩니다.그것은 또한 적혈구에 강한 붉은색을 부여한다.에오신은 또한 그램 염색의 일부 변형 및 다른 많은 프로토콜에서 대항제로 사용될 수 있습니다.실제로 에오신이라고 불리는 매우 가까운 두 가지 화합물이 있습니다.가장 자주 사용되는 것은 에오신 Y(에오신 Y ws 또는 에오신 황색으로도 알려져 있음)입니다; 그것은 매우 약간 노란색을 띠는 주물을 가지고 있습니다.또 다른 에오신 화합물은 에오신 B(에오신 블루이쉬 또는 임페리얼 레드)로 매우 희미한 블루이쉬 캐스트를 가지고 있다.두 염료는 교환이 가능하며, 둘 중 하나를 사용하는 것은 선호와 전통에 관한 문제입니다.
브롬화 에티듐
브롬화 에티듐은 DNA를 서로 바꿔 염색하여 형광성 적색-오렌지색 착색을 제공합니다.건강한 세포를 염색하지는 않지만, 아포토시스 마지막 단계에 있는 세포를 식별하는데 사용될 수 있습니다 – 그러한 세포는 훨씬 더 많은 투과막을 가지고 있습니다.따라서 브롬화 에티듐은 세포군 내에서의 아포토시스 및 겔 전기영동 중 DNA 띠의 위치 결정 마커로 자주 사용된다.이 얼룩은 또한 활성 세포 계수에서 아크리딘 오렌지(AO)와 함께 사용될 수 있다.이 EB/AO 결합 염색은 살아있는 세포가 녹색 형광을 띠게 하는 반면 아포토시스 세포는 독특한 적색-오렌지 형광을 유지합니다.
산후크신
산푸친은 콜라겐, 평활근 또는 미토콘드리아를 염색하기 위해 사용될 수 있다.Mallory의 트리크롬법에서 산푸친은 핵염색 및 세포질염색제로 사용된다.마손의 트리크롬 변종에서 산성 후크신이 세포질을 오염시킨다.반기슨의 피크로푸신은 콜라겐 섬유에 붉은색을 부여한다.산성 후크신은 또한 미토콘드리아의 전통적인 염색체이다.
헤마톡실린
헤마톡실린(북미에서는 헤마톡실린)은 [10]핵염색제이다.매염제, 해마톡실린 염색핵, 청자색 또는 [10]갈색과 함께 사용합니다.조직학에서 가장 일반적인 절차 중 하나인 H&E 염색(해마톡실린 및 에오신)[10]에 에오신과 함께 가장 많이 사용됩니다.
훅스트 얼룩
Hoechst는 DNA의 작은 홈에 결합하는 Bis-benzimidazole 유도체 화합물로, 형광현미경 검사에서 DNA 염색에 많이 사용되며, Hoechst 얼룩은 수용액에 녹으면 노란색으로 보이고 UV 들뜸에서 푸른 빛을 방출한다.Hoechst에는 크게 두 가지 유형이 있습니다.Hoechst 33258 및 Hoechst 33342.그 두 화합물은 기능적으로는 비슷하지만 구조가 조금 다르다.Hoechst 33258은 말단 하이드록실기를 포함하고 있어 수용액에 더 잘 용해되지만, 이러한 특성은 플라즈마막 투과 능력을 감소시킨다.Hoechst 33342는 말단 하이드록실기(에틸에테르기)에 에틸 치환을 포함하고 있어 혈장막 통과를 용이하게 하기 위해 소수성을 더 높인다.
요오드
요오드는 화학에서 전분의 지표로 사용된다.녹말과 요오드를 용액에 섞으면 진한 파란색이 나타나 녹말/요오드 복합체를 나타냅니다.녹말은 대부분의 식물 세포에 흔한 물질이기 때문에 약한 요오드 용액은 세포에 존재하는 녹말을 얼룩지게 할 것이다.요오드는 미생물학에서 사용되는 그램 염색으로 알려진 염색 기술의 한 성분이다.그램의 염색에 매염제로 사용되는 요오드는 세포벽/막 내에 존재하는 모공을 통해 염료의 입구를 강화합니다.
루골의 용액 또는 루골의 요오드(IKI)는 녹말이 있으면 검게 변하는 갈색 용액으로 세포 염색제로 사용될 수 있어 세포핵이 더 잘 보이게 한다.
일반적인 식초(초산)와 함께 사용되는 루골의 용액은 생체검사 준비에 대한 "Pap smear" 후속 검사 동안 자궁경부 및 질 조직의 암 발생 전 변화를 확인하는 데 사용됩니다.아세트산은 비정상적인 세포가 하얗게 변하게 하는 반면, 정상 조직은 [19]요오드로부터 마호가니 브라운을 염색하게 한다.
말라카이트 그린
말라카이트 그린(다이아몬드 그린 B 또는 빅토리아 그린 B라고도 함)은 히메네즈 박테리아 염색 기술에서 사프라닌에 대한 청록색 대항제로 사용될 수 있습니다.포자를 직접 염색하는 데도 사용할 수 있습니다.
메틸그린
메틸그린은 형광 현미경뿐만 아니라 밝은 영역과 함께 세포의 염색질을 더 쉽게 볼 수 있도록 염색하는 데 일반적으로 사용됩니다.
메틸렌블루
메틸렌 블루는 인간의 볼 세포와 같은 동물의 세포를 염색하여 그들의 핵을 더 잘 관찰할 수 있도록 하는데 사용된다.세포학에서 혈액막을 염색하는데도 사용되죠
뉴트럴 레드
중성 적색(또는 톨루이렌 적색)은 Nissl 물질을 빨간색으로 오염시킵니다.그것은 보통 다른 염료와 함께 대향료로 사용된다.
나일 블루
나일 블루(또는 나일 블루 A)는 핵을 파란색으로 염색합니다.살아있는 세포와 함께 사용될 수 있다.
나일 레드
나일 레드(나일 블루 옥사존이라고도 함)는 나일 블루를 황산으로 끓여 형성됩니다.이것은 나일 빨강과 나일 파랑의 혼합물을 만들어냅니다.나일 레드는 친유성 염색체이다; 그것은 세포 내부의 지질 구덩이에 축적되어 붉게 물들일 것이다.나일 레드는 살아있는 세포와 함께 사용될 수 있다.지질로 분할하면 형광이 강하게 발생하지만 수용액에서는 전혀 발생하지 않습니다.
사산화 오스뮴(정식명: 사산화 오스뮴)
사산화 오스뮴은 광학 현미경 검사에서 지질을 염색하는 데 사용된다.그것은 지방으로 분해되어 유기 물질에 의해 눈에 잘 띄는 검은 물질인 원소 오스뮴으로 환원된다.
요오드화 프로피듐
요오드화 프로피듐은 세포를 염색하는 데 사용될 수 있는 형광성 인터칼레이션제이다.요오드화프로피듐은 세포주기 분석에서 세포의 생존성 또는 DNA 함량을 평가하기 위한 흐름 세포측정법에서 DNA 염색체로서 또는 핵 및 다른 DNA를 포함한 소기관들을 가시화하기 위한 현미경 검사에서 사용된다.요오드화 프로피듐은 살아있는 세포의 막을 통과할 수 없기 때문에 괴사, 아포토시스, 건강한 세포를 구별하는 데 유용하다.PI는 또한 RNA와 결합하며, RNA와 DNA 염색의 구별을 위해 핵산 분해 효소에 의한 치료가 필요하다.
로다민
로다민은 형광 현미경 검사에 일반적으로 사용되는 단백질 특이 형광 염색체이다.
사프라닌
사프라닌(또는 사프라닌 O)은 적색 양이온 염료입니다.그것은 연골세포와 비만세포의 글리코사미노글리칸, 그리고 [21]식물조직의 리그닌과 플라스티드의 성분들을 포함한 핵과 다른 조직 폴리아니언에 결합합니다.사프라닌은 동물(인간 포함) 조직의 핵과 세포질에 다른 염료에 의해 부여되는 파란색과 빨간색과 대조하기 위해 콜라겐에 노란색을 부여하기 위해 사용되는 값비싼 천연 염료인 샤프란과 혼동해서는 안 된다.
잘못된 철자 "safranin"이 일반적으로 사용되고 있습니다.사프라닌 O는 아민 [4][22][23]색소이므로 -ine 엔딩이 적합합니다.
조직의 착색성
얼룩을 흡수하는 조직을 유색 조직이라고 한다.염색체는 보라색 얼룩을 흡수하는 능력 때문에 이름이 붙여졌다.
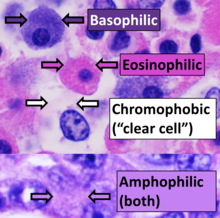
특정 얼룩에 대한 양성 친화력은 접미사 - philic로 지정될 수 있다.예를 들어, 청색 얼룩으로 얼룩진 조직을 아즈로필릭(Azurophyronic)이라고 할 수 있다.또한 산성염색(특히 에오신)에 의해 염색되는 조직에 대한 산성염색성, 염기성 염료에 염색될 때 호염기성, 산염색 또는 염기성 염료로 염색될[24] 때 호염기성 등 보다 일반적인 염색성에도 사용될 수 있다.반면에, 색소 공포증 조직은 색소를 쉽게 흡수하지 않는다.
전자 현미경 검사
광현미경 검사와 마찬가지로 투과 전자현미경 검사에서도 대비를 높이기 위해 얼룩을 사용할 수 있다.일반적으로 중금속의 전자 밀도가 높은 화합물이 사용된다.
포스포퉁스트산
[25]포스포퉁스틴산은 바이러스, 신경, 다당류, 그리고 다른 생체 조직 물질에 대한 흔한 음성 염색체이다.중성인 0.5~2% ph 형태로 주로 사용되며 물과 결합하여 수용액을 만든다.포스포퉁스트산은 검체를 둘러싼 배경을 어둡게 하고 검체 자체를 밝게 하는 전자 밀도가 높은 물질로 채워져 있다.이 과정은 검체가 어둡고 배경이 밝은 곳에 염색하는 일반적인 양성 기법이 아니다.
사산화 오스뮴
사산화 오스뮴은 광학 현미경 검사에서 지질을 염색하는 데 사용된다.그것은 지방으로 분해되어 유기 물질에 의해 눈에 잘 띄는 검은 물질인 원소 오스뮴으로 환원된다.그것은 전자를 흡수하는 중금속이기 때문에, 아마도 생물학적 전자 현미경 검사에서 형태학에 사용되는 가장 흔한 얼룩일 것이다.또한 TEM에 의한 형태학 연구를 위해 다양한 폴리머의 염색에도 사용됩니다.OsO는
4 매우 휘발성이 높고 매우 독성이 강하다.오스뮴의 산화수는 +8이므로 강한 산화제입니다.많은 물질을 적극적으로 산화시켜 비휘발성 오스뮴의 퇴적을 낮은 산화 상태로 남깁니다.
사산화 루테늄
사산화 루테늄은 마찬가지로 휘발성이 높고 사산화 오스뮴보다 더 공격적이며, 폴리에틸렌과 같은 오스뮴 얼룩에 저항하는 물질도 염색할 수 있습니다.
전자현미경 염색에 사용되는 기타 화학물질은 몰리브덴산암모늄, 요오드화카드뮴, 카르보히드라지드, 염화제철, 헥사민, 삼염화인듐, 랜턴(II) 질산염, 아세트산납, 구연산납, 납()이다.II 질산, 주기산, 포스포몰리브디산, 펠리시안화칼륨, 페로시안화칼륨, 루테늄레드, 질산은, 단백질산은, 클로로아우르산나트륨, 질산탈륨, 티오세미카르바지드, 아세트산우라닐, 질산우라닐 및 황산바나딜.
「 」를 참조해 주세요.
- 생물학적 오염 위원회:타사 품질관리 및 오염증명
- 세포학: 세포 연구
- 조직학: 조직의 연구
- 면역조직화학: 특정 항원을 표시하기 위해 항혈청 사용
- 루테늄(Ruthenium)II) 단백질 염료인 트리스(바토페난트로린 디술폰산염).
- 바이탈 얼룩 : 세포를 죽이지 않는 얼룩
- 페이지: 단백질 분자의 분리
- 바륨 관장 - 광스펙트럼의 X선 부분에서 대조를 만드는 생체 내 염색의 일종
- 발췌
레퍼런스
- ^ a b c d Parker N (2012). Microbiology. OpenStax.
- ^ a b Pommerville JC (2017). Fundamentals of Microbiology. Vol. I. Jones & Bartlett Learning. pp. 248, 249. ISBN 978-1-284-10095-2.
- ^ Penney DP, Powers JM, Frank M, Willis C, Churukian C (2002). "Analysis and testing of biological stains--the Biological Stain Commission Procedures". Biotechnic & Histochemistry. 77 (5–6): 237–75. doi:10.1080/714028210. PMID 12564600.
- ^ a b Horobin R, Kiernan J, eds. (2002). Conn's Biological Stains: A Handbook of Dyes, Stains and Fluorochromes for Use in Biology and Medicine. Taylor & Francis. ISBN 978-1-85996-099-8.
- ^ "Vendors List - The Biological Stain Commission". biologicalstaincommission.org. Retrieved 25 March 2018.
- ^ Clark G (1981). Staining Procedures (4th ed.). Baltimore: Williams & Wilkins. p. 412. ISBN 978-0-683-01707-6.
- ^ Elementary Microbiology Vol - I.
- ^ Stone, Rebecca B.; Steele, John C. H. (2009-07-01). "Impact of Reporting Gram Stain Results From Blood Cultures on the Selection of Antimicrobial Agents". American Journal of Clinical Pathology. 132 (1): 5–6. doi:10.1309/AJCP9RUV0YGLBVHA. ISSN 0002-9173. PMID 19864226.
- ^ Schaeffer AB, Fulton MD (February 1933). "A Simplified Method of Staining Endospores". Science. 77 (1990): 194. Bibcode:1933Sci....77..194S. doi:10.1126/science.77.1990.194. PMID 17741261.
- ^ a b c d e f Bancroft J, Stevens A, eds. (1982). The Theory and Practice of Histological Techniques (2nd ed.). Longman Group Limited.
- ^ a b Gill GW (2013). "Papanicolaou Stain". Cytopreparation. Essentials in Cytopathology. Vol. 12. pp. 143–189. doi:10.1007/978-1-4614-4933-1_10. ISBN 978-1-4614-4932-4. ISSN 1574-9053.
- ^ Thakur M, Guttikonda VR (2017). "Modified ultrafast Papanicolaou staining technique: A comparative study". Journal of Cytology. 34 (3): 149–153. doi:10.4103/JOC.JOC_23_16. PMC 5492752. PMID 28701828.
- ^ "Periodic Acid-Schiff (PAS): Diagnostic Applications - LabCE.com, Laboratory Continuing Education". labce.com. Retrieved 2020-04-16.
- ^ Bezrukov AV (2017-01-02). "Romanowsky staining, the Romanowsky effect and thoughts on the question of scientific priority". Biotechnic & Histochemistry. 92 (1): 29–35. doi:10.1080/10520295.2016.1250285. PMID 28098484. S2CID 37401579.
- ^ Corey L (March 1986). "Laboratory diagnosis of herpes simplex virus infections. Principles guiding the development of rapid diagnostic tests". Diagnostic Microbiology and Infectious Disease. 4 (3 Suppl): 111S–119S. doi:10.1016/s0732-8893(86)80049-9. PMID 3009082.
- ^ Wells J (1988). "A Technique for Staining the Superficial Cells of Plucked Hair Follicles and Other Solid Tissues". Stain Technology. 63 (3).
- ^ Tomov N, Dimitrov N (2017). "Modified bismarck brown staining for demonstration of soft tissue mast cells" (PDF). Trakia Journal of Sciences. 15 (3): 195–197. doi:10.15547/tjs.2017.03.001.
- ^ Levenfus I (2011). An efficient method for counting DAPI-stained cells using Fiji. Munich: Grin. ISBN 978-3-640-86284-9.
- ^ Sellors JW, Sankaranarayanan R (eds.). "Chapter 4: An introduction to colposcopy: indications for colposcopy, instrumentation, principles and documentation of results". Colposcopy and treatment of cervical intraepithelial neoplasia: a beginners' manual. The World Health Organization. Archived from the original on 31 January 2019.
- ^ Prieto D, Aparicio G, Morande PE, Zolessi FR (September 2014). "A fast, low cost, and highly efficient fluorescent DNA labeling method using methyl green". Histochemistry and Cell Biology. 142 (3): 335–45. doi:10.1007/s00418-014-1215-0. PMID 24671497. S2CID 11094194.
- ^ 베를린 GP, Miksche JP(1976).식물학 마이크로테크놀로지와 세포화학.아이오와 주립 대학 출판부입니다.
- ^ 베이커 JR(1958)생물학적 미세기술의 원리 329 ff. 페이지런던:메튜엔.
- ^ Kiernan JA (2001). "Classification and naming of dyes, stains and fluorochromes". Biotechnic & Histochemistry. 76 (5–6): 261–78. doi:10.1080/bih.76.5-6.261.278. PMID 11871748. S2CID 32479873.
- ^ thefreedictionary.com > 호호성 인용: Saunders Comprehensive Netrical Dictionary, 2007년 3월 3일자 Elsevier, Inc.
- ^ "Negative Staining Central Microscopy Research Facility". cmrf.research.uiowa.edu. Retrieved 2020-04-16.
추가 정보
- Bancroft JD, Gamble M, eds. (2002). Theory and Practice of Histological Techniques (5th ed.). London: Churchill-Livingstone. ISBN 978-0-443-06435-7.
- Kiernan JA (2015). Histological and Histochemical Methods. Theory and Practice. Banbury, UK: Scion. ISBN 978-1-907904-32-5.
- Presnell JK, Schreibman MP (1997). Humason's Animal tissue Techniques (5th ed.). Baltimore: Johns Hopkins University Press.
- Ruzin SE (1999). Plant Microtechnique and Microscopy. New York: Oxford University Press. ISBN 978-0-19-508956-1.
외부 링크
| 라이브러리 리소스 정보 염색 |
- 생물학적 착색 위원회는 1920년대 초부터 염료를 테스트하고 국제적으로 공인된 기준에 부합하는 염료 배치에 대해 승인 인증서를 발급해 온 독립 비영리 기업입니다.
- 염색 및 염색 기술에 대한 StainsFile 참조.
- 원생동물용 바이탈 염색 및 관련 임시 장착 기술 ~ Howey, 2000
- 고정에 대해 말하자면: 파트 1과 파트 2 – M에 의한.할리트 우마르
- 조직학적 얼룩 사진
- Sridhar Rao P에서의 염색 연습에 관한 자주 묻는 질문.N의 홈페이지