데스 이펙터 도메인
Death effector domain| 데스 이펙터 도메인 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 FADD(Mort1) 사망-영향력 영역의 구조.[1] | |||||||||||
| 식별자 | |||||||||||
| 기호 | 디디 | ||||||||||
| Pfam | PF01335 | ||||||||||
| 인터프로 | IPR001875 | ||||||||||
| 스마트 | 디디 | ||||||||||
| 프로사이트 | PS50168 | ||||||||||
| SCOP2 | 1a1z / SCOPe / SUPFAM | ||||||||||
| CDD | cd00045 | ||||||||||
| |||||||||||
데스-이펙터 도메인(DED)은 다양한 세포 신호 전달 경로를 조절하는 진핵생물에서만 발견되는 단백질 상호작용 영역이다.[2]DED 도메인은 비활성 프로스파아시스(시스틴 프로테아제)와 FAS 관련 사망영역 함유 단백질(FADD)과 같은 세포사멸 폭포에서 캐스파아제 활성화를 조절하는 단백질에서 발견된다.FADD는 8번 생식을 모집하고 10번 생식을 DISC(Death Induced Signal Complex)로 한다.이 모집은 활성 TNF 수용체와 직접 연관된 어댑터 단백질에서 프로스파아세제 DED와 데스 이펙터 영역인 두 번째 DED 사이의 동형 상호작용에 의해 매개된다.복잡한 형성은 활성 카스파아제 형태로 프로테아플라세스를 활성화하여 세포사멸( 세포사멸)을 일으킬 수 있다.구조적으로 DED 영역은 데스폴드라고 알려진 단백질 모티브의 하위 등급으로 6개의 알파 나선형을 포함하고 있는데, 이는 데스 도메인(DD)의 구조와 매우 흡사하다.
구조
DED는 DD 슈퍼 패밀리의 하위 제품군(이 슈퍼 패밀리에서 인지할 수 있는 다른 도메인은 캐스파이스-채용 도메인(CARD), 피린 도메인(PYD), 데스 도메인(DD)이다.서브패밀리는 구조적으로 서로 닮아 있으며, 모두(특히 DED) 6개의 알파헬리크로 구성된 묶음으로 구성되지만, 표면적인 특징에서는 갈라진다.
이 보호영역의 완전한 일차적 구조는 합의로 정의되지 않았다.일부 연구에서는 잔류물 2-184를 설명했지만 C-terminus와 N-terminus 잔류물은 아직 확인되지 않았다.DED에 대한 용해성과 집적을 결정하는 아미노산의 존재는 캐스파제-8과 MC159와 같은 다른 단백질에서 DED를 식별할 수 있게 했다.그 도메인의 2차 구조는, 말했듯이, 6개의 알파헬리츠에 의해 구축된다.
그 영역의 3차 구조는 인간의 카스파아제 8의 결정체로부터 설명되어 왔다.구조를 설명하기 위해 사용된 방법은 X-RAY 회절이었고 얻은 분해능은 2.2 å이다.[3] 이 단백질에서 DED는 비대칭 단위 조광기를 보여주는데, 그것의 인터페이스는 필라멘트 구조로 보이는 두 개의 수소 본딩 네트워크를 포함하고 있다.DED의 기능은 그 구조에 의해 결정된다.알려진 한, 카스파제와 트리거 사멸을 활성화하는 동형 상호작용은 파트너 사이의 비대칭 표면 접촉에 의해 매개된다(카스파제-8 케이스의 DED1과 DED2와 같은).[4]표면을 형성하는 잔여물은 전형적으로 충전된 아미노산이지만, 도메인의 상호작용 표면에서도 짧은 소수성 패치를 관찰할 수 있다.
함수
DED 도메인은 사멸에 대한 역할로 가장 잘 알려져 있다.그러나 DED를 함유한 단백질은 다른 세포 과정에도 관여하여 생사와 사물의 세포 결정을 모두 통제한다.
외인성 사포증
[5] 세포사멸은 유기체 수명주기 동안 이점을 혼란시키는 통제되고 프로그램된 세포사멸이다.외인성 경로는 사망 자극에 반응하여 활성화되는 보호자 가족에 의해 지시한다.이 과정에서 DED의 역할을 아는 것은 신호화 복합체(DISC)를 포함한 다단백질 죽음의 형성을 관찰하는 것이 중요하다.
DR4, TRAIL-R2 및 CD95는 세포내 사망영역(DD)을 사용하여 함께 상호작용하는 사망수용체(TNF 수용체 슈퍼 패밀리의 구성원)이다.그러면 DED를 포함하는 단백질인 FADD의 DD는 설명한 DD와 상호작용을 할 수 있다.여기서 FADD DED의 기능은 FADD를 자체 연관시켜 안정화된 구조를 만드는 것이다.
[6] 이러한 상호작용은 헬리케스 α1/α4 및 α2/α3으로 정의된다: 잔류물 Ser1, Val6, His9, Leu43, Asp44 및 α1/α4의 Glu51이 두 번째 분자의 α2/α3에서 Thr21, Phe25, Lys33, Arg34, Glu37 및 Glu51과 접촉한다.각각의 상호작용은 1062 å의2 면적과 소수성 측 체인, 수소 결합 및 염교로부터의 기여를 포함한다.최종 호모디머는 각 하위 유닛이 2개의 상호 작용 사이트를 가질 수 있도록 구조 지향성을 가진다.
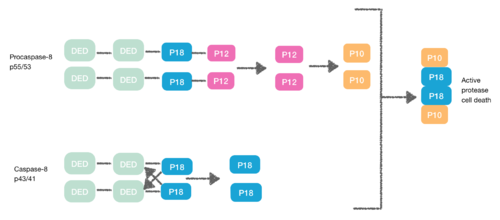
Procaspase-8은 또한 DED를 함유하는 단백질로서 FADD DED에 친화력을 가지고 있다.그들이 DED를 통해 FADD에 모노머로 채용되는 것은 그런 이유 때문이다.이러한 상호작용은 proapase-8 DED-A의 α1/α4와 FADD DED의 α2/α3 또는 fADD DED의 α1/α4와 proapase-8 DED-B의 α2/α5로 정의된다.Procaspase-8 DED-B는 FADD 및 DED-A와 상호작용하며, 또는 그 반대로 Capase-8 체인 형성을 매개한다.그러나 두 경우 모두 교호작용으로 인해 생식 사이에 조광기가 생성되어 순응적 변화가 발생한다.이러한 조광은 활성 사이트를 만드는 데 필수적이다; p12 하위 유닛이 해방되고 이후 작은 p10 하위 유닛으로 처리된다.Procapase-8의 두 분자는 이 p10 하위 단위가 활성 단백질 분해효소-8 세포 사멸을 일으키는 것과 연관되어 있다.[7][8]
괴사증
[9] 또한 DISC 프로카스파제-8을 생성하는 동안L FLIP로 알려진 또 다른 DED 함유 단백질과 이질화시킬 수 있다.FLIF의L 사이비 카스파아제는 카파제-8의 N-terminus와 매우 유사하지만 활성 부위에서 중요한 돌연변이(시스틴에서 티로신까지)가 발생하는 두 개의 탠덤 DED를 가지고 있다.
그들의 DED들 사이에 행해지는 이 이이성 자극은 사이비-카스파제가 사멸성 폭포를 활성화할 수 없도록 정상적인 호모디메이션을 방지한다.FLIFL 의 의사-카스파아제는 순응적 변화를 유도하는 데 더 효율적이다.그러나 FLIP는L 효소 활성도가 충분하지 않아 DED와 p18 사이의 갈라짐은 불가능하다.그 결과 활성 단백질 분해효소 세포죽음을 만드는 것은 불가능하다.[10]
Procaspase-8은 또한 단백질을 함유한 DED인 FLIP로S 이질화 할 수 있다.이 경우 초기 순응적 변화가 프로스파제-8의 캐스파제 영역에서 발생할 수 없으므로 이성애자화가 직접 프로스파제-8을 활성화하지 못한다.[10]
이것이 DED가 세포사멸의 폭포도 억제할 수 있는 방법이며, 그 결과는 괴사증이다.
DED 단백질 제품군
DED 함유 단백질
Caspase-8과 Caspase-10
[11] 캐스파아제는 세포가 사멸하는 동안 분해를 담당하는 시스테인 보호제다.
이 단백질들은 지모균이고 분자 내의 특정 부위에서 갈라진 후에 활동한다.
구조:
- 데스 이펙터 도메인(DED)과 캐스파이스 모집 도메인(CARD)은 N-terminus에 위치한 프로 도메인이라는 구조로 엔글로브 되어 있다.
- C-terminus의 촉매 프로테아제 영역.
프로테아제에는 다음과 같은 그룹이 있다.
- 이펙터 캐스페이즈: 세포사멸 중에 발생하는 형태학적 변화의 가장 큰 부분을 유도한다.
- 이니시에이터 캐스페이스: 이펙터 캐스패스의 활성화 담당.이러한 캐스파이스는 단백질을 기능적으로 만드는 과점화와 갈라짐을 통해 활성화된다.
카스파제의 친영역에 있는 두 개의 탠덤 DED는 FADD와 같은 다른 단백질과의 단백질-단백질 상호작용을 유도한다.
캐스퍼스는 세포의 필요성에 따라 세포사멸을 조절할 뿐만 아니라 억제하기 때문에 캐스퍼스를 연구하는 것이 중요하다.과학자들은 그것들이 세포 수명을 조절할 수 있는 메커니즘이며 암 치료에 중요하다는 것을 발견한다.
FLICE 유사 억제 단백질(FLIP)
FLICE와 같은 억제 단백질(FLIPs)은 세포 사멸을 일으키는 죽음의 수용체들의 신호를 막을 수 있는 세포 억제제다.
확인된 첫 번째 FLIF는 γ-herpes 바이러스에 의해 표현되었기 때문에 v-FLIPs라고 불렸다.이들 v-FLIP는 사망유도 신호복합체(DISC)에서 수용체와 결합할 수 있어 CD95 매개 세포사멸을 차단했다.
vFLips는 주로 2개의 순차 DED를 포함하며, 이는 캐스파제-8의 N-terminus에 매우 동질적이다.
[10] v-FLIP의 세포 호몰로어는 일반적으로 두 가지 형태로 표현된다.
- c-FLIP(짧은 길이): 아미노-단자 탠덤 DED와 그 뒤에 짧은 카복시-단자 단면만 들어 있다.그것의 구조는 바이러스성 플립과 비슷하다.
- c-FLIP(긴 길이): 탠덤 DED뿐만 아니라 활성 사이트 시스테인을 포함하여 프로테아제 활성 아미노산을 위해 서로 다른 중요성이 있는 프로테아제 유사 도메인(호몰로쿠스 투 카스파제-8)으로 구성된다.
[12] c-FLIP의 두 형태는 모두 CD95 DISC로 초안되며, 여기서 그들은 캐스파제-8로 이질화한다. c-FLIP는 CD95 수용체를 NF-118B, JNK 및 MAPK 경로에 연결하는 대체 경로 신호에 관여해왔다.
PEA-15/PED
PEA-15(Astrocytes-15 kDa 농축)는 PED(Phosphoprotein Foreigned in Phantosphytes-15 kDa)로도 알려져 있으며, 플리토프 효과가 있는 DED 함유 단백질이다.
PED는 N-단자 데스-이펙터 영역(DED)과 불규칙한 구조를 가진 C-단자 꼬리로 구성된 작고 비-촉성 단백질이다.[13]PED/PEA-15는 DED를 포함하거나 포함하지 않고 다양한 유형의 단백질과 상호작용하며, 이러한 단백질을 결합하는 그것의 특수성은 C-단자 꼬리의 두 세린 잔류물에 대한 인산화에 의해 매개된다.
- Ser104: 단백질 키나아제 C(PKC)에 의해 인산염 처리됨.
- Ser116: 칼슘/칼모둘린 의존 단백질 키나아제 II(CamKIII)용 기질.
[13] PEA-15는 몇 가지 신호 폭포에서 항응축성 DED 단백질로 작용한다.TNF α-, CD95- 및 TRAIL 매개 경로에서 PEA-15는 FADD와 캐스파제-8 상호작용을 구속하고 방해한다.
[10] PEA-15는 사멸 외에도 근육 세포의 인슐린 매개 포도당 이동을 억제하므로 PEA-15의 mRNA의 높은 수준의 발현이 당뇨병 제2형과 연관되어 왔다.
DEDD/DEDD2
DNA 결합(DEDD)을 포함하는 데스 이펙터 도메인.DNA 결합 능력을 보여주며, 과다압압축의 핵에서 그것이 사멸을 촉진하는 DEDAF (DED 관련 인자)라고 불리는 분자와 연관된다.게다가 DNA에 결합하여 RNA 중합효소 I 전사를 차단한다.
DEDD2(FLAME-3)는 아미노산성 수열의 48.5%를 공유하는 DEDD 호몰로뉴다.c-FLIP 및 DEDD와 상호작용하고 중합효소 II 의존적 전사 억제에 중요한 역할을 하는 것으로 알려져 있다.
HIP-1과 HIPI
헌팅틴 상호작용 단백질-1(HUP-1)은 헌팅틴(Htt)과 상호작용하는 단백질로, 헌팅턴병(HD) 환자들의 뇌에서 돌연변이(확대된 폴리글루타민 반복)가 단백질 골재를 형성하는 또 다른 단백질이다.
[14] HIP-1은 유사 데스 이펙터 영역(pED)을 포함하고 있으며, 그래서 HIP-1의 과도한 압박은 DED 단백질처럼 여러 세포의 세포사멸을 유도한다.이러한 유형의 사멸은 HIP-1의 pED에 따라 달라지는데, 야생형 Htt가 표현되면 감소되는 효소인 caspase-3의 활성화에 구성되는데, 그 사실은 HIP-1이 Hott와 Huntington 질병의 병리학에서 협력한다는 것을 시사한다.
[10] 효모 2-하이브리드 스크리닝에 의해 HIP-1은 HIPI(HIP-1 단백질 인터랙터)라고 불리는 419개의 아미노산 단백질과 상호작용하는 것으로 나타났다.HIPI의 존재가 HIP-1 유도 사멸을 결정한다는 것이 후속 실험에서 밝혀졌다.
플래시
플라이스와 연관된 거대한 단백질.DED와 비슷한 도메인을 포함하고 있지만, 호몰로지(homology)는 매우 약하고 그 기능은 여전히 불분명하다.
DED를 이용한 치료법
[7] DED 콤플렉스는 생명과 죽음의 세포 과정을 통제하는 중요한 단계에서 기능하는 것으로 나타났다.이러한 지식은 세포 수명에 대한 비정상적인 조절과 관련된 병리학이 너무나 많기 때문에 치료에 특히 유용하다.
사멸의 부재는 암의 특징이다.유전자 인코딩 procaspase-8이 메틸화에 의해 침묵되는 경우도 있으므로 후생유전학적 치료법을 사용하여 유전자를 활성화시켜 활성 프로테아제를 갖는 것이 필요하다.다른 경우에는 활성 캐스파아제의 형성을 막는 항중독성 분자인 FLIP의 과도한 압박이 있다.이 경우 FLIF 표현을 하향 조절하는 항암제가 있다.
그러나 암에서 배타적이지 않은 비정상적 사멸은 염증, 신경퇴행성 질환과 같은 다른 병리학들이 있는데 이러한 종류의 치료법으로 치료할 수 있는 병리학도 있다.
참조
- ^ Eberstadt M, Huang B, Chen Z, et al. (April 1998). "NMR structure and mutagenesis of the FADD (Mort1) death-effector domain". Nature. 392 (6679): 941–5. doi:10.1038/31972. PMID 9582077. S2CID 4370202.
- ^ Valmiki MG, Ramos JW (March 2009). "Death effector domain-containing proteins". Cell. Mol. Life Sci. 66 (5): 814–30. doi:10.1007/s00018-008-8489-0. PMID 18989622. S2CID 13117680.
- ^ Shen, Chen; Yue, Hong; Pei, Jianwen; Guo, Xiaomin; Wang, Tao; Quan, Jun-Min (2015). "Crystal structure of the death effector domains of caspase-8". Biochemical and Biophysical Research Communications. 463 (3): 297–302. doi:10.1016/j.bbrc.2015.05.054. ISSN 0006-291X. PMID 26003730.
- ^ "Structures, Domains and Function in Cell Death".
- ^ Elmore, Susan (2007). "Apoptosis: A Review of Programmed Cell Death". Toxicologic Pathology. 35 (4): 495–516. doi:10.1080/01926230701320337. ISSN 1533-1601. PMC 2117903. PMID 17562483.
- ^ Singh, Nitu; Hassan, Ali; Bose, Kakoli (2015). "Molecular basis of death effector domain chain assembly and its role in caspase-8 activation". The FASEB Journal. 30 (1): 186–200. doi:10.1096/fj.15-272997. ISSN 1530-6860. PMID 26370846.
- ^ a b Riley, JS; Malik, A; Holohan, C; Longley, DB (2015). "DED or alive: assembly and regulation of the death effector domain complexes". Cell Death and Disease. 6 (8): e1866. doi:10.1038/cddis.2015.213. ISSN 2041-4889. PMC 4558505. PMID 26313917.
- ^ Yao, Zhan; Duan, Shanshan; Hou, Dezhi; Heese, Klaus; Wu, Mian (2007). "Death effector domain DEDa, a self-cleaved product of caspase-8/Mch5, translocates to the nucleus by binding to ERK1/2 and upregulates procaspase-8 expression via a p53-dependent mechanism". The EMBO Journal. 26 (4): 1068–1080. doi:10.1038/sj.emboj.7601571. ISSN 1460-2075. PMC 1852837. PMID 17290218.
- ^ Lee, Eun-Woo; Seo, Jinho; Jeong, Manhyung; Lee, Sangsik; Song, Jaewhan (2012). "The roles of FADD in extrinsic apoptosis and necroptosis". BMB Reports. 45 (9): 496–508. doi:10.5483/BMBRep.2012.45.9.186. ISSN 1976-670X. PMID 23010170.
- ^ a b c d e Barnhart, Bryan C; Lee, Justine C; Alappat, Elizabeth C; Peter, Marcus E (2003). "The death effector domain protein family". Oncogene. 22 (53): 8634–8644. doi:10.1038/sj.onc.1207103. ISSN 0950-9232. PMID 14634625.
- ^ Schleich, K.; Buchbinder, J. H.; Pietkiewicz, S.; Kähne, T.; Warnken, U.; Öztürk, S.; Schnölzer, M.; Naumann, M.; Krammer, P. H. (2016-04-01). "Molecular architecture of the DED chains at the DISC: regulation of procaspase-8 activation by short DED proteins c-FLIP and procaspase-8 prodomain". Cell Death & Differentiation. 23 (4): 681–694. doi:10.1038/cdd.2015.137. ISSN 1350-9047. PMC 4986640. PMID 26494467.
- ^ a b Yu, JW; Shi, Y (2008). "FLIP and the death effector domain family". Oncogene. 27 (48): 6216–6227. doi:10.1038/onc.2008.299. ISSN 0950-9232. PMID 18931689.
- ^ a b Twomey, Edward C; Cordasco, Dana F; Wei, Yufeng (2012). "Profound conformational changes of PED/PEA-15 in ERK2 complex revealed by NMR backbone dynamics". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1824 (12): 1382–1393. doi:10.1016/j.bbapap.2012.07.001. ISSN 1570-9639. PMID 22820249.
- ^ Bhattacharyya, Nitai P; Banerjee, Manisha; Majumder, Pritha (2008). "Huntington's disease: roles of huntingtin-interacting protein 1 (HIP-1) and its molecular partner HIPPI in the regulation of apoptosis and transcription". The FEBS Journal. 275 (17): 4271–4279. doi:10.1111/j.1742-4658.2008.06563.x. ISSN 1742-464X. PMID 18637945.