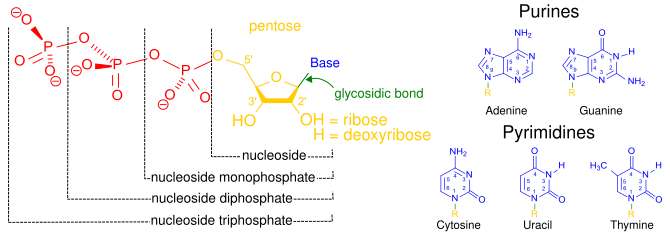
뉴클레오시드3인산
Nucleoside triphosphate뉴클레오시드 삼인산은 5-탄소당(리보스 또는 디옥시리보스)에 결합된 질소 염기를 포함하는 분자이며,[1] 3개의 인산기가 당에 결합되어 있다.그것은 뉴클레오티드의 한 예이다.그들은 DNA와 RNA의 분자 전구체이며, 이것은 DNA 복제와 [2]전사의 과정을 통해 만들어진 뉴클레오티드의 사슬이다.뉴클레오시드 삼인산염은 세포[3] 반응의 에너지원으로도 작용하며 신호 [4]전달 경로에 관여한다.
뉴클레오시드 삼인산은 흡수가 잘 되지 않기 때문에 일반적으로 세포 [5]내에서 합성된다.합성 경로는 만들어지는 특정 뉴클레오시드 삼인산에 따라 다르지만, 뉴클레오시드 삼인산의 많은 중요한 역할을 감안할 때, 합성은 모든 [6]경우에 엄격하게 조절된다.뉴클레오시드 유사체는 바이러스 [7]감염 치료에 사용될 수도 있다.예를 들어 아지도티미딘(AZT)은 HIV/[8]AIDS 예방 및 치료에 사용되는 뉴클레오시드 유사체입니다.
명명
뉴클레오시드라는 용어는 5-탄소 당(리보스 또는 디옥시리보스)[1]과 연결된 질소 염기를 의미한다.뉴클레오티드는 하나 이상의 인산기와 [9]공유 결합하는 뉴클레오시드이다.인산염의 수에 대한 정보를 제공하기 위해, 뉴클레오타이드는 대신 뉴클레오사이드 (모노, 디 또는 트리) 인산염으로 [10]언급될 수 있다.따라서 뉴클레오시드 트리포스페이트는 뉴클레오티드의 [10]한 종류이다.
뉴클레오티드는 일반적으로 3자(디옥시뉴클레오티드 또는 디데옥시뉴클레오티드의 경우 4자 또는 5자)로 축약된다.첫 번째 글자는 질소 염기의 동일성(예: 아데닌의 경우 A, 구아닌의 경우 G), 두 번째 글자는 인산염의 수(모노, di, tri)를 나타내며, 세 번째 글자는 P로 [11]인산염을 나타낸다.리보스를 당으로 함유하는 뉴클레오시드 트리포스페이트는 NTP로, 디옥시리보스를 당으로 함유하는 뉴클레오시드 트리포스페이트는 dNTP로 약칭한다.예를 들어 dATP는 디옥시리보스 아데노신 삼인산염을 나타낸다.NTP는 RNA의 구성 요소이고 dNTP는 [12]DNA의 구성 요소입니다.
뉴클레오시드 삼인산에 있는 설탕의 탄소는 설탕의 원래 카르보닐에서 시작하여 탄소 고리 주위에 번호가 매겨집니다.기존에는 설탕 중 탄소수 뒤에 소수 기호(')가 붙어 질소 염기의 탄소와 구별된다.질소 염기는 글리코시드 결합을 통해 1' 탄소에 연결되고 인산기는 5' [13]탄소에 공유 결합된다.당과 연결된 첫 번째 인산기는 α-인산, 두 번째 인산기는 β-인산, 세 번째 인산기는 [14]γ-인산이다.
DNA 및 RNA합성
DNA 복제와 전사의 세포 과정은 각각 DNA와 RNA 합성을 포함한다.DNA 합성은 dNTP를 기질로 사용하는 반면, RNA 합성은 NTP를 [2]기질로 사용합니다.NTP 를 dNTP 로 직접 변환할 수 없습니다.DNA는 아데닌, 구아닌, 시토신, 티민 등 네 가지 질소 염기를 함유하고 있다.RNA는 또한 아데닌, 구아닌, 시토신을 포함하지만 티민을 우라실로 [15]대체한다.따라서 DNA 합성은 기질로 dATP, dGTP, dCTP 및 dTTP를 필요로 하며, RNA 합성은 ATP, GTP, CTP 및 UTP를 필요로 한다.
핵산 합성은 DNA 중합효소 또는 RNA 중합효소 중 하나로 각각 [16]촉매된다.이러한 효소는 뉴클레오티드 성장 사슬의 3' 탄소에 있는 유리 -OH기를 다음 (d)의 5' 탄소에 있는 α-인산에 공유 결합한다.NTP: β-인산 및 β-인산기를 PPI([17]pyrophosphate)로 방출합니다.이는 두 개의 (d) NTP 사이에 포스포디에스테르 결합을 일으킨다.PPi의 방출은 반응이 일어나는 [17]데 필요한 에너지를 제공합니다.핵산 합성은 오직 5' ~ 3' 방향으로만 발생한다는 점에 유의해야 한다.
뉴클레오시드3인산대사
세포에서 뉴클레오시드 트리포스페이트의 합성과 분해는 엄격한 [6]통제 하에 있다.본 절에서는 인간의 뉴클레오시드 삼인산 대사에 초점을 맞추고 있지만,[18] 그 과정은 종들 사이에서 상당히 보존되어 있다.뉴클레오시드 트리포스페이트는 흡수가 잘 되지 않기 때문에 모든 뉴클레오시드 트리포스페이트는 일반적으로 de novo로 [19]만들어진다.ATP와 GTP(청정)의 합성은 CTP, TTP, UTP(피리미딘)의 합성과 다르다.푸린 합성과 피리미딘 합성은 모두 시작 [20]분자로 포스포리보실 피로인산(PRPP)을 사용한다.
NTP 에서 dNTP 로의 변환은, 2인산 형식에서만 실행할 수 있습니다.전형적으로 NTP는 하나의 인산염이 제거되어 NDP가 된 후 리보뉴클레오티드 환원효소라는 효소에 의해 dNDP로 변환된 후 인산염이 다시 첨가되어 dNTP를 [21]얻는다.
푸린합성
히포산틴이라고 불리는 질소 염기는 [22]PRPP에 직접 조립됩니다.이것은 이노신 일인산이라고 불리는 뉴클레오티드를 생성한다.그런 다음 IMP는 AMP 또는 GMP의 전구체로 변환된다. AMP 또는 GMP가 형성되면 ATP에 의해 인산염 및 삼인산염 [23]형태로 인산화될 수 있다.
푸린 합성은 아데닌 또는 구아닌 뉴클레오티드에 [24]의한 IMP 형성의 알로스테릭 저해에 의해 조절된다.AMP와 GMP는 또한 경쟁적으로 [25]IMP로부터의 전구체 형성을 억제한다.
피리미딘합성
오로테이트라고 하는 질소 염기는 [25]PRPP와는 독립적으로 합성되며, 오로테이트가 만들어진 후 PRPP에 공유 결합된다.이것은 OMP라고 불리는 뉴클레오티드를 [26]생성한다. OMP는 UMP로 변환되고, OMP는 ATP에 의해 UDP와 UTP로 인산화 될 수 있다. 그리고 UTP는 탈아미네이션 [27]반응에 의해 CTP로 변환될 수 있다.TTP는 핵산 합성을 위한 기질이 아니므로 세포 내에서 합성되지 않는다.대신 dTTP는 각각의 디옥시리보스 형태로 [20]변환된 후 dUDP 또는 dCDP 중 하나에서 간접적으로 생성된다.
피리미딘 합성은 UDP 및 UTP에 의한 오로테이트 합성의 알로스테릭 저해에 의해 조절된다. PRPP 및 ATP도 오로테이트 [28]합성의 알로스테릭 활성제이다.
리보뉴클레오티드환원효소
리보뉴클레오티드환원효소(RNR)는 NTP를 dNTP로 변환하는 효소이다.dNTP가 DNA 복제에 사용되기 때문에 RNR의 활성은 엄격하게 [6]규제됩니다.RNR은 NDP만 처리할 수 있으므로 NTP는 dNDP로 [29]변환되기 전에 먼저 NDP로 탈인산됩니다.그 후 일반적으로 dNDP는 재인산화됩니다.RNR에는 2개의 서브유닛과 3개의 부위(촉매 부위, 활성(A) 부위, 특이(S) 부위)[29]가 있습니다.촉매 부위는 NDP 대 dNDP 반응이 일어나는 곳이고 활성 부위는 효소의 활성 여부를 결정하며 특이성 부위는 촉매 부위에서 일어나는 반응을 결정합니다.
활성 사이트는 ATP 또는 dATP [30]중 하나를 결합할 수 있습니다.ATP에 결합하면 RNR이 활성화됩니다.언제 ATP나 dATP은 S사이트에 수밖에 없잖나 RNR를 많이 쓰고 민주당. dCDP과 dUDP 간접적으로 dTTP를 만들기 위해 dTTP은 S사이트에 바인딩 되어 국내 총생산에서 dGDP의 종합 크고, dGDP의 S사이트에 바인딩은 그 다음, 이것 dATP을 제시할 phosphorylated dADP의 ADP.[31일]dADP를 합성할 것으로 계속해 볼 수 있dCDP의 합성 솔루션 그리고 dUDP 크다.biA 사이트로 이동하여 RNR을 [30]끕니다.
기타 세포 역할
세포 에너지원으로서의 ATP
ATP는 세포의 [32]1차 에너지 통화이다.위에서 설명한 대사 경로를 통해 합성됨에도 불구하고, 그것은 주로 세포 호흡과[33] ATP[34] 합성 효소에 의한 광합성 과정에서 합성된다.ATP 합성효소는 ADP와 인산염으로부터 ATP의 합성을 미토콘드리아 내막(세포 호흡) 또는 틸라코이드막(광합성)[35]을 통해 양성자의 펌프에 의해 생성된 전기 화학적 구배와 결합한다.ATP의 형성이 에너지적으로 불리하기 때문에 이러한 전기화학적 구배가 필요하다.
ATP의 ADP 및 Pi로의 가수분해는 다음과 [36]같이 진행된다.
이 반응은 에너지적으로 유리하며 30.5 kJ/mol의 [3]에너지를 방출한다.세포에서, 이러한 반응은 종종 그들이 [37]진행하기 위한 에너지를 제공하기 위해 바람직하지 않은 반응과 결합된다.GTP는 에너지 커플링에 유사한 [38]방법으로 사용되는 경우가 있습니다.
GTP 신호 변환
GTP는 신호 전달, 특히 G 단백질에 필수적이다.G단백질은 세포막 결합 [4]수용체와 결합된다.이 전체 복합체를 G 단백질 결합 수용체(GPCR)라고 한다.G단백질은 GDP 또는 GTP에 결합할 수 있다.G단백질은 GDP와 결합하면 비활성이다.리간드가 GPCR에 결합하면 G단백질의 알로스테릭 변화가 유발되어 GDP가 이탈하고 [39]GTP로 대체된다. GTP는 G단백질의 알파 서브유닛을 활성화하여 G단백질과 분리하여 하류 [39]이펙터 역할을 한다.
뉴클레오시드 유사체
뉴클레오시드 유사체는 바이러스 [40]감염 치료에 사용될 수 있다.뉴클레오시드 유사체는 DNA와 RNA [41]합성에 사용되는 뉴클레오시드와 구조적으로 유사한(유사체) 뉴클레오시드이다.일단 이 뉴클레오시드 유사체들이 세포에 들어가면, 그것들은 바이러스 효소에 의해 인산화 될 수 있다.생성된 뉴클레오티드는 DNA 또는 RNA 합성에 사용되는 뉴클레오티드와 유사하여 성장하는 DNA 또는 RNA 가닥에 통합되지만, 다음 뉴클레오티드를 공격할 수 있는 3' OH기를 가지고 있지 않아 연쇄 [42]종료를 유발한다.바이러스 DNA 중합효소가 진핵생물 DNA [40]중합효소보다 더 쉽게 특정 뉴클레오티드 유사체를 인식하기 때문에 이것은 바이러스 감염의 치료 용도로 이용될 수 있습니다.예를 들어 아지도티미딘은 HIV/[8]AIDS 치료에 사용된다.선택성이 낮은 뉴클레오시드 유사체는 특정 백혈병 [7]치료에서 시토신 아라비노오스(ara-C)와 같은 암을 [43]치료하기 위한 화학요법으로 사용될 수 있다.
뉴클레오시드 유사체에 대한 저항은 흔하며,[7] 종종 세포에 들어간 후 뉴클레오시드를 인산화시키는 효소의 돌연변이 때문이다.이것은 HIV/[44]AIDS 치료에 사용되는 뉴클레오시드 유사체에서 흔히 볼 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b "Nucleotides and Bases - Genetics Generation". Genetics Generation. Retrieved 11 November 2017.
- ^ a b Chargaff E (2012-12-02). The Nucleic Acids. Elsevier. ISBN 9780323144773.
- ^ a b "Overview of ATP Hydrolysis". Khan Academy. Archived from the original on 2017-12-01. Retrieved 2017-11-11.
- ^ a b "GPCR". Scitable. 2014.
- ^ "Eating DNA: Dietary Nucleotides in Nutrition". The call of the Honeyguide. 2014-04-09. Retrieved 11 November 2017.
- ^ a b c Wyngaarden JB (1976). "Regulation of purine biosynthesis and turnover". Advances in Enzyme Regulation. 14: 25–42. doi:10.1016/0065-2571(76)90006-6. PMID 184697.
- ^ a b c Galmarini CM, Mackey JR, Dumontet C (2001). "Nucleoside analogues: mechanisms of drug resistance and reversal strategies". Leukemia. 15 (6): 875–90. doi:10.1038/sj.leu.2402114. PMID 11417472.
- ^ a b "Zidovudine Monograph for Professionals - Drugs.com". Drugs.com. Retrieved 30 November 2017.
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). Structure of Nucleic Acids.
- ^ a b Secrist JA (May 2001). "Nucleoside and nucleotide nomenclature" (PDF). Current Protocols in Nucleic Acid Chemistry. Appendix 1: A.1D.1–A.1D.3. doi:10.1002/0471142700.nca01ds00. hdl:2027.42/143595. PMID 18428808. S2CID 205152902.
- ^ "Nomenclature of Nucleosides". www.biochem.uthscsa.edu. Retrieved 2017-11-11.
- ^ "From DNA to RNA to protein, how does it work?". Science Explained. Retrieved 11 November 2017.
- ^ "Numbering convention for nucleotides". www.biosyn.com. Retrieved 2017-11-11.
- ^ "SparkNotes: DNA Replication and Repair: The Chemistry of the Addition of Substrates of DNA Replication". www.sparknotes.com. Retrieved 2017-11-11.
- ^ "Do You Know the Differences Between DNA and RNA?". ThoughtCo. Retrieved 2017-11-11.
- ^ "Difference Between DNA Polymerase and RNA Polymerase". 2011-12-24. Retrieved 2017-11-11.
- ^ a b Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). Nucleic Acid Synthesis.
- ^ Samant S, Lee H, Ghassemi M, Chen J, Cook JL, Mankin AS, Neyfakh AA (February 2008). "Nucleotide biosynthesis is critical for growth of bacteria in human blood". PLOS Pathogens. 4 (2): e37. doi:10.1371/journal.ppat.0040037. PMC 2242838. PMID 18282099.
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Nucleotide Biosynthesis.
- ^ a b "Nucleotide Metabolism: Nucleic Acid Synthesis". themedicalbiochemistrypage.org. Retrieved 2017-11-15.
- ^ Stubbe J (1990). "Ribonucleotide reductases: amazing and confusing" (PDF). The Journal of Biological Chemistry. 265 (10): 5329–32. doi:10.1016/S0021-9258(19)39357-3. PMID 2180924.
- ^ Berg J, Tymoczko JL, Stryer L (2002). Purine Bases Can Be Synthesized de Novo or Recycled by Salvage Pathways.
- ^ "Purine Synthesis : Synthesis of Purine RiboNucleotides". BiochemDen.com. 2016-03-16. Retrieved 15 November 2017.
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Key Steps in Nucleotide Biosynthesis Are Regulated by Feedback Inhibition.
- ^ a b Nierlich DP, Magasanik B (1965). "Regulation of purine ribonucleotide synthesis by end product inhibition. the effect of adenine and guanine ribonucleotides on the 5'-phosphoribosyl-pyrophosphate amidotransferase of aerobacter aerogenes". The Journal of Biological Chemistry. 240: 358–65. doi:10.1016/S0021-9258(18)97657-X. PMID 14253438.
- ^ Moffatt BA, Ashihara H (April 2002). "Purine and pyrimidine nucleotide synthesis and metabolism". The Arabidopsis Book. 1: e0018. doi:10.1199/tab.0018. PMC 3243375. PMID 22303196.
- ^ "Pyrimidine Metabolism". www.cliffsnotes.com. Retrieved 2017-11-15.
- ^ Lane AN, Fan TW (February 2015). "Regulation of mammalian nucleotide metabolism and biosynthesis". Nucleic Acids Research. 43 (4): 2466–85. doi:10.1093/nar/gkv047. PMC 4344498. PMID 25628363.
- ^ a b Kolberg M, Strand KR, Graff P, Andersson KK (June 2004). "Structure, function, and mechanism of ribonucleotide reductases". Biochimica et Biophysica Acta. 1699 (1–2): 1–34. doi:10.1016/j.bbapap.2004.02.007. PMID 15158709.
- ^ a b Ahmad MF, Dealwis CG (2013). "The Structural Basis for the Allosteric Regulation of Ribonucleotide Reductase". Oligomerization in Health and Disease. Progress in Molecular Biology and Translational Science. Vol. 117. pp. 389–410. doi:10.1016/B978-0-12-386931-9.00014-3. ISBN 9780123869319. PMC 4059395. PMID 23663976.
- ^ Fairman JW, Wijerathna SR, Ahmad MF, Xu H, Nakano R, Jha S, Prendergast J, Welin RM, Flodin S, Roos A, Nordlund P, Li Z, Walz T, Dealwis CG (March 2011). "Structural basis for allosteric regulation of human ribonucleotide reductase by nucleotide-induced oligomerization". Nature Structural & Molecular Biology. 18 (3): 316–22. doi:10.1038/nsmb.2007. PMC 3101628. PMID 21336276.
- ^ "ATP". Scitable.
- ^ "Mitochondria, Cell Energy, ATP Synthase". Scitable.
- ^ "ATP Synthesis". Plants in Action. Retrieved 2017-11-12.
- ^ Jonckheere AI, Smeitink JA, Rodenburg RJ (March 2012). "Mitochondrial ATP synthase: architecture, function and pathology". Journal of Inherited Metabolic Disease. 35 (2): 211–25. doi:10.1007/s10545-011-9382-9. PMC 3278611. PMID 21874297.
- ^ Dittrich M, Hayashi S, Schulten K (October 2003). "On the mechanism of ATP hydrolysis in F1-ATPase". Biophysical Journal. 85 (4): 2253–66. Bibcode:2003BpJ....85.2253D. doi:10.1016/S0006-3495(03)74650-5. PMC 1303451. PMID 14507690.
- ^ "ATP: Adenosine Triphosphate Boundless Biology". courses.lumenlearning.com-US. Retrieved 2017-11-12.
- ^ Carvalho AT, Szeler K, Vavitsas K, Åqvist J, Kamerlin SC (September 2015). "Modeling the mechanisms of biological GTP hydrolysis". Archives of Biochemistry and Biophysics. Special issue in computational modeling on biological systems. 582 (Supplement C): 80–90. doi:10.1016/j.abb.2015.02.027. PMID 25731854.
- ^ a b "G protein-coupled receptor (GPCR) biochemistry". Encyclopedia Britannica. Retrieved 2017-11-12.
- ^ a b "Nucleoside Analogues". Molecules. Retrieved 2017-11-13.
- ^ Jordheim LP, Durantel D, Zoulim F, Dumontet C (June 2013). "Advances in the development of nucleoside and nucleotide analogues for cancer and viral diseases". Nature Reviews. Drug Discovery. 12 (6): 447–64. doi:10.1038/nrd4010. PMID 23722347. S2CID 39842610.
- ^ Ewald B, Sampath D, Plunkett W (October 2008). "Nucleoside analogs: molecular mechanisms signaling cell death". Oncogene. 27 (50): 6522–37. doi:10.1038/onc.2008.316. PMID 18955977.
- ^ Galmarini CM, Mackey JR, Dumontet C (July 2002). "Nucleoside analogues and nucleobases in cancer treatment". The Lancet. Oncology. 3 (7): 415–24. doi:10.1016/s1470-2045(02)00788-x. PMID 12142171.
- ^ Menéndez-Arias L (June 2008). "Mechanisms of resistance to nucleoside analogue inhibitors of HIV-1 reverse transcriptase". Virus Research. 134 (1–2): 124–46. doi:10.1016/j.virusres.2007.12.015. PMID 18272247.