난소균세포종양
Ovarian germ cell tumors| 난소균세포종양 | |
|---|---|
| 전문 | 종양학 |
| 증상 | 팽창, 복부 팽만, 승천, 이상증 |
난소배아세포종양(OGCTs)은 배아고나드의 원시배아세포에서 파생되는 이질적인 종양으로 전체 난소 악성종양의 약 2.6%를 차지한다.[1]OGCT에는 4가지 주요 유형이 있다. 즉, 이질소마, 노른자낭종양, 테라토마, 초리오카르시노마종이다.[1]
다이거미노마는 난소의 악성 세균 세포종양으로 특히 생식기 이질 진단을 받은 환자들에게서 두드러진다.[1]OGCT는 비특정적 역사학적 특성 때문에 초기에 감지하고 진단하기가 비교적 어렵다.[1]OGCT의 일반적인 증상은 붓기, 복부팽만, 복부팽만, 복부 팽만감, 이상증이다.[1]OGCT는 주로 난소의 원시 세균 세포에 악성 암세포가 형성되면서 발생한다.[1]OGCTs의 정확한 병원체는 아직 알려지지 않았지만, 다양한 유전적 돌연변이와 환경적 요인이 확인되었다.[1]OGCTs는 임신 중에 골반 검사 중 부신질량이 발견될 때 흔히 발견되며, 초음파 검사에서 난소 내 고체질량이나 혈청 검사에서 알파-페토프로틴 수치가 상승하는 것으로 나타난다.[1]그들은 전이될 가능성이 낮으며 따라서 표준 종양 관리는 화학요법과 결합된 외과적 절제술이다.[2]발생률은 전 세계적으로 3% 미만이다.[3]
분류
OGCT는 유병률순으로 나열한 이질균, 테라토마, 노른자낭종양, 초리오카시노마 등으로 분류할 수 있다.[1]
이질소종
다이제르미노마는 고환성 세미노마스와 유사하며 모든 OGCT의 약 32~37%를 차지한다.[1]이들은 특히 46명의 이질 생식곤란이 있는 XY 순수 생식곤란 환자들에게서 두드러진다.[1]난독증은 총체적인 검사를 바탕으로 '고체적이고, 침이 고이고, 그을리고, 살이 찐 듯한 총체적인 외관과 표면이 매끄러운' 것이 특징이다.[1]현미경으로 보면 세포구조는 풍부한 어시노필릭 세포질(oosinophilic cytoplasm)과 불규칙한 모양의 핵이 들어 있는 둥근-오보이드 형상으로 구분된다.[1]균일하게 배치된 세포는 섬유 가닥을 통해 분리되며 림프구 침투를 흔히 관찰한다.[5]
테라토마스
기형종은 난소의 가장 흔한 세균세포종양이다.테라토마는 성숙한 테라토마(베니그)와 미성숙한 테라토마(악성)의 두 종류로 나눌 수 있다.미성숙한 테라토마는 성숙한 테라토마와 현저하게 구별되는 미성숙하거나 배아 조직을 가지고 있다.[7]15세에서 19세 사이의 여성들에게서 흔히 볼 수 있으며 폐경 후 여성들 사이에서는 드물게 관찰된다.[8]미성숙 기형테라마는 지름 14~25cm, 캡슐화된 질량, 낭포성 부위, 간혹 출혈부위가 나타나는 것이 특징이다.[9]미숙한 테라토마의 단계는 미숙한 신경세포 조직의 검출량에 따라 결정된다.[7]
노른자낭종양
난소 노른자 주머니 종양은 피부 내 부비동 종양이라고도 알려져 있으며, 모든 OGCT의 약 15.5%를 책임진다.[11]그것들은 특히 어린 나이에 여성들에게서 관찰되었고, 40세 이후에는 거의 관찰되지 않았다.[12]치명적인 병리학적 특징은 외부 표면이 매끄러운 것과 빠른 성장 속도에 따른 눈물이다.난소 노른자 주머니 종양의 71개 개별 사례로 구성된 연구는 종양의 증식에 대한 증거를 제공한다.이 중 한 건은 4주 뒤 9㎝, 12㎝ 크기의 종양이 발견되기 전까지 골반검사에서 정상 활동이 확인됐다.[12]또 다른 경우, 정기적으로 관찰되고 난소 절제술이 필수적이 될 때까지 정상적인 발견을 한 임산부에게서 23cm의 종양이 발견되었다.[12]역사학적으로 이러한 종양은 고체성분과 낭포성분이 혼합된 것이 특징이다.[1]혼합 고형 성분은 회색에서 노란색 고형 성분에 상당한 출혈과 괴사를 동반한 것이 특징이다.낭종은 직경이 약 2cm이며 조직 전체에 걸쳐 채워져 있어 신엽에 '벌집 모양'[1]을 부여한다.
초리오카르시노마
초리오카르시노마스는 예외적으로 희귀하며 전체 OGCT의 2.1~3.4%를 차지한다.[14]총체 검사에서, 시니티오토프로포블라스틱 세포는 출혈의 초점을 둘러싸고 있는 단핵 세포세포 세포세포와 플렉스폼 배열로 정렬된다.[1]초리오카르시노마스는 임신성 초리오카르시노마와 면역항화학적 차이가 있는 비거성 초리오카르시노마로 나눌 수 있다.[15]
징후 및 증상
OGCTs는 증상이 보통 미묘하고 특이하지 않기 때문에 비교적 초기에 발견하고 진단하기가 어렵다.그들은 거대하고 유형적인 덩어리가 될 때 탐지할 수 있게 된다.증상으로는 붓기, 복부팽만, 복부 팽만, 승천, 이상증 등이 있다.[16]종양이 파열되는 경우는 드물지만 급성 복통을 경험할 수 있다.[17]악성종양의 결정적 지표는 대개 마리아 요셉 노odle 수녀의 출현이다.[18]OGCTs는 어린 아이들에게 난소 비틀림, 출혈, 심지어 성애 조숙한 사춘기를 유발할 수 있다.[19]
원인들
OGCT의 정확한 원인은 아직 밝혀지지 않았다.그러나 자궁내막증, 다낭성 난소증후군, 유전적 위험인자를 포함하여 OGCT의 위험 증가에 기여할 수 있는 몇 가지 요인이 확인되었다.[20]OGCT를 개발하기 쉬운 개인은 대개 자가 우성인 BRCA-1/BRCA-2 돌연변이를 포함한다.[20]린치 증후군으로 알려진 유전성 비폴리포증 대장암과 같은 다른 암과의 합병증은 난소암 발병 위험을 증가시킨다.[20]임신, 모유수유, 경구피임약은 OGCT의 위험을 줄인 것으로 알려져 있다.[20]OGCT의 생물학은 아직 연구 중에 있지만, 유전적 변화는 고전적인 종양 억제기 유전자와 종양 억제기 유전자와 종양 유전자와 같은 OGCT의 발전에 기여할 수 있다.과 함께 유전적 수정, 내분비 교란 물질과 같은 특정 환경 요인, 개인의 생화학 에 영향을 끼치는 일상이의 존재, 그리고 모성 호르몬에 노출되는 것은 OGCT.[20]의 쥐에 관한 최근 연구에서는transgenerational 후생 유전학적 상속 재산은 inf을 보여 준 확산에 기여할 수 있습니다.lueOGCT의 병원체 생성에 플라스틱, 살충제, 다이옥신을 포함한 유해 환경 물질의 cce.[20]
병생성
그럼에도 불구하고, 그 원인에 대한 몇 가지 추측이 있었다.배란 중에 모낭이 파열되어 상피세포가 손상된다.[1]조직을 치유하고 손상을 대체하기 위해 세포는 세포분열을 겪는다.세포가 분열할 때마다 돌연변이가 일어날 가능성이 있고 종양이 형성될 가능성이 높아진다.[1]종양은 난소의 세균 세포가 걷잡을 수 없이 분열되기 시작하고 악성이 될 때 발생하는데, 이것은 덜 조직된 핵과 불분명한 경계선으로 특징지어진다.[1]또 다른 잠재적 유전학으로는 종양 억제기 유전자인 TRC8/RNF139의 기능부전이나 심지어 분자 정밀검사 후 카리오타입의 이상까지 있다.[21]
OGCT는 원초 생식세포(PGC)가 초기에 분리되는 배아발달에 뿌리를 두고 있으며, 유전자(Genome)는 물론 대뇌전증(Transcriptom)까지 변형할 수 있는 능력을 갖고 있다.[20]OGCT는 PGC의 내부 메커니즘과 그 변환 특성에 기인할 수 있다.[20]
스테이징
OGCT가 진단된 후에는 암이 체내 다른 부위로 전이됐는지 여부를 판단하기 위한 다양한 검사를 실시할 예정이다.OGCT의 확산은 1단계, 2단계, 3단계, 4단계 등 다른 단계를 통해 확인된다.
1단계: 종양 세포는 난소나 나팔관에 국부화되어 다른 신체 부위로 광범위하게 퍼지지 않는다.[22]
2단계: 암은 한 개 또는 두 개의 난소나 나팔관에 있고 골반으로 퍼졌다.[22]
3단계:암은 골반을 넘어 복부까지, 복막 림프절(복부 뒤쪽에 위치)까지 퍼졌다.변전소는 종양의 상대적인 크기가 특징이다.[22]
주: 2기 난소암도 암세포가 간으로 전이된 경우 선언될 것이다.4단계: 암은 복부와 골반 바깥으로 폐와 같은 더 먼 장기로 전이되었다.[22]
진단
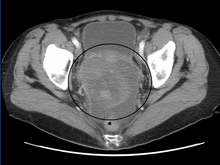
예비 진단은 골반 검사, 혈청 종양 마커 검사, 영상 촬영으로 시작한다.의사는 장갑을 낀 손가락을 질에 삽입할 때 큰 덩어리나 하복부에 혹을 느낄 수 있다.OGMT의 조직학적 하위 유형을 보다 자세히 파악하기 위해 환자의 혈액 샘플을 수집하여 종양 세포가 방출하는 바이오마커의 혈청 수치를 분석한다.인간 맥락막 고나도트로핀과 알파-페토프로테인의 혈장 수치의 급상승은 OGMTs를 나타낸다.[1] 젖산탈수소효소, 알칼리성 인산염 및 암 항원 125 또한 잠재적으로 증가할 수 있다.[24]종양의 위치와 형태학을 시각화하기 위해 보통 초음파 검사를 사용한다.[1]가장 특징적인 외형은 날카로운 테두리와 높은 혈관 형성으로 실질성 피부 같은 이질성 질량이다.[1]컴퓨터 단층 촬영은 종양의 전두엽 패턴을 시각화하기 위해 신체의 복막 영역 내부에 누적된 이미지를 생성할 수 있다.[1]보통 이상소아종의 경우, 강화 증상과 함께 로브로 분리되는 고체 덩어리는 출혈이나 괴사에 대해 명백할 수 있다.[1]
수술 전 절차
FIGO 스테이징 지침에 따라 복막 부위나 림프 배수구를 통해 종양이 퍼지는 정도를 검사하는 종합 수술 스테이징이 진행된다.
2기 환자의 28%는 임파선 전이라고 불리는 암의 1차 부위에서 거리가 먼 림프절에서 2차 악성성장이 발병해 발견된다.[1]
다음과 같은 세 가지 주요 림프관 배수 경로가 있다.[1]
종양 및 림프 확산[1] 예후를 추론하기 위한 수술 전 단계로 일방적인 골반 및 파라오트 림프절의 팰프 또는 생체검사를 실시한다.
복막 내 종양 함량 유출이나 복막강 내 이식 정도를 평가하기 위해 복막 생체검사와 복막절제술도 도입된다.[1]종양 세포는 원래 부위에서 복막강으로 떨어져 나와 간 캡슐 표면이나 횡격막에 이식될 수 있다.[24]횡격막 주위의 림프관 안에서 막히고 복막액의 재흡수를 막을 수 있다.[24]결국, 심막신경쇠약과 복수는 이 솔직한 침공에서 비롯될지도 모른다.[1][24]
치료
수술
악성 OGCT는 주로 일방적이고 화학작용을 민감하게 하는데, 이는 이들이 난소의 한쪽 면에만 국부화되어 있다는 것을 의미한다.[24]생식력 보존 수술은 편측 난소와 나팔관을 온전하게 유지하기 위해 주로 표준화되는데, 이는 일방적인 절개-오포 절제술로도 알려져 있다.[1][24]관찰 가능한 전이가 있는 2단계 환자의 경우 자궁 절제술( 자궁 전체 또는 일부의 제거)과 쌍방향 절개-오포 절제술과 같은 종양의 부피를 제거하기 위해 세포 유도 수술을 실시할 수 있다.[1][24]보조 항암 화학요법 완료 후 복강에서 수술 절개를 하는 것이 이전의 세포유도 수술 후 기형 원소를 가진 환자에게 가장 적합하다.[1][24]
아드주반트 화학 요법
초기 단계 환자의 경우 최대 15~25%의 재발로 보조 항암화학요법이 종양의 수술적 절제술과 결합해 완전한 인양을 보장할 필요가 있다.[1]전신 화학요법(구강 또는 정맥주사)의 경우, BEP 치료라고도 하는 블로마이신, 에토포사이드 및 시스플라틴으로 구성되도록 모든 FIGO 스테이징에서 양생법을 표준화한다.[2]환자에게 3~4주기 BEP를 발급해 완전한 인양을 보장해야 한다.[2]개인화된 조건에 따라 BEP치료 비응답자 일부 환자에게는 시스플라틴, 이포스팜드, 팩리탁셀 등으로 구성된 인양요법이 처방된다.[2][26]그러나 BEP 치료 후 OGCT 생존자들은 36세의 험난한 나이에 조기 폐경을 겪을 가능성이 높다.[24]대신 일부 병원은 약물에 존재하는 백금복합체가 DNA 가닥 안에 화학적 교차연결을 형성해 DNA 전사에 개입해 암세포의 번식을 막는다는 점에서 백금 기반 항암치료를 택했다.[27]주요 원소는 시스플라틴, 카보플라틴, 옥살리플라틴이다.[28]초기 단계 환자들 사이에서 완치된 것으로 보고되었으며, 약물에 대한 저항으로 인해 잠재적으로 4분의 1의 선진국 환자들만이 구조되지 않고 있다.[1][29]
고도 단계 환자들의 경우 세포 유도 수술 후, 보이지 않는 미세한 암세포나 결절이 여전히 감염 현장에 존재할 수 있다.[27]따라서 의사는 1.5시간 동안 카터 튜브를 통해 복강에 가열된 화학요법 용액(약 42~43°C)을 주입할 수 있다.[30]암세포는 보통 40℃에서 죽는다는 원리에 근거해 체세포는 44℃에서 사망하기 때문에 영향을 받지 않고 그대로 남아 있다.[30]이 새로운 방법은 재발이 10%에 불과하고 사망률이 기록되지 않아 효과가 입증됐다.[31]그것은 Docetaxel과 시스플라틴을 함유한 고열성 복강내 화학요법(HIPEC)으로 알려져 있다.[31]복강 내 국소적으로 전파되는 약으로 볼 때 다른 활성 복제 세포에는 전신적 부작용이 없고 전신적 화학요법보다 선호된다.[30]
일반적으로 전신 화학요법에서 통제할 수 없는 약물분포는 골수압증을 유발하는데, 특히 관찰된 열 중성미자, 신경독성, 이독성, 신독성 등이 있다.[2]화학요법에 의한 독성에 대처하기 위한 치료법은 과립세포 군집 자극 인자 또는 골수성 성장 인자를 주사하거나 예방 항생제의 구강 섭취를 통해 이루어진다.[2]
역학
OGCT는 난소암의 범위에 속하는 희귀 종양으로, 전체 난소 악성종양의 5% 미만을 차지한다.주로 15~19세 여성에게서 발생하며, <30세 여성>의 경우 75%의 발병률을 보인다.[31]2011년 전 세계적으로 발생한 신규 건수는 100만 건당 5.3건이다.[32]대부분의 국가에서 평균 발생률은 인구의 3% 미만이다.[3]그러나 아시아는 인구의 젊은 연령층 때문에 4.3%까지 가장 높은 비율을 보고하고 있다.[3]다른 지역의 경우 보고된 발병률은 오세아니아 2.5%, 북미 2.0%, 유럽 1.3%이다.[3]
5년 생존율은 상피 난소암보다 훨씬 높은 90~92%에 달했다.[33]백금성 화학요법의 효과가 높다는 것이 주된 이유다.[1]
참조
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Shaaban AM, Rezvani M, Elsayes KM, Baskin H, Mourad A, Foster BR, Jarboe EA, Menias CO (2014). "Ovarian malignant germ cell tumors: cellular classification and clinical and imaging features". Radiographics. 34 (3): 777–801. doi:10.1148/rg.343130067. PMID 24819795.
- ^ a b c d e f "Ovarian Germ Cell Tumors" (PDF). April 2013. Retrieved 2019-04-01.
- ^ a b c d Matz M, Coleman MP, Sant M, Chirlaque MD, Visser O, Gore M, Allemani C (February 2017). "The histology of ovarian cancer: worldwide distribution and implications for international survival comparisons (CONCORD-2)". Gynecologic Oncology. 144 (2): 405–413. doi:10.1016/j.ygyno.2016.10.019. PMC 6195192. PMID 27931752.
- ^ "Dysgerminoma", Wikipedia, 2019-02-13, retrieved 2019-04-09
- ^ Hazard FK (2019). "Ovarian Dysgerminomas Pathology: Overview of Ovarian Dysgerminomas, Differentiating Ovarian Dysgerminomas, Laboratory Markers". Medscape.
- ^ "Immature teratoma", Wikipedia, 2019-03-14, retrieved 2019-04-10
- ^ a b Medeiros F, Strickland KC (January 2018). "Chapter 26: Germ cell tumors of the ovary.". Diagnostic Gynecologic and Obstetric Pathology (third ed.). pp. 949–1010. doi:10.1016/B978-0-323-44732-4.00026-1. ISBN 978-0-323-44732-4.
- ^ Templeman CL, Hertweck SP, Scheetz JP, Perlman SE, Fallat ME (December 2000). "The management of mature cystic teratomas in children and adolescents: a retrospective analysis". Human Reproduction. 15 (12): 2669–72. doi:10.1093/humrep/15.12.2669. PMID 11098043.
- ^ Outwater EK, Siegelman ES, Hunt JL (2001). "Ovarian teratomas: tumor types and imaging characteristics". Radiographics. 21 (2): 475–90. doi:10.1148/radiographics.21.2.g01mr09475. PMID 11259710.
- ^ "Endodermal sinus tumor", Wikipedia, 2019-02-01, retrieved 2019-04-10
- ^ Talerman A (July 1975). "The incidence of yolk sac tumor (endodermal sinus tumor) elements in germ cell tumors of the testis in adults". Cancer. 36 (1): 211–5. doi:10.1002/1097-0142(197507)36:1<211::AID-CNCR2820360122>3.0.CO;2-W. PMID 1203848.
- ^ a b c Kurman RJ, Norris HJ (December 1976). "Endodermal sinus tumor of the ovary: a clinical and pathologic analysis of 71 cases". Cancer. 38 (6): 2404–19. doi:10.1002/1097-0142(197612)38:6<2404::aid-cncr2820380629>3.0.co;2-3. PMID 63318.
- ^ "Choriocarcinoma", Wikipedia, 2019-02-23, retrieved 2019-04-10
- ^ Smith HO, Berwick M, Verschraegen CF, Wiggins C, Lansing L, Muller CY, Qualls CR (May 2006). "Incidence and survival rates for female malignant germ cell tumors". Obstetrics and Gynecology. 107 (5): 1075–85. doi:10.1097/01.AOG.0000216004.22588.ce. PMID 16648414. S2CID 25914370.
- ^ Ulbright TM (February 2005). "Germ cell tumors of the gonads: a selective review emphasizing problems in differential diagnosis, newly appreciated, and controversial issues". Modern Pathology. 18 Suppl 2 (2): S61-79. doi:10.1038/modpathol.3800310. PMID 15761467.
- ^ "Germ cell ovarian tumours Ovarian cancer Cancer Research UK". www.cancerresearchuk.org. Retrieved 2019-04-10.
- ^ Moniaga NC, Randall LM (February 2011). "Malignant mixed ovarian germ cell tumor with embryonal component". Journal of Pediatric and Adolescent Gynecology. 24 (1): e1-3. doi:10.1016/j.jpag.2010.05.001. PMC 5111966. PMID 20869284.
- ^ Calongos G, Ogino M, Kinuta T, Hori M, Mori T (2016). "Sister Mary Joseph Nodule as a First Manifestation of a Metastatic Ovarian Cancer". Case Reports in Obstetrics and Gynecology. 2016: 1087513. doi:10.1155/2016/1087513. PMC 5007344. PMID 27635270.
- ^ Williams SD (June 1998). "Ovarian germ cell tumors: an update". Seminars in Oncology. 25 (3): 407–13. PMID 9633853.
- ^ a b c d e f g h Kraggerud SM, Hoei-Hansen CE, Alagaratnam S, Skotheim RI, Abeler VM, Rajpert-De Meyts E, Lothe RA (June 2013). "Molecular characteristics of malignant ovarian germ cell tumors and comparison with testicular counterparts: implications for pathogenesis". Endocrine Reviews. 34 (3): 339–76. doi:10.1210/er.2012-1045. PMC 3787935. PMID 23575763.
- ^ "Ovarian Dysgerminomas: Background, Pathophysiology, Epidemiology". 2019-03-18.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ a b c d "Ovarian Germ Cell Tumors Symptoms, Tests, Prognosis, and Stages". National Cancer Institute. 1980-01-01. Retrieved 2019-04-03.
- ^ "Ovarian cancer", Wikipedia, 2019-03-19, retrieved 2019-04-10
- ^ a b c d e f g h i Bixel KL, Fowler J (2018). "Ovarian Germ Cell Tumors". Gynecologic Care. Cambridge University Press. pp. 350–359. doi:10.1017/9781108178594.037. ISBN 9781108178594.
- ^ "Hyperthermic intraperitoneal chemotherapy", Wikipedia, 2019-03-19, retrieved 2019-04-10
- ^ "Ovarian Germ Cell Tumors - Review of Cancer Medicines on WHO list of Essential Medicines" (PDF). Union for International Cancer Control. 2014.
- ^ a b "Chemotherapy". Ovarian Cancer Research Alliance. Retrieved 2019-04-01.
- ^ "Platinum therapy (anti-cancer treatment) information". myVMC. 2005. Retrieved 2019-04-01.
- ^ Wang Y, Yang JX, Yu M, Cao DY, Shen K (2018). "Malignant mixed ovarian germ cell tumor composed of immature teratoma, yolk sac tumor and embryonal carcinoma harboring an EGFR mutation: a case report". OncoTargets and Therapy. 11: 6853–6862. doi:10.2147/ott.s176854. PMC 6190639. PMID 30349318.
- ^ a b c "Peritoneal Cancer Treatment Boston". Tufts Medical Center. Retrieved 2019-04-01.
- ^ a b c Yu HH, Yonemura Y, Hsieh MC, Lu CY, Wu SY, Shan YS (2019). "Experience of applying cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for ovarian teratoma with malignant transformation and peritoneal dissemination". Therapeutics and Clinical Risk Management. 15: 129–136. doi:10.2147/tcrm.s190641. PMC 6338109. PMID 30679911.
- ^ Kaatsch P, Häfner C, Calaminus G, Blettner M, Tulla M (January 2015). "Pediatric germ cell tumors from 1987 to 2011: incidence rates, time trends, and survival". Pediatrics. 135 (1): e136-43. doi:10.1542/peds.2014-1989. PMID 25489016. S2CID 1149576.
- ^ Wang Y, Yang JX, Yu M, Cao DY, Shen K (2018). "Malignant mixed ovarian germ cell tumor composed of immature teratoma, yolk sac tumor and embryonal carcinoma harboring an EGFR mutation: a case report". OncoTargets and Therapy. 11: 6853–6862. doi:10.2147/OTT.S176854. PMC 6190639. PMID 30349318.







