시스플라틴
Cisplatin | |||
| |||
| 임상 데이터 | |||
|---|---|---|---|
| 상호 | 플라티놀, 기타 | ||
| 기타 이름 | 시스플라티넘, 플라타민, 네오플라틴, 시스마플랫, 시스디아미네디클로로플라티넘(II)(CDDP) | ||
| AHFS/Drugs.com | 모노그래프 | ||
| Medline Plus | a684036 | ||
| 라이선스 데이터 | |||
| 임신 카테고리 | |||
| 루트 행정부. | 정맥 주사 | ||
| ATC 코드 | |||
| 법적 상태 | |||
| 법적 상태 | |||
| 약동학 데이터 | |||
| 바이오 어베이러빌리티 | 100%(IV) | ||
| 단백질 결합 | 95% 이상 | ||
| 반감기 제거 | 30~100시간 | ||
| 배설물 | 신장 | ||
| 식별자 | |||
| CAS 번호 | |||
| PubChem CID | |||
| 드러그뱅크 | |||
| 켐스파이더 | |||
| 유니 | |||
| 케그 | |||
| 체비 | |||
| 첸블 | |||
| PDB배위자 | |||
| CompTox 대시보드 (EPA ) | |||
| ECHA 정보 카드 | 100.036.106 | ||
| 화학 및 물리 데이터 | |||
| 공식 | [Pt(NH3)2 Cl2] | ||
| 몰 질량 | 300.05 g/g−1/g | ||
| 3D 모델(JSmol) | |||
| |||
| |||
| | |||
시스플라틴은 많은 [2]암을 치료하기 위해 사용되는 화학요법 약물이다.여기에는 고환암, 난소암, 자궁경부암, 유방암, 방광암, 두경부암, 식도암, 폐암, 중피종, 뇌종양,[2] 신경아세포종이 포함된다.정맥에 [2]주사하여 투여한다.
일반적인 부작용으로는 골수 억제, 청력 문제, 신장 손상, [2][3]구토가 포함됩니다.다른 심각한 부작용으로는 저림, 보행 장애, 알레르기 반응, 전해질 문제, 심장 [2]질환 등이 있다.임신 중에 사용하면 발육 중인 [1][2]태아에게 해를 끼칠 수 있습니다.시스플라틴은 백금계 항종양제 계열의 [2]약물에 속한다.그것은 부분적으로 DNA에 결합하고 그것의 [2]복제를 억제함으로써 작용한다.
시스플라틴은 1845년에 발견되었고 1978년과 [4][2]1979년에 의료용으로 허가되었다.그것은 세계보건기구의 필수 [5]의약품 목록에 있다.
의료용
시스플라틴은 고형 및 혈액학적 악성종양의 치료를 위해 일반 식염수에 단기 주입으로 정맥에 투여된다.그것은 육종, 일부 암종(예: 소세포 폐암, 두경부 편평상피암, 난소암), 림프종, 방광암,[6] 자궁경부암, 생식세포종양을 포함한 다양한 종류의 암을 치료하는데 사용된다.
시스플라틴은 고환암에 특히 효과적이다. 시스플라틴의 채택으로 치료율이 10%에서 85%[7]로 증가했다.
추가 시험이 필요하지만, 시스플라틴은 정상 조직 [8]독성을 증가시키지 않고 시스플라틴의 치료 효과를 증가시키기 위해 오거 요법으로 연구되었다.
부작용
시스플라틴에는 사용을 제한할 수 있는 여러 가지 부작용이 있습니다.
- 신독성(신장 손상)은 1차 용량 제한 부작용이며 임상적으로 중요한 문제이다.시스플라틴은 선택적으로 기저외측에서 꼭대기로의 수송을 통해 근위세관에 축적되어 미토콘드리아 에너지학 및 소포체2+ Ca 항상성을 교란시키고 활성산소종과 소염성 사이토카인을 [9]자극한다.수화요법, 아미포스틴, 운반체 억제제, 항산화제, 항염증제, 에폭시이코사트리엔산 및 이들의 [9][10]유사물을 포함한 여러 완화 전략이 임상적 및 임상적으로 검토되고 있다.
- 신경 독성(신경 손상)은 치료 전과 후에 신경 전도 연구를 수행함으로써 예측할 수 있습니다.시스플라틴의 일반적인 신경학적 부작용은 치료를 [11]시작한 직후에 발생할 수 있는 시각지각과 청각장애를 포함한다.DNA 복제 간섭을 통한 아포토시스 유발은 시스플라틴의 주요 메커니즘으로 남아있지만, 신경학적 부작용에 기여하는 것으로는 발견되지 않았다.최근의 연구는 시스플라틴이 NHE-1로 [11]알려진 원형, 막 결합 메카노센시티브 나트륨-수소 이온 전달체를 비경쟁적으로 억제한다는 것을 보여주었다.그것은 주로 말초 신경계의 세포에서 발견되며, 말초 신경계는 안구 및 청각 자극 수용 중추 근처에 다량 집적되어 있다.이러한 비경쟁적 상호작용은 시험관내 및 생체내로 확인된 가수분해 불균형 및 세포골격 변화와 관련이 있다.그러나 NHE-1 억제는 용량 의존적(half-distration = 30 μg/mL)인 동시에 [11]가역적인 것으로 밝혀졌다.
- 메스꺼움 및 구토: 시스플라틴은 가장 구토 유발 화학요법 중 하나이지만, 이 증상은 코르티코스테로이드와 함께 예방적 항토제(온단세트론, 그래니세트론 등)로 관리된다.온단세트론 및 덱사메타손과 조합된 항진제제는 온단세트론 및 덱사메타손보다 고구토성 화학요법에 더 좋은 것으로 나타났다.
- 이독성(청력 손실): 예방적 [12]조치로서 아세틸시스테인 주입에 대한 연구가 진행 중이지만, 심각할 수 있는 이 부작용을 예방할 수 있는 효과적인 치료법이 현재 없다.청각 분석은 이독성의 심각성을 평가하기 위해 필요할 수 있다.다른 약물(아미노글리코시드 항생제 클래스 등)도 이독성을 일으킬 수 있으며, 일반적으로 시스플라틴을 투여하는 환자에게서 이 종류의 항생제를 투여하는 것은 피한다.아미노글리코시드와 시스플라틴의 이독성은 내이의 선조혈관 내 멜라닌에 결합하는 능력 또는 활성산소종의 생성과 관련이 있을 수 있다.
- 전해질 장애:시스플라틴은 저자석혈증, 저칼라혈증, 저칼륨혈증을 일으킬 수 있다.저칼슘혈증은 시스플라틴에 2차적인 혈청 마그네슘이 낮은 사람에게서 발생하는 것으로 보이기 때문에 주로 시스플라틴에 의한 것은 아닙니다.
- 용혈성 빈혈은 시스플라틴을 여러 차례 투여한 후에 발병할 수 있다.시스플라틴-적혈구막과 반응하는 항체가 [13]용혈의 원인이 되는 것이 제안된다.
약리학
시스플라틴은 DNA 복제를 방해하는데, 이것은 이론적으로 암세포인 가장 빨리 증식하는 세포를 죽인다.투여 후, 아쿠아레이션이라고 불리는 과정에서 아쿠아 복합체 cis-[PtCl(NH3)(2HO2)]+를 얻기 위해 1개의 염화 이온이 물에 의해 서서히 치환된다.세포 내 염화물 농도는 세포 외 [14][15]액체의 약 100mM 염화물 농도의 3~20%에 불과하기 때문에 세포 내에서는 염화물의 해리가 바람직하다.
cis-[PtCl(NH3)(2HO2)]+의 물 분자는 DNA의 N-헤테로사이클 염기에 의해 쉽게 치환된다.구아닌은 우선적으로 결합한다.[PtCl(guanine-DNA)(NH3)]2+의 형성에 이어 다른 염화물(일반적으로 다른 구아닌)[16]의 치환을 통해 가교될 수 있다.시스플라틴은 유사분열로 세포분열을 방해하며 DNA를 여러 가지 다른 방식으로 가교한다.손상된 DNA는 DNA 복구 메커니즘을 유도하여 복구가 불가능하다고 판명되면 아포토시스를 활성화한다.2008년, 연구자들은 인간 대장암 세포에서 시스플라틴에 의해 유도되는 아포토시스가 미토콘드리아 세린 단백질 Omi/Htra2에 [17]의존한다는 것을 보여줄 수 있었다.이는 대장암세포에서만 입증되었기 때문에, Omi/Htra2 단백질이 다른 [17]조직의 암종에서 시스플라틴 유도 아포토시스에 관여하는지는 여전히 미결로 남아 있다.
DNA의 변화 중 가장 눈에 띄는 것은 퓨린 염기와 1,2-성간 교잡이다.여기에는 부가물의 거의 90%를 구성하는 1,2-성간 d(GpG) 부가물과 덜 일반적인 1,2-성간 d(ApG) 부가물이 포함된다. 1,3-성간 d(GpXpG) 부가물은 발생하지만 뉴클레오티드 절제 수리기(NER)에 의해 쉽게 제거된다.다른 부가물에는 시스플라틴의 활성에 기여하는 것으로 가정된 사슬 간 가교와 비기능 부가물이 포함된다.세포단백질, 특히 HMG 도메인 단백질과의 상호작용도 유사분열을 방해하는 메커니즘으로 발전되어 왔지만, 이것은 아마도 주요 [18]작용 방법이 아닐 것이다.
시스플라틴 내성
시스플라틴 복합화학요법은 많은 암 치료의 초석이다.초기 백금 반응성은 높지만 대부분의 암 환자는 결국 시스플라틴 내성 질환으로 재발할 것이다.약물의 세포 흡수 및 유출의 변화, 약물의 해독의 증가, 아포토시스 억제 및 DNA [19]수복의 증가를 포함한 시스플라틴 내성의 많은 메커니즘이 제안되어 왔다.옥살리플라틴은 실험실의 높은 시스플라틴 내성 암세포에서 활성화되지만, 시스플라틴 내성 [19]암 환자의 임상 치료에서 옥살리플라틴의 활성에 대한 증거는 거의 없다.약물 파클리탁셀은 시스플라틴 내성 암 치료에 유용할 수 있다. 이 활성의 메커니즘은 아직 알려지지 않았다.[20]
트랜스파틴
시스플라틴의 트랜스스테레오이소머인 트랜스-[PtCl2(NH3)]2는 비교적 유용한 약리학적 효과를 나타내지 않는다.트랜스포타틴의 항암 효과 감소를 설명하기 위해 두 가지 메커니즘이 제안되었다.첫째, 클로로 리간드의 트랜스 배열은 더 큰 화학적 반응성을 가진 트랜스아틴을 부여하여 트랜스아틴이 DNA에 도달하기 전에 비활성화되어 시스플라틴이 약리 작용을 하는 것으로 생각된다.다음으로 시스플라틴에 의해 형성되는 특징적인 1,2-프라스트랜드 내 d(GpG) 부가물을 [21]풍부하게 형성할 수 없는 것이 특징이다.
분자 구조
시스플라틴은 정사각형 평면 배위 복합체 cis-[Pt(NH3)2Cl2][22]: 286–8 [23]: 689 이다.접두사 cis는 두 개의 유사한 배위자가 인접한 [22][23]: 550 위치에 있는 cis 이성질체를 나타냅니다.이 분자의 체계적 화학명은 cis-diamminedichlorplatinum이며, 여기서 2m의 아민은 [22]: 284 1m의 유기 아민과 대조적으로 암모니아([22]: 286 NH3) 배위자를 나타낸다.
역사
화합물 cis-[Pt(NH3)2Cl2]는 1845년 이탈리아 화학자 Michele Peyrone에 의해 처음 설명되었고 오랫동안 Peyrone의 [24]소금으로 알려져 왔다.그 구조는 알프레드 [16]베르너에 의해 1893년에 추론되었다.1965년 미시간 주립 대학의 Barnett Rosenberg, Van Camp et al.는 백금 전극의 전기 분해가 대장균(E. coli) 박테리아에서 2분열을 억제하는 수용성 백금 복합체를 발생시킨다는 것을 발견했다.박테리아 세포의 성장은 계속되었지만, 세포 분열은 억제되었고, 박테리아는 필라멘트로 정상 [25]길이의 300배까지 성장했습니다.트랜스 이성질체가 아닌 팔면체 Pt(IV) 복합체 cis-[PtCl4(NH3)]2는 대장균 세포의 필라멘트 성장을 강제하는 데 효과적인 것으로 밝혀졌다.정사각형 평면 Pt(II) 복합체 cis-[PtCl2(NH3)]2는 필라멘트 성장을 [26][27]강제하는 데 더욱 효과적인 것으로 밝혀졌다.이 연구 결과는 cis-2[PtCl(2NH3)]가 실제로 [28]랫드에서 육종 덩어리를 회귀시키는 데 매우 효과적이라는 관찰로 이어졌다.이 발견의 확인과 다른 종양 세포주로의 시험 확장은 시스플라틴의 의학적 응용을 시작했다.시스플라틴은 1978년 [16][29][30]12월 19일 미국 식품의약국에 의해 고환암과 난소암에 사용하도록 승인되었고 [31]1979년 영국(및 몇몇 다른 유럽 국가)에서 승인되었다.시스플라틴은 최초로 [32]개발되었습니다.1983년 소아암 전문의 로저 패커는 소아수질아세포종 [33]치료를 위한 보조화학요법에 시스플라틴을 포함시키기 시작했다.그가 개발한 새로운 프로토콜은 약 85%[34]의 수종 환자의 무병 생존율을 현저하게 증가시켰다.패커 프로토콜은 그 이후로 수질아세포종의 표준 치료법이 되었다.마찬가지로, 시스플라틴은 고환암에 특히 효과가 있는 것으로 밝혀졌으며, 그 사용으로 치료율이 10%에서 85%[35]로 향상되었다.
최근 일부 연구자들은 표적 [36][37]내 약물 방출을 국소화하기 위해 나노 물질과 함께 시스플라틴 프로드러그의 새로운 형태를 임상 이전 수준에서 조사했다.
합성
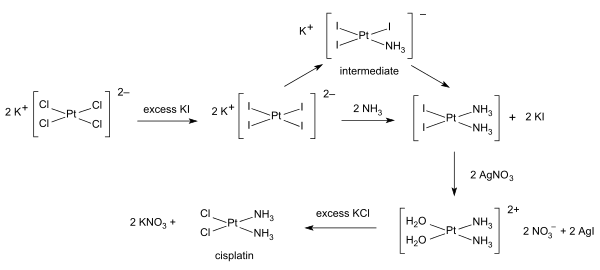
시스플라틴의 합성은 테트라클로로플라틴산칼륨에서 시작된다.몇 가지 절차를 사용할 수 있습니다.한 가지 장애물은 시스플라틴과 동일한 경험식을 가진 마그누스 녹색염(MGS)의 원활한 형성이다.MGS를 피하는 전통적인 방법은 Dhara가 [38][39]원래 설명한 바와 같이 KPtCl을24 KPtI로24 변환하는 것이다.암모니아와의 반응으로 PtI(NH3)2가 형성되어2 황색 화합물로 분리된다.물에 질산은을 첨가하면 불용성 요오드화은이 침전되고 [Pt2(2OH)(NH3)](22NO3)가 용액에 남는다.염화칼륨의 첨가는 최종 생성물을 형성하고 트라이요오드 중간체에서는 두 번째 암모니아 배위자의 첨가는 트랜스 [39]효과에 의해 제어된다.
KPtCl에서24 시스플라틴의 1포트 합성이 개발되었다.아세트산 [40]암모늄에서 암모니아가 천천히 방출되기 때문입니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d "Cisplatin Use During Pregnancy". Drugs.com. 12 September 2019. Retrieved 25 February 2020.
- ^ a b c d e f g h i "Cisplatin". The American Society of Health-System Pharmacists. Archived from the original on 21 December 2016. Retrieved 8 December 2016.
- ^ Oun R, Moussa YE, Wheate NJ (May 2018). "The side effects of platinum-based chemotherapy drugs: a review for chemists". Dalton Transactions. 47 (19): 6645–6653. doi:10.1039/c8dt00838h. PMID 29632935.
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 513. ISBN 9783527607495. Archived from the original on 20 December 2016.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ "Cisplatin". National Cancer Institute. 2 March 2007. Archived from the original on 8 October 2014. Retrieved 13 November 2014.
- ^ Einhorn LH (November 1990). "Treatment of testicular cancer: a new and improved model". Journal of Clinical Oncology. 8 (11): 1777–81. doi:10.1200/JCO.1990.8.11.1777. PMID 1700077.
- ^ Ku, Anthony; Facca, Valerie J.; Cai, Zhongli; Reilly, Raymond M. (11 October 2019). "Auger electrons for cancer therapy – a review". EJNMMI Radiopharmacy and Chemistry. 4 (1): 27. doi:10.1186/s41181-019-0075-2. ISSN 2365-421X. PMC 6800417. PMID 31659527.
- ^ a b Miller RP, Tadagavadi RK, Ramesh G, Reeves WB (October 2010). "Mechanisms of Cisplatin Nephrotoxicity". Toxins. 2 (11): 2490–2518. doi:10.3390/toxins2112490. PMC 3153174. PMID 22069563.
- ^ Singh N, Vik A, Lybrand DB, Morisseau C, Hammock BD (November 2021). "New Alkoxy- Analogues of Epoxyeicosatrienoic Acids Attenuate Cisplatin Nephrotoxicity In Vitro via Reduction of Mitochondrial Dysfunction, Oxidative Stress, Mitogen-Activated Protein Kinase Signaling, and Caspase Activation". Chemical Research in Toxicology. 34 (12): 2579–2591. doi:10.1021/acs.chemrestox.1c00347. PMC 8853703. PMID 34817988.
- ^ a b c Milosavljevic N, Duranton C, Djerbi N, Puech PH, Gounon P, Lagadic-Gossmann D, et al. (October 2010). "Nongenomic effects of cisplatin: acute inhibition of mechanosensitive transporters and channels without actin remodeling". Cancer Research. 70 (19): 7514–22. doi:10.1158/0008-5472.CAN-10-1253. PMID 20841472.
- ^ Sarafraz Z, Ahmadi A, Daneshi A (June 2018). "Transtympanic Injections of N-acetylcysteine and Dexamethasone for Prevention of Cisplatin-Induced Ototoxicity: Double Blind Randomized Clinical Trial". The International Tinnitus Journal. 22 (1): 40–45. doi:10.5935/0946-5448.20180007. PMID 29993216.
- ^ Levi JA, Aroney RS, Dalley DN (June 1981). "Haemolytic anaemia after cisplatin treatment". British Medical Journal. 282 (6281): 2003–4. doi:10.1136/bmj.282.6281.2003. PMC 1505958. PMID 6788166.
- ^ Wang D, Lippard SJ (April 2005). "Cellular processing of platinum anticancer drugs". Nature Reviews. Drug Discovery. 4 (4): 307–320. doi:10.1038/nrd1691. PMID 15789122. S2CID 31357727.
- ^ Johnstone TC, Suntharalingam K, Lippard SJ (March 2016). "The Next Generation of Platinum Drugs: Targeted Pt(II) Agents, Nanoparticle Delivery, and Pt(IV) Prodrugs". Chemical Reviews. 116 (5): 3436–3486. doi:10.1021/acs.chemrev.5b00597. PMC 4792284. PMID 26865551.
- ^ a b c Trzaska S (20 June 2005). "Cisplatin". Chemical & Engineering News. 83 (25): 52. doi:10.1021/cen-v083n025.p052.
- ^ a b Pruefer FG, Lizarraga F, Maldonado V, Melendez-Zajgla J (June 2008). "Participation of Omi Htra2 serine-protease activity in the apoptosis induced by cisplatin on SW480 colon cancer cells". Journal of Chemotherapy. 20 (3): 348–354. doi:10.1179/joc.2008.20.3.348. PMID 18606591. S2CID 11052459.
- ^ Hu J, Lieb JD, Sancar A, Adar S (October 2016). "Cisplatin DNA damage and repair maps of the human genome at single-nucleotide resolution". PNAS. 113 (41): 11507–11512. doi:10.1073/pnas.1614430113. PMC 5068337. PMID 27688757. S2CID 11052459.
- ^ a b Stordal B, Davey M (November 2007). "Understanding cisplatin resistance using cellular models" (PDF). IUBMB Life. 59 (11): 696–699. doi:10.1080/15216540701636287. PMID 17885832. S2CID 30879019.
- ^ Stordal B, Pavlakis N, Davey R (December 2007). "A systematic review of platinum and taxane resistance from bench to clinic: an inverse relationship" (PDF). Cancer Treatment Reviews. 33 (8): 688–703. doi:10.1016/j.ctrv.2007.07.013. hdl:2123/4068. PMID 17881133.
- ^ Coluccia M, Natile G (January 2007). "Trans-platinum complexes in cancer therapy". Anti-Cancer Agents in Medicinal Chemistry. 7 (1): 111–123. doi:10.2174/187152007779314080. PMID 17266508.
- ^ a b c d Miessler GL, Tarr DA (1999). Inorganic Chemistry (2nd ed.). Prentice Hall. ISBN 978-0-13-841891-5.
- ^ a b Housecroft CE, Sharpe AG (2005). Inorganic Chemistry (2nd ed.). Pearson Prentice Hall. ISBN 978-0-130-39913-7.
- ^ Peyrone M (1844). "Ueber die Einwirkung des Ammoniaks auf Platinchlorür" [On the action of ammonia on platinum chloride]. Ann. Chem. Pharm. 51 (1): 1–29. doi:10.1002/jlac.18440510102.
- ^ Rosenberg B, Vancamp L, Krigas T (February 1965). "Inhibition of cell division in Escherichia coli by electrolysis products from a platinum electrode". Nature. 205 (4972): 698–9. Bibcode:1965Natur.205..698R. doi:10.1038/205698a0. PMID 14287410. S2CID 9543916.
- ^ Rosenberg B, Van Camp L, Grimley EB, Thomson AJ (March 1967). "The inhibition of growth or cell division in Escherichia coli by different ionic species of platinum(IV) complexes". The Journal of Biological Chemistry. 242 (6): 1347–52. doi:10.1016/S0021-9258(18)96186-7. PMID 5337590.
- ^ Christie DA, Tansey EM, Thomson AJ, eds. (2007). The Discovery, Use and Impact of Platinum Salts as Chemotherapy Agent for Cancer. Wellcome Trust Witnesses to Twentieth Century Medicine. Vol. 30. pp. 6–15. ISBN 978-0-85484-112-7.
- ^ Rosenberg B, VanCamp L, Trosko JE, Mansour VH (April 1969). "Platinum compounds: a new class of potent antitumour agents". Nature. 222 (5191): 385–6. Bibcode:1969Natur.222..385R. doi:10.1038/222385a0. PMID 5782119. S2CID 32398470.
- ^ Carpenter DP (2010). Reputation and power: organizational image and pharmaceutical regulation at the FDA. Princeton, NJ: Princeton University Press. ISBN 978-0-691-14180-0.
- ^ "Approval Summary for cisplatin for Metastatic ovarian tumors". FDA Oncology Tools. Food and Drug Administration, Center for Drug Evaluation and Research. 19 December 1978. Archived from the original on 8 February 2008. Retrieved 15 July 2009.
- ^ Wiltshaw E (1979). "Cisplatin in the treatment of cancer". Platinum Metals Review. 23 (3): 90–8.
- ^ Kelland L (2007). "The resurgence of platinum-based cancer chemotherapy". Nature Reviews Cancer. 7 (8): 573–584. doi:10.1038/nrc2167. PMID 17625587. S2CID 205468214.
- ^ Packer RJ, Sutton LN, Elterman R, Lange B, Goldwein J, Nicholson HS, et al. (November 1994). "Outcome for children with medulloblastoma treated with radiation and cisplatin, CCNU, and vincristine chemotherapy". Journal of Neurosurgery. 81 (5): 690–8. doi:10.3171/jns.1994.81.5.0690. PMID 7931615.
- ^ Packer RJ, Sutton LN, Goldwein JW, Perilongo G, Bunin G, Ryan J, et al. (March 1991). "Improved survival with the use of adjuvant chemotherapy in the treatment of medulloblastoma". Journal of Neurosurgery. 74 (3): 433–40. doi:10.3171/jns.1991.74.3.0433. PMID 1847194.
- ^ Einhorn LH (November 1990). "Treatment of testicular cancer: a new and improved model". Journal of Clinical Oncology. 8 (11): 1777–81. doi:10.1200/JCO.1990.8.11.1777. PMID 1700077.
- ^ Dhar S, Daniel WL, Giljohann DA, Mirkin CA, Lippard SJ (October 2009). "Polyvalent oligonucleotide gold nanoparticle conjugates as delivery vehicles for platinum(IV) warheads". Journal of the American Chemical Society. 131 (41): 14652–3. doi:10.1021/ja9071282. PMC 2761975. PMID 19778015.
- ^ Santi M, Mapanao AK, Cassano D, Vlamidis Y, Cappello V, Voliani V (April 2020). "Endogenously-Activated Ultrasmall-in-Nano Therapeutics: Assessment on 3D Head and Neck Squamous Cell Carcinomas". Cancers. 12 (5): 1063. doi:10.3390/cancers12051063. PMC 7281743. PMID 32344838.
- ^ Dhara SC (1970). "Cisplatin". Indian J. Chem. 8: 123–134.
- ^ a b c Alderden RA, Hall MD, Hambley TW (2006). "The Discovery and Development of Cisplatin". J. Chem. Educ. 83 (5): 728. Bibcode:2006JChEd..83..728A. doi:10.1021/ed083p728. S2CID 29546931.
- ^ Kukushikin VY, Oskarsson Å, Elding LI, Farrell N (2007). Facile Synthesis of Isomerically Pure cis -Dichlorodiammineplatinum(II), Cisplatin. Inorganic Syntheses. Vol. 32. pp. 141–144. doi:10.1002/9780470132630.ch23. ISBN 9780470132630.
추가 정보
- Riddell IA, Lippard SJ (2018). "Cisplatin and Oxaliplatin: Our Current Understanding of Their Actions". In Sigel A, Sigel H, Freisinger E, Sigel RK (eds.). Metallo-Drugs: Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Vol. 18. Berlin: de Gruyter GmbH. pp. 1–42. doi:10.1515/9783110470734-007. ISBN 978-3-11-046984-4. PMID 29394020.
외부 링크
- "Cisplatin". Drug Information Portal. U.S. National Library of Medicine.
- IARC Monograph: "Cisplatin"