파라믹소바이러스과
Paramyxoviridae| 파라믹소바이러스과 | |
|---|---|
 | |
| 개 디스템퍼 바이러스(CDV) 바이러스 및 게놈 조직 | |
| 바이러스 분류 | |
| (순위 미지정): | 바이러스 |
| 영역: | 리보비리아 |
| 왕국: | 오르토나비라과 |
| 문: | 네가르나비리코타 |
| 클래스: | 몬지비리세테스 |
| 주문: | 모노네가비랄레스 |
| 패밀리: | 파라믹소바이러스과 |
| 아과 | |
Paramyxoviridae(그리스어 para-by of "side"와 mixa "mucus"에서 유래)는 [1][2]모노네가비랄레스목의 음성 가닥 RNA 바이러스 과이다.척추동물은 자연 [3]숙주의 역할을 한다.이 패밀리와 관련된 질병에는 홍역, 유행성 이하선염, 호흡기 [4]감염 등이 있습니다.4개의 아과, 17개 속, 78종이 있으며, 이 중 3개 속은 [5]한 아과에 속하지 않는다.
구조.
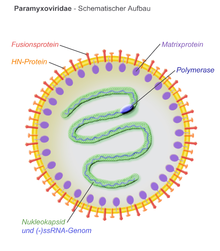
비리온은 포락되어 구면 또는 다형일 수 있으며 필라멘트형 비리온을 생성할 수 있습니다.직경은 약 150 nm입니다.게놈은 선형으로 길이가 [6][1]약 15kb입니다.핵융합 단백질과 부착 단백질은 비리온 표면에 스파이크로 나타납니다.외피 내부의 매트릭스 단백질은 바이러스 구조를 안정화시킨다.뉴클레오캡시드 코어는 게놈 RNA, 뉴클레오캡시드 단백질, 인단백질 및 중합효소 단백질로 구성됩니다.
게놈
게놈은 분절되지 않은 음의 감각의 RNA로 길이가 15-19킬로베이스이며 6-10개의 유전자를 포함하고 있다.외부 전자(비코딩) 영역에는 다음이 포함됩니다.
- 3' 리더 배열, 길이 50 뉴클레오티드로, 전사 촉진제 역할을 합니다.
- 5' 트레일러 배열, 길이 50–161 뉴클레오티드
- 각 유전자 사이의 게놈 간 영역, 즉 모르빌리바이러스, 레스피로바이러스, 헤니파바이러스의 길이와 루불라바이러스의 길이 가변(1-56뉴클레오티드)입니다.
각 유전자는 유전자의 일부로 전사되는 전사 시작/정지 신호를 선두 및 끝에 포함한다.
게놈 내의 유전자 배열은 게놈의 3' 말단에 가장 가까운 유전자가 5' 말단에 있는 유전자보다 더 풍부하게 전사되는 전사 극성(모노네가비랄레스 참조)으로 알려진 현상으로 인해 가족 전체에 걸쳐 보존된다.이것은 게놈 구조의 결과입니다.각 유전자가 전사된 후 RNA의존성 RNA 중합효소는 유전자 간 배열을 만나면 새로운 mRNA를 방출하기 위해 일시 정지한다.RNA 중합효소가 일시 정지하면 RNA 게놈에서 분리될 가능성이 있다.만약 그것이 분리된다면, 그것은 게놈의 길이를 계속 전사하는 것이 아니라 선두 배열로 게놈에 다시 들어가야 한다.그 결과, 하류 유전자가 리더 배열에서 더 멀어질수록 RNA 중합효소에 의해 덜 전사된다.
바이러스가 자외선에 노출되었을 때 단일 프로모터 모델에 대한 증거가 확인되었다.자외선은 RNA의 이량체를 유발하여 RNA 중합효소에 의한 전사를 방해할 수 있다.만약 바이러스 게놈이 다중 프로모터 모델을 따른다면, 전사의 수준 억제는 RNA 유전자의 길이와 관련이 있을 것입니다.그러나 게놈은 단일 프로모터 모델에 의해 가장 잘 묘사되었다.파라믹소바이러스 게놈이 자외선에 노출되었을 때, 전사 억제 수준은 리더 배열과의 거리에 비례하였다.즉, 유전자가 리더 배열에서 멀어질수록 RNA 이량화 억제 RNA 중합효소 가능성이 높아진다.
이 바이러스는 성공적인 감염에 필요한 단백질의 상대적 순서로 유전자를 배열함으로써 단일 프로모터 모델을 이용한다.예를 들어 뉴클레오캡시드 단백질 N은 RNA 중합효소 L보다 더 많은 양이 필요하다.
Paramyxoviridae 계열의 바이러스들은 또한 항원적으로 안정적이며, 이는 바이러스의 당단백질이 같은 종류의 다른 변종들 사이에서 일관된다는 것을 의미한다.이 현상에 대한 두 가지 이유는 다음과 같습니다.첫째는 게놈이 분할되지 않아 유전자 재분배를 받을 수 없다는 것이다.이 프로세스를 수행하기 위해 다른 균주의 세그먼트가 혼합되어 새로운 균주가 생성될 때 재배치로 필요한 세그먼트가 발생합니다.세그먼트가 없으면 아무것도 서로 혼합할 수 없으므로 항원 이동이 발생하지 않습니다.두 번째 이유는 항원 드리프트의 개념과 관련이 있다.RNA의존성 RNA중합효소에는 오류체크 기능이 없기 때문에 RNA를 가공할 때 많은 돌연변이가 발생한다.이 돌연변이는 축적되고 결국 새로운 변종이 만들어집니다.이러한 개념으로 인해 파라믹소바이러스는 항원적으로 안정되어서는 안 된다고 예상할 수 있지만, 그 반대인 것으로 보인다.바이러스가 항원적으로 안정적인 이유의 주된 가설은 각각의 단백질과 아미노산이 중요한 기능을 가지고 있다는 것이다.따라서, 어떤 돌연변이도 감소 또는 완전한 기능 상실로 이어질 것이고, 이는 다시 새로운 바이러스의 효율성을 떨어뜨릴 것이다.이 바이러스들은 더 치명적인 변종들에 비해 오래 살아남을 수 없을 것이고, 그래서 멸종될 것이다.
많은 파라믹소바이러스 게놈은 "6의 법칙"을 따른다.게놈의 전체 길이는 거의 항상 6의 배수이다.이것은 아마도 모든 RNA가 N 단백질에 의해 결합되는 이점 때문일 것이다(N은 RNA의 헥사머를 결합하기 때문이다).RNA가 노출되면 바이러스가 효율적으로 복제되지 않습니다.유전자 배열은 다음과 같습니다.
- 뉴클레오캡시드 – 인단백질 – 매트릭스 – 융접 – 부착 – 대(중합효소)
단백질
- N – 뉴클레오캡시드 단백질은 게놈 RNA(헥사머당 분자 1개)와 관련지어 뉴클레아제 소화로부터 RNA를 보호한다.
- P – 인단백질은 N 및 L 단백질에 결합하고 RNA 중합효소 복합체의 일부를 형성합니다.P는 중합효소 보조인자이다.
- M – 외피와 핵캡시드 코어 사이에 조립된 매트릭스 단백질로, 비리온 구조를 구성하고 유지합니다.
- F – 융합단백질은 삼량체로 외피 표면에서 돌출되어 바이러스 외피와 세포막 사이의 융합을 I급 융합으로 유도함으로써 세포 진입을 매개한다.파라믹소바이러스과(Paramyxoviridae)의 명확한 특징 중 하나는 융해 활성에 대한 중성 pH 요건이다.
- H/HN/G – 세포 부착 단백질이 바이러스 외피를 가로질러 표면에서 스파이크로 돌출됩니다.그들은 세포 진입을 용이하게 하기 위해 표적 세포 표면의 단백질에 결합한다.단백질은 혈액응집 활성을 가지고 있기 때문에 모르빌리바이러스의 경우 H(헤마글루티닌)로 불리며, 실험실 검사에서 적혈구가 뭉치게 하는 능력으로 관찰된다.HN(Hemaglutinin-neuraminidase) 부착 단백질은 레스피로바이러스, 루뷸라바이러스, 어뷸라바이러스에서 발생한다.이것들은 혈액응집과 세포 표면의 시알산을 분해하는 뉴라미니다아제 활성을 모두 가지고 있어 이전에 감염된 세포에 바이러스 입자가 다시 부착되는 것을 방지한다.혈응집 및 뉴라미니다아제 활성이 없는 부착단백질은 G(당단백질)로 표기된다.이는 헤니파바이러스에서 발생합니다.
- L – 큰 단백질은 RNA의존성 RNA중합효소(RDRP)의 촉매 서브유닛이다.
- 보조 단백질 – RNA 편집으로 알려진 메커니즘 (모노가비랄레스 참조)은 P 유전자로부터 여러 개의 단백질이 생성되도록 합니다.이들은 복제에 필수적인 것은 아니지만 체외 생존에 도움을 주거나 mRNA 합성에서 항원 합성으로의 전환을 조절하는 데 관여할 수 있다.
라이프 사이클

바이러스 복제는 세포질이다.숙주 세포로의 진입은 숙주 세포에 대한 바이러스 부착에 의해 이루어진다.복제와 전사는 음성 가닥 RNA 바이러스 [7]모델을 따릅니다.리크 스캔, 리보솜 분쇄, RNA 종단-재발생을 통해 번역이 이루어진다.바이러스는 싹을 틔워 숙주 세포에서 나온다.인간, 척추동물, 조류가 자연 숙주 역할을 한다.전송 경로는 공기 중의 [1]입자입니다.
파라믹소바이러스과(Paramyxoviridae)는 mRNA 편집을 수행할 수 있으며, 이는 의사 노트와 같은 2차 구조의 존재로 인해 다른 ORF(Open Reading Frame)에서 읽기 위해 하나의 염기를 뒤로 미끄러뜨려 동일한 mRNA 전사로부터 다른 단백질을 생성한다.파라믹소바이러스과는 또한 RNA [8][9]템플릿의 끝에서 한 번에 하나의 뉴클레오티드를 반복하여 뒤로 이동시킴으로써 mRNA 전사 말미에 폴리(A) 꼬리를 만들기 위해 전사적 말더듬기를 거친다.
분류법

과 : 파라믹소바이러스과[5]
- 서브패밀리:3속 22종을 포함하는 아불라바이러스아과
- 서브패밀리:1속 1종을 포함하는 Metaparamyxovirinae
- 서브패밀리:8속 34종을 포함하는 오르토파라믹소바이러스과
- 아과: 2속 18종을 포함하는 Rubulavirinae
- 할당되지 않은 속:
병원성 파라믹소바이러스
많은 중요한 인간 질병들이 파라믹소바이러스에 의해 발생한다.여기에는 유행성 이하선염과 2000년에 [11]약 73만3천명이 사망한 홍역이 포함된다.
인간 파라인플루엔자 바이러스(HPIV)는 유아와 어린이에게 호흡기 질환의 두 번째로 흔한 원인이다.HPIV에는 HPIV-1, HPIV-2, HPIV-3 및 HPIV-4로 알려진 4가지 유형이 있습니다.HPIV-1과 HPIV-2는 어린이에게 크룹과 함께 감기 같은 증상을 일으킬 수 있다.HPIV-3는 기관지염, 기관지염, 폐렴과 관련이 있다.HPIV-4는 다른 유형보다 덜 흔하며 가벼운 호흡기 [12]질환에서 심각한 호흡기 질환을 일으키는 것으로 알려져 있다.
파라믹소바이러스는 또한 개 디스템퍼 바이러스, 포카인 디스템퍼 바이러스, 고래 몰빌리바이러스, 뉴캐슬병 바이러스, 그리고 린더페스트 바이러스 같은 다른 동물 종들의 다양한 질병에 책임이 있습니다.헤니파바이러스와 같은 일부 파라믹소바이러스는 동물 숙주에서 자연적으로 발생하지만 인간을 감염시킬 수도 있는 동물성 병원균이다.
Hendra virus(HeV)와 NiPah virus(NiV)는 호주와 동남아시아의 인간과 가축에서 발생했다.두 바이러스 모두 전염성이 있고, 매우 치명적이며, 많은 포유류 종을 감염시키고 잠재적으로 치명적인 질병을 일으킬 수 있습니다.허가된 백신이나 항바이러스 치료제가 없기 때문에 HeV와 NiV는 BSL(Biosafety Level) 4제로 지정됩니다.두 바이러스의 게놈 구조는 전형적인 파라믹소바이러스의 [13]것이다.
다양성과 진화
이 섹션은 업데이트해야 합니다.하도록 이 . (2020년 3월) |
지난 몇 [when?]십 년 동안, 파라믹소바이러스는 육생 동물, 휘발성 동물, 수생 동물에서 발견되었고, 광범위한 숙주 범위와 거대한 바이러스 유전적 다양성을 보여 주었다.분자 기술이 발전하고 바이러스 감시 프로그램이 시행됨에 따라 이 그룹에서 새로운 바이러스의 발견이 증가하고 [4]있습니다.
파라믹소바이러스의 진화는 여전히 논의되고 있다.paramyxovirus는 두 개의 군으로 나눌 수 있다. 하나는 어뷸라바이러스와 루뷸라바이러스로 구성되고 다른 하나는 레스피로바이러스, 헤니파바이러스, 그리고 모르빌리바이러스로 [14]구성된다.두 번째 분지 내에서는 레스피로바이러스가 기초군인 것으로 보인다.레스피로바이러스-헤니바이러스-모빌리바이러스 분지군은 아뷸라바이러스-루불라바이러스 분지군의 기초가 될 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c "Viral Zone". ExPASy. Retrieved 15 June 2015.
- ^ "Paramyxoviridae - Paramyxoviridae - Negative-sense RNA Viruses - ICTV". talk.ictvonline.org. Retrieved 2020-12-14.
- ^ Fields virology. Fields, Bernard N., Knipe, David M. (David Mahan), 1950-, Howley, Peter M. (6th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2013. p. 883. ISBN 9781451105636. OCLC 825740706.
{{cite book}}: CS1 유지보수: 기타 (링크) - ^ a b Samal, SK, ed. (2011). The Biology of Paramyxoviruses. Caister Academic Press. ISBN 978-1-904455-85-1.
- ^ a b "Virus Taxonomy: 2020 Release". International Committee on Taxonomy of Viruses (ICTV). March 2021. Retrieved 18 May 2021.
- ^ Rima, B; Balkema-Buschmann, A; Dundon, WG; Duprex, WP; Easton, A; Fouchier, R; Kurath, G; Lamb, R; Lee, B; Rota, P; Wang, L; ICTV Report Consortium (December 2019). "ICTV Virus Taxonomy Profile: Paramyxoviridae". The Journal of General Virology. 100 (12): 1593–1594. doi:10.1099/jgv.0.001328. PMC 7273325. PMID 31609197.
- ^ Fearns, Rachel; Plemper, Richard K (2017-04-15). "Polymerases of paramyxoviruses and pneumoviruses". Virus Research. 234: 87–102. doi:10.1016/j.virusres.2017.01.008. ISSN 0168-1702. PMC 5476513. PMID 28104450.
- ^ Harmon, Shawn B.; Megaw, A. George; Wertz, Gail W. (January 2001). "RNA Sequences Involved in Transcriptional Termination of Respiratory Syncytial Virus". Journal of Virology. 75 (1): 36–44. doi:10.1128/JVI.75.1.36-44.2001. ISSN 0022-538X. PMC 113895. PMID 11119571.
- ^ Jacques, J. P.; Kolakofsky, D. (1991-05-01). "Pseudo-templated transcription in prokaryotic and eukaryotic organisms". Genes & Development. 5 (5): 707–713. doi:10.1101/gad.5.5.707. ISSN 0890-9369. PMID 2026325. S2CID 37461543.
- ^ Marsh GA, de Jong C, Barr JA, Tachedjian M, Smith C, Middleton D, Yu M, Todd S, Foord AJ, Haring V, Payne J, Robinson R, Broz I, Crameri G, Field HE, Wang LF (2012). "Cedar virus: a novel Henipavirus isolated from Australian bats". PLOS Pathogens. 8 (8): e1002836. doi:10.1371/journal.ppat.1002836. PMC 3410871. PMID 22879820.
- ^ "Global Measles Mortality, 2000--2008". www.cdc.gov.
- ^ "CDC – HPIVs – Overview of Human Parainfluenza Viruses". www.cdc.gov. Retrieved September 19, 2014.
- ^ Sawatsky (2008). "Hendra and Nipah Virus". Animal Viruses: Molecular Biology. Caister Academic Press. ISBN 978-1-904455-22-6.
- ^ McCarthy AJ, Goodman SJ (January 2010). "Reassessing conflicting evolutionary histories of the Paramyxoviridae and the origins of respiroviruses with Bayesian multigene phylogenies". Infect. Genet. Evol. 10 (1): 97–107. doi:10.1016/j.meegid.2009.11.002. PMID 19900582.
외부 링크
- ICTV 보고서: 파라믹소바이러스과
- Paramyxovirus (1998) - 형태학, 게놈, 레플리케이션, 병원성 (특별한 접근 필요)
- "Hendra virus has a growing family tree". CSIRO Paramyxovirus press release. 2001. Archived from the original on 2007-08-04.
- 동물바이러스
- 파라믹소바이러스과 게놈바이러스생물정보자원센터
- 바이러스존: 파라믹소바이러스과
- 바이러스 병원체 데이터베이스 및 분석 자원(ViPR): Paramyxoviridae