선천성 면역체계
Innate immune system
선천적 또는 비특이적 면역체계는[1] 척추동물의 두 가지 주요 면역 전략 중 하나입니다. 선천성 면역계는 대체 방어 전략이며 식물, 균류, 원핵생물 및 무척추동물에서 발견되는 지배적인 면역계 반응입니다(척추동물 너머 참조).[2]
선천성 면역계의 주요 기능은 다음과 같습니다.
- 사이토카인이라 불리는 화학적 매개체를 포함한 화학적 인자를 생산함으로써 면역세포를 감염 부위로 모집합니다.
- 보체 캐스케이드를 활성화하여 박테리아를 식별하고 세포를 활성화하며 항체 복합체 또는 죽은 세포의 제거를 촉진합니다.
- 장기, 조직, 혈액, 림프 등에 존재하는 이물질을 특수 백혈구에 의해 확인 및 제거합니다.
- 항원제시를 통한 적응면역체계 활성화
- 피부 및 점액과 같은 물리적 조치와 응고 인자 및 숙주 방어 펩티드와 같은 화학적 조치를 통해 감염원에 대한 물리적 및 화학적 장벽으로 작용합니다.
해부학적 장벽
해부학적 장벽에는 물리적, 화학적, 생물학적 장벽이 포함됩니다. 상피 표면은 대부분의 감염원에게 불침투성인 물리적 장벽을 형성하여 침입하는 유기체에 대한 첫 번째 방어선 역할을 합니다.[3] 피부 상피의 박리(shadding)는 상피 표면에 부착된 박테리아 및 기타 감염원을 제거하는 데도 도움이 됩니다. 혈관이 부족하고 표피가 수분을 유지할 수 없으며 진피에 피지선이 존재하여 미생물의 생존에 적합하지 않은 환경이 됩니다.[3] 위장관과 호흡기에서는 각각 연동운동이나 섬모로 인한 운동이 감염원 제거에 도움이 됩니다.[3] 또한 점액은 감염원을 가둡니다.[3] 장내 세균총은 독성 물질을 분비하거나 영양분이나 세포 표면 부착 부위를 놓고 병원균과 경쟁하여 병원균의 집락화를 막을 수 있습니다.[3] 눈물과 침의 홍조 작용은 눈과 입의 감염을 예방하는 데 도움이 됩니다.[3]
| 해부학적 장벽 | 추가 방어 메커니즘 |
|---|---|
| 피부. | 땀(dermcidin 포함), 카텔리시딘, 박리, 홍조,[3] 유기산,[3] 피부 식물상 |
| 위장관 | 연동운동, 위산, 담즙산, 소화효소, 홍조, 티오시아네이트,[3] 디펜신,[3] 장내 세균총,[3] 리소자임 |
| 호흡기 및 폐 | 점막 연골 에스컬레이터,[4] 계면활성제,[3] 디펜신[3] |
| 비인두 | 점액, 침, 리소자임[3] |
| 아이즈 | 눈물[3] |
| 혈뇌장벽 | (passive diffusion/osmosis & active selection을 통해) 내피 세포. P-glycoprotein (능동적인 수송이 매개되는 메커니즘) |
염증
염증은 감염이나 자극에 대한 면역체계의 첫 번째 반응 중 하나입니다. 염증은 손상된 세포에서 방출되는 화학적 요인에 의해 자극됩니다. 감염 확산에 대한 물리적 장벽을 구축하고 병원체 제거 후 손상된 조직의 치유를 촉진합니다.[5]
급성 염증의 과정은 주로 상주하는 대식세포, 수지상세포, 조직구, 쿠퍼세포, 비만세포 등 모든 조직에 이미 존재하는 세포에 의해 시작됩니다. 이 세포들은 표면 또는 세포 내에 포함된 수용체를 존재하는데, 이 수용체는 병원체에 의해 광범위하게 공유되지만 숙주 분자와 구별될 수 있는 분자를 인식하는 PRR(pattern recognition receptor)로 명명되며, 이를 통칭하여 병원체 관련 분자 패턴(pathogen-associated molecular pattern)이라고 합니다. 이 세포들은 감염, 화상 또는 다른 손상이 시작되면 활성화(PRR 중 하나가 PAMP를 인식함)를 거쳐 염증의 임상 징후를 담당하는 사이토카인 및 케모카인과 같은 염증 매개체를 방출합니다. PRR 활성화 및 그 세포 결과는 파이롭토시스, 괴사 및 PANoptosis를 포함하는 염증 세포 사멸 방법으로 잘 특성화되었습니다. 이러한 세포 사멸 경로는 감염되거나 비정상적인 세포를 제거하고 세포 내용물과 염증 매개체를 방출하는 데 도움이 됩니다.
염증 시 생성되는 화학적 인자(히스타민, 브래디키닌, 세로토닌, 류코트리엔, 프로스타글란딘)는 통증 수용체를 민감하게 만들고 혈관의 국소 혈관 확장을 유발하며 식세포, 특히 호중구를 유인합니다.[5] 그런 다음 호중구는 백혈구와 림프구를 추가로 소환하는 인자를 방출함으로써 면역계의 다른 부분을 유발합니다. 대식세포와 선천성 면역계의 다른 세포에서 생성된 사이토카인이 염증 반응을 매개합니다. 이러한 사이토카인에는 TNF, HMGB1 및 IL-1이 포함됩니다.[6]
염증 반응은 다음과 같은 증상을 특징으로 합니다.
- 국소적으로 혈액순환이 증가하여 피부가 붉어지는 경우
- 열, 국소 감염 주변의 따뜻한 느낌과 같은 지역 온도 상승 또는 전신 열
- 일반적인 감기 중에 목 위쪽이나 류마티스 관절염의 영향을 받는 관절과 같은 영향을 받는 조직의 부종
- 콧물이나 생성성 기침과 같은 증상을 유발할 수 있는 점액의 생산 증가
- 통증, 관절통이나 인후통과 같은 국소적인 통증 또는 몸살과 같은 전신에 영향을 주는 통증,
- 관련 기관/tissues의 기능 장애 가능성
보체계
보체계는 항체가 병원체를 제거하거나 다른 세포에 의해 파괴되는 것을 표시하는 능력을 돕는, 또는 "보충"하는 면역체계의 생화학적 캐스케이드입니다. 캐스케이드는 주로 간세포에 의해 간에서 합성되는 많은 혈장 단백질로 구성됩니다. 단백질은 다음과 같이 작용합니다.
- 염증 세포의 모집을 유발합니다.
- 병원체 표면을 옵소닌화(opsonizing)하거나 코팅하여 다른 세포에 의한 병원체의 파괴를 "태그(tag)"합니다.
- 병원체의 원형질막에 구멍을 형성하여 병원체 세포의 세포용해를 일으켜 사망에 이르게 함
- 중화항원과 antibody 복합체를 제거합니다
세 가지 다른 보완 시스템은 고전, 대체 및 렉틴입니다.
보체 캐스케이드의 요소는 식물, 새, 물고기 및 무척추동물의 일부 종을 포함한 많은 비포유류 종에서 발견될 수 있습니다.[7]
백혈구

백혈구(WBC)는 백혈구라고도 합니다. 대부분의 백혈구는 특정 장기나 조직과 밀접하게 연관되어 있지 않다는 점에서 신체의 다른 세포들과 다릅니다. 따라서 그들의 기능은 독립적인 단세포 생물의 기능과 비슷합니다. 대식세포, 비만세포, 수지상세포는 이동성이 떨어지지만, 대부분의 백혈구는 자유롭게 이동하여 세포 잔해, 이물질, 침입 미생물과 상호작용하고 포획할 수 있습니다. 다른 많은 세포와 달리 대부분의 선천성 면역 백혈구는 스스로 분열하거나 번식할 수 없지만 골수에 존재하는 다능한 조혈모세포의 산물입니다.[8][9]
선천성 백혈구에는 자연살해세포, 비만세포, 호산구, 호염기구, 식세포에는 대식세포, 호중구, 수지상세포가 있으며, 감염을 일으킬 수 있는 병원체를 찾아 제거함으로써 면역계 내에서 기능합니다.[2]
비만세포
비만 세포는 결합 조직과 점막에 존재하는 선천성 면역 세포의 한 종류입니다. 상처 치유 및 병원균 방어와 밀접한 관련이 있지만 알레르기 및 아나필락시스와도 종종 관련이 있습니다.[5] 비만 세포는 활성화되면 히스타민과 헤파린이 풍부한 특징적인 과립을 다양한 호르몬 매개체와 케모카인, 또는 화학주성 사이토카인을 환경으로 빠르게 방출합니다. 히스타민은 혈관을 확장시켜 염증의 특징적인 징후를 유발하고 호중구와 대식세포를 모집합니다.[5]
식세포
식세포라는 말은 문자 그대로 '먹는 세포'라는 뜻입니다. 이것들은 병원균이나 입자를 집어삼키는 면역 세포, 즉 '식세포'입니다. 식세포는 입자나 병원체를 집어삼키기 위해 원형질막의 일부를 확장하여 입자가 둘러싸일 때까지 막을 감싼다(즉, 입자는 이제 세포 안에 있습니다). 일단 세포 안에 들어가면 침입하는 병원체는 리소좀과 결합하는 식세포 내부에 포함됩니다.[2] 리소좀에는 입자나 유기체를 죽이고 소화시키는 효소와 산이 포함되어 있습니다. 일반적으로 식세포는 병원균을 찾아 몸을 순찰하지만, 사이토카인이라고 불리는 다른 세포가 만들어내는 고도로 전문화된 분자 신호 그룹에도 반응할 수 있습니다. 면역계의 식세포에는 대식세포, 호중구, 수지상세포 등이 있습니다.
숙주 자신의 세포의 식균작용은 정기적인 조직 발달과 유지의 일부로서 일반적입니다. 숙주 세포가 사멸하거나 감염으로 인한 세포 손상으로 사망하면 식세포는 영향을 받은 부위에서 제거되는 역할을 합니다.[9] 식균작용은 새로운 건강한 세포의 성장과 발달에 앞서 죽은 세포를 제거하는 데 도움을 줌으로써 조직 손상 후 치유 과정의 중요한 부분입니다.

대식세포
'대식가'라는 뜻의 그리스어에서 온 대식세포는 큰 식세포 백혈구로 모세혈관 벽을 통해 이동하고 침입 병원체를 찾아 세포 사이의 영역으로 들어가 혈관계를 넘어 이동할 수 있습니다. 조직에서 장기 특이적 대식세포는 단핵구라고 불리는 혈액에 존재하는 식세포와 구별됩니다. 대식세포는 가장 효율적인 식세포이며, 상당한 수의 박테리아나 다른 세포나 미생물을 식균할 수 있습니다.[2] 대식세포 표면의 수용체에 박테리아 분자가 결합하면 '호흡 폭발'의 발생을 통해 박테리아를 집어삼키고 파괴하여 활성산소종의 방출을 유발합니다. 병원균은 또한 대식세포를 자극하여 케모카인을 생성하고, 케모카인은 다른 세포를 감염 부위로 소환합니다.[2]
호중구
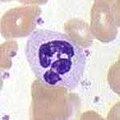
호중구는 호산구, 호염기구와 함께 과립이 세포질에 존재하여 과립구로 알려져 있거나, 특유의 엽핵으로 인해 다형핵세포(PMN)로 알려져 있습니다. 호중구 과립에는 박테리아와 곰팡이의 성장을 죽이거나 억제하는 다양한 독성 물질이 포함되어 있습니다. 호중구는 대식세포와 마찬가지로 호흡 폭발을 활성화시켜 병원체를 공격합니다. 호중구 호흡 파열의 주요 생성물은 과산화수소, 활성산소 라디칼 및 차아염소산염을 포함한 강력한 산화제입니다. 호중구는 가장 풍부한 유형의 식세포로, 일반적으로 전체 순환 백혈구의 50-60%를 차지하며, 일반적으로 감염 부위에 도달하는 첫 번째 세포입니다.[5] 정상적인 건강한 성인의 골수는 하루에 1,000억 개 이상의 호중구를 생산하며, 급성 염증 시에는 하루에 그 10배 이상의 호중구를 생산합니다.[5]
수지상세포
수지상세포(dendritic cells, DCs)는 주로 피부(흔히 랑게르한스 세포라고 불리는 곳)와 코, 폐, 위, 장의 내부 점막 안감과 같은 외부 환경과 접촉하는 조직에 존재하는 식세포입니다.[9] 그들은 신경 수상돌기와 닮았다고 해서 이름 지어졌지만, 수상돌기 세포는 신경계와 연결되어 있지 않습니다. 수지상 세포는 항원 제시 과정에서 매우 중요하며, 선천성 면역계와 적응성 면역계를 연결하는 연결고리 역할을 합니다.
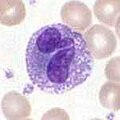
호산구와 호산구
호산구와 호산구는 호중구와 관련된 세포입니다. 병원체 접촉에 의해 활성화되면 히스타민 방출 호염구는 기생충에 대한 방어에 중요하고 천식과 같은 알레르기 반응에 역할을 합니다.[2] 활성화되면 호산구는 다양한 독성이 강한 단백질과 활성산소를 분비하여 기생충을 죽이는 데 매우 효과적이지만 알레르기 반응 중 조직을 손상시킬 수도 있습니다. 따라서, 호산구에 의한 독소의 활성화 및 방출은 부적절한 조직 파괴를 방지하기 위해 엄격하게 규제됩니다.[5]
자연살해세포
자연살해세포(NK세포)는 침입하는 미생물을 직접 공격하지 않습니다. 오히려 NK 세포는 종양 세포나 바이러스에 감염된 세포와 같은 손상된 숙주 세포를 파괴하여 "실종된 자아"라고 알려진 상태로 그러한 세포를 인식합니다. 이 용어는 숙주 세포의 바이러스 감염에서 발생할 수 있는 상황인 MHC I(주요 조직적합성 복합체)라고 불리는 세포 표면 마커의 비정상적으로 낮은 수준을 가진 세포를 설명합니다.[10] 그들은 "자아를 놓치고 있는" 세포를 죽이기 위해 활성화를 필요로 하지 않는다는 최초의 생각 때문에 "자연 살해자"로 명명되었습니다. 이를 인식하면 손상된 세포 표면의 MHC 조성이 변화하고 NK세포가 활성화됩니다. 정상적인 체세포는 온전한 자가 MHC 항원을 발현하기 때문에 NK세포가 인식하고 공격하지 않습니다. 이러한 MHC 항원은 NK 세포의 반응을 늦추는 킬러 세포 면역글로불린 수용체(KIR)에 의해 인식됩니다. NK-92 세포주는 KIR을 발현하지 않으며 종양 치료를 위해 개발되었습니다.[11][12][13][14]
γδ T세포
CD1d 제한 자연 살해 T 세포와 같이 불변 T 세포 수용체(TCR)를 포함하는 다른 '비재래적' T 세포 하위 집합과 마찬가지로 γδ T 세포는 선천성 면역과 적응성 면역의 경계에 위치하는 특성을 나타냅니다. γδ T 세포는 TCR 유전자를 재배열하여 접합 다양성을 생성하고 기억 표현형을 발달시킨다는 점에서 적응 면역의 구성 요소로 간주될 수 있습니다. 다양한 하위 집합은 제한된 TCR 또는 NK 수용체가 패턴 인식 수용체로 사용될 수 있는 선천 면역 시스템의 일부로 간주될 수 있습니다. 예를 들어, 이 패러다임에 따르면, 많은 수의 V γ9/V δ2 T 세포는 미생물이 생산하는 공통 분자에 수 시간 내에 반응하고, 고도로 제한된 상피 내 V δ1 T 세포는 스트레스를 받는 상피 세포에 반응할 것입니다.
기타 척추동물 메커니즘
응고 시스템은 면역 시스템과 겹칩니다. 응고 시스템의 일부 제품은 혈관 투과성을 증가시키고 식세포에 대한 화학주성제 역할을 하는 능력을 통해 비특이적 방어에 기여할 수 있습니다. 또한 응고 시스템의 일부 제품은 직접 항균제입니다. 예를 들어 응고 과정에서 혈소판에 의해 생성되는 단백질인 베타-라이신은 양이온성 세제 역할을 함으로써 많은 그람양성균의 용해를 일으킬 수 있습니다.[3] 염증의 많은 급성기 단백질이 응고 시스템에 관여합니다.
락토페린과 트랜스페린의 수치가 증가하면 필수 세균 영양소인 철분을 결합시켜 세균의 성장을 억제합니다.[3]
신경조절
감염성 및 무균성 손상에 대한 선천성 면역 반응은 사이토카인 생성 기간을 조절하는 신경 회로에 의해 조절됩니다. 염증 반사는 비장에서 사이토카인 생성을 조절하는 원형 신경 회로입니다.[15] 미주신경을 통해 비장으로 전달되는 활동전위는 사이토카인 생성 세포에서 발현되는 알파7 니코틴성 아세틸콜린 수용체(CHRNA7)와 상호작용하여 사이토카인 방출을 억제하는 신경전달물질인 아세틸콜린의 방출을 매개합니다.[16] 염증 반사의 운동 호를 콜린성 항염증 경로라고 합니다.
병원체특이성
선천성 면역계의 일부는 다양한 병원체에 대한 특이성을 나타냅니다.
| 병원체 | 주요예시[17] | Phagocytosis[17] | 보필의[17] | NK세포[17] |
|---|---|---|---|---|
| 세포내 및 세포질 바이러스 | 네. | 네[18] | 네. | |
| 세포내세균 | 예(specif적으로 호중구) | 네[19] | 네. | |
| 아니요. | 네. | 네. | ||
| 세포외세균 | 네. | 네. | 아니요. | |
| 세포내원생동물 | 아니요. | 아니요. | 네. | |
| 세포외원생동물 | 네. | 네. | 아니오/그렇지 않다 | |
| 세포외균류 | 아니요. | 네. | 네[20] |
면역회피
선천성 면역계 세포는 체내에서 미생물의 자유로운 성장을 막지만, 많은 병원균들이 이를 회피하는 메커니즘을 진화시켜 왔습니다.[21][22]
한 가지 전략은 Mycobacterium tuberculosis에 의해 실행되는 세포 내 복제 또는 보호 캡슐을 착용하는 것인데, 이는 살모넬라에서와 같이 보체 및 식세포에 의한 용해를 방지합니다.[23] 박테로이데스 종은 보통 포유류의 위장 식물군의 상당 부분을 차지하는 상호주의 박테리아입니다.[24] B. fragilis와 같은 종은 기회주의적 병원체로 복막강의 감염을 유발합니다. 그들은 박테리아를 집어삼키는 데 사용되는 식세포 수용체에 영향을 주어 식균 작용을 억제합니다. 그들은 또한 숙주 세포를 모방할 수 있으므로 면역 체계가 그들을 외래 세포로 인식하지 못합니다. 황색포도상구균은 식세포가 케모카인 신호에 반응하는 능력을 억제합니다. M. tuberculosis, Streptococcus pyogenes, Bacillus anthracis는 식세포를 직접 죽이는 메커니즘을 사용합니다.[citation needed]
박테리아와 곰팡이는 복잡한 생물막을 형성하여 면역 세포와 단백질로부터 보호할 수 있습니다; 생물막은 낭포성 섬유증의 특징인 만성 녹농균(Pseudomonas aeruginosa) 및 버크홀데리아 세노세파시아(Burkholderia cenecepacia) 감염에 존재합니다.[25]
바이러스
주로 수지상 세포에서 분비되는 I형 인터페론([26]IFN)은 항바이러스 숙주 방어와 세포의 항바이러스 상태에 중심적인 역할을 합니다.[27] 바이러스 성분은 다양한 수용체에 의해 인식됩니다. 톨 유사 수용체는 엔도솜 막에 위치하며 이중가닥 RNA(dsRNA), MDA5 및 RIG-I 수용체는 세포질에 위치하며 각각 긴 dsRNA 및 인산염 함유 dsRNA를 인식합니다.[28] 세포질 수용체 MDA5 및 RIG-I가 바이러스를 인식하면 카스파제-모집 도메인(CASPase-ruction domain, CARD)과 CARD-함유 어댑터 MAVS 사이의 형태가 바뀝니다. 동시에, 세포내 구획의 TLR이 바이러스를 인식할 때 어댑터 단백질 TRIF의 활성화가 유도됩니다. 두 경로 모두 IKK ε/TBK-1 복합체의 모집 및 활성화에 수렴하여 핵에 전위된 전사 인자 IRF3 및 IRF7의 이량체화를 유도하고, 여기서 특정 전사 인자의 존재로 IFN 생산을 유도하고 전사 인자 2를 활성화합니다. IFN은 분비 소포를 통해 분비되며, 분비된 세포(자가분비) 또는 주변 세포(파라크린)에서 모두 수용체를 활성화할 수 있습니다. 이는 인터페론 자극 유전자 수백 개가 발현되도록 유도합니다. 이것은 바이러스 단백질 합성을 억제하는 단백질 키나제 R이나 바이러스 RNA를 분해하는 2',5'-올리고아데닐레이트 합성효소 계열과 같은 항바이러스 단백질 생성으로 이어집니다.[27]
일부 바이러스는 IFN 생성을 방해하는 분자를 생성하여 이를 회피합니다. 예를 들어, 인플루엔자 A 바이러스는 NS1 단백질을 생성하는데, NS1 단백질은 숙주 및 바이러스 RNA와 결합하여 면역 신호 단백질과 상호 작용하거나 유비퀴틴화에 의해 활성화를 차단하여 I형 IFN 생성을 억제할 수 있습니다.[29] 인플루엔자 A는 또한 단백질 키나제 R의 활성화와 항바이러스 상태의 확립을 차단합니다.[30] 또한 뎅기 바이러스는 NS2B3 프로테아제 복합체를 이용하여 IRF-3 인산화를 차단함으로써 I형 IFN 생성을 억제합니다.[31]
척추동물을 넘어서
원핵생물
박테리아(그리고 아마도 다른 원핵생물)는 박테리오파지와 같은 병원체로부터 자신을 보호하기 위해 제한 변형 시스템이라고 불리는 독특한 방어 메커니즘을 사용합니다. 이 시스템에서 박테리아는 침입하는 박테리오파지의 바이러스 DNA의 특정 영역을 공격하고 파괴하는 제한 엔도뉴클레아제라고 불리는 효소를 생산합니다. 숙주 자신의 DNA를 메틸화하면 "자기"로 표시되고 엔도뉴클레아제의 공격을 받지 않습니다.[32] 제한 엔도뉴클레아제와 제한 변형 시스템은 원핵생물에만 존재합니다.[33]
무척추동물
무척추동물은 림프구나 항체를 기반으로 하는 체액성 면역체계를 가지고 있지 않으며, 최초의 척추동물에서 다성분 적응 면역체계가 발생했을 가능성이 높습니다.[34] 그럼에도 불구하고 무척추동물은 이러한 척추동물 면역의 전조로 보이는 메커니즘을 가지고 있습니다. 패턴 인식 수용체(PRR)는 미생물 병원체와 관련된 분자를 식별하기 위해 거의 모든 유기체가 사용하는 단백질입니다. TLR은 인간을 포함한 모든 실로메이트(체강이 있는 동물)에 존재하는 패턴 인식 수용체의 주요 부류입니다.[35] 보완 시스템은 대부분의 생명체에 존재합니다. 다양한 곤충, 게 및 벌레를 포함한 일부 무척추동물은 프로페놀 산화효소(proPO) 시스템으로 알려진 보체 반응의 변형된 형태를 사용합니다.[34]
항균 펩타이드는 모든 생명의 계층에서 발견되는 선천성 면역 반응의 진화적으로 보존된 성분으로 무척추동물 전신 면역의 주요 형태를 나타냅니다. 여러 종의 곤충이 디펜신과 세크로핀으로 알려진 항균 펩티드를 생산합니다.
단백질 분해 캐스케이드
무척추동물에서 PRR은 단백질을 분해하고 혈림프 응고 및 멜라닌화를 포함한 무척추동물의 선천 면역계의 많은 메커니즘을 제어하는 단백질 분해 캐스케이드를 유발합니다. 단백질 분해 캐스케이드는 유전자 변화에 의존하지 않기 때문에 다른 선천성 면역 반응보다 더 빨리 켜지기 때문에 무척추동물 면역계의 중요한 구성 요소입니다. 단백질 분해 캐스케이드는 척추동물과 무척추동물 모두에서 기능하지만, 다른 단백질이 캐스케이드 전체에 사용됩니다.[36]
응고 메커니즘
절지동물의 순환계에서 액체를 구성하는 혈림프에서는 다른 동물의 혈액과 마찬가지로 병원체 침입자를 둘러싸고 있는 겔 모양의 액체가 존재합니다. 무척추동물의 응고에는 다양한 단백질과 메커니즘이 관여합니다. 응고 시스템은 갑각류에서 혈액 세포의 트랜스글루타미나제와 이동성 혈장 단백질로 구성되며, 트랜스글루타미나제는 혈장 응고 단백질의 210 kDa 소단위를 중합합니다. 한편, 편자게 응고 시스템에서는 단백질 분해 캐스케이드의 성분이 비활성 형태로 혈구의 과립에 저장되며, 이는 지질다당류와 같은 외부 분자가 들어갈 때 방출됩니다.[36]
식물
인간을 감염시키는 모든 종류의 병원체의 구성원들은 식물도 감염시킵니다. 정확한 병원성 종은 감염된 종에 따라 다르지만 박테리아, 곰팡이, 바이러스, 선충류, 곤충 모두 식물 질병을 유발할 수 있습니다. 동물과 마찬가지로 곤충이나 다른 병원체의 공격을 받은 식물도 일련의 복잡한 대사 반응을 사용하여 감염과 싸우거나 곤충이나 다른 초식동물에게 식물을 덜 매력적으로 만드는 방어적인 화학 화합물을 형성합니다.[37] (참조: 초식동물에 대한 식물 방어).
식물은 무척추동물과 마찬가지로 항체나 T세포 반응을 일으키지 않으며 병원체를 감지하고 공격하는 이동성 세포도 가지고 있지 않습니다. 또한 감염의 경우 일부 식물의 일부는 일회용 및 교체용으로 처리되는데, 이는 동물이 거의 할 수 없는 방식입니다. 식물의 일부를 벽으로 막거나 폐기하는 것은 감염 확산을 막는 데 도움이 됩니다.[37]
대부분의 식물 면역 반응은 식물 전체에 전달되는 전신 화학 신호를 포함합니다. 식물은 PRR을 사용하여 보존된 미생물 서명을 인식합니다. 이 인식은 면역 반응을 유발합니다. 보존된 미생물 시그니처의 첫 번째 식물 수용체는 벼(XA21, 1995)[38][39]와 Arabidopsis(FLS2, 2000)에서 확인되었습니다.[40] 식물은 또한 다양한 병원체 이펙터를 인식하는 면역 수용체를 운반합니다. 여기에는 단백질의 NBS-LRR 그룹이 포함됩니다. 식물의 일부가 미생물 또는 바이러스 병원체에 감염되면 특정 유도체에 의해 유발되는 양립할 수 없는 상호작용의 경우 식물은 국소적인 과민 반응(HR)을 생성하며, 이 반응에서 감염 부위의 세포는 식물의 다른 부분으로 확산되는 것을 방지하기 위해 빠른 세포자멸사를 거칩니다. HR은 세포 사멸 동안 세포 분해를 조절하는 시스테인 단백질분해효소인 VPE γ의 카스파제-1 유사 단백질 분해 활성 요구와 같은 동물성 파이롭토시스와 유사한 점이 있습니다.
R 유전자에 의해 암호화된 "내성"(R) 단백질은 식물에 널리 존재하며 병원체를 감지합니다. 이 단백질은 NOD 유사 수용체 및 TLR과 유사한 도메인을 포함합니다. 전신 후천성 저항성(SAR)은 광범위한 감염원에 대해 식물 전체를 내성으로 만드는 일종의 방어 반응입니다.[42] SAR은 살리실산 또는 자스몬산과 같은 화학적 메신저의 생성을 포함합니다. 이들 중 일부는 식물을 통해 이동하여 다른 세포에 신호를 보내어 미감염 부분, 예를 들어 잎을 보호하는 방어 화합물을 생성합니다.[43] 살리실산 자체는 SAR의 발현에 필수적이지만 전신 반응을 담당하는 전위된 신호는 아닙니다. 최근의 증거는 식물의 말단 부분으로 신호를 전달하는 데 있어 자스모네이트의 역할을 나타냅니다. RNA 침묵 메커니즘은 바이러스 복제를 차단할 수 있기 때문에 식물의 전신 반응에서 중요합니다.[44] 자스몬산 반응은 곤충에 의해 손상된 잎에서 자극을 받고, 메틸 자스몬산의 생성을 수반합니다.[37]
참고 항목
참고문헌
- ^ "Immune response: MedlinePlus Medical Encyclopedia". medlineplus.gov. Retrieved 7 November 2021.
- ^ a b c d e f Janeway C, Paul C, Travers M, Walport M, Shlomchik M (2001). Immunobiology (Fifth ed.). New York and London: Garland Science. ISBN 0-8153-4101-6..
- ^ a b c d e f g h i j k l m n o p q Mayer G. "Innate (Non-Specific) Immunity". Immunology Section of Microbiology and Immunology On-line. University of South Carolina.
- ^ "Mucociliary escalator". Saunders Comprehensive Veterinary Dictionary (3rd ed.). Elsevier, Inc. 2007. Retrieved 11 June 2018.
- ^ a b c d e f g Stvrtinová V, Jakubovský J, Hulín I (1995). "Inflammation and Fever". Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. Archived from the original on 18 June 2007.
- ^ Lotze MT, Tracey KJ (April 2005). "High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal". Nature Reviews. Immunology. 5 (4): 331–342. doi:10.1038/nri1594. PMID 15803152. S2CID 27691169.
- ^ Janeway CA, Travers P, Walport M, Shlomchik MJ (2005). Immunobiology (6th ed.). Garland Science. ISBN 0-443-07310-4.
- ^ Monga I, Kaur K, Dhanda S (March 2022). "Revisiting hematopoiesis: applications of the bulk and single-cell transcriptomics dissecting transcriptional heterogeneity in hematopoietic stem cells". Briefings in Functional Genomics. 21 (3): 159–176. doi:10.1093/bfgp/elac002. PMID 35265979.
- ^ a b c Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (Fourth ed.). New York and London: Garland Science. ISBN 0815332181.
- ^ Janeway C (2005). Immunobiology (6th ed.). Garland Science. ISBN 0-443-07310-4.
- ^ Arai S, Meagher R, Swearingen M, Myint H, Rich E, Martinson J, Klingemann H (2008). "Infusion of the allogeneic cell line NK-92 in patients with advanced renal cell cancer or melanoma: a phase I trial". Cytotherapy. 10 (6): 625–632. doi:10.1080/14653240802301872. PMID 18836917.
- ^ Tonn T, Becker S, Esser R, Schwabe D, Seifried E (August 2001). "Cellular immunotherapy of malignancies using the clonal natural killer cell line NK-92". Journal of Hematotherapy & Stem Cell Research. 10 (4): 535–544. doi:10.1089/15258160152509145. PMID 11522236.
- ^ Gong JH, Maki G, Klingemann HG (April 1994). "Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells". Leukemia. 8 (4): 652–658. PMID 8152260.
- ^ Klingemann HG (2010). "Development and testing of NK cell lines". In Lotze MT, Thompson AW (eds.). Natural killer cells - Basic Science and Clinical applications. pp. 169–175.
- ^ Tracey KJ (February 2007). "Physiology and immunology of the cholinergic antiinflammatory pathway". The Journal of Clinical Investigation. 117 (2): 289–296. doi:10.1172/JCI30555. PMC 1783813. PMID 17273548.
- ^ Tracey KJ (June 2009). "Reflex control of immunity". Nature Reviews. Immunology. 9 (6): 418–428. doi:10.1038/nri2566. PMC 4535331. PMID 19461672.
- ^ a b c d Doan T (2008). Immunology. Lippincott Williams & Wilkins. p. 172. ISBN 978-0-7817-9543-2.
- ^ Agrawal P, Nawadkar R, Ojha H, Kumar J, Sahu A (16 June 2017). "Complement Evasion Strategies of Viruses: An Overview". Frontiers in Microbiology. 8: 1117. doi:10.3389/fmicb.2017.01117. PMC 5472698. PMID 28670306.
- ^ Croize J, Arvieux J, Berche P, Colomb MG (December 1993). "Activation of the human complement alternative pathway by Listeria monocytogenes: evidence for direct binding and proteolysis of the C3 component on bacteria". Infection and Immunity. 61 (12): 5134–5139. doi:10.1128/iai.61.12.5134-5139.1993. PMC 281293. PMID 8225590.
- ^ Ma LL, Wang CL, Neely GG, Epelman S, Krensky AM, Mody CH (September 2004). "NK cells use perforin rather than granulysin for anticryptococcal activity". Journal of Immunology. 173 (5): 3357–3365. doi:10.4049/jimmunol.173.5.3357. PMID 15322199. S2CID 43258057.
- ^ Kennedy A. "Immune Evasion by bacteria". Crohnie. Archived from the original on 10 October 2006. Retrieved 25 October 2006.
- ^ Finlay BB, McFadden G (February 2006). "Anti-immunology: evasion of the host immune system by bacterial and viral pathogens". Cell. 124 (4): 767–782. doi:10.1016/j.cell.2006.01.034. PMID 16497587. S2CID 15418509.
- ^ Finlay BB, Falkow S (June 1997). "Common themes in microbial pathogenicity revisited". Microbiology and Molecular Biology Reviews. 61 (2): 136–169. doi:10.1128/mmbr.61.2.136-169.1997. PMC 232605. PMID 9184008.
- ^ Dorland WA, ed. (2003). Dorland's Illustrated Medical Dictionary (30th ed.). W.B. Saunders. ISBN 0-7216-0146-4.
- ^ Kobayashi H (2005). "Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections". Treatments in Respiratory Medicine. 4 (4): 241–253. doi:10.2165/00151829-200504040-00003. PMID 16086598. S2CID 31788349.
- ^ Le Bon A, Tough DF (August 2002). "Links between innate and adaptive immunity via type I interferon". Current Opinion in Immunology. 14 (4): 432–436. doi:10.1016/s0952-7915(02)00354-0. PMID 12088676.
- ^ a b Akira S, Uematsu S, Takeuchi O (February 2006). "Pathogen recognition and innate immunity". Cell. 124 (4): 783–801. doi:10.1016/j.cell.2006.02.015. PMID 16497588. S2CID 14357403.
- ^ Baum A, García-Sastre A (May 2010). "Induction of type I interferon by RNA viruses: cellular receptors and their substrates". Amino Acids. 38 (5): 1283–1299. doi:10.1007/s00726-009-0374-0. PMC 2860555. PMID 19882216.
- ^ Heaton SM, Borg NA, Dixit VM (January 2016). "Ubiquitin in the activation and attenuation of innate antiviral immunity". The Journal of Experimental Medicine. 213 (1): 1–13. doi:10.1084/jem.20151531. PMC 4710203. PMID 26712804.
- ^ García-Sastre A, Egorov A, Matassov D, Brandt S, Levy DE, Durbin JE, et al. (December 1998). "Influenza A virus lacking the NS1 gene replicates in interferon-deficient systems". Virology. 252 (2): 324–330. doi:10.1006/viro.1998.9508. PMID 9878611.
- ^ Rodriguez-Madoz JR, Belicha-Villanueva A, Bernal-Rubio D, Ashour J, Ayllon J, Fernandez-Sesma A (October 2010). "Inhibition of the type I interferon response in human dendritic cells by dengue virus infection requires a catalytically active NS2B3 complex". Journal of Virology. 84 (19): 9760–9774. doi:10.1128/jvi.01051-10. PMC 2937777. PMID 20660196.
- ^ Peters P. "Restriction Enzymes". Access Excellence Classic Collection Background Paper.
- ^ Oliveira PH, Touchon M, Rocha EP (2014). "The interplay of restriction-modification systems with mobile genetic elements and their prokaryotic hosts". Nucleic Acids Research. 42 (16): 10618–10631. doi:10.1093/nar/gku734. PMC 4176335. PMID 25120263.
- ^ a b Beck G, Habicht GS (November 1996). "Immunity and the invertebrates". Scientific American. 275 (5): 60–63, 66. Bibcode:1996SciAm.275e..60B. doi:10.1038/scientificamerican1196-60. PMID 8875808.
- ^ Imler JL, Hoffmann JA (July 2001). "Toll receptors in innate immunity". Trends in Cell Biology. 11 (7): 304–311. doi:10.1016/S0962-8924(01)02004-9. PMID 11413042.
- ^ a b Cerenius L, Kawabata S, Lee BL, Nonaka M, Söderhäll K (October 2010). "Proteolytic cascades and their involvement in invertebrate immunity". Trends in Biochemical Sciences. 35 (10): 575–583. doi:10.1016/j.tibs.2010.04.006. PMID 20541942.
- ^ a b c Schneider D (2005). "Plant immune responses". Stanford University Department of Microbiology and Immunology. Archived from the original on 9 June 2007.
- ^ Song WY, Wang GL, Chen LL, Kim HS, Pi LY, Holsten T, et al. (December 1995). "A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21". Science. 270 (5243): 1804–1806. Bibcode:1995Sci...270.1804S. doi:10.1126/science.270.5243.1804. PMID 8525370. S2CID 10548988.
- ^ Ronald PC, Beutler B (November 2010). "Plant and animal sensors of conserved microbial signatures". Science. 330 (6007): 1061–1064. Bibcode:2010Sci...330.1061R. doi:10.1126/science.1189468. PMID 21097929. S2CID 18311102.
- ^ Gómez-Gómez L, Boller T (June 2000). "FLS2: an LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in Arabidopsis". Molecular Cell. 5 (6): 1003–1011. doi:10.1016/S1097-2765(00)80265-8. PMID 10911994.
- ^ Rojo E, Martín R, Carter C, Zouhar J, Pan S, Plotnikova J, et al. (November 2004). "VPEgamma exhibits a caspase-like activity that contributes to defense against pathogens". Current Biology. 14 (21): 1897–1906. doi:10.1016/j.cub.2004.09.056. PMID 15530390. S2CID 3231431.
- ^ 키토산#농원예용
- ^ Linden JC, Stoner RJ, Knutson KW, Gardner-Hughes CA (2000). "Organic disease control elicitors" (PDF). Agro Food Industry Hi-Tech. 11 (5): 32–34. Archived from the original (PDF) on 6 July 2007.
- ^ Baulcombe D (September 2004). "RNA silencing in plants". Nature. 431 (7006): 356–363. Bibcode:2004Natur.431..356B. doi:10.1038/nature02874. PMID 15372043. S2CID 4421274.
외부 링크
- Breuer K, Foroushani AK, Laird MR, Chen C, Sribnaia A, Lo R, Winsor GL, Hancock RE, Brinkman FS, Lynn DJ. "InnateDB".
database of proteins and their interactions in innate immune
체계적인 - 선천 면역 시스템 애니메이션 XVIVO 과학 애니메이션

