TGFβ신호경로
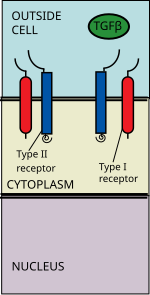
TGF beta signaling pathway변환성장인자 베타(TGFB) 시그널링 경로는 세포 성장, 세포 분화, 세포 이동, 아포토시스, 세포 항상성 및 기타 세포 기능을 포함한 성체 유기체와 발달 중인 배아의 많은 세포 과정에 관여한다.TGFB 시그널링 패스는 [1]보존됩니다.TGFβ 시그널링 경로가 조절하는 광범위한 세포 과정에도 불구하고, 그 과정은 비교적 단순하다.TGFβ 슈퍼 패밀리 리간드는 II형 수용체에 결합하고, II형 수용체는 I형 수용체를 모집하고 인산화한다.I형 수용체는 이제 coSMAD4와 결합할 수 있는 수용체 조절 SMAD(R-SMADs)를 인산화한다. R-SMAD/coSMAD 복합체는 핵에 축적되어 전사 인자로 작용하고 표적 유전자 [2]발현 조절에 참여한다.
메커니즘
배위자 결합
리간드의 TGF 베타 슈퍼패밀리는 다음을 포함한다.골형성단백질(BMPs), 성장과 분화인자(GDFs), 항뮬러 호르몬(AMH), 액티빈, 노달 및 TGFβs.[3]시그널링은 TGF 베타 슈퍼패밀리 리간드가 TGF 베타 타입 II 수용체에 결합하는 것으로 시작된다.II형 수용체는 I형 수용체의 인산화를 촉매하는 세린/트레오닌 수용체 키나제이다.리간드의 각 클래스는 특정 타입 II [4]수용체에 결합합니다.포유류에는 7개의 알려진 I형 수용체와 5개의 II형 [5]수용체가 있다.
다음 3가지 액티비티가 있습니다.액티빈 A, 액티빈 B 및 액티빈 AB.액티빈들은 배아발생과 골형성에 관여한다.그들은 또한 인슐린뿐만 아니라 뇌하수체, 생식선, 시상하부 호르몬을 포함한 많은 호르몬을 조절한다.그것들은 또한 신경 세포의 생존 요인이다.
BMP는 골형성 단백질 수용체 타입 2(BMPR2)에 결합한다.그들은 골형성, 세포 분화, 전/후축 사양, 성장 및 항상성을 포함한 다수의 세포 기능에 관여한다.
TGFβ 제품군은 다음을 포함한다.TGFβ1, TGFβ2, TGFβ3BMP와 마찬가지로 TGFβs는 발생과 세포 분화뿐만 아니라 아포토시스 및 기타 기능에도 관여한다.이들은 TGF-β 수용체 Type-2(TGFBR2)에 결합한다.
노달은 IIB ACVR2B형 A 수용체에 결합한다.그런 다음 IB형 A 수용체(ACVR1B) 또는 IC형 A 수용체(ACVR1C)[5]와 함께 수용체 복합체를 형성할 수 있다.
리셉터 리간드 결합이 국소 작용에 의해 발생하는 경우, 이는 파라크린 시그널링으로 분류된다.
수용체 모집 및 인산화
TGF 베타 리간드는 II형 수용체 이합체에 결합하며, II형 수용체 이합체는 리간드와 [6]함께 헤테로 4중합체를 형성하는 I형 수용체 이합체를 형성한다.이들 수용체는 세린/트레오닌 키나아제 수용체이다.그들은 시스테인이 풍부한 세포외 도메인, 막 통과 도메인 및 세포질 세린/트레오닌 풍부 도메인을 가지고 있다.I형 수용체의 GS 도메인은 일련의 약 30개의 세린 글리신 [7]반복으로 구성됩니다.TGFβ족 리간드의 결합은 수용체의 회전을 유발하여 세포질 키나제 도메인이 촉매적으로 유리한 방향으로 배열되도록 한다.Type II 수용체는 Type I 수용체의 세린 잔기를 인산화하여 단백질을 활성화시킵니다.
SMAD인산화
SMAD1, SMAD2, SMAD3, SMAD5 및 SMAD9(SMAD8이라고도 함)의 5가지 수용체 조절 SMAD가 있습니다.이러한 R-SMAD를 포함하는 세포 내 경로는 기본적으로 두 가지가 있다. TGFβs, Activins, Nodals 및 일부 GDF는 SMAD2 및 SMAD3에 의해 매개되며, BMP, AMH 및 일부 GDF는 SMAD1, SMAD5 및 SMAD에 의해 매개된다.I형 수용체에 대한 R-SMAD의 결합은 단백질을 포함한 아연 이중 손가락 FYVE 도메인에 의해 매개된다.TGFβ 경로를 매개하는 두 가지 단백질은 SARA(수용체 활성화를 위한 SMAD 앵커)와 HGS(헤파토세포 성장인자 조절 티로신 키나제 기질)를 포함한다.
SARA는 클라트린 매개성 엔도사이토시스에 의해 수용체 [8]복합체를 내장하는 초기 엔도솜에 존재한다.SARA는 R-SMAD를 모집합니다.SARA는 R-SMAD가 Type [9]I 수용체의 L45 영역에 결합하는 것을 허용합니다.SARA는 R-SMAD의 C 말단에 있는 세린 잔기가 Type I 수용체의 촉매 영역을 향하도록 방향을 잡습니다.I형 수용체는 R-SMAD의 세린 잔기를 인산화한다.인산화 작용은 R-SMAD의 MH2 도메인의 입체구조 변화와 수용체 복합체 및 [10]SARA로부터의 후속 해리를 유도한다.
CoSMAD 바인딩
현재 인산화 된 RSMAD는 coSMAD(예: SMAD4)에 높은 친화력을 가지며, coSMAD와 복합체를 형성한다.인산기는 coSMAD의 도킹 부위로 작용하지 않고, 오히려 인산화가 아미노산 확장을 열어 상호작용을 가능하게 한다.
문자 변환
인산화 RSMAD/coSMAD 복합체는 핵으로 들어가 전사 촉진제/보조 인자와 결합하고 DNA 전사를 일으킨다.
골형성 단백질은 골형성, 신경생성, 복측 중배엽 사양과 관련된 mRNA의 전사를 일으킨다.
TGFβs는 아포토시스, 세포외 매트릭스 신생 및 면역 억제에 관여하는 mRNA의 전사를 일으킨다.그들은 또한 세포주기의 G1 정지에도 관여한다.
액티빈은 생식선 성장, 배아 분화, 태반 형성에 관여하는 mRNA의 전사를 일으킨다.
노달은 좌우 축 사양, 중배엽 및 내배엽 유도와 관련된 mRNA의 전사를 일으킨다.
경로 조절
TGF 베타 시그널링 경로는 광범위한 세포 과정에 관여하며, 그 후 매우 심하게 조절된다.경로가 양 또는 음으로 조절되는 메커니즘은 리간드 및 R-SMAD용 작용제, 유인체 수용체, R-SMAD 및 수용체의 유비퀴티화를 포함하여 다양하다.
리간드 작용제/안타고니스트
코딘과 노긴은 모두 BMP의 길항제이다.그들은 [11]리셉터에 대한 리간드의 결합을 막는 BMP를 결합한다.Chordin과 Noggin이 중배엽을 등지고 있다는 것이 증명되었다.둘 다 Xenopus의 등쪽 입술에서 발견되며 그렇지 않으면 표피 특정 조직을 신경 조직으로 변환합니다(신경 조직 참조).노긴은 연골과 뼈의 패턴화에 중요한 역할을 한다.생쥐 노긴--은 과도한 연골을 가지고 있고 관절 [11]형성이 부족했다.
단백질의 DAN 계열의 구성원은 또한 TGF 베타 계열의 구성원들을 길항시킨다.여기에는 Cerberus, DAN 및 Gremlin이 포함됩니다.이 단백질들은 디술피드 다리를 형성할 수 있는 9개의 보존된 시스테인을 포함합니다.DAN은 GDF5, GDF6, GDF7에 대항하는 것으로 생각된다.
모피스타틴은 결합하는 액티빈을 억제한다.그것은 모낭자극호르몬(FSH) 분비에 직접적인 영향을 미친다.폴리스타틴은 또한 유전자의 돌연변이가 항생식 특성을 [11]가진 활성에 작용하는 것을 방해할 수 있는 전립선암에 관여한다.
Lefty는 TGFβ의 조절제이며 배아 발생 시 축 패턴화에 관여한다.그것은 또한 단백질의 TGF 슈퍼패밀리의 구성원이다.그것은 쥐 배아의 왼쪽에서 비대칭적으로 발현되며, 이후 좌우 종분류에 역할을 한다.레프티는 R-SMAD의 인산화 방지에 의해 작용하며, 구성 활성 TGFβ형 I 수용체와 그 활성화의 [12]하류 과정을 통해 작용한다.
ALK4, ALK5, ALK7을 선택적으로 억제하는 SB431542와 [13]같은 약물 기반 길항제도 확인되었다.
수용체 조절
형질전환성장인자수용체 3(TGFBR3)은 [14]TGF-β 수용체 중 가장 풍부하며, 알려진 신호 [15]도메인은 없다.그러나 TGFβ를 결합하고 TGFBR2에 제시함으로써 TGFβ형 II 수용체에 대한 TGFβ 리간드의 결합을 증진시키는 역할을 할 수 있다.TGF β 시그널링의 하류 표적 중 하나인 GIPC는 PDZ 도메인에 결합하며, 이는 프로테오솜 분해를 방지하고, 이후 TGFβ 활성을 증가시킨다.또한 ActivinRII에 [11]대한 인히빈 코어 수용체 역할을 할 수 있다.
BMP와 액티빈막결합억제제(BAMBI)는 I형 수용체와 유사한 세포외 도메인을 가지고 있다.세포내 세린/트레오닌 단백질인산화효소 도메인이 없으므로 의사수용체이다.I형 수용체에 결합되어 활성화되는 것을 막습니다.이것은 TGFβ 시그널링의 음성 조절기 역할을 하며 배아 발생 동안 TGFβ 발현을 제한할 수 있다.표현에는 BMP 시그널링이 필요합니다.
FKBP12는 II형 수용체에 의한 수용체의 인산화 방지를 위해 I형 수용체의 GS영역을 결합시킨다.FKBP12와 그 상동체는 리간드 결합이 해리를 일으키기 때문에 리간드가 없을 때 타입 I 수용체 활성화를 방지하는 데 도움이 되는 것으로 생각된다.
R-SMAD 규제
억제 SMAD의 역할
SMAD 패밀리를 완성하는 다른 두 가지 SMAD, 억제 SMAD(I-SMADS), SMAD6 및 SMAD7이 있다.이들은 TGF 베타 시그널링 조절에 중요한 역할을 하며 부정적인 피드백에 관여한다.다른 SMAD와 마찬가지로 MH1 도메인과 MH2 도메인이 있습니다.SMAD7은 I형 수용체를 가진 다른 R-SMAD와 경쟁하여 인산화 작용을 [11][16]막는다.그것은 핵에 존재하며 TGFβ 수용체 활성화가 세포질로 전이되어 I형 수용체와 결합한다.SMAD6는 SMAD4를 결합시켜 다른 R-SMAD와 coSMAD의 결합을 방지한다.I-SMAD의 수치는 TGFβ 시그널링과 함께 증가하여 TGFβ 시그널링의 다운스트림 타겟임을 시사한다.
R-SMAD 유비쿼티네이션
E3 유비퀴틴 단백질 결합효소 SMUF1 및 SMUF2는 SMAD의 레벨을 제어합니다.그들은 E2 결합 효소로부터 유비퀴틴을 받아 들여 유비퀴틴을 RSMADs로 전달하고, RSMAD는 유비퀴틴화 및 후속 프로테오솜 분해를 일으킨다.스머프1은 SMAD1 및 SMAD5에 바인드하고, 스머프2는 SMAD1, SMAD2, SMAD3, SMAD6 및 SMAD7에 바인드 합니다[clarification needed].SMAD2의 문자 변환 액티비티를 줄이면서 SMAD7의 억제 액션을 강화합니다.
요약표
회색으로 강조된 H.sapiens의 TGF-β 배위자, 분홍색으로 강조된 D.melanogaster 배위자, 노란색으로 강조된 C.elegans.
| TGF-β슈퍼패밀리배위자 | 리간드 억제제 | 타입 II 리셉터 | I형 수용체 | R-SMAD | 코즈마드 | I-SMAD |
|---|---|---|---|---|---|---|
| 액티비티 A | 폴리스타틴 | ACVR2A | ACVR1B(ALK4) | SMAD2, SMAD3 | SMAD4 | SMAD7 |
| GDF1 | ACVR2A | ACVR1B(ALK4) | SMAD2, SMAD3 | SMAD4 | SMAD7 | |
| GDF11 | ACVR2B | ACVR1B(ALK4), TGFβRI(ALK5) | SMAD2, SMAD3 | SMAD4 | SMAD7 | |
| BMP2-8 | 노긴, 코딘, 댄 | BMPR2 | BMPR1A(ALK3), BMPR1B(ALK6) | SMAD1 SMAD5, SMAD8 | SMAD4 | SMAD6, SMAD7 |
| 노달 | 레프티 | ACVR2B | ACVR1B(ALK4), ACVR1C(ALK7) | SMAD2, SMAD3 | SMAD4 | SMAD7 |
| TGFβs | LTBP1, THBS1, 데코린 | TGFβRII | ACVRL1(ALK1), TGFβRI(ALK5) | SMAD2, SMAD3 | SMAD4 | SMAD7 |
| Dpp | 팬트 | Tkv | 미친 | 메데아 | ||
| 나사 | 팬트 | 색소폰 | 미친 | 메데아 | ||
| 미오글리아닌 | 위트 | 개코원숭이 | dSmad2 | 메데아 | ||
| 액티빈 | 위트 펀트 | 개코원숭이 | dSmad2 | 메데아 | ||
| GBB | 위트 펀트 | Tkv, 색스 | 미친 | 메데아 | ||
| Daf-7 | Daf-4 | Daf-1 | Daf-8, Daf-14 | Daf-3 | ||
| Dbl-1 | Daf-4 | 스마-6 | Sma-2, Sma-3, Sma-4 | 스마-4 |
외부 링크
- 교토 유전자 게놈 백과사전 - TGF 베타 시그널링 경로도
- Netpath - 인간의 신호 전달 경로의 큐레이션된 자원
레퍼런스
- ^ Huminiecki L, Goldovsky L, Freilich S, Moustakas A, Ouzounis C, Heldin CH (February 2009). "Emergence, development and diversification of the TGF-beta signalling pathway within the animal kingdom". BMC Evolutionary Biology. 9 (1): 28. doi:10.1186/1471-2148-9-28. PMC 2657120. PMID 19192293.
- ^ Zi, Zhike (2019-07-12). "Molecular Engineering of the TGF-β Signaling Pathway". Journal of Molecular Biology. 431 (15): 2644–2654. doi:10.1016/j.jmb.2019.05.022. ISSN 1089-8638. PMID 31121181. S2CID 163166017.
- ^ "Prosite Documentation PDOC00223". Archived from the original on 2011-05-25. Retrieved 2006-07-01.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular Biology of the Cell. New York, NY: Garland Science. ISBN 978-0-8153-3218-3.
- ^ a b Munir S, Xu G, Wu Y, Yang B, Lala PK, Peng C (July 2004). "Nodal and ALK7 inhibit proliferation and induce apoptosis in human trophoblast cells". The Journal of Biological Chemistry. 279 (30): 31277–86. doi:10.1074/jbc.M400641200. PMID 15150278.
- ^ Wrana JL, Attisano L, Cárcamo J, Zentella A, Doody J, Laiho M, et al. (December 1992). "TGF beta signals through a heteromeric protein kinase receptor complex". Cell. 71 (6): 1003–14. doi:10.1016/0092-8674(92)90395-S. PMID 1333888. S2CID 54397586.
- ^ "Pfam entry TGF_beta_GS". Retrieved 2006-07-01.
- ^ Runyan CE, Schnaper HW, Poncelet AC (March 2005). "The role of internalization in transforming growth factor beta1-induced Smad2 association with Smad anchor for receptor activation (SARA) and Smad2-dependent signaling in human mesangial cells". The Journal of Biological Chemistry. 280 (9): 8300–8. doi:10.1074/jbc.M407939200. PMID 15613484.
- ^ Moustakas A (September 2002). "Smad signalling network". Journal of Cell Science. 115 (Pt 17): 3355–6. doi:10.1242/jcs.115.17.3355. PMID 12154066.
- ^ Souchelnytskyi S, Rönnstrand L, Heldin CH, ten Dijke P (2001). "Phosphorylation of Smad signaling proteins by receptor serine/threonine kinases". Protein Kinase Protocols. Methods in Molecular Biology. Vol. 124. pp. 107–20. doi:10.1385/1-59259-059-4:107. ISBN 1-59259-059-4. PMID 11100470.
- ^ a b c d e Massagué J, Chen YG (March 2000). "Controlling TGF-beta signaling". Genes & Development. 14 (6): 627–44. doi:10.1101/gad.14.6.627. PMID 10733523. S2CID 84047115.
- ^ Ulloa L, Tabibzadeh S (June 2001). "Lefty inhibits receptor-regulated Smad phosphorylation induced by the activated transforming growth factor-beta receptor". The Journal of Biological Chemistry. 276 (24): 21397–404. doi:10.1074/jbc.M010783200. PMID 11278746.
- ^ Laping NJ, Grygielko E, Mathur A, Butter S, Bomberger J, Tweed C, et al. (July 2002). "Inhibition of transforming growth factor (TGF)-beta1-induced extracellular matrix with a novel inhibitor of the TGF-beta type I receptor kinase activity: SB-431542". Molecular Pharmacology. 62 (1): 58–64. doi:10.1124/mol.62.1.58. PMID 12065755.
- ^ Blobe GC, Liu X, Fang SJ, How T, Lodish HF (October 2001). "A novel mechanism for regulating transforming growth factor beta (TGF-beta) signaling. Functional modulation of type III TGF-beta receptor expression through interaction with the PDZ domain protein, GIPC". The Journal of Biological Chemistry. 276 (43): 39608–17. doi:10.1074/jbc.M106831200. PMID 11546783.
- ^ 인간에서의 온라인 멘델리안 유전(OMIM): 형질전환성장인자-베타 수용체, TYPE III; TGFBR3 - 600742
- ^ Itoh F, Asao H, Sugamura K, Heldin CH, ten Dijke P, Itoh S (August 2001). "Promoting bone morphogenetic protein signaling through negative regulation of inhibitory Smads". The EMBO Journal. 20 (15): 4132–42. doi:10.1093/emboj/20.15.4132. PMC 149146. PMID 11483516.