트립토판 2,3-다이옥시게나제
Tryptophan 2,3-dioxygenase| TDO2 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | TDO2, TDO, TO, TPH2, TRPO, 트립토판 2,3-다이옥시제네제, HYPTPRP | ||||||||||||||||||||||||
| 외부 ID | OMIM: 191070 MGI: 1928486 호몰로Gene: 4132 GeneCard: TDO2 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 4: 155.85 – 155.92Mb | Cr 3: 81.96 – 81.98Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
효소에서는 트립토판 2,3-다이옥시제네아제(EC 1.13.11.11)는 키뉴레나인 경로의 첫 번째이자 요율제한 단계로서 L-트립토판(L-Trp)을 N-포밀-L-키뉴레나인에 산화시키는 헤메 효소다.null
- L-트립토판2 + O ⇌ N-포밀-L-키누레나인
트립토판 2,3-다이옥시겐효소는 트립토판 신진대사의 전반적인 생물학적 과정의 일부로서 인체 내 트립토판 유동성의 생리학적 조절에 중심적인 역할을 한다.TDO는 트립토판 분해의 첫 번째 및 속도 제한 단계를 키누레나인 경로를 따라 강직화하여 시스템 트립토판 레벨을 조절한다.[5]인간에서 트립토판 2,3-다이옥시겐아제는 TDO2 유전자에 의해 암호화된다.[6]null
함수
| 트립토판 2,3-다이옥시게나제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
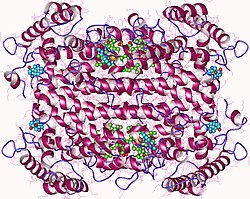
 크산토모나스 캄페스트리스에서 추출한 트립토판 2,3-다이옥시게나아제의 결정구조 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 1.13.11.11 | ||||||||
| CAS 번호. | 9014-51-1 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| 진 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
이 효소는 산화효소 계열에 속하며, 특히 O를2 산화제로 하여 단일 기증자에게 작용하고 두 개의 산소 원자를 기질에 결합(산소 생성물)한다.이 제품군에는 트립토판 2,3-다이옥시제나아제(TDO, tryptophan oxygenase,[7][8] L-tryptophan pyrrolase라고도 한다)와 밀접하게 연관된 인도레아민 2,3-다이옥시제나아제 효소(IDO)가 포함된다.TDO와 IDO는 모두 단량체 당 1개의 비동결 heme를 포함하고 있으며, TDO는 대게 4중격인 반면, IDO는 단량체다.null
트립토판 2,3-다이옥시제나아제는 1930년대에[9] 처음 발견되었으며 진핵생물과 원핵생물에 모두 발견된다.포유류에서 트립토판 2,3-다이옥시겐아제의 발현은 보통 간으로 제한되지만, 일부 종의 뇌와 전염병에서 확인되었으며, 일부 조직에서는 자극에 반응하여 트립토판 생성을 유도할 수 있다.[8]쥐의 TDO는 (대장균에서) 재조합적으로 가장 먼저 발현되었다.[10]인간 TDO도 표현되었다.[11][12]null
같은 효소 제품군도 아직 디옥시제네아제 활성이 입증되지 않았지만,[14] 슈와넬라 원니덴시스(Shewanella oneidensis[13])의 인도레 2,3-다이옥시제네아제(dioxygenase)와 PrnB(PrnB)를 포함한다.2007년에는 L-트립토판 이산화효소(L-tryptophan dioxygenation, IDO2)를 촉매하는 기능을 가진 새로운 효소가 확인되었다.[15]null
구조
트립토판 2,3-다이옥시제나아제는 유전자 TDO2에 의해 인코딩된 헤메 함유 세포독성 효소다.[5]크산토모나스 캠페스트리스 TD)[13]와 랄스토니아 메탈리듀란스 [16]TDO)의 결정학적 연구는 그들의 구조가 본질적으로 동일하며 친밀하게 연관된 호모테트라메르 효소라는 것을 밝혀냈다.[17]각 모노머의 N 단자 잔류물이 인접한 모노머의 기질 결합 부위의 일부를 형성하기 때문에 그것들은 조광기의 조광기로 가장 잘 설명된다.단백질은 완전히 나선형이며, L-트립토판 결합에 관여하는 유연한 루프가 활성 부위 주머니 바로 밖에서 관찰된다.이 루프는 L-트립토판(L-tryptophan)이 있는 곳에서 자란 결정에서만 관찰되기 때문에 기질 결합 유도된 것으로 보인다.[17]null
기질(트립토판) 바인딩으로 사용할 수 있는 두 개의 TDO 구조가 있다.[17],[18]null
메커니즘
트립토판 산화의 메커니즘에 대한 초기 제안은 소노와 도슨에 의해 제시되었다.[19]이것은 철(FeII) heme만을 포함하는 염기성 추상화 메커니즘을 제안했다.그것에 대한 구체적인 증거는 없지만 TDO와 IDO는 동일한 메커니즘에 의해 반응한다고 가정한다.IDO에서는 이직 시 여객선 헤미(FeIV)[20][21]가 확인되었다.따라서 기계론적 제안은 메커니즘 동안 페리호 heme의 형성을 포함하도록 조정되었다.[22]TDO는 동일한 방식으로 반응하는 것으로 가정되지만, TDO에서는 페리호 heme이 관찰되지 않았다.또한 인도레아민 2,3-다이옥시제네제 메커니즘에 대한 논의를 참조하십시오.null
임상적 유의성
트립토판 2,3-다이옥시제나아제는 인간 종양의 상당부분에서 발현되는 것으로 나타났다.[5]같은 연구에서는 종양에 의한 트립토판 2,3-다이옥시겐아제 발현이 면역된 생쥐에 의한 거부반응을 막았다.그룹에 의해 개발된 트립토판 2,3-디옥시제네제 억제제는 이들 생쥐가 트립토판 2,3-디옥시제네제네제네제 억제제가 암 치료에서 잠재력을 보인다는 것을 보여주면서 트립토판 2,3-디옥시제네제네제네제네제 억제제를 제거하는 능력을 회복시켰다.null
또 다른 연구는 트립토판 2,3-다이옥시겐아제가 불안과 관련된 행동을 담당하는 신진대사 경로에 잠재적으로 관여한다는 것을 보여주었다.[23]트립토판 2,3-다이옥시제나아제 결핍 생쥐를 생성하고 야생형 생쥐와 비교한 결과 트립토판 2,3-다이옥시제나제 결핍 생쥐는 트립토판뿐만 아니라 해마와 중간뇌에서 세로토닌과 5-HIAA의 혈장 수치가 증가했음을 발견했다.상승 플러스 미로, 오픈 필드 테스트와 같은 다양한 테스트에서는 이러한 녹아웃된 생쥐에서 항불안제 변조가 나타났으며, 이 결과는 트립토판 2,3-다이옥시겐아제와 트립토판 대사 및 생리학적 조건에서의 불안 관련 행동 사이의 직접적인 연관성을 입증했다.null
참고 항목
참조
- ^ a b c ENSG00000151790 GRCh38: 앙상블 릴리스 89: ENSG000002635, ENSG00000151790 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000028011 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c Pilotte L, Larrieu P, Stroobant V, Colau D, Dolusic E, Frédérick R, De Plaen E, Uyttenhove C, Wouters J, Masereel B, Van den Eynde BJ (February 2012). "Reversal of tumoral immune resistance by inhibition of tryptophan 2,3-dioxygenase". Proceedings of the National Academy of Sciences of the United States of America. 109 (7): 2497–2502. Bibcode:2012PNAS..109.2497P. doi:10.1073/pnas.1113873109. PMC 3289319. PMID 22308364.
- ^ "Entrez Gene: TDO2 tryptophan 2,3-dioxygenase".
- ^ Efimov I, Basran J, Thackray SJ, Handa S, Mowat CG, Raven EL (April 2011). "Structure and reaction mechanism in the heme dioxygenases". Biochemistry. 50 (14): 2717–2724. doi:10.1021/bi101732n. PMC 3092302. PMID 21361337.
- ^ a b Thackray SJ, Bruckmann C, Mowat CG, Forouhar F, Chapman SK, Tong L (2008). "Indoleamine 2,3-dioxygenase and tryptophan 2,3-dioxygenase". Handbook of Metalloproteins. doi:10.1002/0470028637.met223.
- ^ Kotake Y.; Masayama I. Z. (1936). "Über den Mechanismus der Kynureninbildung aus Tryptophan". Z. Physiol. Chem. 243: 237–244. doi:10.1515/bchm2.1936.243.6.237.
- ^ Ren S, Liu H, Licad E, Correia MA (September 1996). "Expression of rat liver tryptophan 2,3-dioxygenase in Escherichia coli: structural and functional characterization of the purified enzyme". Archives of Biochemistry and Biophysics. 333 (1): 96–102. doi:10.1006/abbi.1996.0368. PMID 8806758.
- ^ Batabyal D, Yeh SR (December 2007). "Human tryptophan dioxygenase: a comparison to indoleamine 2,3-dioxygenase". Journal of the American Chemical Society. 129 (50): 15690–15701. doi:10.1021/ja076186k. PMID 18027945.
- ^ Basran J, Rafice SA, Chauhan N, Efimov I, Cheesman MR, Ghamsari L, Raven EL (April 2008). "A kinetic, spectroscopic, and redox study of human tryptophan 2,3-dioxygenase". Biochemistry. 47 (16): 4752–4760. doi:10.1021/bi702393b. PMID 18370401.
- ^ a b Forouhar F, Anderson JL, Mowat CG, Vorobiev SM, Hussain A, Abashidze M, Bruckmann C, Thackray SJ, Seetharaman J, Tucker T, Xiao R, Ma LC, Zhao L, Acton TB, Montelione GT, Chapman SK, Tong L (January 2007). "Molecular insights into substrate recognition and catalysis by tryptophan 2,3-dioxygenase". Proceedings of the National Academy of Sciences of the United States of America. 104 (2): 473–478. Bibcode:2007PNAS..104..473F. doi:10.1073/pnas.0610007104. PMC 1766409. PMID 17197414.
- ^ De Laurentis W, Khim L, Anderson JL, Adam A, Johnson KA, Phillips RS, Chapman SK, van Pee KH, Naismith JH (October 2007). "The second enzyme in pyrrolnitrin biosynthetic pathway is related to the heme-dependent dioxygenase superfamily". Biochemistry. 46 (43): 12393–12404. doi:10.1021/bi7012189. PMC 3326534. PMID 17924666.
- ^ Ball HJ, Sanchez-Perez A, Weiser S, Austin CJ, Astelbauer F, Miu J, McQuillan JA, Stocker R, Jermiin LS, Hunt NH (July 2007). "Characterization of an indoleamine 2,3-dioxygenase-like protein found in humans and mice". Gene. 396 (1): 203–213. doi:10.1016/j.gene.2007.04.010. PMID 17499941.
- ^ Zhang Y, Kang SA, Mukherjee T, Bale S, Crane BR, Begley TP, Ealick SE (January 2007). "Crystal structure and mechanism of tryptophan 2,3-dioxygenase, a heme enzyme involved in tryptophan catabolism and in quinolinate biosynthesis". Biochemistry. 46 (1): 145–155. doi:10.1021/bi0620095. PMID 17198384.
- ^ a b c Thackray SJ, Mowat CG, Chapman SK (December 2008). "Exploring the mechanism of tryptophan 2,3-dioxygenase". Biochemical Society Transactions. 36 (Pt 6): 1120–1123. doi:10.1042/bst0361120. PMC 2652831. PMID 19021508.
- ^ Lewis-Ballester A, Forouhar F, Kim SM, Lew S, Wang Y, Karkashon S, Seetharaman J, Batabyal D, Chiang BY, Hussain M, Correia MA, Yeh SR, Tong L (October 2016). "Molecular basis for catalysis and substrate-mediated cellular stabilization of human tryptophan 2,3-dioxygenase". Scientific Reports. 6: 35169. Bibcode:2016NatSR...635169L. doi:10.1038/srep35169. PMC 5071832. PMID 27762317.
- ^ Sono M, Roach MP, Coulter ED, Dawson JH (November 1996). "Heme-Containing Oxygenases". Chemical Reviews. 96 (7): 2841–2888. doi:10.1021/cr9500500. PMID 11848843.
- ^ Lewis-Ballester A, Batabyal D, Egawa T, Lu C, Lin Y, Marti MA, Capece L, Estrin DA, Yeh SR (October 2009). "Evidence for a ferryl intermediate in a heme-based dioxygenase". Proceedings of the National Academy of Sciences of the United States of America. 106 (41): 17371–17376. Bibcode:2009PNAS..10617371L. doi:10.1073/pnas.0906655106. PMC 2765089. PMID 19805032.
- ^ Yanagisawa S, Yotsuya K, Hashiwaki Y, Horitani M, Sugimoto H, Shiro Y, Appelman EH, Ogura T (2010). "Identification of the Fe-O2 and the Fe=O heme species for indoleamine 2,3-dioxygenase during catalytic turnover". Chem Lett. 39: 36–37. doi:10.1246/cl.2010.36.
- ^ Basran J, Efimov I, Chauhan N, Thackray SJ, Krupa JL, Eaton G, Griffith GA, Mowat CG, Handa S, Raven EL (October 2011). "The mechanism of formation of N-formylkynurenine by heme dioxygenases". Journal of the American Chemical Society. 133 (40): 16251–16257. doi:10.1021/ja207066z. PMC 3210546. PMID 21892828.
- ^ Kanai M, Funakoshi H, Takahashi H, Hayakawa T, Mizuno S, Matsumoto K, Nakamura T (March 2009). "Tryptophan 2,3-dioxygenase is a key modulator of physiological neurogenesis and anxiety-related behavior in mice". Molecular Brain. 2 (8): 8. doi:10.1186/1756-6606-2-8. PMC 2673217. PMID 19323847.
추가 읽기
- Comings DE, Muhleman D, Dietz GW, Donlon T (February 1991). "Human tryptophan oxygenase localized to 4q31: possible implications for alcoholism and other behavioral disorders". Genomics. 9 (2): 301–308. doi:10.1016/0888-7543(91)90257-F. PMID 2004780.
- Comings DE, Muhleman D, Dietz G, Sherman M, Forest GL (September 1995). "Sequence of human tryptophan 2,3-dioxygenase (TDO2): presence of a glucocorticoid response-like element composed of a GTT repeat and an intronic CCCCT repeat". Genomics. 29 (2): 390–396. doi:10.1006/geno.1995.9990. PMID 8666386.
- Dick R, Murray BP, Reid MJ, Correia MA (August 2001). "Structure--function relationships of rat hepatic tryptophan 2,3-dioxygenase: identification of the putative heme-ligating histidine residues". Archives of Biochemistry and Biophysics. 392 (1): 71–78. doi:10.1006/abbi.2001.2420. PMID 11469796.
- Kudo Y, Boyd CA, Sargent IL, Redman CW (March 2003). "Decreased tryptophan catabolism by placental indoleamine 2,3-dioxygenase in preeclampsia". American Journal of Obstetrics and Gynecology. 188 (3): 719–726. doi:10.1067/mob.2003.156. PMID 12634647.
- Nabi R, Serajee FJ, Chugani DC, Zhong H, Huq AH (February 2004). "Association of tryptophan 2,3 dioxygenase gene polymorphism with autism". American Journal of Medical Genetics. Part B, Neuropsychiatric Genetics. 125B (1): 63–68. doi:10.1002/ajmg.b.20147. PMID 14755447. S2CID 26302464.
- Guillemin GJ, Smythe G, Takikawa O, Brew BJ (January 2005). "Expression of indoleamine 2,3-dioxygenase and production of quinolinic acid by human microglia, astrocytes, and neurons". Glia. 49 (1): 15–23. doi:10.1002/glia.20090. PMID 15390107. S2CID 31823904.
- Baharvand H, Hashemi SM, Kazemi Ashtiani S, Farrokhi A (2006). "Differentiation of human embryonic stem cells into hepatocytes in 2D and 3D culture systems in vitro". The International Journal of Developmental Biology. 50 (7): 645–652. doi:10.1387/ijdb.052072hb. PMID 16892178.
- Batabyal D, Yeh SR (December 2007). "Human tryptophan dioxygenase: a comparison to indoleamine 2,3-dioxygenase". Journal of the American Chemical Society. 129 (50): 15690–15701. doi:10.1021/ja076186k. PMID 18027945.
- Gupta R, Fu R, Liu A, Hendrich MP (2007). "EPR and Mossbauer spectroscopy show inequivalent hemes in tryptophan dioxygenase". Journal of the American Chemical Society. 132 (3): 1098–1109. doi:10.1021/ja908851e. PMC 4251817. PMID 20047315.
- Allegri G, Ragazzi E, Bertazzo A, Costa CV, Rocchi R (2003). "Tryptophan metabolism along the kynurenine pathway in rats". Advances in Experimental Medicine and Biology. 527: 481–496. doi:10.1007/978-1-4615-0135-0_56. ISBN 978-1-4613-4939-6. PMID 15206766.
- Chung LW, Li X, Sugimoto H, Shiro Y, Morokuma K (September 2008). "Density functional theory study on a missing piece in understanding of heme chemistry: the reaction mechanism for indoleamine 2,3-dioxygenase and tryptophan 2,3-dioxygenase". Journal of the American Chemical Society. 130 (37): 12299–12309. doi:10.1021/ja803107w. PMID 18712870.
- Allegri G, Ragazzi E, Bertazzo A, Biasiolo M, Costa CV (2003). "Tryptophan metabolism in rabbits". Advances in Experimental Medicine and Biology. 527: 473–479. doi:10.1007/978-1-4615-0135-0_55. ISBN 978-1-4613-4939-6. PMID 15206765.








