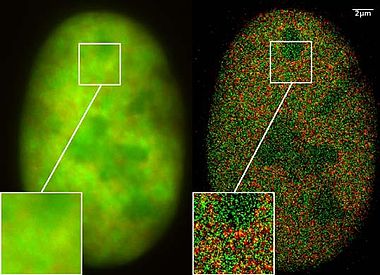
Vertico 공간 변조 조명
Vertico spatially modulated illuminationVertico 공간 변조 조명(Vertico-SMI)은 나노미터 범위에서 완전한 세포의 3D 분석을 위한 가장 빠른[citation needed] 광현미경이다. 1996년에 개발된 두 가지 기술인 SMI(spatial modulated 조명)와 SPDM(spectral 정밀 거리 현미경)을 기반으로 한다. 이 광학 나노스코프의 유효 광학 분해능은 2D에서는 5nm, 3D에서는 40nm 부근에 도달하여 아베베에 따른 자연광의 전송이나 반사(구조화된 조명이나 형광과는 반대로)를 이용한 표준 현미경 검사에 적용되는 λ/2 분해능 한계치(파란광의 경우 약 200nm)를 크게 초과하였다.해상도 한계[1] 그 한계(레이리 한계라고도 함)는 1873년 에른스트 아베에 의해 결정되었고 재래식 기법을 사용하여 현미경의 달성 가능한 해상도 한계를 지배한다.
베르티코-SMI 현미경은 하이델베르크 대학의 명예교수[2] 크리스토프 크레머가 이끄는 팀이 개발한 것으로 국산화 현미경(SPDM, 스펙트럼 정밀 거리 현미경)과 구조화 조명(SMI, 공간적으로 변조된 조명)의 광학 기법이 결합한 것이다.
2008년 3월부터 GFP나 알렉사 형광 염료와 같은 많은 표준 형광 염료들은 적절한 강도의 단 하나의 레이저 파장만으로 충분한 소위 SPDMphymod (physically modifyable fluorophores) 국산화 현미경으로 사용될 수 있다.
배열
SMI는 특수 유형의 레이저 광학 조명(spatial modulated 조명)을 의미하며, Vertico는 고정 셀의 분석이 가능한 현미경 축의 수직 배치를 반영하고 광학 분해능이 10나노미터(1나노미터 = 1나노미터 = 1×10m−9) 미만인 살아있는 셀도 반영한다.
4Pi 현미경 등 초점기법과 비교했을 때 이 기술의 특이점은 전체 세포를 나노 규모로 묘사할 수 있는 광폭 현장 노출이다. 일반적인 물체 크기가 20µm × 20µm인 셀 전체의 이러한 3D 노출은 2분밖에 걸리지 않는다. 넓은 필드 노출은 전체 물체가 동시에 조명되고 감지된다는 것을 의미한다.
공간 변조 조명
SMI 현미경 검사는 소위 점 스프레드 기능 공학의 가벼운 광학 과정이다. 광학적 분해능을 높이기 위해 현미경의 점확대함수(PSF)를 적절하게 수정하여 광학적 분해능을 높이거나, 조명등의 파장에 비해 작은 형광체의 거리 측정 정밀도를 최대화하거나, 나노미터 라의 다른 구조적 파라미터를 추출하는 공정이다.에이지
하이델베르크 대학의 Kirchhoff 물리학 연구소에서 개발되고 있는 SMI 현미경은 다음과 같은 방법으로 이를 달성한다. 물체 범위 내의 조도는 기존의 넓은 장 형광 현미경과 달리 균일하지 않지만 축을 따라 대립되는 두 개의 간섭 레이저 빔을 사용하여 공간적으로 정밀하게 조절된다. 공간적으로 변조된 파장의 원리는 1993년 베일리 외 연구진에 의해 개발되었다. 하이델베르크 어플리케이션에 사용되는 SMI 현미경 접근방식은 물체를 고정밀 단계로 파장 사이를 이동시키거나, 파장 자체를 위상 이동에 의해 물체에 상대적으로 이동시킨다. 이를 통해 축 크기와 거리 분해능이 개선된다.[3][4]
SMI는 다른 슈퍼 해상도 기술과 결합될 수 있다. 예를 들어 3D LIMON 또는 LSI-TIRF는 측면 구조 조명이 있는 총 내부 반사 간섭계로 사용할 수 있다. 이 SMI 기법은 이전에 비교할 수 없었던 광학적 분해능을 가진 인간의 눈 조직으로부터 단면 내 자기 광학 분포를 획득할 수 있도록 했다. 세 가지 서로 다른 호기 파장(488, 568, 647nm)을 사용하면 자동 유체 신호에 대한 스펙트럼 정보를 수집할 수 있다. 이것은 황반변성 AMD에 의해 영향을 받는 인간의 눈 조직에 사용되어 왔다.[5]
SPDM: 국산화 현미경
현미경의 해상도보다 작은 단일 광원이 훨씬 더 잘 위치할 수 있다. 빛이 흐릿한 지점을 만들지만 컴퓨터 알고리즘을 사용하면 현미경의 포인트 스프레드 기능, 검출기의 잡음 특성 등을 고려해 흐릿한 지점의 중심을 정확하게 계산할 수 있다. 그러나 서로 가까이 있는 출처가 너무 많으면 이 접근법은 작동하지 않는다. 출처가 모두 흐릿하다.
SPDM(Spectral 정밀 거리 현미경)은 형광 현미경 기법 계열로, 한 번에 몇 개의 선원을 측정함으로써 이 문제를 극복하여 각 선원이 다른 선원과 "실제적으로 격리"되도록 한다(즉, 현미경의 해상도보다 더 많이, 일반적으로 ~200~250nm까지).[6][7][8] 그런 다음 위의 기법을 사용할 수 있다(각 흐릿한 지점의 중심을 찾는다).
분자가 다양한 스펙트럼(흡수 스펙트럼 및/또는 방출 스펙트럼)을 가질 경우 적절한 광원과 필터를 사용하여 한 번에 몇 개의 분자에서 빛을 볼 수 있다. 분자는 형광의 수명과 다른 기술에 기초하여 더욱 미묘한 방법으로 구별될 수 있다.[6]
SPDM을 사용하여 달성할 수 있는 구조적 분해능은 서로 다른 스펙트럼 특성을 가진 펑크형 입자("위상학적 분해능")로 결정된 공간 위치에서 둘 사이의 가장 작은 측정 가능한 거리로 표현할 수 있다. 모델링에 따르면 국소화 정밀도, 입자 밀도 등과 관련된 적절한 조건에서 "위상학적 분해능"은 고전적 정의의 측면에서 훨씬 개선된 광학적 분해능과 동등한 "공간 주파수"에 해당한다.
SPDM은 유효점 이미지 기능의 주 최대값의 절반 너비로 대표되는 기존의 광학적 해상도(약 200~250nm)보다 몇 배나 우수한 유효 광학적 해상도를 달성하는 국소 현미경이다. 적절한 레이저 광학 정밀 공정을 적용함으로써 포인트 스프레드 기능의 절반 너비(컨벤션적으로 200~250nm)보다 훨씬 작은 위치 및 거리를 스펙트럼 서명이 다른 표적들 사이에서 나노미터 정확도로 측정할 수 있다.[6] 응용의 중요한 영역은 게놈 연구(게놈의 기능적 조직에 대한 연구)이다. 또 다른 중요한 사용 영역은 막의 구조에 대한 연구다.
형광 물체의 나노스 케일(3D)에서 현지화에 대한 국산화 정확도 1nm의 범위 안에 국산화 현미경 검사를 위해 기준 1/100보다 더 나은 – 보이는 빛을 이용하여 1996년[9]과 실험 이론적 증거의 한 국산화를 현미경의 일반적으로 가장 중요한 기본 중의 기본은 최초의 실험 작품이다. 의 파장[10][11]
SPDMphymod: GFP와 같은 깜박임 모드의 표준 형광 염료
지난 2년 동안만 분자가 동일한 스펙트럼 광 주파수(그러나 깜박이는 특성에 따라 다른 스펙트럼 시그니처를 갖는)를 발산하지만 스펙트럼 정밀 거리 현미경 검사에 필요한 빛을 이용하여 켜고 끌 수 있는 나노스코픽 연구에 사용되었다. 같은 셀의 수천 개의 영상을 조합해 레이저 광학 정밀도 측정을 통해 광학적 분해능이 현저히 향상된 국소화 영상을 기록할 수 있었다. 이러한 참신한 나노진찰 과정의 적용은 빛을 이용하여 특수 제작된 분자만이 적절한 방법으로 켜고 끌 수 있다고 가정했기 때문에 최근까지 매우 어려운 것으로 나타났다.
2008년 3월 크리스토프 크레머의 연구소는 특정 광물학적 조건이 존재한다면 GFP, 알렉사 염료, 플루오르세신 분자와 같은 많은 표준 형광 염료에서도 이것이 가능하다는 것을 발견했다. 소위 SPDMphymod (physically modifyable fluorophores) 기술을 이용하면 적절한 강도의 단일 레이저 파장만으로도 나노 이미징에 충분하다. 대조적으로 다른 국소 현미경은 특별한 광 전환/사진 활성 형광 분자를 사용할 때 두 개의 레이저 파장을 필요로 한다.[12]
GFP 유전자는 많은 생리적, 유제품적 세포에 도입되어 표현되어 왔고 2008년 노벨 화학상은 마틴 찰피, 시모무라 오사무, 로저 Y에게 수여되었다. 녹색 형광 단백질의 발견과 개발을 위한 Tsien. 이러한 표준 형광 분자가 사용될 수 있다는 발견은 SPMD 방법의 적용 가능성을 생물 물리학, 세포 생물학 및 의학 분야의 수많은 연구 분야로 확장시킨다.
표준 형광 염료는 이미 SPDMphymod 기술과 함께 성공적으로 사용되고 있다: GFP, RFP, YFP, 알렉사 488, 알렉사 568, 알렉사 647, Cy2, Cy3, Atto 488, 플루오레신.
리몬: 3D 슈퍼 해상도 현미경
라이몬(Light MicrScoscopic nanosizing 현미경)은 하이델베르크 대학교에서 2001년에 발명되었으며, 3D 슈퍼 해상도 현미경에 국산화 현미경과 공간적으로 변조된 조명을 결합하였다.
Vertico-SMI를 사용하는 3D 영상은 SMI와 SPDM의 결합을 통해 가능하며, SMI를 먼저 적용한 다음 SPDM 프로세스를 적용한다. SMI 공정은 입자의 중심과 입자가 현미경 축 방향으로 퍼지는 방향을 결정한다. 입자/분자 중심은 1-2nm의 정밀도로 결정할 수 있지만, 이 지점 주위의 확산은 약 30-40nm의 축 직경으로 확인할 수 있다.
이후 SPDM을 사용하여 개별 입자/분자의 측면 위치를 결정하여 몇 나노미터의 정밀도를 달성한다. 현재 SPDM은 2D(객체 평면)에서 10nm의 유효 분해능으로 16프레임/초를 달성하며, 약 2000개의 그러한 프레임을 SMI 데이터(ca. 10초 획득 시간)와 결합하여 최고 분해능의 3차원 영상(유효 광학 3D 분해능 ca. 40-50nm)을 달성한다. 더 빠른 카메라로 더 높은 요금(최대 수백 프레임/초, 개발 중)을 기대할 수 있다. 적절한 염료를 사용하면 훨씬 더 효과적인 광학 3D 해상도가 가능해야[13] 한다.
SPDMphymod와 SMI를 결합함으로써 (둘 다 1996년 크리스토프 크레머 연구소에서 발명됨) Her2/neu와 Her3 클러스터의 공간 배치를 3D 이중 색상으로 재구성했다. 단백질 군집의 모든 세 방향의 위치는 약 25 nm의 정확도로 결정할 수 있다.[14]
산업에서 초해상도 현미경 사용
생물의학 실험실에서 사용함에도 불구하고, 슈퍼 해상도 기술은 제약 연구에서 중요한 도구로 작용할 수 있다. 그것들은 특히 대상의 식별과 평가에 도움이 될 수 있다. 예를 들어, 생체 분자 기계(BMM)는 몇 개의 큰 분자로 구성된 매우 복잡한 나노 구조체로서, 신체 세포의 기본 기능을 담당한다. 기능 상태에 따라 3D 구조가 정의된다. 생체 분자 기계의 예로는 유전자 정보의 2미터 길이 캐리어인 DNA가 직경 몇 백만분의 1밀리미터의 공간에서 체세포 안에서 접힐 수 있는 핵이 있다. 따라서, DNA는 정보 및 통제 센터 역할을 할 수 있다.
리몬 3D를 리몬 복합체 라벨링과 결합해 사용함으로써, 콤플렉스를 파괴하지 않고 이른바 생체분자 기계의 3D 분자 복합체의 숨겨진 단백질이나 핵산을 처음으로 볼 수 있게 할 수 있다. 지금까지 대부분의 경우, 그 곳의 개별 고분자에 대한 상세한 분석을 위해 단지를 파괴해야 한다는 것이 문제였다. 또는 가상 컴퓨터 시뮬레이션 모델이나 값비싼 핵자기공명 방법을 사용하여 그러한 복합체의 3차원 구조를 시각화하였다.[15]
문학
- ^ Reymann, J; Baddeley, D; Gunkel, M; Lemmer, P; Stadter, W; Jegou, T; Rippe, K; Cremer, C; Birk, U (2008). "High-precision structural analysis of subnuclear complexes in fixed and live cells via spatially modulated illumination (SMI) microscopy". Chromosome Research. 16 (3): 367–82. doi:10.1007/s10577-008-1238-2. PMID 18461478.
- ^ "Fakultät für Physik und Astronomie".
- ^ Heintzmann R., Cremer C. (1999). "Lateral modulated excitation microscopy: Improvement of resolution by using a diffraction grating". Proc. SPIE. 3568: 185–196. Bibcode:1999SPIE.3568..185H. doi:10.1117/12.336833. S2CID 128763403.
- ^ 미국 특허 7,342,717: 크리스토프 크레머, Michael Hausmann, Joachim Bradl, Bernhard Schneider Wave 필드 현미경(검출 지점 확산 기능 포함), 우선 순위 날짜 1997년 7월 10일
- ^ Best G, Amberger R, Baddeley D, Ach T, Dithmar S, Heintzmann R, Cremer C (2011). "Structured illumination microscopy of autofluorescent aggregations in human tissue". Micron. 42 (4): 330–335. doi:10.1016/j.micron.2010.06.016. PMID 20926302.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b c Lemmer P, Gunkel M, Baddeley D, Kaufmann R, Urich A, Weiland Y, Reymann J, Müller P, Hausmann M, Cremer C (2008). "SPDM: Light Microscopy with Single Molecule Resolution at the Nanoscale" (PDF). Applied Physics B. 93 (1): 1–12. Bibcode:2008ApPhB..93....1L. doi:10.1007/s00340-008-3152-x. S2CID 13805053.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ A.M. van Oijen, J Köhler, J Schmidt, M Müller, G. J Brakenhoff (31 July 1998). "3-Dimensional super-resolution by spectrally selective imaging" (PDF). Chemical Physics Letters. 292 (1–2): 183–187. Bibcode:1998CPL...292..183V. doi:10.1016/S0009-2614(98)00673-3. hdl:11370/0aff5aa7-7a2f-4ffb-aff8-2f6a8b425b02.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Bornfleth, Sätzler, Eils, Cremer (1 February 1998). "High-precision distance measurements and volume-conserving segmentation of objects near and below the resolution limit in three-dimensional confocal fluorescence microscopy". Journal of Microscopy. 189 (2): 118–136. doi:10.1046/j.1365-2818.1998.00276.x. S2CID 73578516.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Bradl J., Rinke B., Esa A., Edelmann P., Krieger H., Schneider B., Hausmann M., Cremer C. (1996). Bigio, Irving J; Grundfest, Warren S; Schneckenburger, Herbert; Svanberg, Katarina; Viallet, Pierre M (eds.). "Comparative study of three-dimensional localization accuracy in conventional, confocal laser scanning and axialtomographic fluorescence light microscopy". Proc. SPIE. Optical Biopsies and Microscopic Techniques. 2926: 201–206. Bibcode:1996SPIE.2926..201B. doi:10.1117/12.260797. S2CID 55468495.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Heintzmann R., Münch H., Cremer C. (1997). "High-precision measurements in epifluorescent microscopy - simulation and experiment". Cell Vision. 4: 252–253.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ 미국 특허 6,424,421: Christop Cremer, Michael Hausmann, Joachim Bradl, Bernd Linke Method 및 물체 구조 사이의 거리 측정을 위한 장치, 우선 순위 날짜 1996년 12월 23일
- ^ Manuel Gunkel, Fabian Erdel, Karsten Life, Paul Lemer, Rainer Kaufmann, Christop Hörmann, Roman Amberger 및 Christop Cremer(2009): 세포 나노구조의 이중색 국소 현미경. In: 생명공학 저널, 2009, 4, 927-938. ISSN 1860-6768
- ^ Baddeley D, Batram C, Weiland Y, Cremer C, Birk UJ.: Spatially Modulated Illumination 현미경을 이용한 나노구조 분석. In: Nature Protocols 2007; 2: 2640–2646
- ^ Kaufmann Rainer, Müller Patrick, Hildenbrand Georg, Hausmann Michael, Cremer Christoph (2010). "Analysis of Her2/neu membrane protein clusters in different types of breast cancer cells using localization microscopy". Journal of Microscopy. 242 (1): 46–54. doi:10.1111/j.1365-2818.2010.03436.x. PMID 21118230. S2CID 2119158.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ 제약 산업을 위한 초해상도 현미경: 2012년 1월 9일 웨이백 기계에 보관된 3D 복합 라벨링에 대해 허가된 특허
외부 링크