셀 사이클 체크 포인트
Cell cycle checkpoint세포주기 체크포인트는 진핵세포 사이클의 적절한 진행을 보장하는 제어 메커니즘이다.각 체크포인트는 셀 사이클의 조건이 평가되는 셀 사이클을 따라 잠재적 종료점으로 기능하며, 셀 사이클의 다양한 단계를 통한 진행은 유리한 조건이 충족될 때만 발생한다.셀 [1]사이클에는 많은 체크포인트가 있지만, 3개의 주요 체크포인트([2]시작 또는 제한 체크포인트 또는 메이저 체크포인트라고도 함), G2/M 체크포인트 및 스핀들체크포인트라고도 함)와 메타페이즈에서 아나페이즈로의 이행(Metaphase-to-anaphase)이 있습니다.이러한 체크포인트를 통한 진행은 주로 사이클린이라 불리는 조절 단백질 서브유닛에 의한 사이클린 의존성 키나아제 활성화에 의해 결정되며, 이들 서브유닛은 세포주기의 각 단계에서 발생하는 특정 사건을 [3][4]제어하기 위해 생성된다.
배경
모든 생물은 세포 성장과 [5]분열을 반복한 결과물이다.셀 사이클로 알려진 이 과정 동안 셀은 내용을 복제한 후 두 부분으로 나뉩니다.세포주기의 목적은 각 유기체의 DNA를 정확하게 복제한 후 세포와 그 내용물을 두 개의 결과 세포 사이에 균등하게 나누는 것이다.eukaryotes안에서, 세포 주기 그 동안 예비 세포 대사 작용으로. 그리고 계속적으로 자란다 활동하고 있다. 네가지 주요 단계:G1, S기, 그러는 동안 DNA복제하는 장소;G2, 그러는 동안 세포 성장과 세포 분열에 대한 준비로 여러가지 단백질 synthesizes 계속해서;그리고 M(유사 분열)단계가 중복 ch로 구성되어 있다.r오모솜은 두 개의 딸 핵으로 분리되고, 세포는 각각 [6]DNA의 완전한 복사본을 가진 두 개의 딸 세포로 분할된다.진핵 세포 순환과 비교하여, 원핵 세포 순환은 비교적 간단하고 빠르다: 염색체는 복제의 원점에서 복제되고, 새로운 막이 조립되고, 세포 벽은 세포를 두 [7]개로 나누는 격막을 형성한다.
진핵 세포 주기가 복잡한 과정이기 때문에, 진핵 생물은 세포 [5]주기 제어 시스템으로 알려진 조절 단백질 네트워크를 진화시켜 왔고, 세포 주기를 통해 세포의 진행을 감시하고 지시합니다.이 시스템은 타이머 또는 클럭과 같이 동작합니다.이 타이머는 셀 사이클의 각 단계에서 셀이 소비하는 고정 시간을 설정하는 동시에 셀이 제어하는 프로세스로부터 수신한 정보에 응답합니다.세포주기 체크포인트는 DNA 복제나 염색체 분리 등 필수 프로세스에서 발생하는 결함을 감지하고 결함이 [8]복구될 때까지 이에 대응하여 세포주기 정지를 유도함으로써 제어시스템에서 중요한 역할을 한다.세포 주기 체크포인트의 주요 작용 메커니즘은 사이클린으로 알려진 다른 등급의 조절 단백질에 결합하는 CDK(cyclin-dependent kinase)로 알려진 단백질 키나아제군의 활성 조절을 통해 특정 사이클린-CDK 복합체가 형성되고 세포 사이클린의 다른 단계에서 활성화된다.le. 이들 복합체는 세포주기의 [9]진행을 촉진하거나 방지하기 위해 다른 하류 표적을 활성화한다.
G1(제한) 체크 포인트
포유류 세포에서는 제한점, 효모세포에서는 시작점으로도 알려진 G1 체크포인트는 세포가 세포 사이클로 들어가는 데 전념하는 지점이다.셀이 G1을 통과함에 따라 내부 및 외부 조건에 따라 G1을 지연시키거나 G0으로 알려진 대기 상태로 들어가거나 제한 [5]지점을 통과할 수 있습니다.DNA 손상은 세포가 "제한"하고 세포 순환에 들어가지 않는 주요 지표이다.세포 분열의 새로운 라운드에 대한 결정은 세포가 S상 진입을 촉진하는 사이클린-CDK 의존성 전사를 활성화 할 때 일어난다.이 체크포인트는 추가 [10]프로세스를 보장합니다.
초기 G1 동안, 포켓 단백질로 알려진 세 개의 전사 억제제가 E2F 전사 인자와 결합합니다.E2F 유전자 패밀리는 사이클린, CDK, 체크포인트 조절기, DNA 복구 단백질을 포함한 세포 주기의 조절에 중요한 많은 유전자를 대상으로 하는 전사 인자의 그룹입니다.E2F 패밀리의 잘못된 조절은 종종 암 사례에서 발견되며, E2F 패밀리가 DNA 복제와 분열을 [10]엄격하게 조절하는데 필수적이라는 증거를 제공한다.세 개의 포켓 단백질은 망막아종(Rb), p107, p130으로, G1 체크포인트를 통과하는 진행을 막기 위해 E2F 전사 인자에 결합한다.
E2F 유전자 패밀리는 활성제 메커니즘을 가진 단백질과 억제 메커니즘을 가진 단백질을 포함합니다.P107 및 P130은 E2F 4 및 E2F 5의 공동 억제제로서 기능하며, G1-to-S 촉진 인자의 전사를 억제합니다.세 번째 포켓 단백질 Rb는 활성화 [10]능력을 가진 E2F 단백질인 E2F 1, E2F 2, E2F 3에 결합 및 억제된다.
양성 피드백은 특히 사이클린/CDK 단백질 복합체에 의한 Rb의 인산화와 관련된 G1에서 S상으로의 진행을 조절하는 데 필수적인 역할을 한다.인산염이 없는 Rb 또는 비인산화 Rb는 G0 세포주기의 출구 및 분화를 조절한다.G1 단계 시작 시 사이클린 D 수준의 상승에 대한 성장 인자와 DNA 손상 신호가 Cdk4 및 Cdk6에 결합되어 CyclinD:Cdk4/6 [11]복합체를 형성합니다.이 복합체는 인산화 작용에 의해 Rb를 비활성화하는 것으로 알려져 있다.그러나 Rb 인산화 세부사항은 G1 체크포인트에 대한 이전의 지식과 비교하면 상당히 복잡하고 구체적이다.CyclinD:Cdk4/6은 14개의 접근 가능하고 고유한 인산화 부위 중 하나에 1개의 인산염 또는 단인산염 Rb만 배치합니다.14개의 특정 단인산화 이소형식은 각각 E2F 계열에 대한 차동결합 선호도를 가지며, 이는 포유류 [11]체내 세포 과정의 다양성을 더할 가능성이 있다.
E2F 4와 E2F 5는 핵 위치 파악을 유지하기 위해 p107과 p130에 의존한다.그러나 Cyclin D:Cdk 4/6 또한 E2F 1-3. 반면 Cyclin E와 쌓이는 DNA로, Cyclin E.[10]Rb 단백질의 전사를 개시하다 묶도록 초기 G1 단계 동안에 그들의mono-phosphorylated 상태를 유지시키는 허용하는 p107과 p130는 E2F 4,5(세포질에 그 탈출)에서 바인드 방출하는 과정 phosphorylates.biCdk2에 접속합니다.
CyclinE:Cdk2는 G1-S 전환에서 추가적인 중요한 인산화 역할을 한다.특히 CyclinE:Cdk2는 플러스 피드백 루프를 촉진하여 "모두 아니면 아무것도" 스위치를 만듭니다.많은 유전자 제어 네트워크에서, 양성 피드백은 세포가 세포 주기 단계 사이에서 앞뒤로 미끄러지지 않도록 보장한다. Cyclin E:Cdk2는 Rb의 완전한 불활성화를 보장하는 "고인산염"이라고도 불리는 모든 인산화 부위에서 Rb를 인산화한다.Rb의 과잉인산화(hyper posphalization)는 세포주기에서 세포가 뒤로 갈 수 없는 후기 G1 제한점으로 간주된다.이 때 E2F1~3 단백질은 DNA에 결합해 사이클린A와 Cdc6을 [11]전사한다.
p27로도 알려진 사이클린 의존성 키나제 억제제 1B(CDKN1B)는 CyclinE의 활성화를 결합하고 예방한다.억제에 의한 Cdk2.그러나 Cyclin A가 축적되어 Cdk2에 결합함에 따라 착체를 형성하여 p27을 억제한다.G1상 사이클린 의존성 인산화효소는 분해 대상으로 하는 S상 사이클린 의존성 인산화효소 p27과 함께 작용한다.차례로, 이것은 DNA 프로모터 부위에서 그들의 분리를 시작하는 E2F 1-3을 인산화시키는 복합체인 Cyclin A:Cdk2의 완전한 활성화를 가능하게 한다.이것에 의해, E2F 6-8이 DNA에 결합해,[10] 전사를 억제할 수 있습니다.억제제 p27을 성공적으로 억제하기 위해 사용된 네거티브 피드백 루프는 세포 주기의 역추적 없이 단방향 이동을 보장하기 위해 세포에 의해 사용되는 또 다른 필수 프로세스입니다.
DNA 손상이 발생하거나 세포가 G1에서 세포주기를 지연 또는 정지시킬 필요가 있는 결함을 발견하면 여러 메커니즘을 통해 정지된다.신속한 반응에는 손상 유형에 따라 센서 역할을 하는 키나아제 ATM(Ataxia Telangioctasia 변이) 또는 ATR(Ataxia Telangioctasia 및 Rad3 관련)에서 시작되는 인산화 이벤트가 포함된다.이러한 키나아제들은 각각 이펙터 키나제 Chk2와 Chk1을 인산화 및 활성화하고, 이는 다시 포스파타아제 Cdc25A를 인산화하여 유비쿼티네이션 및 분해에 대한 표시를 한다.Cdc25A는 CDK2에서 억제인산염을 제거함으로써 앞에서 기술한 사이클린E-CDK2 복합체를 활성화하므로 Cdc25A가 없을 경우 사이클린E-CDK2는 불활성 상태로 유지되며 세포는 G1에 남는다.
구속을 유지하기 위해 Chk2 또는 Chk1이 종양억제제인 p53을 인산화하여 분해목적으로 p53을 억제하는 유비퀴틴 연결효소인 Mdm2와 결합하는 것을 방지함으로써 p53을 안정화시키는 또 다른 반응을 개시한다.안정된 p53은 복합 사이클린 E-CDK2를 촉진하는 G1-to-S의 억제제인 p21을 포함한 여러 표적 유전자의 전사 활성제를 작용한다.또한 p21이 활성화되는 또 다른 메커니즘은 DNA 손상에 대한 반응으로 p16의 축적을 통해 이루어진다. p16은 사이클린 D-CDK4 복합체를 교란시켜 복합체로부터의 p21의 방출을 유발하고, 이는 Rb가 E2F1-3과 결합하여 세포 전달을 억제할 수 있도록 한다.ning to S 단계.[13]최근 이 모델의 일부 측면은 [14]논란이 되고 있다.
G2 체크 포인트
S상에서의 DNA 복제에 이어, 세포는 G2로 알려진 성장 단계를 거친다.이 기간 동안 필요한 유사분열단백질이 생성되고 세포는 다시 한번 증식성 유사분열(M) 단계로 진입하기 위한 적절한 상태를 보장하기 위한 조절 메커니즘을 받는다.G2에서 M으로의 이행에는 사이클린-Cdk 활성의 공통 결합 인자와 함께 여러 기계적 체크포인트가 관여한다.
유기체에 걸쳐 필요한 사이클린-Cdk 복합체의 변화가 존재하지만, 키나제 활성의 필요성은 보존되고 일반적으로 단일 쌍에 초점을 맞춘다.핵분열 효모에는 3가지 형태의 유사분열 사이클린이 존재하며, 발아 효모에는 6가지 형태가 존재하지만 사용되는 1차 사이클린은 사이클린 [15]B이다.Cyclin B는 G2/M 체크포인트 이행에 대한 논의에 참고가 됩니다.
S Phase와 마찬가지로 G2는 DNA 손상 검사점을 경험합니다.세포는 DNA 손상 부위나 불완전한 복제 부위가 있는지 다시 한 번 검사하고 손상 부위에 키나아제 ATR과 ATM을 모집한다.Chk1과 Chk2의 활성화는 p53 활성화와 함께 세포주기 정지 및 유사분열 진행을 억제하기 위해 일어난다.S상의 추가 성분인 Pre-Replicative Complex는 사이클린 B-Cdk1 인산화로 [16]불활성화되어야 한다.
앞서 평가한 바와 같이 G2 단백질 축적은 여러 메커니즘을 통해 사이클린B-Cdk1 활성을 활성화하는 역할을 한다.CyclinA-Cdk2는 CyclinB-Cdk1의 활성제인 Cdc25를 활성화하여 CyclinB-Cdk1 억제제인 Wee1을 비활성화한다.그 결과 양성 피드백 루프가 발생하여 사이클린B 발현과 Cdk1 활성화가 현저하게 증가합니다.세포가 G2를 진행하여 G2/M 전이 상태에 도달하면 키나제 Plk1은 Wee1을 인산화하며, Wee1은 SCF 유비퀴틴 리가아제 [17]착체를 통해 Wee1의 분해를 목표로 한다.Plk1의 추가적인 기능은 인산화를 통해 Cdc25를 활성화하는 것이다.Wee1 분해와 Cdc25 활성화의 복합 효과는 cdc2를 활성화하는 cdc2에서 억제 인산화 작용이 순수하게 제거되는 것이다.Plk1은 G2/M 전이 시에 Aurora A와 Bora에 의해 활성화되어 G2 중에 축적되어 활성화 복합체를 형성한다.그런 다음 Plk1-Cdc2-cdc25 복합체는 Cdc2를 더욱 활성화하는 역할을 하는 양성 피드백 루프를 시작하고, G2 중 사이클린 B 복합체의 증가와 함께 생성된 cdc2-cyclin [18]B 복합체는 유사분열 진입을 촉진하는 하류 표적들을 활성화한다.생성된 Cdk1 활성은 또한 G2/M 전이 [19]유전자인 Mem1-Fkh의 발현을 활성화한다.M상 개시는 히스테리시스에 관여하는 전부 또는 무이상이므로 사이클린B-Cdk1 활성의 급격한 증가가 필요합니다.사이클린B 농도의 최소 역치를 설정하여 사이클린B를 통한 Cdk1 활성의 이력 M상 진입을 구동한다.이는 진입 후 M 단계 지속에 필요한 최소 수준보다 높은 수준으로 존재하며 all-or-nothing 이벤트를 보호합니다.이 진입 농도는 DNA 복제가 불완전한 경우 더욱 증가하며, G2/M 전환 [20]지점에 다른 조절 메커니즘을 추가합니다.히스테리시스가 존재하면 사이클린B-Cdk1 활성의 함수로서 M상 진입을 고도로 조절할 수 있습니다.
DNA 손상에 대한 반응으로 유사분열 침입을 방지하는 메커니즘은 G1/S 체크포인트와 유사하다.DNA 손상은 앞서 언급한 ATM/ATR 경로의 활성화를 유발하며, ATM/ATR은 Chk1/Chk2 체크포인트 키나제를 인산화 및 활성화한다.억제되는 것 외에 14-3-3 단백질에 의해 세포질 내에 격리되는 Chk1/2 인산화 cdc25. 14-3-3은 앞에서 설명한 바와 같이 Chk1에 의해 활성화되고 ATM/ATR. p53도 p21 및 p21 및 p21 및 14-3을 차례로 억제하는 p53에 의해 활성화된다.cdc2의 세포질 분리작용을 합니다.또한 cdc25의 불활성화는 cdc2를 [21][22]탈인산 및 활성화하지 못하게 한다.마지막으로 ATM/ATR에 의한 Plk1의 네거티브 조절에 의한 손상반응의 또 다른 메커니즘은 Wee1과 Myt1의 안정화를 초래하고, Wee1과 Myt1은 cdc2를 인산화 억제할 수 있으므로 손상이 고정될 [23]때까지 세포가 G2에서 정지된 상태를 유지한다.
Xenopus 난모세포의 G2-M 전이
G2의 마지막에 세포는 세포 분열로 이행하고 거기서 핵이 분열한다.G2에서 M으로의 이행은 극적으로 이루어집니다.모두 아니면 전혀 효과가 없으며 이행은 되돌릴 수 없습니다.유사분열 진입은 세포의 수명 주기에서 중요한 단계이기 때문에 이것은 세포에 유리하다.완전히 커밋되지 않으면, 세포는 부분 분열과 관련된 많은 문제에 직면하게 되고, 궁극적으로 세포 사멸로 이어질 수 있습니다.
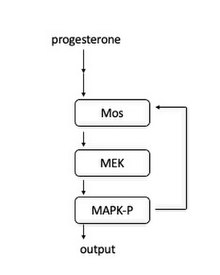
개구리 난모세포에서는 프로게스테론이 막결합 수용체에 결합할 때 신호 캐스케이드가 유도된다.다운스트림에서 Mos가 활성화됩니다.Mos는 MAPK를 인산화시키는 MEK1을 인산화한다.MAPK는 CyclinB-Cdk1 콤플렉스를 활성화하여 유사분열을 시작하는 것과 Mos를 활성화하는 두 가지 역할을 수행합니다.Mos의 활성화는 양의 피드백 루프로 이어지며, 따라서 "toggle switch"로 작동하여 유사분열로 가는 모든 입구를 만듭니다.
이 피드백 루프는 프로게스테론 [24]수치가 증가함에 따라 MAPK-P(인산화 MAPK) 농도가 증가했음을 보여줌으로써 처음 발견되었다.단일 세포 수준에서 각 세포는 완전히 인산화 MAPK를 가지고 있거나 인산화 MAPK를 가지고 있지 않아 각 세포에서 스위치와 같은 메커니즘으로 작용함을 확인하였다.또한 Mos 단백질 합성을 차단하면 MAPK-P 반응이 보다 등급화되어 MAPK [25]활성화의 전체 또는 없음 특성을 위해 Mos 단백질 합성이 필요하다는 것을 보여주었다.
쌍안정성
이 프로세스는 쌍안정성을 사용하여 이해할 수 있습니다.오른쪽에 표시된 그래프를 사용하면 프로게스테론이 더 많이 추가됨에 따라 Mos 합성 속도가 변화합니다.각 곡선에는 안정적인 고정점과 불안정한 고정점이 있습니다.불안정한 고정점에서는 시스템이 안정된 고정점 중 하나를 향해 푸시됩니다.따라서 시스템은 "on" 상태 또는 "off" 상태 중 하나일 수 있습니다.프로게스테론 레벨이 충분히 높으면 Mos 곡선은 더 높게 이동하고 최종적으로 하나의 점에서만 열화선과 교차하기 때문에 안정된 "ON" 상태는 1개뿐이며 유사분열로 진입했음을 나타냅니다.
유사분열 전이점에서 볼 수 있는 불가역성은 세포에 프로게스테론이 충분히 많이 함유되어 있기 때문이다.충분히 높은 수준의 프로게스테론에서는 시스템은 Mapk와 Mos 사이의 포지티브 피드백 루프의 결과로 단일 안정적입니다.시스템이 쌍안정 상태에서 단안정 상태로 전환되는 시점을 새들 노드 분기라고 합니다.
그래서 우리는 분자조절기의 수학적 모델을 통해 유사분자 전환의 전부 또는 무(無)의 불가역적인 반응을 긍정적인 피드백의 존재에 의존하는 쌍안정적인 시스템으로서 이해할 수 있습니다.「오프 상태」는, 충분한 레벨의 프로게스테론에 의해서 소멸해, 일단 셀이 오프 상태를 지나면, 온 상태로 고정됩니다.
히스테리시스와 노박-타이슨 모형
이 쌍안정적 모델에서 유래한 것으로, 유사분열적 전이를 구동하기 위해 히스테리시스에 의존하는 것으로 이해할 수 있습니다.히스테리시스는 시스템 상태에 대한 이력 의존으로 정의됩니다.더 노박-타이슨 모델은 세포 순환 진행의 수학적 모델로 유사분열로 들어가고 나가는 돌이킬 수 없는 전환이 히스테리시스에 의해 추진된다고 예측합니다.이 모델은 세포 주기 진행이 이력서에 [26]따라 달라지는 순환 난모세포 추출물에서 참이어야 하는 세 가지 기본적인 예측을 가지고 있다.
- 유사분열에 들어가는 데 필요한 사이클린 B의 농도는 유사분열에서 유사분열 추출물을 유지하는 데 필요한 농도보다 높다.
- 복제되지 않은 DNA는 Cdc2 활성화에 필요한 사이클린의 수치를 증가시켜 유사분열로 진입한다.
- 활성화 임계값 바로 위의 사이클린 B 농도에서 Cdc2 활성화 속도가 감소한다.
Sha et al은 2003년에 Xenopus laevis 난자 추출물을 실험하여 이 이력학적 [27]성질을 증명하였다.사이클링 추출물을 사용하여 δcyclin B의 활성화 임계값이 32~42nM인 반면 비활성화 임계값이 16~24nM δcyclin B인 것을 확인했다.따라서, 이러한 실험들은 이 시스템의 쌍안정성과 이 세포 주기 천이에서 이력의 중요성을 확인하였습니다.중간 사이클린 B 농도에서는 세포의 상간 상태 또는 유사분열 상태 중 하나가 가능하다.
레플리케이션 스트레스 응답
유사분열은 세포에게 크고 비용이 많이 들기 때문에 시스템이 이 단계에 너무 일찍 진입하지 않도록 하는 것이 논리적이다.DNA의 복제되지 않은 부분이 세포 [28]주기의 진행을 막는 것과 같은 이전 단계의 실수가 있는 것으로 나타났다.더 노박-타이슨 모델은 체세포 [26]분열에 들어가는 데 필요한 사이클린 B의 수치를 높임으로써 이것이 일어날 것으로 예측한다.
샤 등은 Xenopus 계란 추출물에서 이것이 사실인지 조사했다.그들은 DNA 중합효소를 억제하고 DNA 복제를 막기 위해 진피디콜린을 사용했다.Cyclin B를 상간에서 처리했을 때 활성화 임계값은 Novak이 예측한 대로 80~100nM으로 증가했다.타이슨 [27]모델그래서, 이 실험들은 세포에서 복제되지 않은 DNA의 스트레스가 이력 루프에 영향을 미치고 유사분열로 들어가는 훨씬 더 높은 사이클린 B 역치를 초래한다는 것을 확인시켜줍니다.
메타페이즈 체크포인트
유사분열 방추 체크포인트는 모든 염색체가 유사분열판에 정렬되어 양극성 장력을 받아야 하는 중기의 지점에서 발생한다.이 양극성 부착물에 의해 생성되는 장력은 감지되며, 이로 인해 아나페이즈 엔트리가 시작됩니다.이를 위해 센싱 메커니즘은 아나베이스 촉진 복합체(APC/C)가 더 이상 억제되지 않도록 보장하며, 이는 이제 D박스(파괴 상자)를 수용하는 사이클린 B를 자유롭게 분해할 수 있게 [29]되었다.후자는 분리효소를 억제하는 기능을 가진 단백질로, 이는 자매 염색체의 [30]응집력을 담당하는 단백질 복합체인 코히틴을 절단한다.일단 이 억제 단백질이 유비퀴티네이션과 후속 단백질 분해를 통해 분해되면 분리효소는 자매 염색체 [31]분리를 일으킨다.셀이 2개의 딸 셀로 분할되면 셀은 G로 들어갑니다1.
암
DNA 복구 과정과 세포 주기 검사점은 각각 게놈 안정성과 세포 진행을 조절하는 기능 때문에 암과 밀접하게 연관되어 왔다.이러한 경로의 기능 장애를 특정 암의 시작과 연결하는 정확한 분자 메커니즘은 대부분의 [32]경우 잘 이해되지 않는다.ATM의 손실은 과도한 상동 재조합으로 인해 림프종 발생에 선행하는 것으로 나타났으며, 이는 [33]높은 게놈 불안정성을 초래한다.생쥐에서 Chk1의 교란은 세포 주기 체크포인트의 유의한 잘못된 조절, DNA 손상 축적, 종양 [34]발생률 증가를 이끌었다.아마도 가장 유명한 것은 BRCA1 또는 BRCA2의 단일 돌연변이 유전은 암컷을 유방암과 난소암에 [35]걸리게 한다.BRCA1은 S 및 G2/M 전이에 필요한 것으로 알려져 있으며, DNA 손상에 대한 세포 반응에 관여한다.BRCA2는 상동재조합과 S상체크포인트 조절에 관여하는 것으로 생각되며, BRCA2의 결핍 돌연변이는 [36]종양유전과 강하게 관련된다.
「 」를 참조해 주세요.
레퍼런스
- ^ Hartwell, L.; Weinert, T. (3 November 1989). "Checkpoints: controls that ensure the order of cell cycle events". Science. 246 (4930): 629–634. Bibcode:1989Sci...246..629H. doi:10.1126/science.2683079. ISSN 0036-8075. PMID 2683079.
- ^ Morgan, David Owen (1958–2007). The cell cycle : principles of control. London: New Science Press. ISBN 978-0-19-920610-0. OCLC 70173205.
- ^ Murray, A.; Kirschner, M. (3 November 1989). "Dominoes and clocks: the union of two views of the cell cycle". Science. 246 (4930): 614–621. Bibcode:1989Sci...246..614M. doi:10.1126/science.2683077. ISSN 0036-8075. PMID 2683077.
- ^ Morgan, David O. (November 1997). "CYCLIN-DEPENDENT KINASES: Engines, Clocks, and Microprocessors". Annual Review of Cell and Developmental Biology. 13 (1): 261–291. doi:10.1146/annurev.cellbio.13.1.261. ISSN 1081-0706. PMID 9442875.
- ^ a b c Alberts B, Johnson A, Lewis J, Raff M, Roberts K (2007). Molecular biology of the cell (5th ed.). New York: Garland Science. ISBN 9780815341055.
- ^ Cooper GM (2000). The cell : a molecular approach (2nd ed.). Washington (DC): ASM Press. ISBN 978-0-87893-106-4.
- ^ Lodish H, Baltimore D, Berk A (2000). Molecular cell biology (4th ed.). New York: Scientific American Books. ISBN 978-0-7167-3136-8.
- ^ Malumbres M, Barbacid M (March 2009). "Cell cycle, CDKs and cancer: a changing paradigm". Nature Reviews. Cancer. 9 (3): 153–66. doi:10.1038/nrc2602. PMID 19238148. S2CID 2613411.
- ^ Vermeulen K, Van Bockstaele DR, Berneman ZN (June 2003). "The cell cycle: a review of regulation, deregulation and therapeutic targets in cancer". Cell Proliferation. 36 (3): 131–49. doi:10.1046/j.1365-2184.2003.00266.x. PMC 6496723. PMID 12814430.
- ^ a b c d e Bertoli C, Skotheim JM, de Bruin RA (August 2013). "Control of cell cycle transcription during G1 and S phases". Nature Reviews Molecular Cell Biology. 14 (8): 518–28. doi:10.1038/nrm3629. PMC 4569015. PMID 23877564.
- ^ a b c Narasimha AM, Kaulich M, Shapiro GS, Choi YJ, Sicinski P, Dowdy SF (June 2014). "Cyclin D activates the Rb tumor suppressor by mono-phosphorylation". eLife. 3. doi:10.7554/eLife.02872. PMC 4076869. PMID 24876129.
- ^ Skotheim JM, Di Talia S, Siggia ED, Cross FR (July 2008). "Positive feedback of G1 cyclins ensures coherent cell cycle entry". Nature. 454 (7202): 291–6. Bibcode:2008Natur.454..291S. doi:10.1038/nature07118. PMC 2606905. PMID 18633409.
- ^ Bartek J, Lukas J (December 2001). "Mammalian G1- and S-phase checkpoints in response to DNA damage". Current Opinion in Cell Biology. 13 (6): 738–47. doi:10.1016/S0955-0674(00)00280-5. PMID 11698191.
- ^ Bertoli C, de Bruin RA (July 2014). "Turning cell cycle entry on its head". eLife. 3: e03475. doi:10.7554/eLife.03475. PMC 4076868. PMID 24986860.
- ^ Morgan D (2007). The Cell Cycle Principles of Control. New Science Press. pp. 92–95.
- ^ Morgan D (2007). The Cell Cycle Principles of Control. New Science Press. pp. 228–229.
- ^ Guardavaccaro D, Pagano M (April 2006). "Stabilizers and destabilizers controlling cell cycle oscillators". Molecular Cell. 22 (1): 1–4. doi:10.1016/j.molcel.2006.03.017. PMID 16600864.
- ^ Seki A, Coppinger JA, Jang CY, Yates JR, Fang G (June 2008). "Bora and the kinase Aurora a cooperatively activate the kinase Plk1 and control mitotic entry". Science. 320 (5883): 1655–8. Bibcode:2008Sci...320.1655S. doi:10.1126/science.1157425. PMC 2834883. PMID 18566290.
- ^ Morgan D (2007). The Cell Cycle Principles of Control. New Science Press. pp. 44–45, 90.
- ^ Sha W, Moore J, Chen K, Lassaletta AD, Yi CS, Tyson JJ, Sible JC (February 2003). "Hysteresis drives cell-cycle transitions in Xenopus laevis egg extracts". Proceedings of the National Academy of Sciences of the United States of America. 100 (3): 975–80. Bibcode:2003PNAS..100..975S. doi:10.1073/pnas.0235349100. PMC 298711. PMID 12509509.
- ^ Wang Y, Ji P, Liu J, Broaddus RR, Xue F, Zhang W (February 2009). "Centrosome-associated regulators of the G(2)/M checkpoint as targets for cancer therapy". Molecular Cancer. 8 (1): 8. doi:10.1186/1476-4598-8-8. PMC 2657106. PMID 19216791.
- ^ Löbrich M, Jeggo PA (November 2007). "The impact of a negligent G2/M checkpoint on genomic instability and cancer induction". Nature Reviews. Cancer. 7 (11): 861–9. doi:10.1038/nrc2248. PMID 17943134. S2CID 30207932.
- ^ Harper JW, Elledge SJ (December 2007). "The DNA damage response: ten years after". Molecular Cell. 28 (5): 739–45. doi:10.1016/j.molcel.2007.11.015. PMID 18082599.
- ^ Gotoh, Yukiko; Masuyama, Norihisa; Dell, Karen; Shirakabe, Kyoko; Nishida, Eisuke (October 1995). "Initiation of Xenopus Oocyte Maturation by Activation of the Mitogen-activated Protein Kinase Cascade". Journal of Biological Chemistry. 270 (43): 25898–25904. doi:10.1074/jbc.270.43.25898. ISSN 0021-9258. PMID 7592777.
- ^ Ferrell Jr., J. E. (1998-05-08). "The Biochemical Basis of an All-or-None Cell Fate Switch in Xenopus Oocytes". Science. 280 (5365): 895–898. Bibcode:1998Sci...280..895F. doi:10.1126/science.280.5365.895. ISSN 0036-8075. PMID 9572732.
- ^ a b Novak, B.; Tyson, J.J. (1993-12-01). "Numerical analysis of a comprehensive model of M-phase control in Xenopus oocyte extracts and intact embryos". Journal of Cell Science. 106 (4): 1153–1168. doi:10.1242/jcs.106.4.1153. ISSN 1477-9137. PMID 8126097.
- ^ a b Sha, W.; Moore, J.; Chen, K.; Lassaletta, A. D.; Yi, C.-S.; Tyson, J. J.; Sible, J. C. (2002-12-30). "Hysteresis drives cell-cycle transitions in Xenopus laevis egg extracts". Proceedings of the National Academy of Sciences. 100 (3): 975–980. doi:10.1073/pnas.0235349100. ISSN 0027-8424. PMC 298711. PMID 12509509.
- ^ Dasso, Mary; Newport, John W. (June 1990). "Completion of DNA replication is monitored by a feedback system that controls the initiation of mitosis in vitro: Studies in Xenopus". Cell. 61 (5): 811–823. doi:10.1016/0092-8674(90)90191-g. ISSN 0092-8674. PMID 2160859. S2CID 34852886.
- ^ Peters JM (December 1998). "SCF and APC: the Yin and Yang of cell cycle regulated proteolysis". Current Opinion in Cell Biology. 10 (6): 759–68. doi:10.1016/S0955-0674(98)80119-1. PMID 9914180.
- ^ Ciosk R, Zachariae W, Michaelis C, Shevchenko A, Mann M, Nasmyth K (June 1998). "An ESP1/PDS1 complex regulates loss of sister chromatid cohesion at the metaphase to anaphase transition in yeast". Cell. 93 (6): 1067–76. doi:10.1016/S0092-8674(00)81211-8. PMID 9635435. S2CID 9951929.
- ^ Karp G (2005). Cell and Molecular Biology: Concepts and Experiments (4th ed.). Hoboken, New Jersey: John Wiley and Sons. pp. 598–9. ISBN 978-0-471-16231-5.
- ^ Kastan MB, Bartek J (November 2004). "Cell-cycle checkpoints and cancer". Nature. 432 (7015): 316–23. Bibcode:2004Natur.432..316K. doi:10.1038/nature03097. PMID 15549093. S2CID 4415666.
- ^ Shiloh Y, Kastan MB (2001). "ATM: genome stability, neuronal development, and cancer cross paths". Advances in Cancer Research. 83: 209–54. doi:10.1016/s0065-230x(01)83007-4. ISBN 9780120066834. PMID 11665719.
- ^ Lam MH, Liu Q, Elledge SJ, Rosen JM (July 2004). "Chk1 is haploinsufficient for multiple functions critical to tumor suppression". Cancer Cell. 6 (1): 45–59. doi:10.1016/j.ccr.2004.06.015. PMID 15261141.
- ^ King MC, Marks JH, Mandell JB (October 2003). "Breast and ovarian cancer risks due to inherited mutations in BRCA1 and BRCA2". Science. 302 (5645): 643–6. Bibcode:2003Sci...302..643K. doi:10.1126/science.1088759. PMID 14576434. S2CID 33441900.
- ^ Venkitaraman AR (January 2002). "Cancer susceptibility and the functions of BRCA1 and BRCA2". Cell. 108 (2): 171–82. doi:10.1016/s0092-8674(02)00615-3. PMID 11832208. S2CID 10397442.